- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Теория электролитической диссоциации презентация
Содержание
- 1. Теория электролитической диссоциации
- 2. их растворы
- 3. Cоли Na2SO4 , KCl, Ca(NO3)2 Кислоты
- 4. Процесс появления гидратированных ионов в
- 5. Современная теория электролитической диссоциации (ТЭД)
- 6. Все вещества по их способности проводить электрический
- 7. В растворах электролиты диссоциируют ( распадаются) на
- 8. Молекула воды является диполем
- 9. 1.Ориентация молекул воды. 2.Гидратация. 3. Разрыв ионной
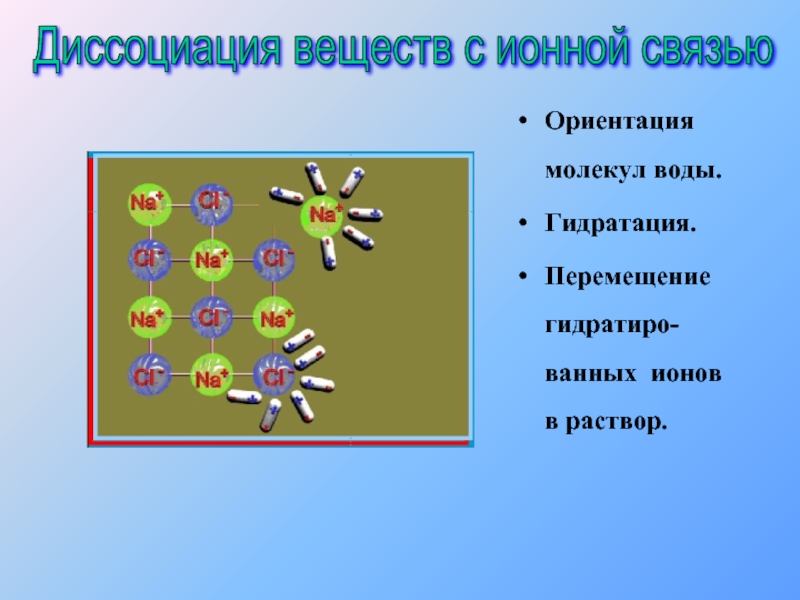
- 10. Ориентация молекул воды. Гидратация. Перемещение гидратиро- ванных
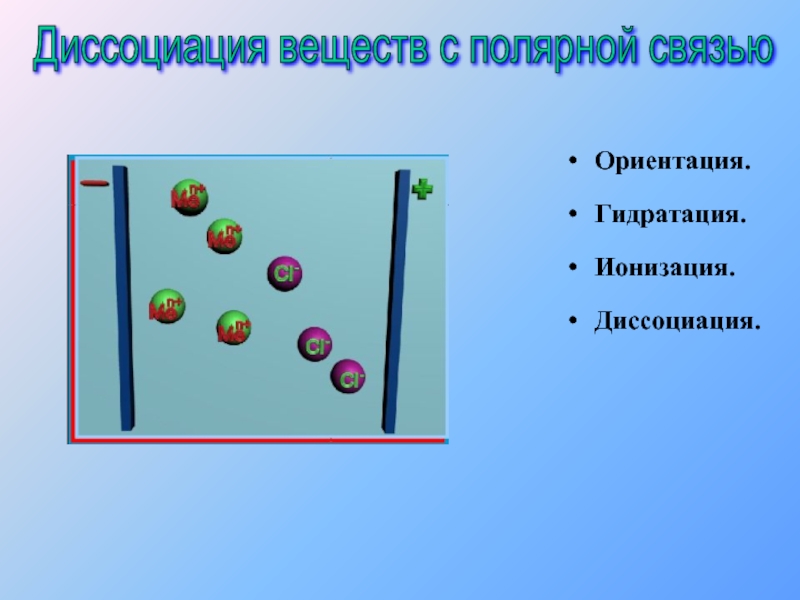
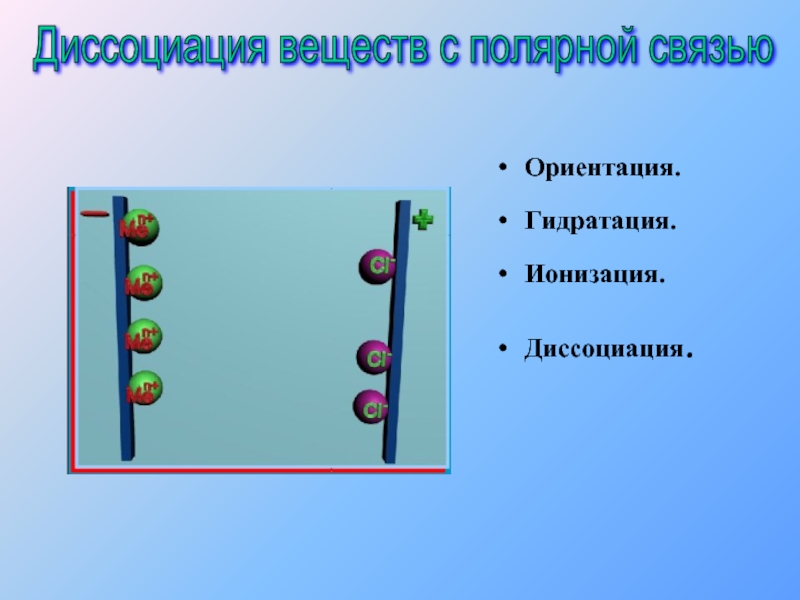
- 11. Ориентация. Гидратация. Ионизация. Диссоциация. Диссоциация веществ с полярной связью
- 12. Ориентация. Гидратация. Ионизация. Диссоциация. Диссоциация веществ с полярной связью
- 13. Ориентация. Гидратация. Ионизация. Диссоциация. Диссоциация веществ с полярной связью
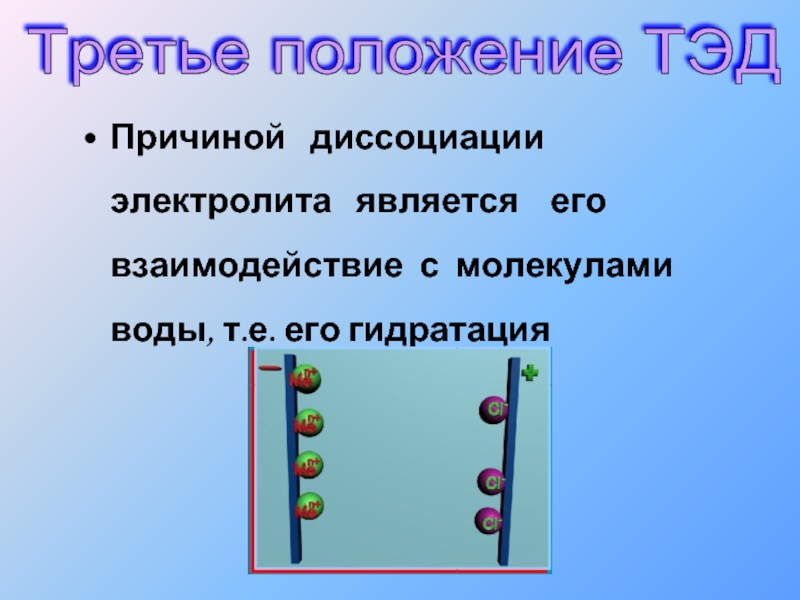
- 14. Причиной диссоциации электролита является
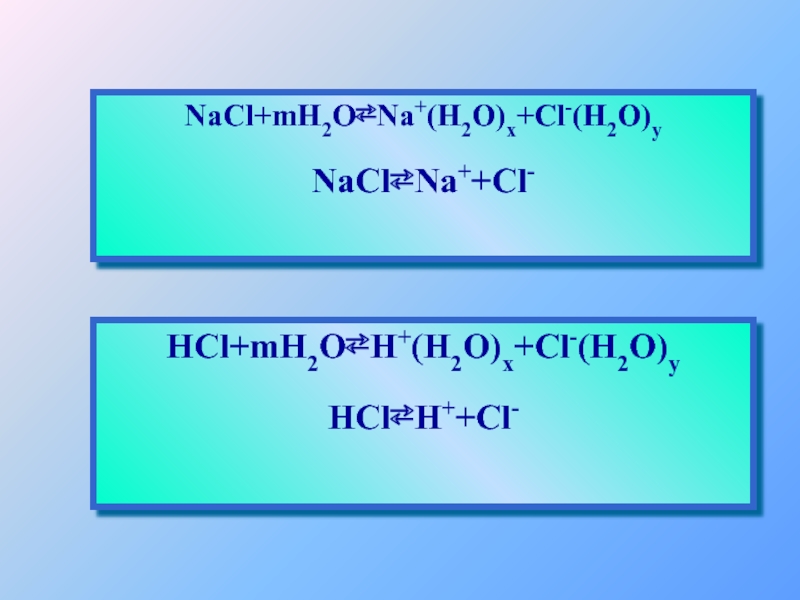
- 15. HCl+mH2O⇄H+(H2O)x+Cl-(H2O)y HCl⇄H++Cl- NaCl+mH2O⇄Na+(H2O)x+Cl-(H2O)y NaCl⇄Na++Cl-
- 16. С точки
- 17. HCl = H+ + Cl- HNO3 =
- 18. Na2SO4 = 2Na+ + SO42- AlCl3
- 19. Многоосновные кислоты диссоциируют ступенчато. Каждая последующая степень
- 20. С точки
- 21. NaOH = Na+ + OH- Ba(OH)2 =
- 22. Соли – это
- 23. Классификация солей средние кислые основные Образованы
- 24. С точки
- 25. Под действием тока положительные ионы движутся к
- 26. С
- 27. Не все электролиты в одинаковой мере диссоциируют
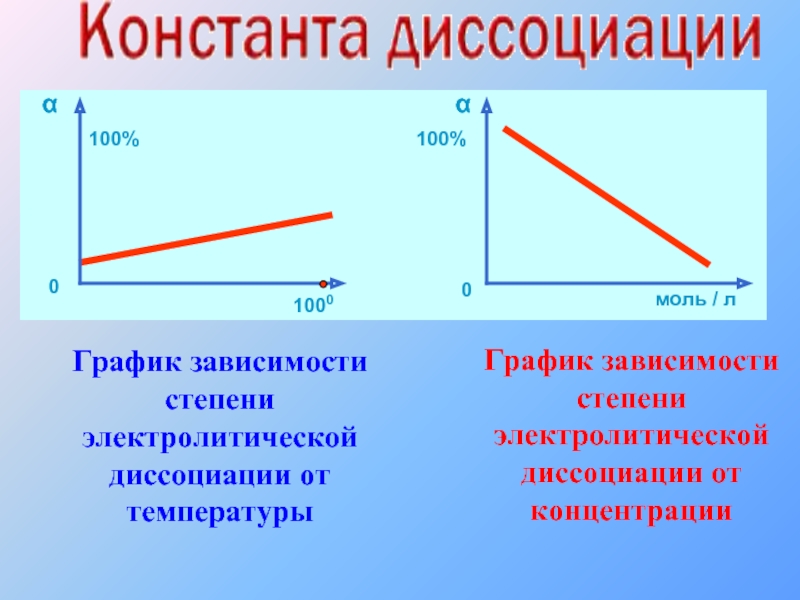
- 28. График зависимости степени электролитической диссоциации от температуры График зависимости степени электролитической диссоциации от концентрации
- 29. Сильные электролиты α > 30%
- 30. Электролиты средней силы 3% ≤
- 31. Слабые электролиты α <
- 32. Свойства растворов электролитов определяются свойствами тех ионов,
- 33. Реакции в растворах электролитов протекают до конца
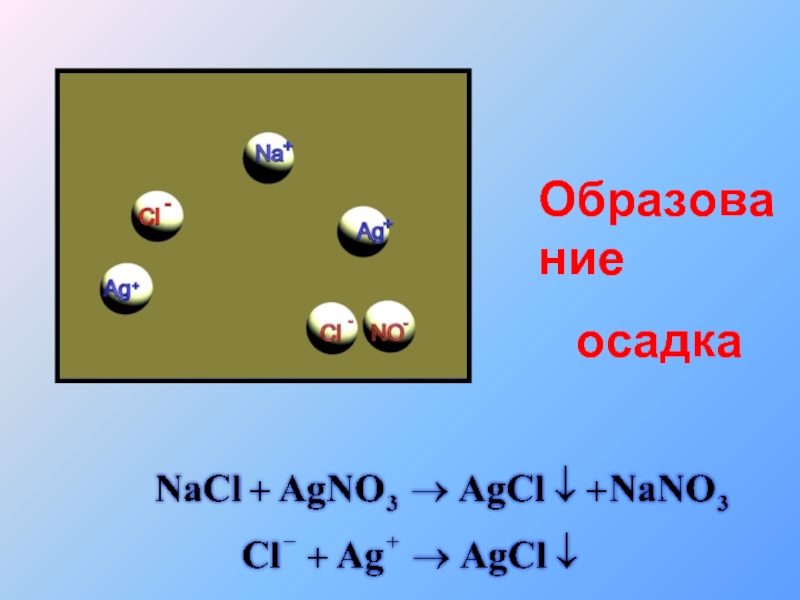
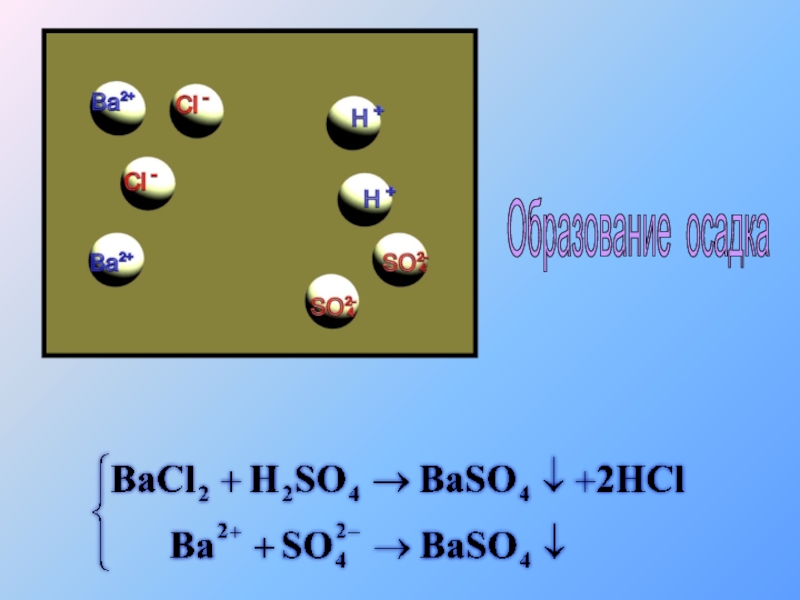
- 34. Образование осадка
- 35. Образование осадка
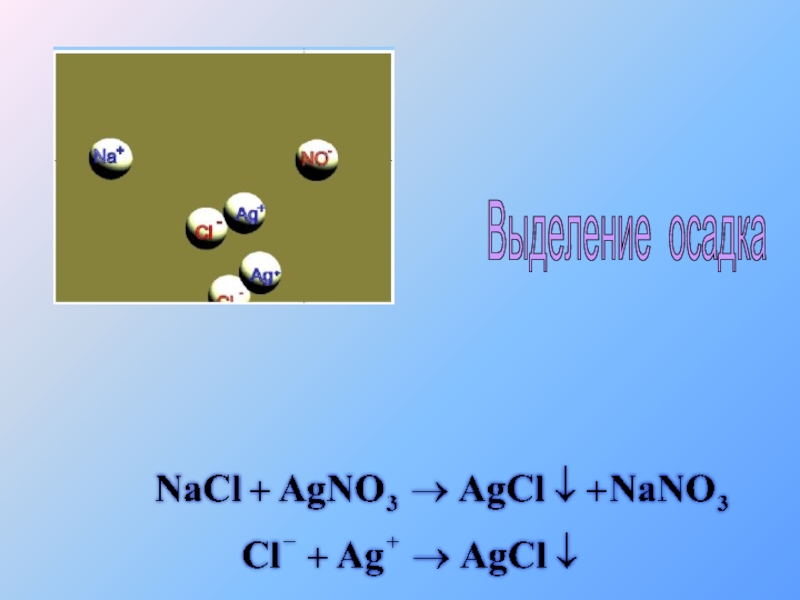
- 36. Выделение осадка
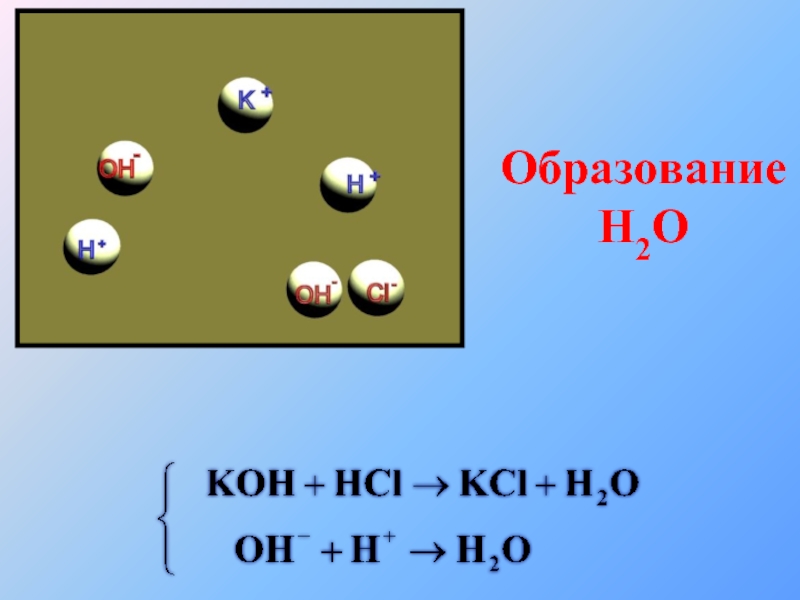
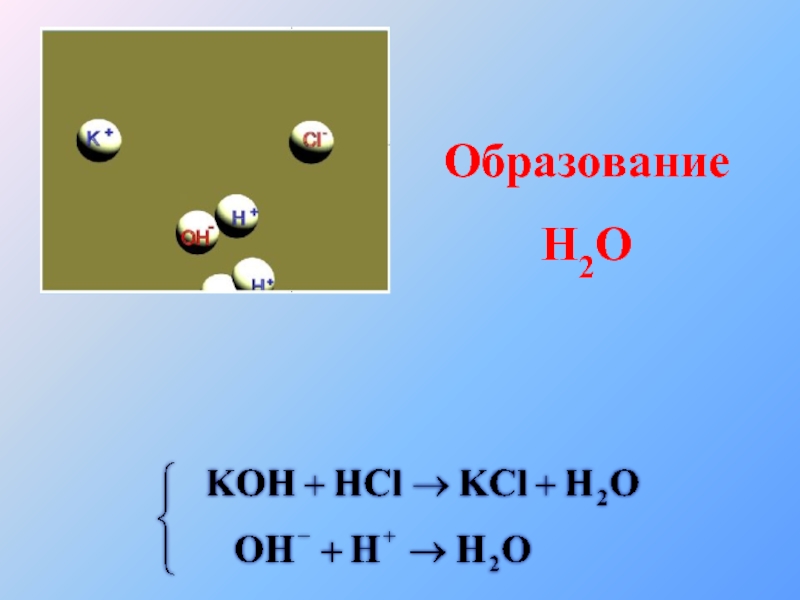
- 37. Образование H2O
- 38. Образование Н2О
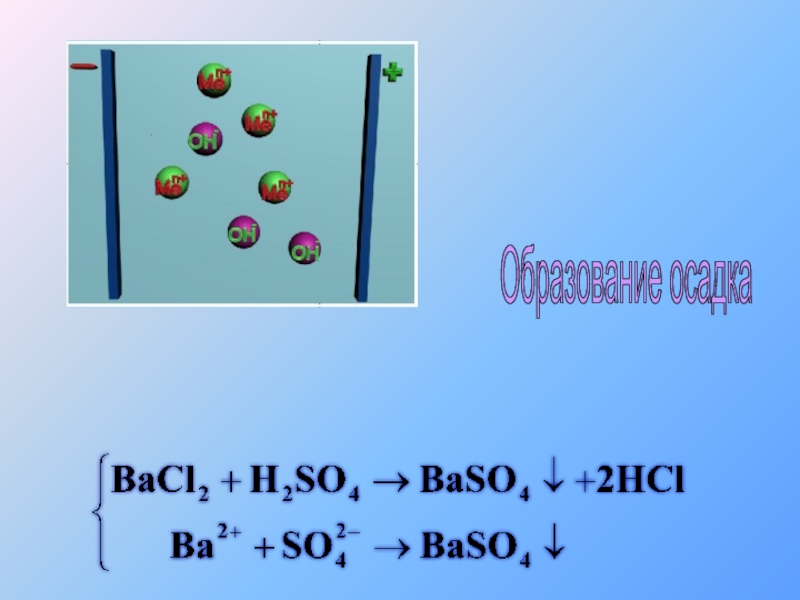
- 39. Образование осадка
- 40. Образование осадка
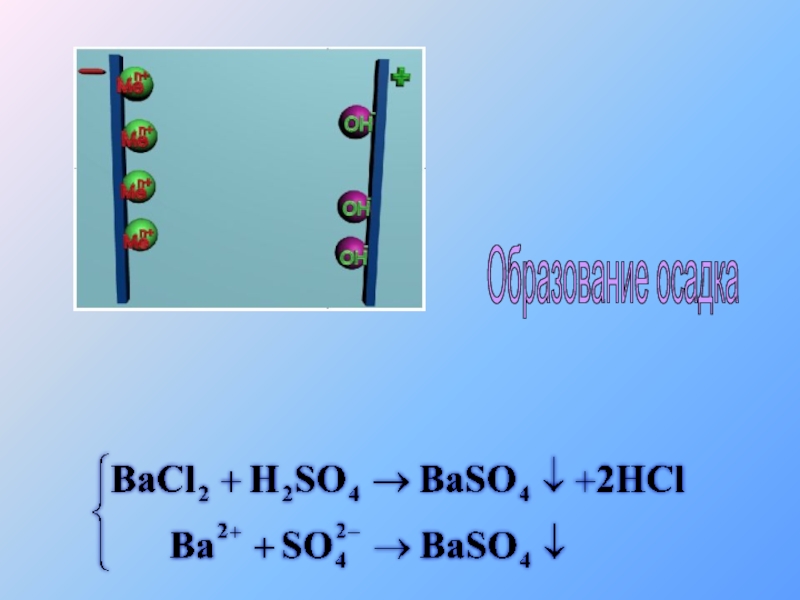
- 41. Образование осадка
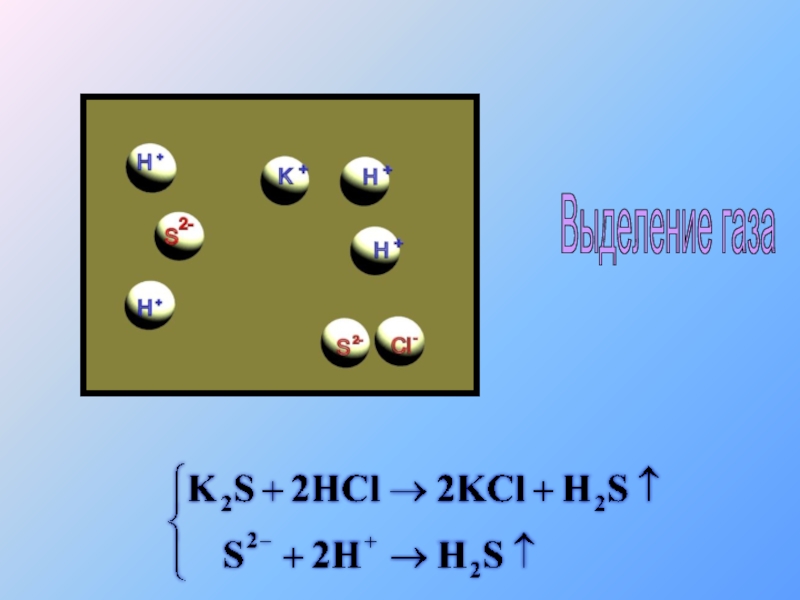
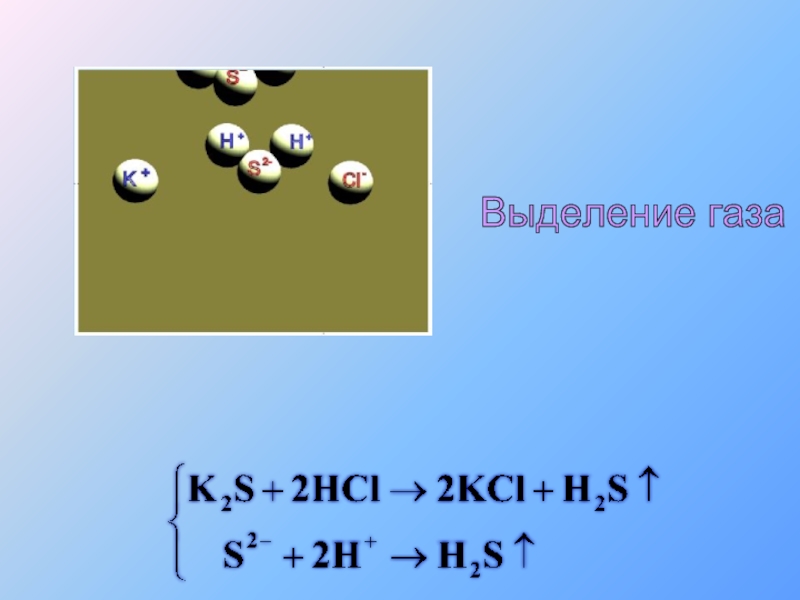
- 42. Выделение газа
- 43. Выделение газа
- 44. Выделение газа
Слайд 2
их растворы
или расплавы
ПРОВОДЯТ электрический
ток
их растворы
Вид химической связи
Ионная или ковалентная
сильно полярная
Ковалентная неполярная
или мало полярная
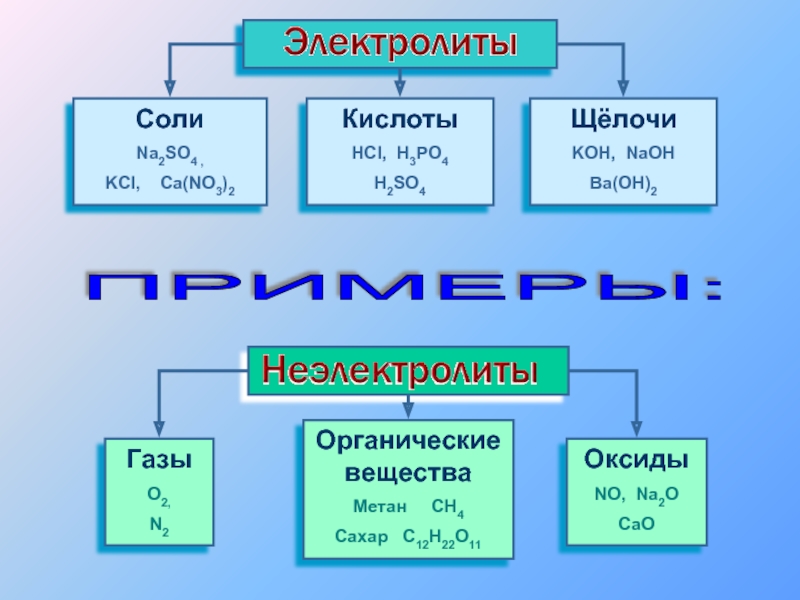
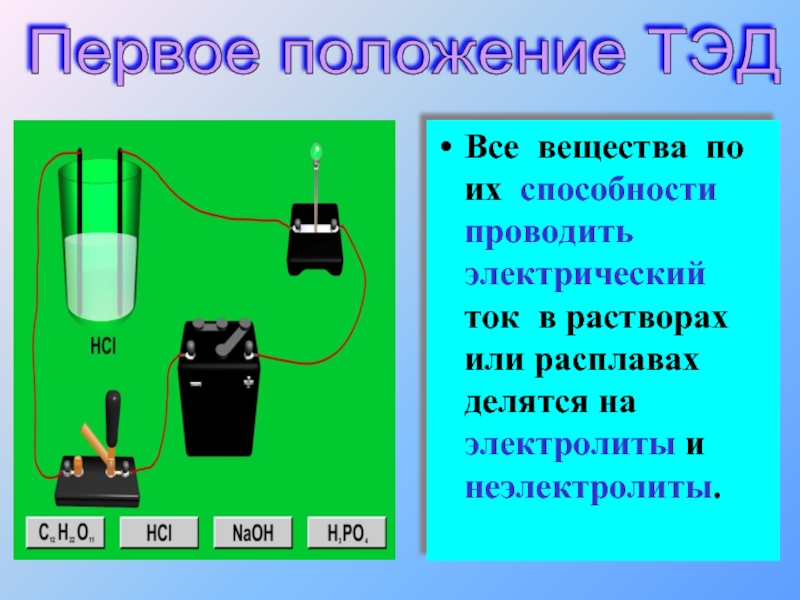
Все вещества по отношению к электрическому току можно разделить на
Слайд 3Cоли
Na2SO4 ,
KCl, Ca(NO3)2
Кислоты
HCl, H3PO4
H2SO4
Щёлочи
KOH, NaOH
Ba(OH)2
Газы
O2,
N2
Органические вещества
Метан CH4
Сахар
Оксиды
NO, Na2O
CaO
ПРИМЕРЫ:
Слайд 4 Процесс появления гидратированных ионов в водном растворе называется электролитической
процесс растворения электролитов сопровождается образованием заряженных частиц, способных проводить электрический ток.
С. А. Аррениус.
Гипотеза Сванте Аррениуса
Слайд 6Все вещества по их способности проводить электрический ток в растворах или
Первое положение ТЭД
Слайд 7В растворах электролиты диссоциируют ( распадаются) на положительные и отрицательные ионы.
Второе положение ТЭД
Слайд 8
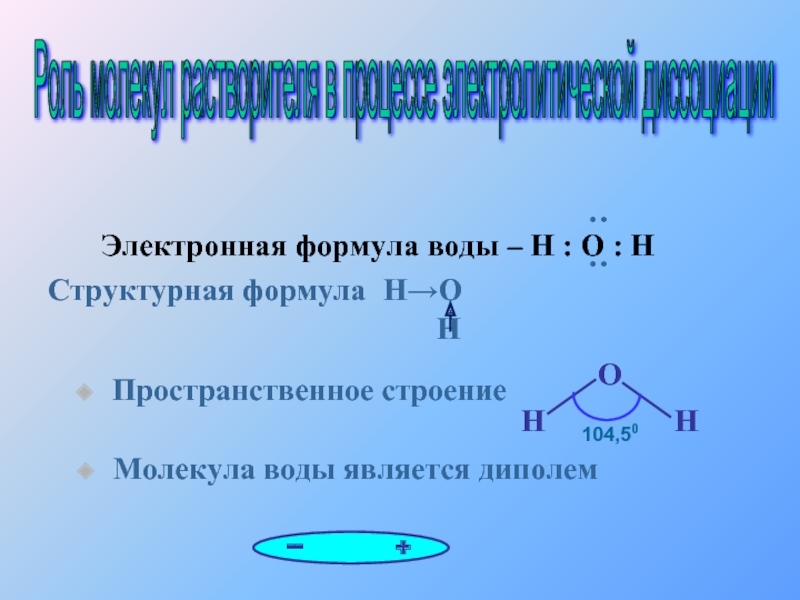
Молекула воды является диполем
Электронная формула воды – Н : О : Н
Пространственное строение
Структурная формула Н→О
Н
Роль молекул растворителя в процессе электролитической диссоциации
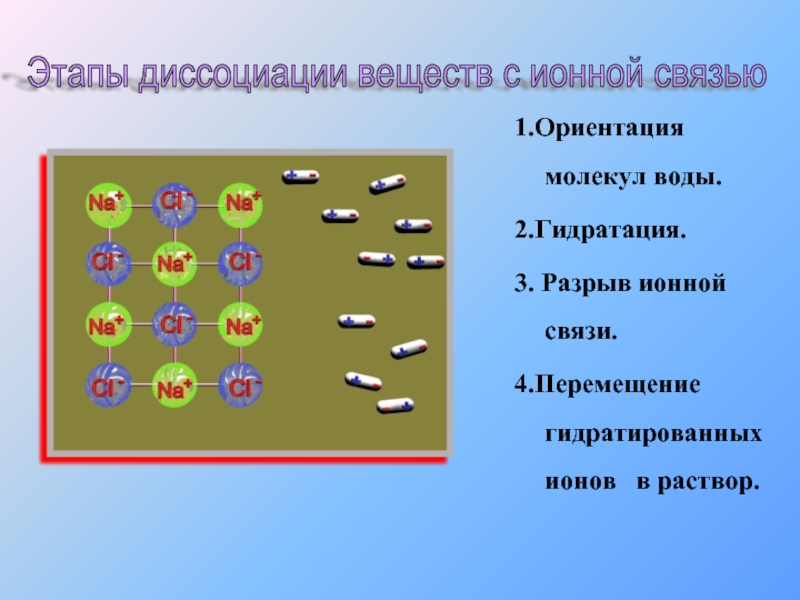
Слайд 91.Ориентация молекул воды.
2.Гидратация.
3. Разрыв ионной связи.
4.Перемещение гидратированных ионов в раствор.
Этапы
Слайд 10Ориентация молекул воды.
Гидратация.
Перемещение гидратиро-
ванных ионов в раствор.
Диссоциация веществ с ионной
Слайд 14Причиной диссоциации электролита является его взаимодействие с
Третье положение ТЭД
Слайд 16 С точки зрения ТЭД,
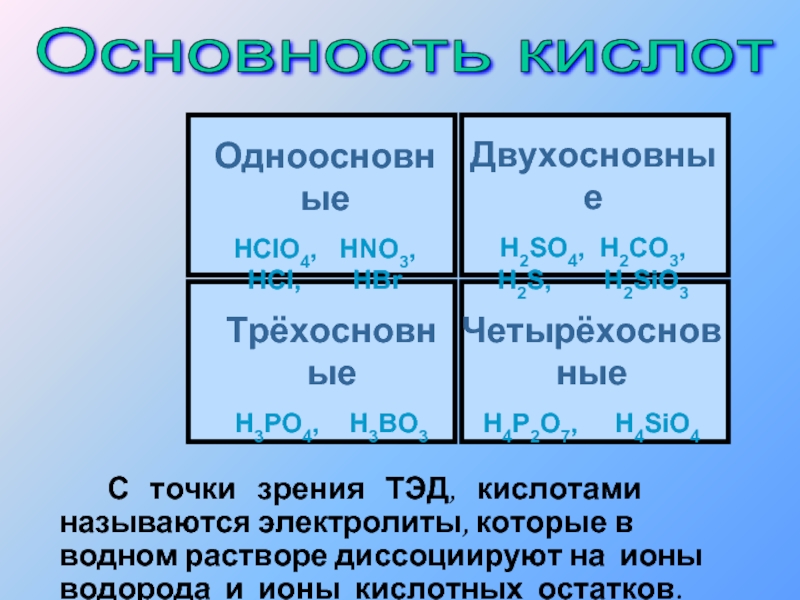
Основность кислот
Слайд 17HCl = H+ + Cl-
HNO3 = H+ + NO3-
HClO4 = H+
Кислоты – это электролиты, которые диссоциируют на катионы водорода и
анионы кислотного остатка.
Диссоциация кислот
Слайд 18Na2SO4 = 2Na+ + SO42-
AlCl3 = Al3+ + 3Cl-
Fe2(SO4)3 =
С точки зрения ТЭД, средними солями называются электролиты, которые в водном растворе диссоциируют на ионы металла и ионы кислотного остатка..
Диссоциация солей
Слайд 19Многоосновные кислоты диссоциируют ступенчато. Каждая последующая степень протекает хуже предыдущей.
Сильный электролит
H2SO4⇄H++
HSO4 - ⇄H++ SO42-α2
α1≈ α2
H2SO4⇄2H++ SO42-
Электролит средней силы
H2SO3⇄H++ HSO3-α1
HSO3 - ⇄H++ SO32-α2
α1>> α2
H2SO3⇄H++ HSO3-
Слайд 20 С точки зрения ТЭД,
Однокислотные
NaOH, KOH,
NH4OH
Двухкислотные
Ca(OH)2, Ba(OH)2,
Fe(OH)2
Трёхкислотные
Fe(OH)3, Al(OH)3, Cr(OH)3,
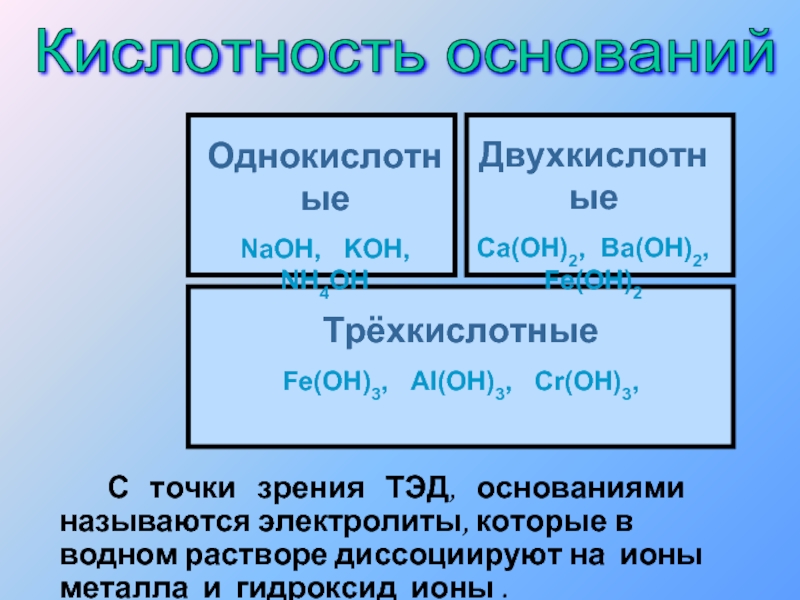
Кислотность оснований
Слайд 21NaOH = Na+ + OH-
Ba(OH)2 = BaOH+ + OH- → Ba2+
KOH = K+ + OH-
Основания – это электролиты, которые диссоциируют на катионы металла и анионы гидроксогрупп
Диссоциация оснований
Слайд 22 Соли – это электролиты, которые диссоциируют на
NaCl = Na+ + Cl-
KNO3 = K+ + NO3-
Al2(SO4)3 = 2Al3+ + 3SO42-
Диссоциация солей
Слайд 23
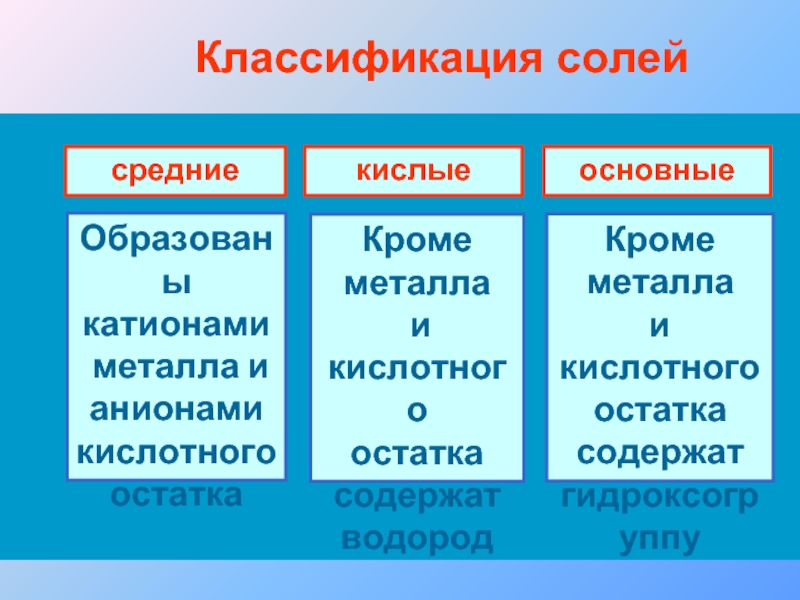
Классификация солей
средние
кислые
основные
Образованы катионами
металла и анионами
кислотного остатка
Кроме металла
и кислотного
остатка содержат
водород
Кроме металла
и кислотного
остатка содержат гидроксогруппу
Слайд 24 С точки зрения ТЭД,
NaHSO4⇄Na++ HSO4-α1
HSO4 - ⇄H++ SO42-α2
α1≈ α2
NaHSO4⇄Na++ HSO4-
Слайд 25Под действием тока положительные ионы движутся к катоду и называются катионы,
Четвёртое положение ТЭД
Слайд 26 С точки зрения
Ba(OH)Cl = BaOH+ + Cl- α1
BaOH- ⇄ Ba2+ + OH- α2
α1≈ α2
Слайд 27Не все электролиты в одинаковой мере диссоциируют на ионы
КЛАССИФИКАЦИЯ ЭЛЕКТРОЛИТОВ
Пятое
Слайд 28График зависимости степени электролитической диссоциации от температуры
График зависимости степени электролитической диссоциации
Слайд 29
Сильные электролиты
α > 30%
Средние водорастворимые соли NaCl, K2SO4, Ba(NO3)2 итд;
Гидроксиды щелочных
Минеральные кислоты: H2SO4, HNO3, HClO3, HClO4, HBrO3, HJO3, HCl, HBr, HJ
Слайд 31
Слабые электролиты
α < 3%
Органические кислоты: HCOOH, CH3COOH, C2H5COOH
Минеральные кислоты:
Гидроксиды малоактивных металлов: Cu(OH)2 , Fe(OH)3 , Al(OH)3 , Cr (OH)3 ,
Гидроксид аммония: NH4OH
Слайд 32Свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при
Шестое положение ТЭД
Слайд 33Реакции в растворах электролитов протекают до конца если:
Образуется или растворяется осадок;
Выделяется
Образуется малодиссоциирующее вещество (например Н2О)
Условия протекания реакции ионного обмена