- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Аминокислоты, пептиды, белки презентация
Содержание
- 1. Аминокислоты, пептиды, белки
- 2. Аминокислоты - это органические соединения, содержащие
- 3. В природе встречаются главным образом а-аминокислоты.
- 4. Номенклатура аминокислот Названия аминокислот произошли в
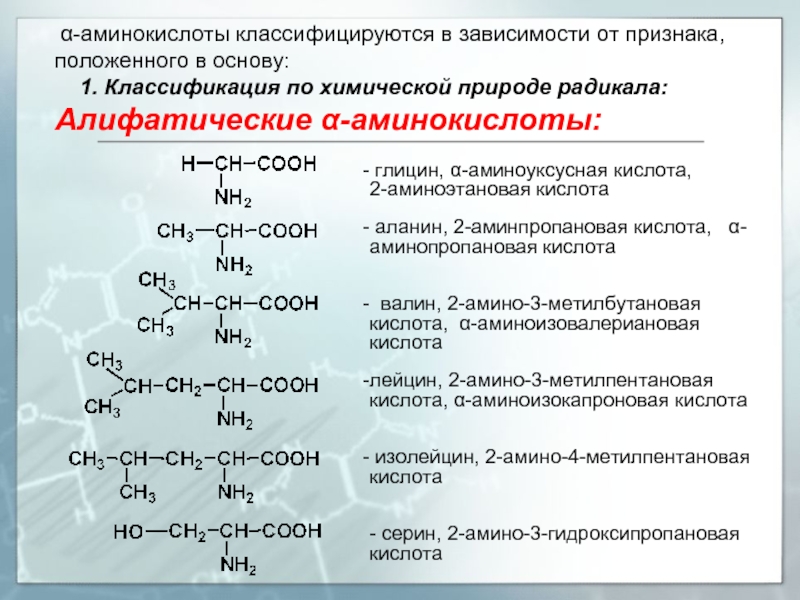
- 5. α-аминокислоты классифицируются в зависимости от признака,
- 6. -треонин, 2-амино-3-
- 7. Гетероциклические α-аминокислоты: -триптофан, α-амино-β-индолилпропановая кислота
- 8. 2. Классификация с учетом общего числа карбоксильных
- 9. Стереохимия α-аминокислот (за исключением глицина) обусловлена наличием
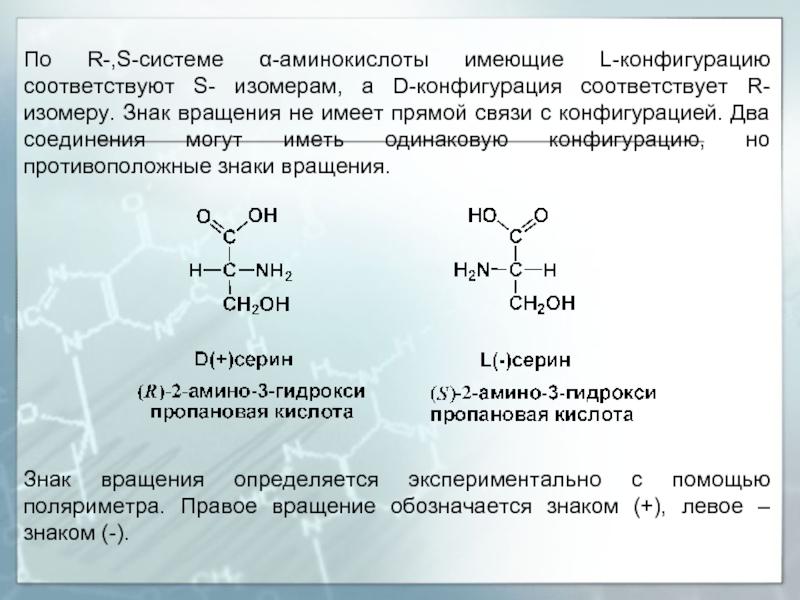
- 10. По R-,S-системе α-аминокислоты имеющие L-конфигурацию соответствуют S-
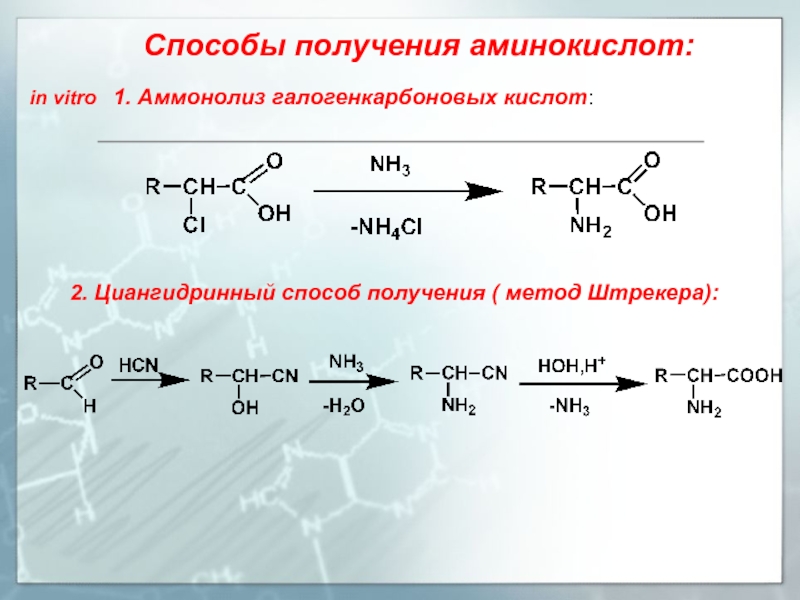
- 11. Способы получения аминокислот: in vitro
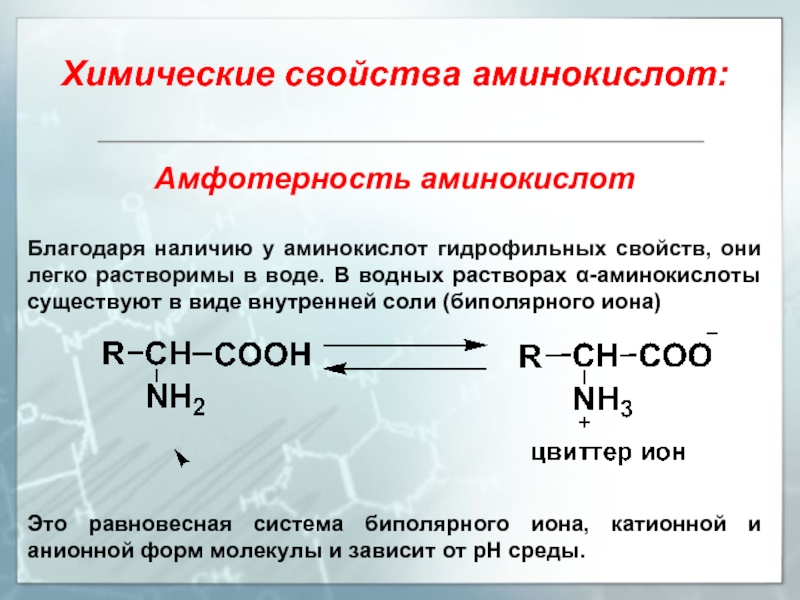
- 13. Амфотерность аминокислот Благодаря наличию
- 14. В сильнокислых средах рН 1-2 преобладают α-аминокислоты
- 15. Реакции по карбоксильной группе: 1.Образование внутрикомплексных
- 16. 3. Образование галогенангидридов При действии
- 17. Реакции аминогруппы: 1. Образование N-ацетильных производных В
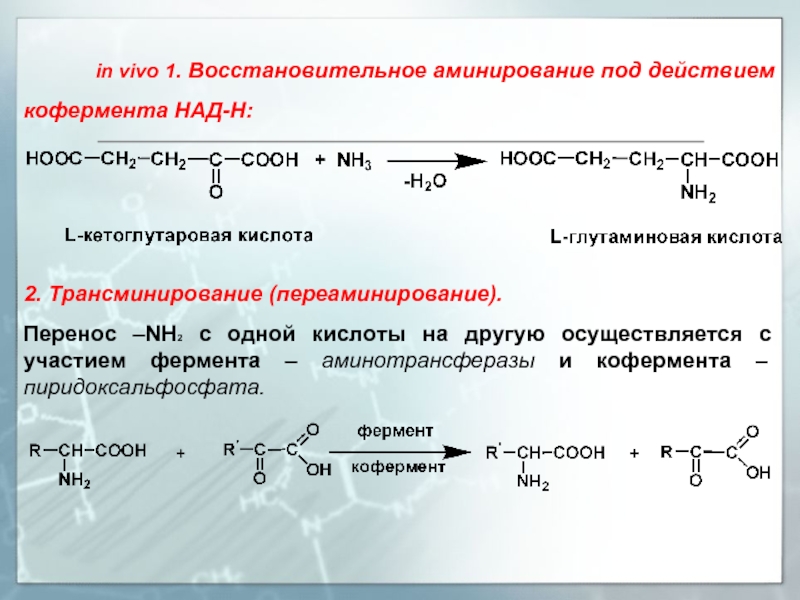
- 18. in vivo
- 19. 3. Образование оснований Шиффа Реакция аминокислот
- 20. 4. Реакция с 2,4-динитрофторбензолом, лежащая в основе
- 21. Качественные реакции на аминокислоты: а) реакция
- 22. в) Ксантопротеиновая реакция используется для обнаружения α-аминокислот,
- 23. д) Биуретовая реакция - важная реакция для
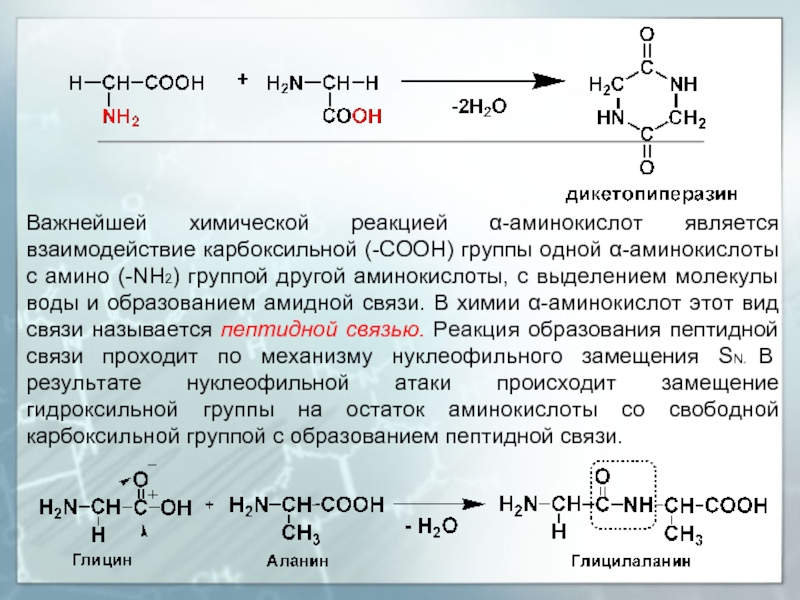
- 24. Важнейшей химической реакцией α-аминокислот является взаимодействие карбоксильной
- 25. Пептиды - это сложные цепочечные
- 26. глицилаланин аланилглицин глицилглицин
- 27. Следующий этап синтеза дипептида – активация карбоксильной
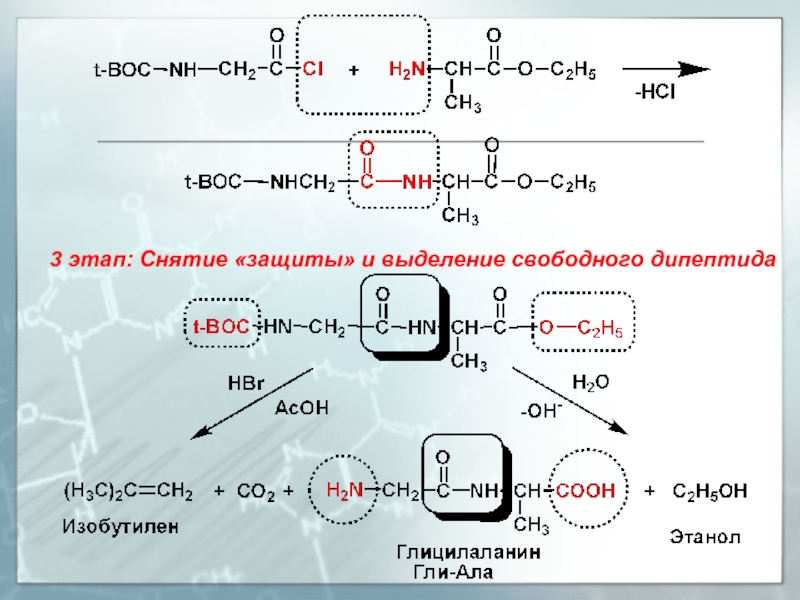
- 28. 3 этап: Снятие «защиты» и выделение свободного дипептида
- 29. Пептидные гормоны и нейропептиды, например, регулируют большинство
- 30. Первичная структура белка - последовательность аминокислот
- 31. СПАСИБО ЗА ВНИМАНИЕ !
Слайд 1Запорожский государственный медицинский университет
Кафедра органической и биоорганической химии
α-аминокислоты, пептиды, белки
Слайд 2 Аминокислоты - это органические соединения, содержащие в составе молекулы основную
Слайд 3
В природе встречаются главным образом а-аминокислоты. α-аминокислоты являются составными частями белков
общая формула α- аминокислот
Они обязательно содержат карбоксильную и аминогруппу, находящиеся у одного и того же тома – α-углеродного атома. Первая α-аминокислота – глицин - была выделена в 1820 году французским исследователем Браконно, кислотным гидролизом различных тканей (кожа, сухожилия, хрящи). В 1871 году Любавин показал роль α-аминокислот, как структурных элементов белка.
Слайд 4Номенклатура аминокислот
Названия аминокислот произошли в основном от исходных материалов, из которых
аспарагин (от лат. asparagus — спаржа) получен из сока спаржи,
цистеин и цистин (от греч. cystis — мочевой пузырь) — из камней мочевого пузыря,
глутаминовая кислота (от нем. das Gluten — клейковина) — из клейковины пшеницы,
серин (от греч. serös — шелковичный червь) — из шелка
тирозин(от греч. tyros — сыр) — из сыра.
α-аминокислоты – кристаллические вещества, растворимые в воде. Основным источником α-аминокислот для животного организма служат пищевые белки. Многие α-аминокислоты синтезируются самим организмом и называются заменимые аминокислоты. Некоторые α-аминокислоты синтезироваться в организме не могут и должны поступать извне. Такие кислоты наз. незаменимые. К ним относятся: валин, лейцин, изолейцин, лизин, треонин, метионин, фенилаланин, триптофан.
Слайд 5 α-аминокислоты классифицируются в зависимости от признака, положенного в основу:
Алифатические α-аминокислоты:
глицин, α-аминоуксусная кислота, 2-аминоэтановая кислота
аланин, 2-аминпропановая кислота, α-аминопропановая кислота
валин, 2-амино-3-метилбутановая кислота, α-аминоизовалериановая кислота
лейцин, 2-амино-3-метилпентановая кислота, α-аминоизокапроновая кислота
изолейцин, 2-амино-4-метилпентановая кислота
- серин, 2-амино-3-гидроксипропановая кислота
Слайд 6-треонин, 2-амино-3-
цистеин, 2-амино-3-гидроксибутановая кислота
метионин
фенилаланин, α-амино-β-фенилпропановая кислота
тирозин, α-амино-β-(4-гидроксифенил)
пропановая кислота
Ароматические (аминокислоты содержащие ароматический фрагмент):
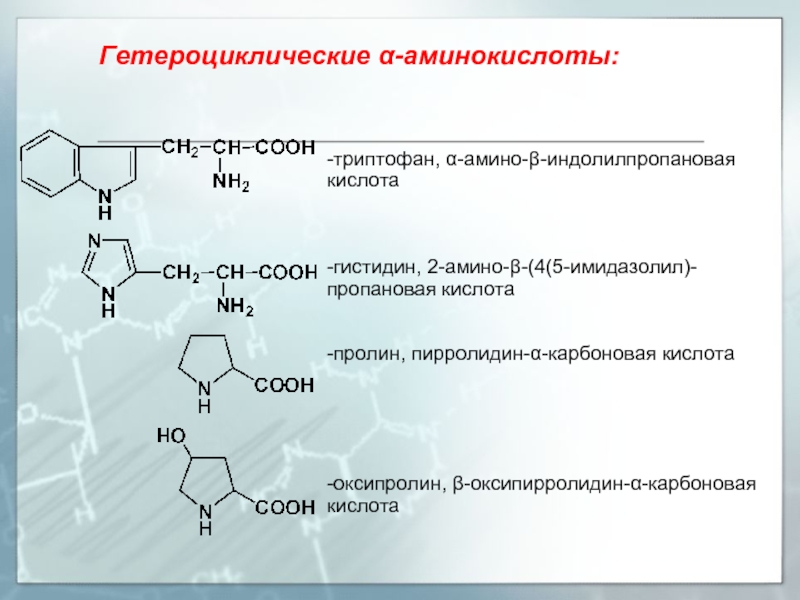
Слайд 7Гетероциклические α-аминокислоты:
-триптофан, α-амино-β-индолилпропановая кислота
-гистидин, 2-амино-β-(4(5-имидазолил)-пропановая кислота
-пролин, пирролидин-α-карбоновая кислота
-оксипролин, β-оксипирролидин-α-карбоновая кислота
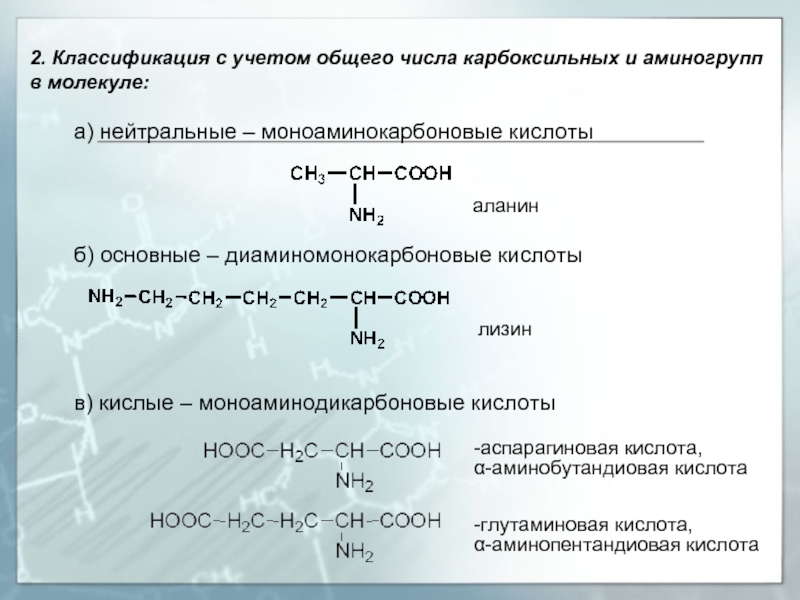
Слайд 82. Классификация с учетом общего числа карбоксильных и аминогрупп в молекуле:
аланин
б) основные – диаминомонокарбоновые кислоты лизин
в) кислые – моноаминодикарбоновые кислоты
-аспарагиновая кислота,
α-аминобутандиовая кислота
-глутаминовая кислота,
α-аминопентандиовая кислота
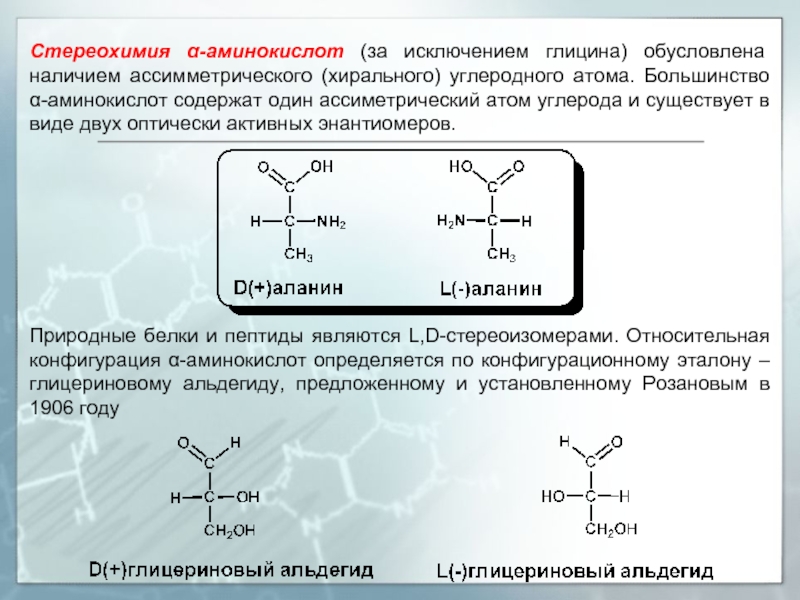
Слайд 9Стереохимия α-аминокислот (за исключением глицина) обусловлена наличием ассимметрического (хирального) углеродного атома.
Природные белки и пептиды являются L,D-стереоизомерами. Относительная конфигурация α-аминокислот определяется по конфигурационному эталону – глицериновому альдегиду, предложенному и установленному Розановым в 1906 году
Слайд 10По R-,S-системе α-аминокислоты имеющие L-конфигурацию соответствуют S- изомерам, а D-конфигурация соответствует
Знак вращения определяется экспериментально с помощью поляриметра. Правое вращение обозначается знаком (+), левое – знаком (-).
Слайд 11Способы получения аминокислот:
in vitro 1. Аммонолиз галогенкарбоновых кислот:
2. Циангидринный способ получения ( метод Штрекера):
Слайд 12
in vivo 1.
2. Трансминирование (переаминирование).
Перенос –NH2 с одной кислоты на другую осуществляется с участием фермента – аминотрансферазы и кофермента – пиридоксальфосфата.
Слайд 13
Амфотерность аминокислот
Благодаря наличию у аминокислот гидрофильных свойств, они легко растворимы в
Это равновесная система биполярного иона, катионной и анионной форм молекулы и зависит от рН среды.
Химические свойства аминокислот:
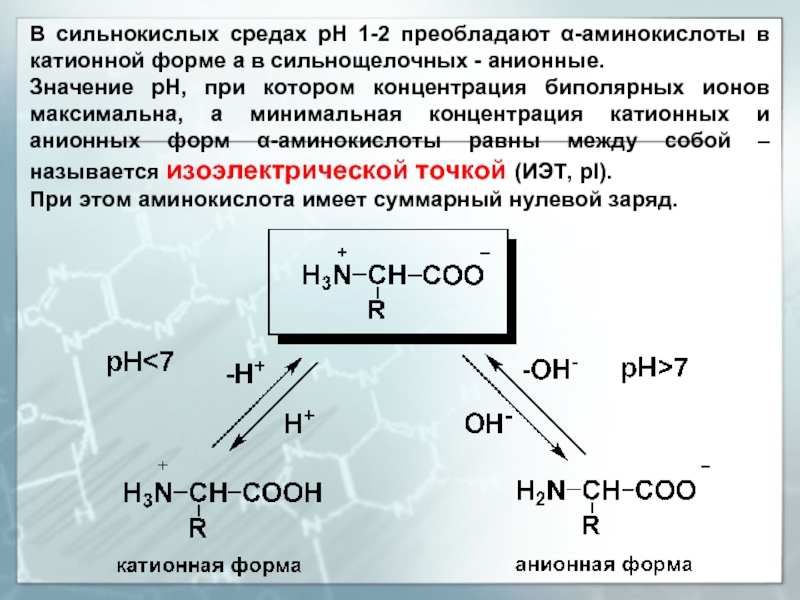
Слайд 14В сильнокислых средах рН 1-2 преобладают α-аминокислоты в катионной форме а
Значение рН, при котором концентрация биполярных ионов максимальна, а минимальная концентрация катионных и анионных форм α-аминокислоты равны между собой – называется изоэлектрической точкой (ИЭТ, рI).
При этом аминокислота имеет суммарный нулевой заряд.
Слайд 15Реакции по карбоксильной группе:
1.Образование внутрикомплексных (хелатных) солей с катионами тяжелых металлов:
2. Получение сложных эфиров:
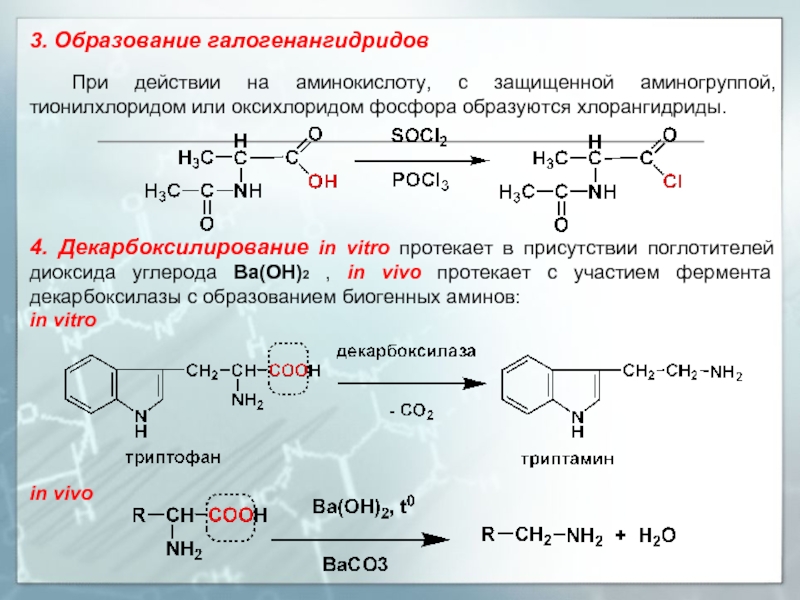
Слайд 163. Образование галогенангидридов
При действии на аминокислоту, с защищенной аминогруппой, тионилхлоридом
4. Декарбоксилирование in vitro протекает в присутствии поглотителей диоксида углерода Ва(ОН)2 , in vivo протекает с участием фермента декарбоксилазы с образованием биогенных аминов:
in vitro
in vivo
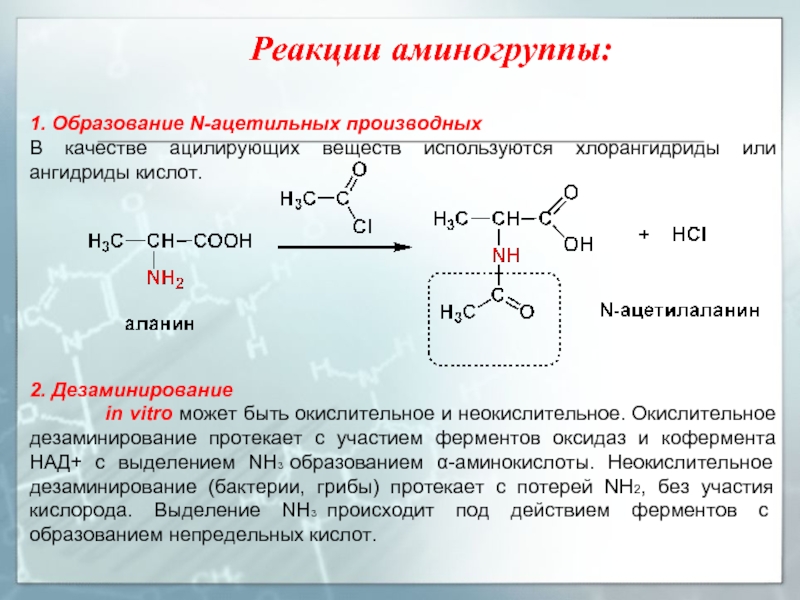
Слайд 17Реакции аминогруппы:
1. Образование N-ацетильных производных
В качестве ацилирующих веществ используются хлорангидриды или
2. Дезаминирование
in vitro может быть окислительное и неокислительное. Окислительное дезаминирование протекает с участием ферментов оксидаз и кофермента НАД+ с выделением NH3 образованием α-аминокислоты. Неокислительное дезаминирование (бактерии, грибы) протекает с потерей NH2, без участия кислорода. Выделение NH3 происходит под действием ферментов с образованием непредельных кислот.
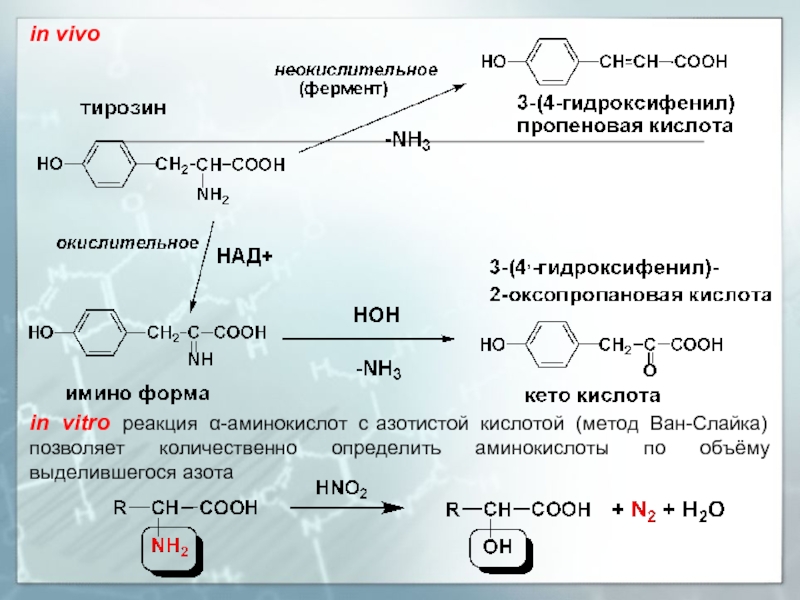
Слайд 18in vivo
in vitro реакция α-аминокислот с азотистой кислотой (метод Ван-Слайка) позволяет
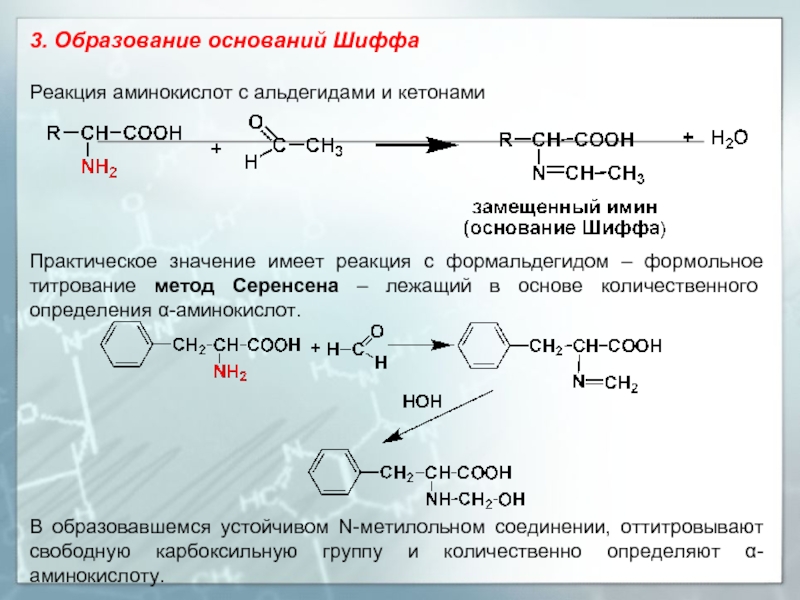
Слайд 193. Образование оснований Шиффа
Реакция аминокислот с альдегидами и кетонами
Практическое значение имеет реакция с формальдегидом – формольное титрование метод Серенсена – лежащий в основе количественного определения α-аминокислот.
В образовавшемся устойчивом N-метилольном соединении, оттитровывают свободную карбоксильную группу и количественно определяют α-аминокислоту.
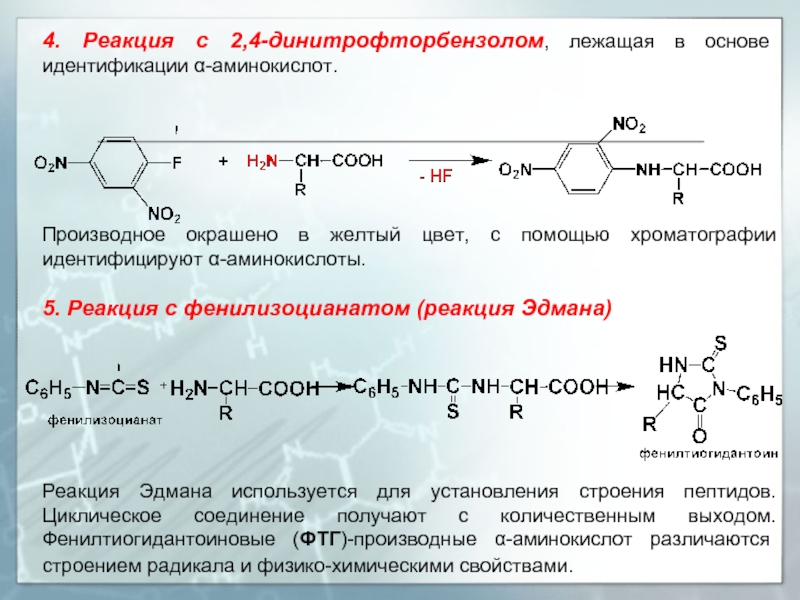
Слайд 204. Реакция с 2,4-динитрофторбензолом, лежащая в основе идентификации α-аминокислот.
Производное окрашено в
5. Реакция с фенилизоцианатом (реакция Эдмана)
Реакция Эдмана используется для установления строения пептидов. Циклическое соединение получают с количественным выходом. Фенилтиогидантоиновые (ФТГ)-производные α-аминокислот различаются строением радикала и физико-химическими свойствами.
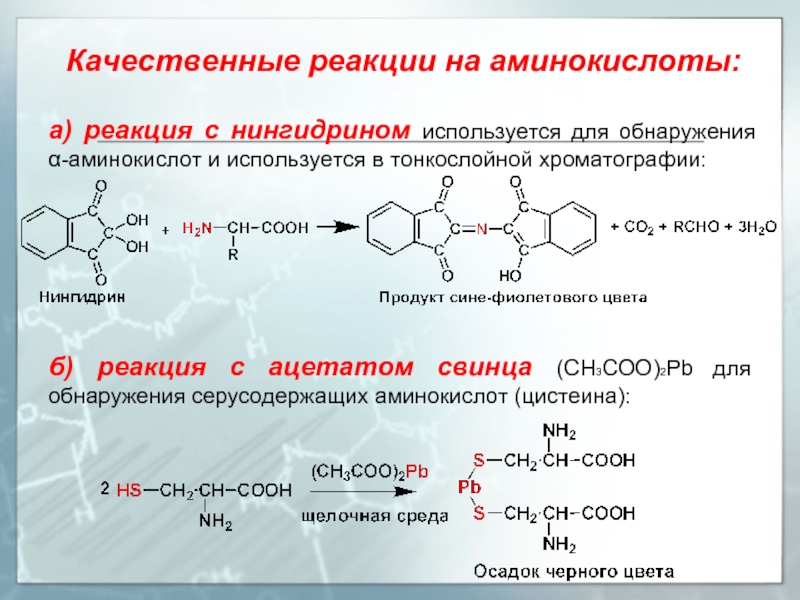
Слайд 21Качественные реакции на аминокислоты:
а) реакция с нингидрином используется для обнаружения α-аминокислот
б) реакция с ацетатом свинца (CH3COO)2Pb для обнаружения серусодержащих аминокислот (цистеина):
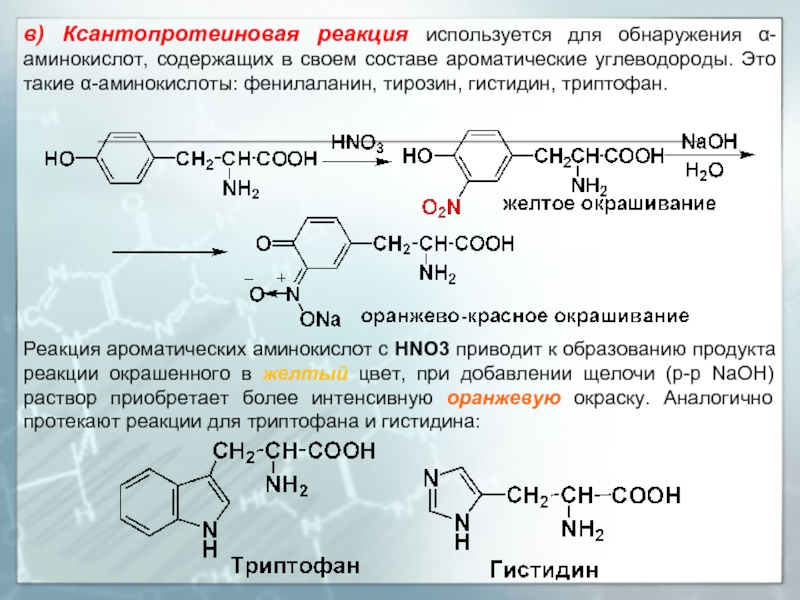
Слайд 22в) Ксантопротеиновая реакция используется для обнаружения α-аминокислот, содержащих в своем составе
Реакция ароматических аминокислот с HNO3 приводит к образованию продукта реакции окрашенного в желтый цвет, при добавлении щелочи (р-р NaOH) раствор приобретает более интенсивную оранжевую окраску. Аналогично протекают реакции для триптофана и гистидина:
Слайд 23д) Биуретовая реакция - важная реакция для пептидов и белков, служащая
Фрагмент биурета в хелатном комплексе имеет имидную структуру.
Наличие двух функциональных групп –СООН и –NН2 в α-аминокислотах обуславливает образование различных продуктов, в зависимости от порядка взаимодействия и условий проведения реакций.
Если в реакции между двумя α-аминокислотами участвуют две аминогруппы и две карбоксильные группы, с выделением двух молекул воды, в этом случае образуется циклический продукт – дикетопиперазин.
Слайд 24Важнейшей химической реакцией α-аминокислот является взаимодействие карбоксильной (-СOOH) группы одной α-аминокислоты
Слайд 25
Пептиды - это сложные цепочечные молекулы, содержащие от двух до
Учитывая бифункциональность α-аминокислот очень сложно получить пептид с определенной последовательностью, без применения специальных методов.
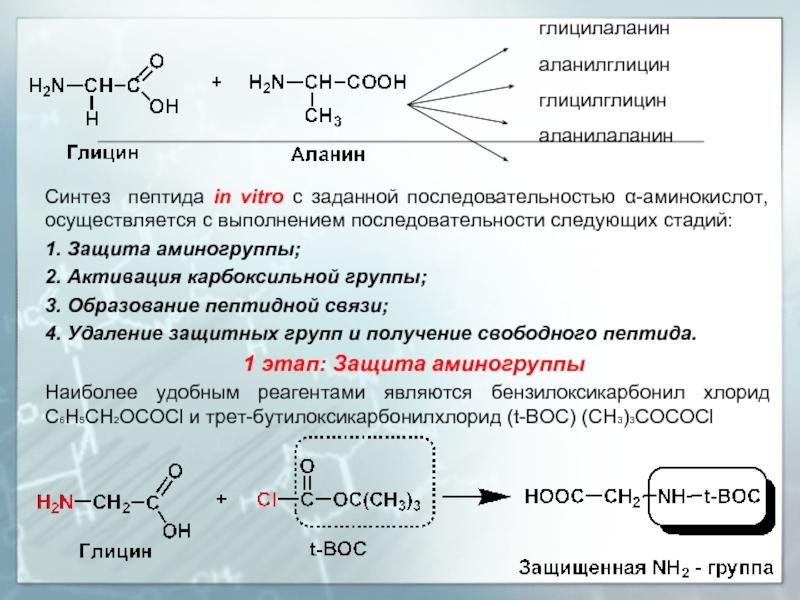
В промышленном производстве с глицином и аланином в случае сочетания двух компонентов можно получить 4 пептида.
Слайд 26 глицилаланин
аланилглицин
глицилглицин
аланилаланин
Синтез пептида in vitro с заданной последовательностью
1. Защита аминогруппы;
2. Активация карбоксильной группы;
3. Образование пептидной связи;
4. Удаление защитных групп и получение свободного пептида.
1 этап: Защита аминогруппы
Наиболее удобным реагентами являются бензилоксикарбонил хлорид С6Н5СН2ОСОСl и трет-бутилоксикарбонилхлорид (t-BOC) (СН3)3СОСОСl
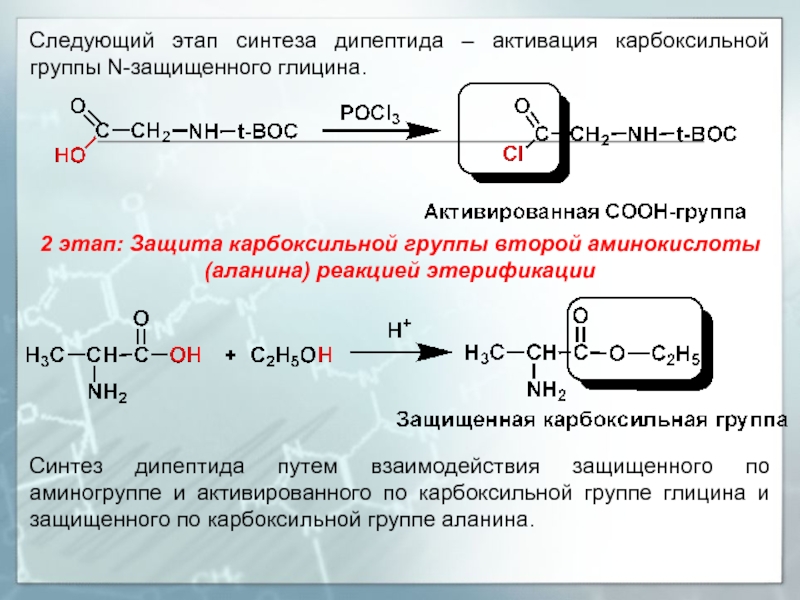
Слайд 27Следующий этап синтеза дипептида – активация карбоксильной группы N-защищенного глицина.
2
Синтез дипептида путем взаимодействия защищенного по аминогруппе и активированного по карбоксильной группе глицина и защищенного по карбоксильной группе аланина.
Слайд 29Пептидные гормоны и нейропептиды, например, регулируют большинство процессов организма человека, в
Белки-высокомолекулярные соединения, построенные из аминокислот и составляющие большую часть органических веществ, содержащихся в живой клетке. Молекулы белков состоят из полипептидных цепей организованных в сложные трехмерные структуры.
Классификация белков
По функциям: Ферменты, структурные, транспортные, резервные, рецепторные.
2) По растворимости: глобулярные и фибриллярные
3) По происхождению: растительные, животные, вирусные и бактериальные.
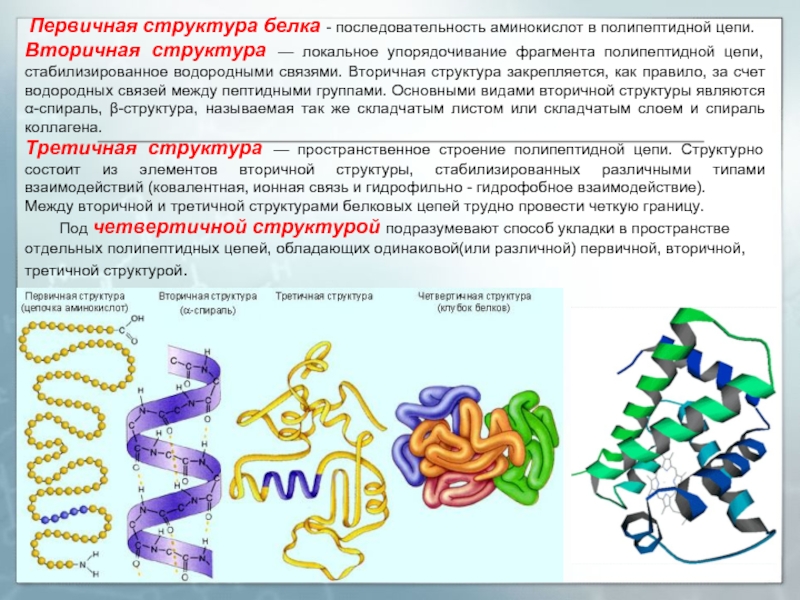
Слайд 30 Первичная структура белка - последовательность аминокислот в полипептидной цепи.
Вторичная
Третичная структура — пространственное строение полипептидной цепи. Структурно состоит из элементов вторичной структуры, стабилизированных различными типами взаимодействий (ковалентная, ионная связь и гидрофильно - гидрофобное взаимодействие).
Между вторичной и третичной структурами белковых цепей трудно провести четкую границу.
Под четвертичной структурой подразумевают способ укладки в пространстве отдельных полипептидных цепей, обладающих одинаковой(или различной) первичной, вторичной, третичной структурой.