- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Теоретические основы органической химии презентация
Содержание
- 1. Теоретические основы органической химии
- 2. Электронная структура атома углерода в органических соединениях
- 3. Электронная структура атома углерода в органических соединениях основное состояние возбужденное состояние
- 4. Электронная структура атома углерода в органических соединениях
- 5. Гибридизация Атомная орбиталь — это
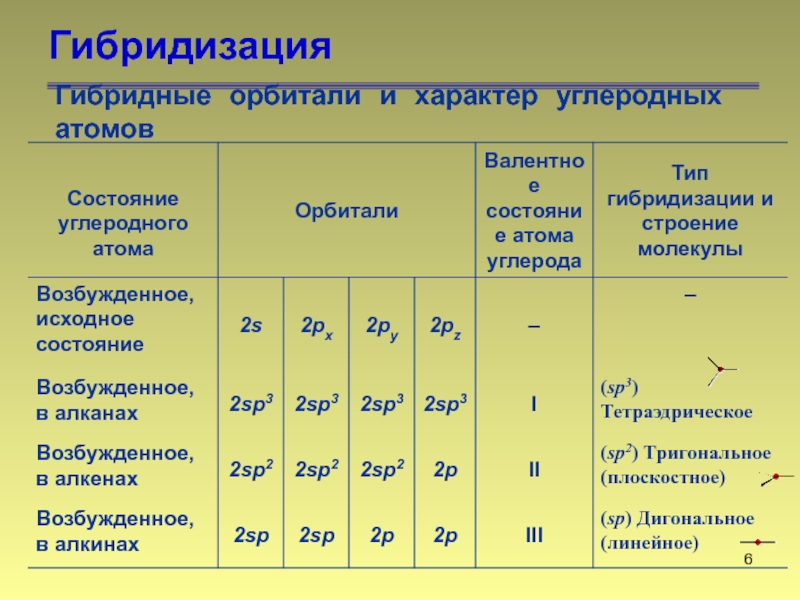
- 6. Гибридизация Гибридные орбитали и характер углеродных атомов
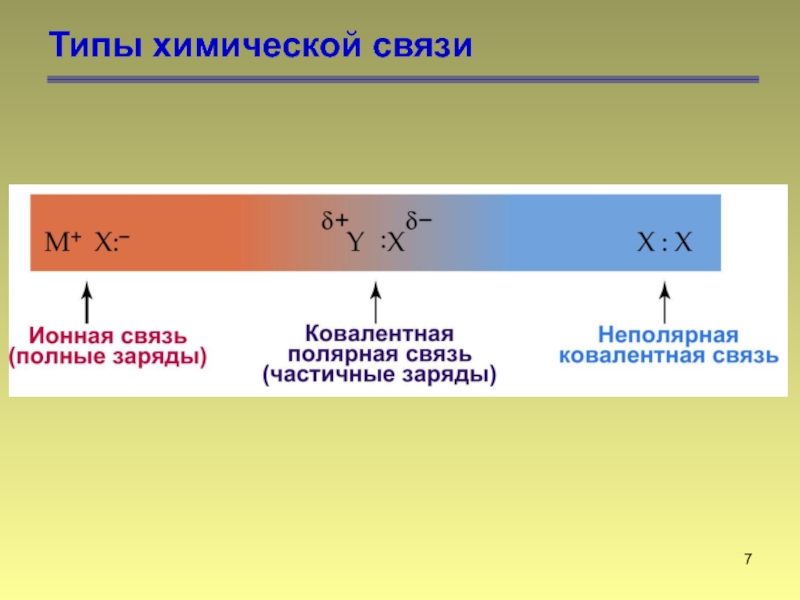
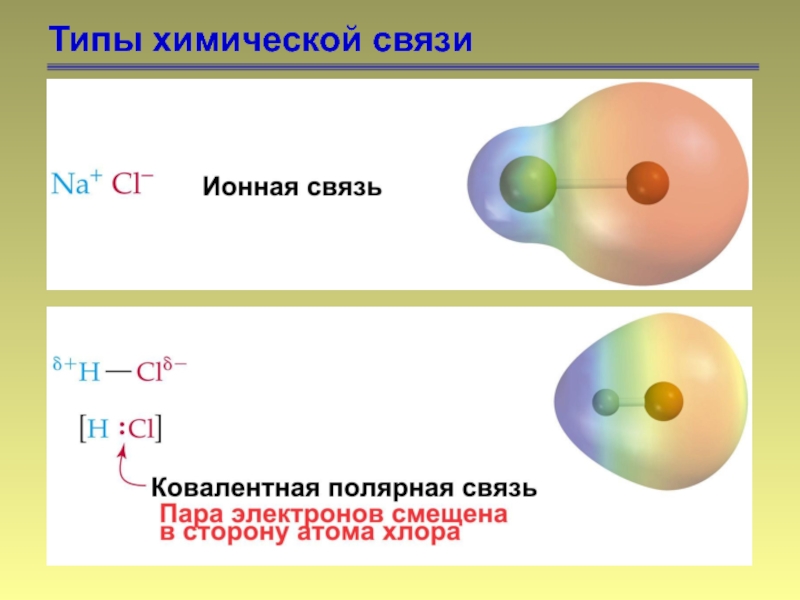
- 7. Типы химической связи
- 8. Типы химической связи
- 9. Типы химической связи
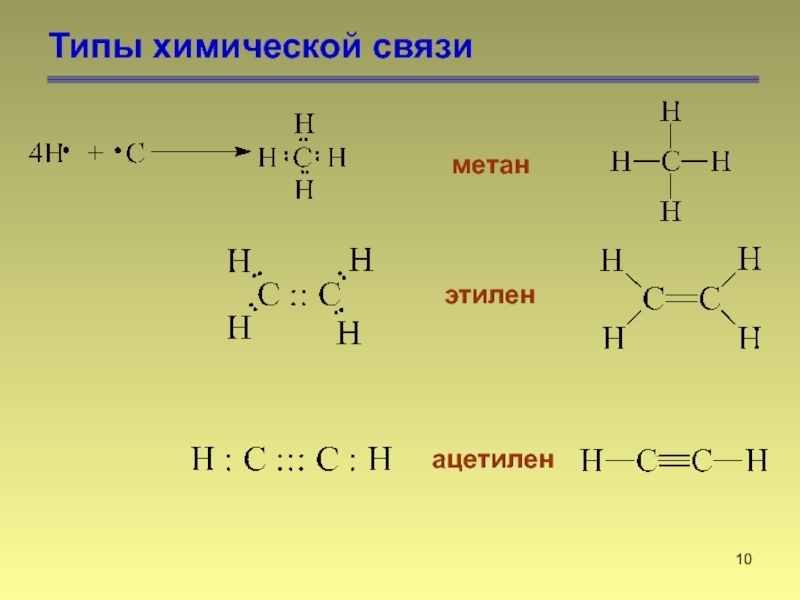
- 10. Типы химической связи метан этилен ацетилен
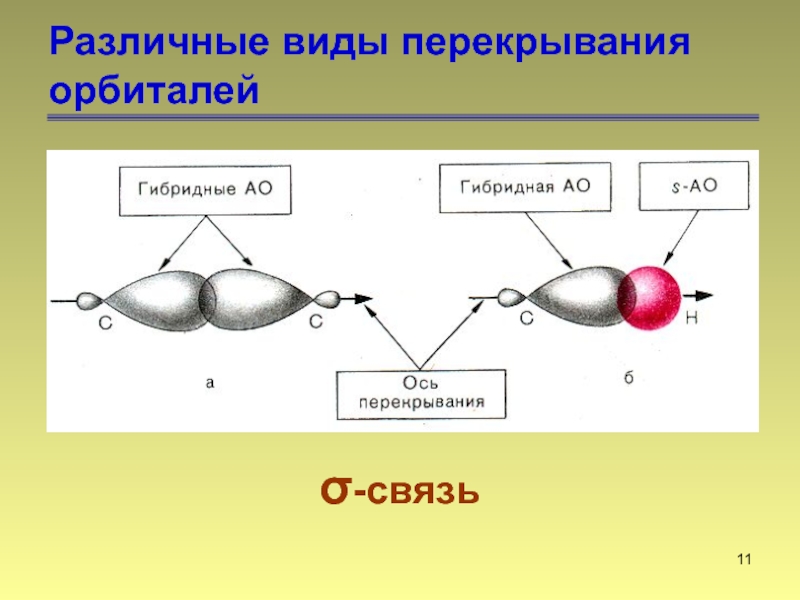
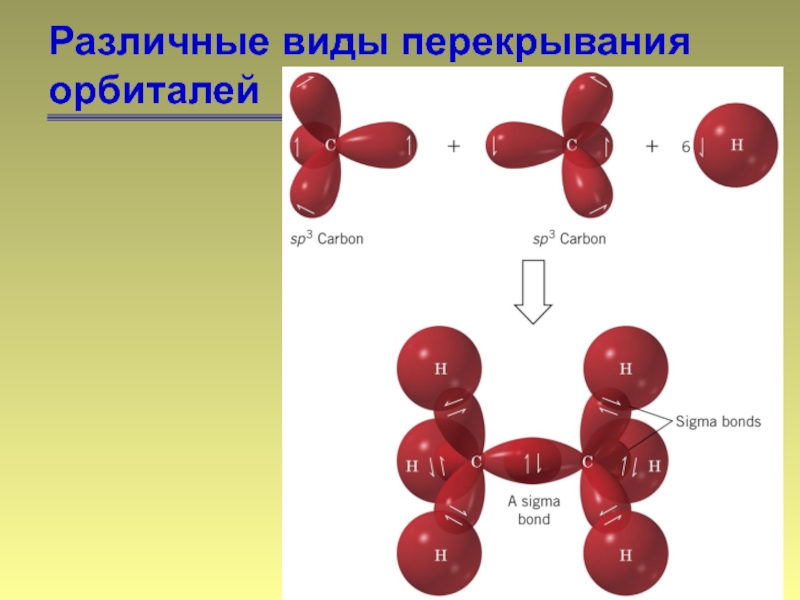
- 11. Различные виды перекрывания орбиталей σ-связь
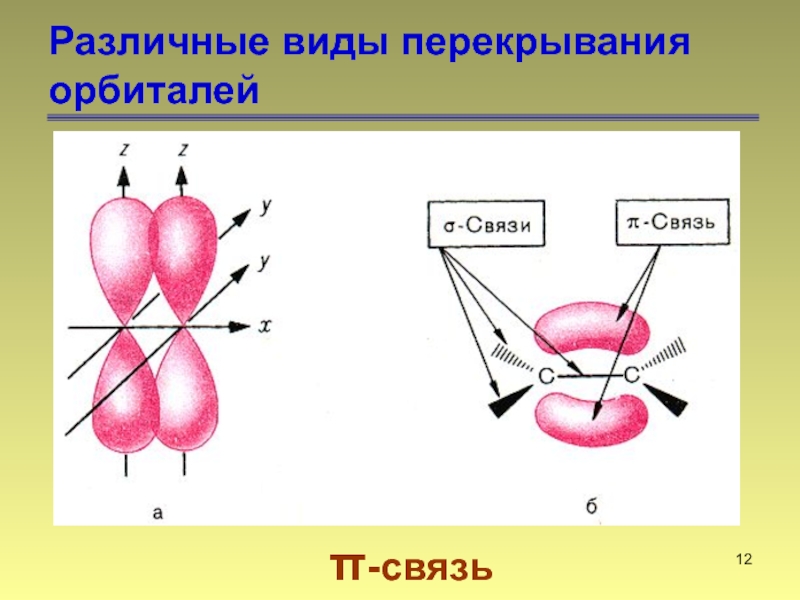
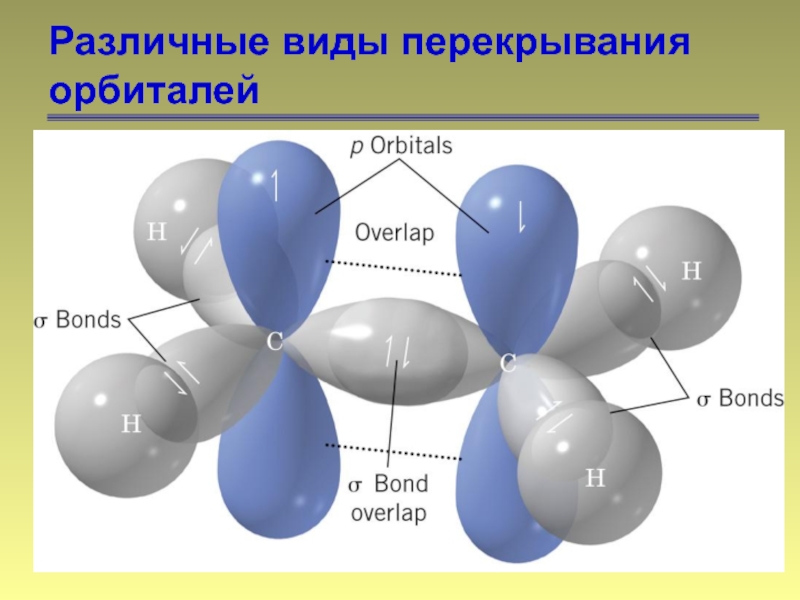
- 12. Различные виды перекрывания орбиталей π-связь
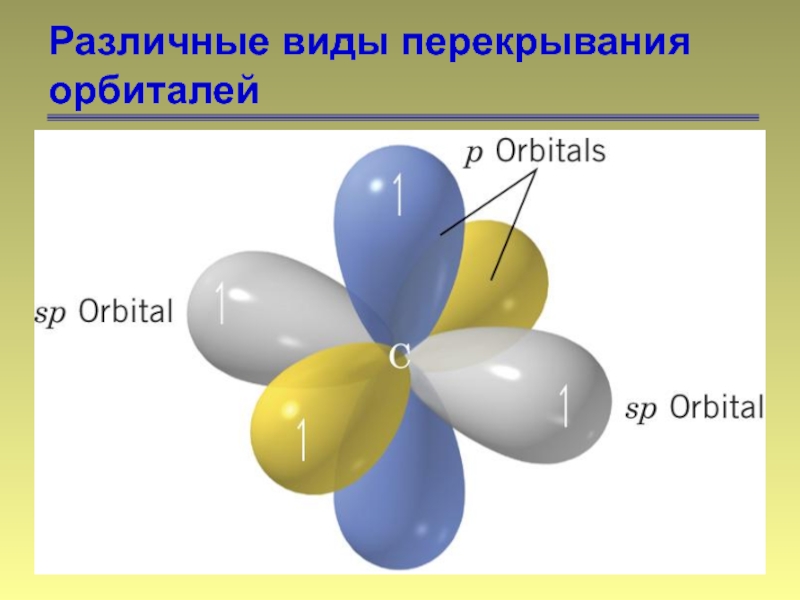
- 13. Различные виды перекрывания орбиталей
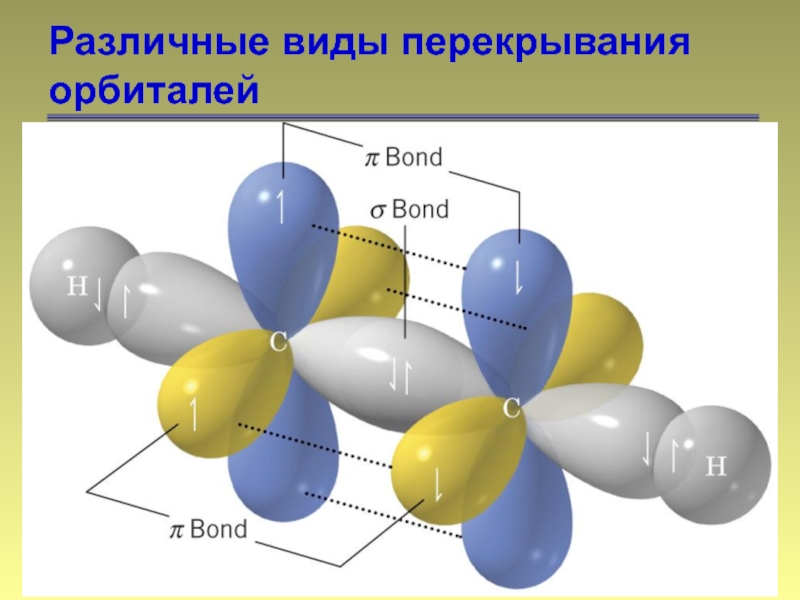
- 14. Различные виды перекрывания орбиталей
- 15. Различные виды перекрывания орбиталей
- 16. Различные виды перекрывания орбиталей
- 17. Различные виды перекрывания орбиталей
- 18. Свойства ковалентной связи Ковалентная связь
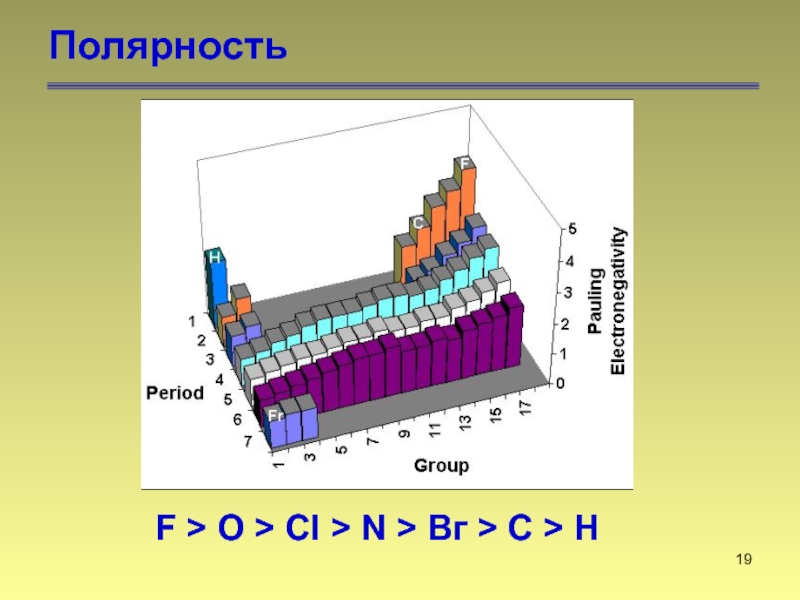
- 19. Полярность F > O >
- 20. Полярность
- 21. Поляризуемость Ковалентная связь обладает поляризуемостью
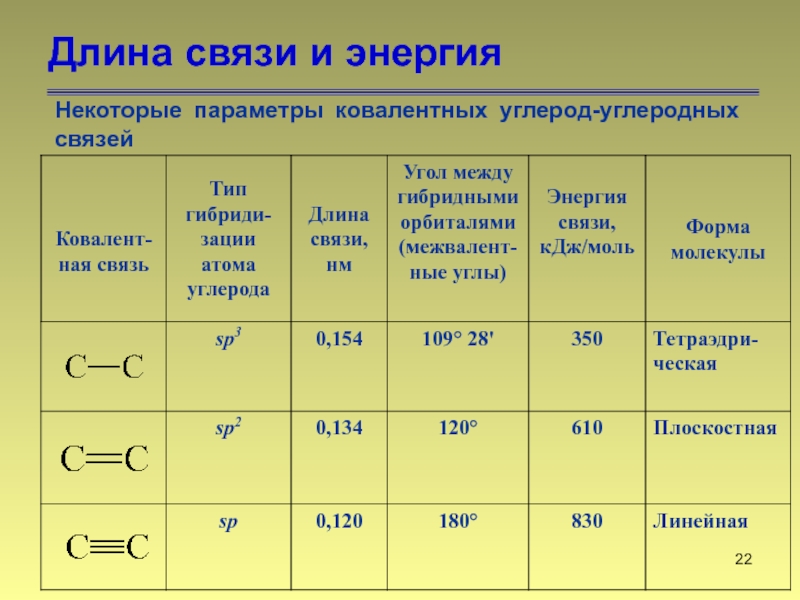
- 22. Длина связи и энергия Некоторые параметры ковалентных углерод-углеродных связей
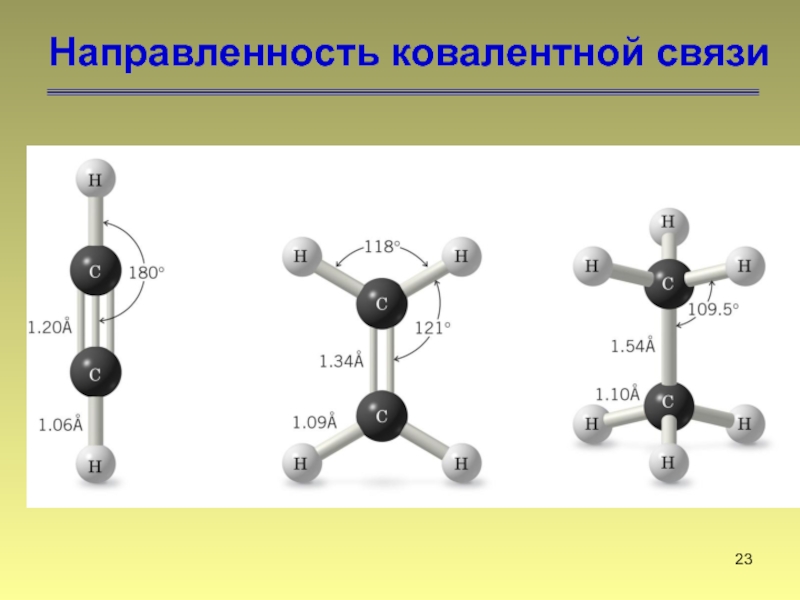
- 23. Направленность ковалентной связи
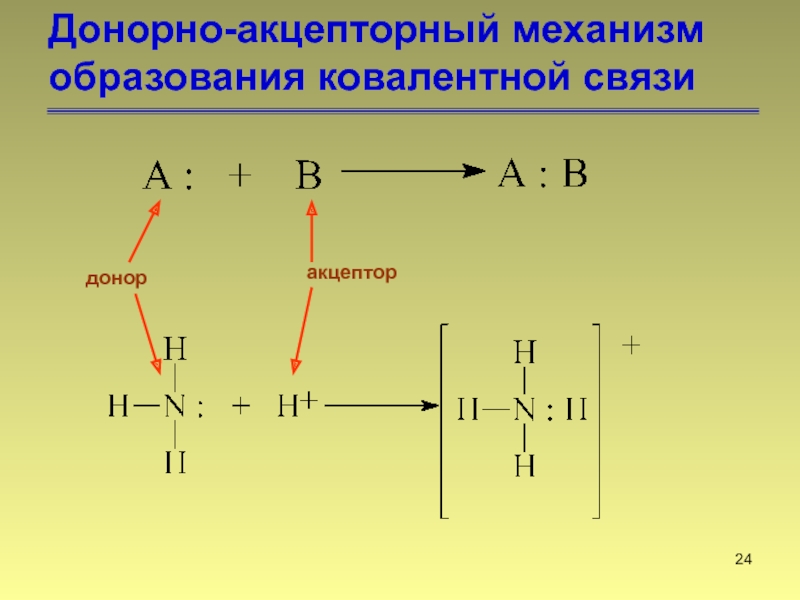
- 24. Донорно-акцепторный механизм образования ковалентной связи донор акцептор
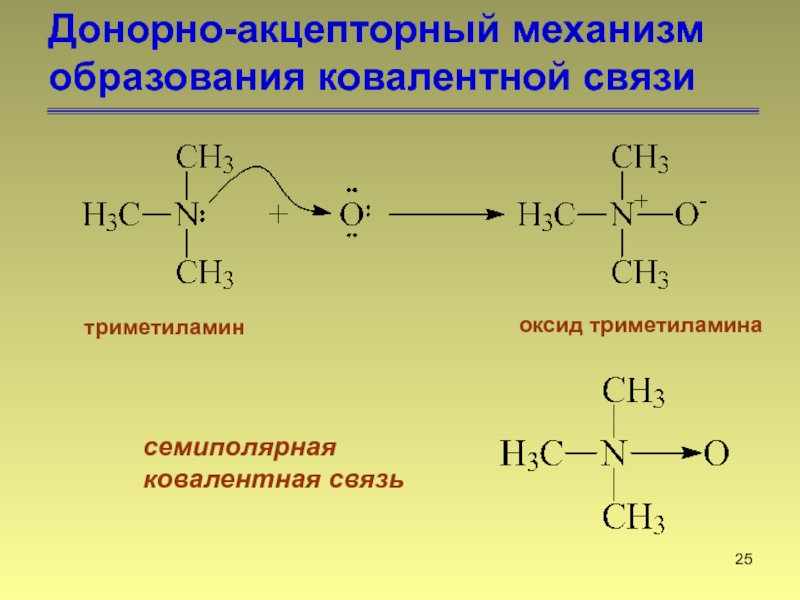
- 25. Донорно-акцепторный механизм образования ковалентной связи триметиламин оксид триметиламина семиполярная ковалентная связь
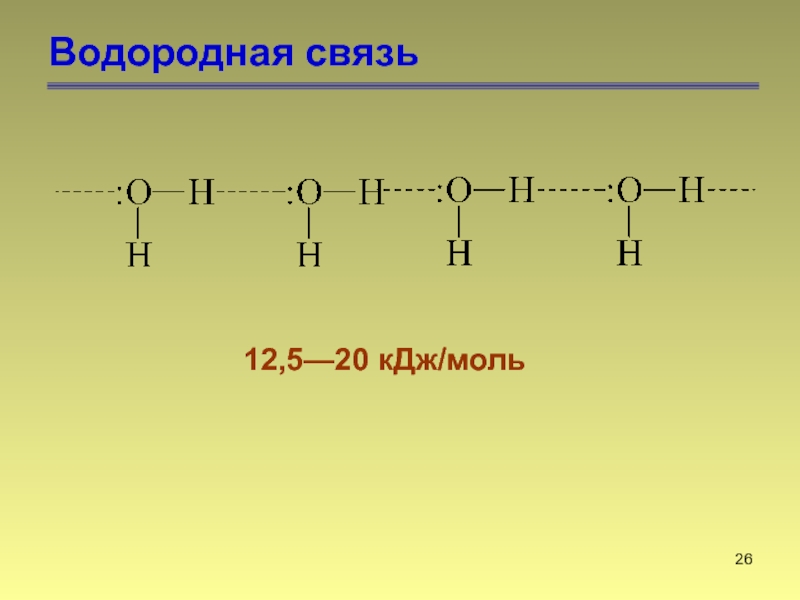
- 26. Водородная связь 12,5—20 кДж/моль
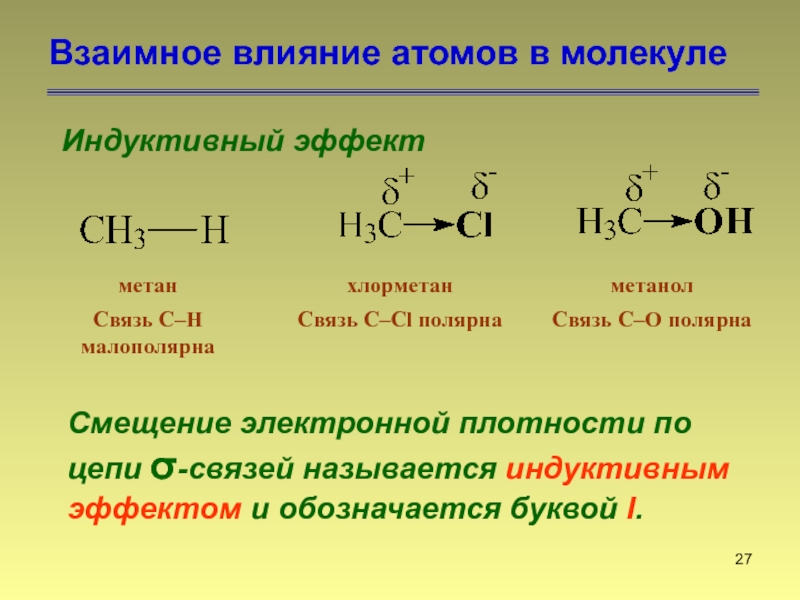
- 27. Взаимное влияние атомов в молекуле Индуктивный
- 28. Взаимное влияние атомов в молекуле Индуктивный
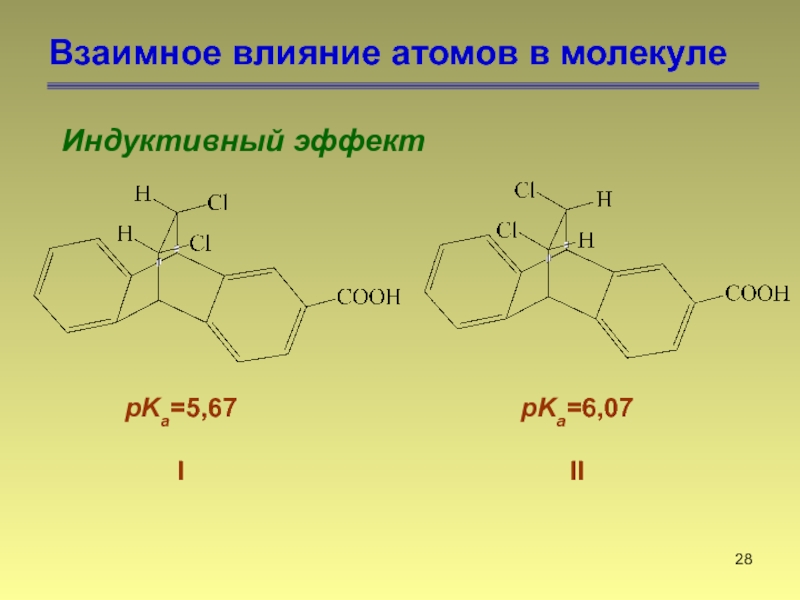
- 29. Взаимное влияние атомов в молекуле Индуктивный
- 30. Взаимное влияние атомов в молекуле Индуктивный
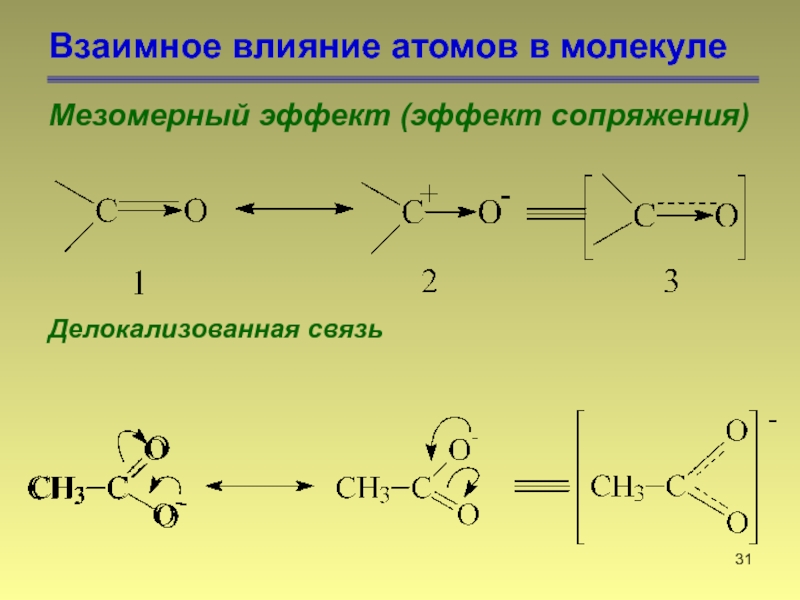
- 31. Взаимное влияние атомов в молекуле Мезомерный эффект (эффект сопряжения) Делокализованная связь
- 32. Взаимное влияние атомов в молекуле Мезомерный эффект (эффект сопряжения)
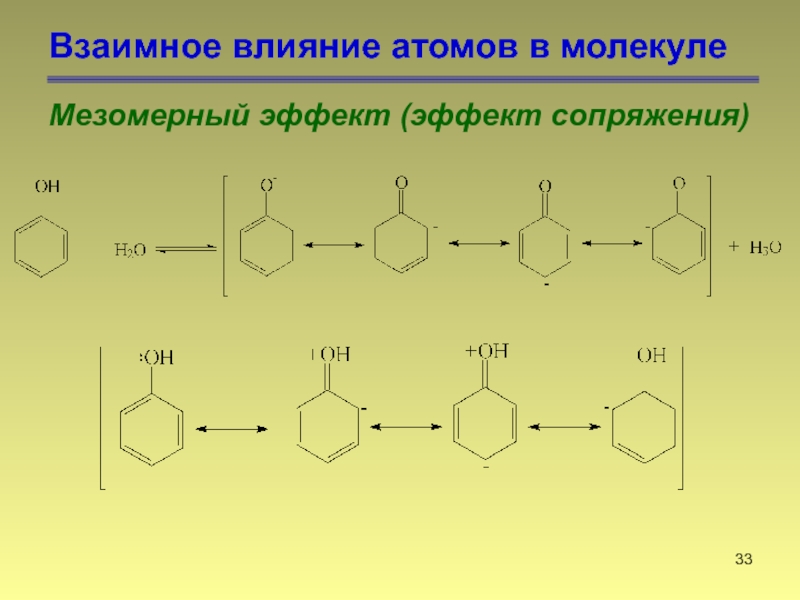
- 33. Взаимное влияние атомов в молекуле Мезомерный эффект (эффект сопряжения)
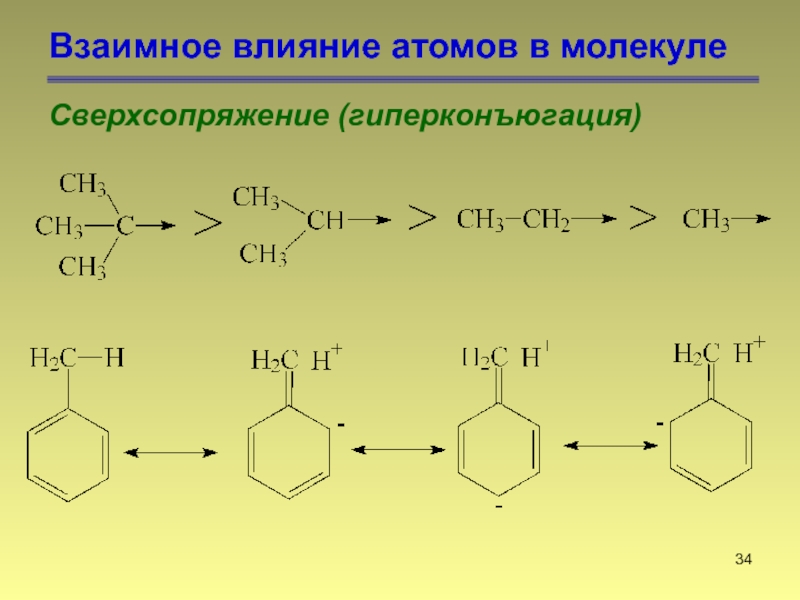
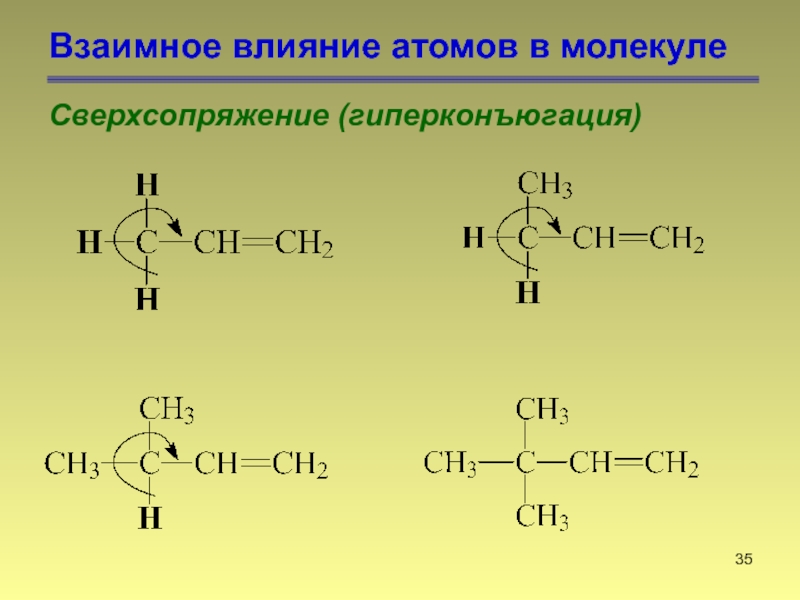
- 34. Взаимное влияние атомов в молекуле Сверхсопряжение (гиперконъюгация)
- 35. Взаимное влияние атомов в молекуле Сверхсопряжение (гиперконъюгация)
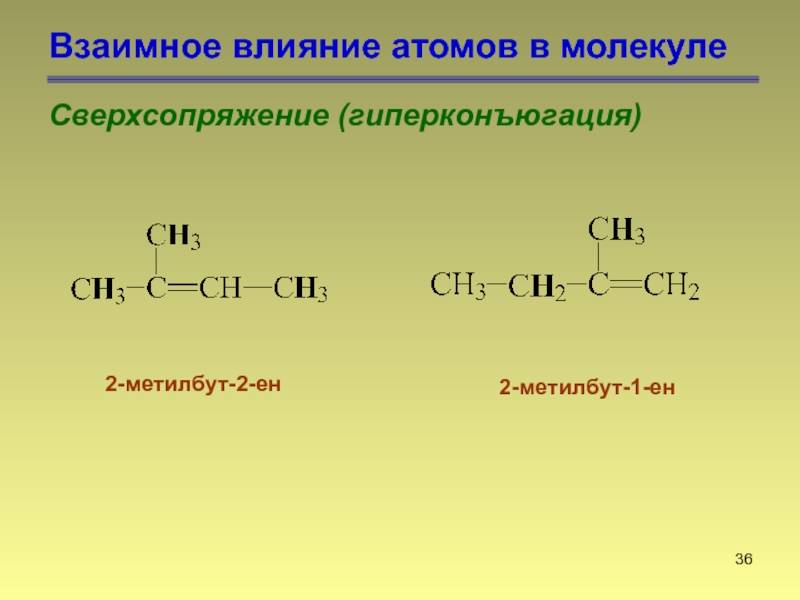
- 36. Взаимное влияние атомов в молекуле Сверхсопряжение (гиперконъюгация) 2-метилбут-2-ен 2-метилбут-1-ен
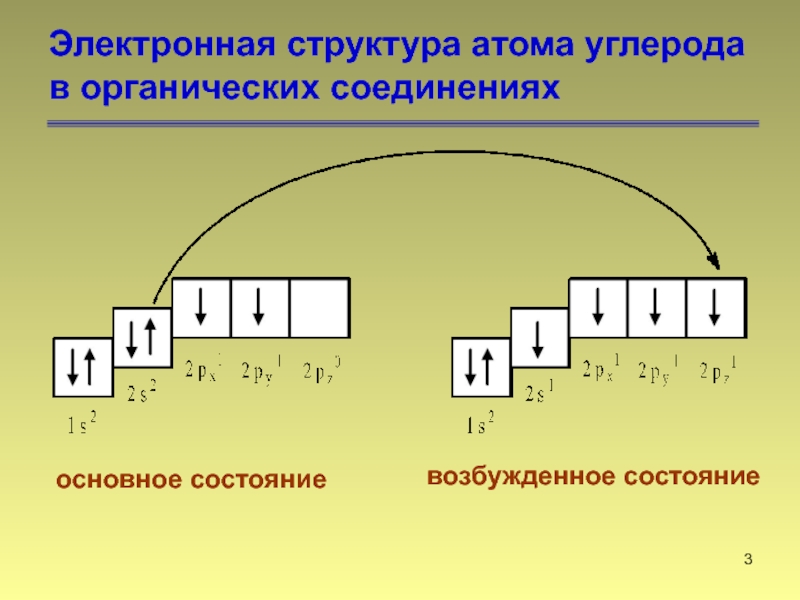
Слайд 3Электронная структура атома углерода
в органических соединениях
основное состояние
возбужденное состояние
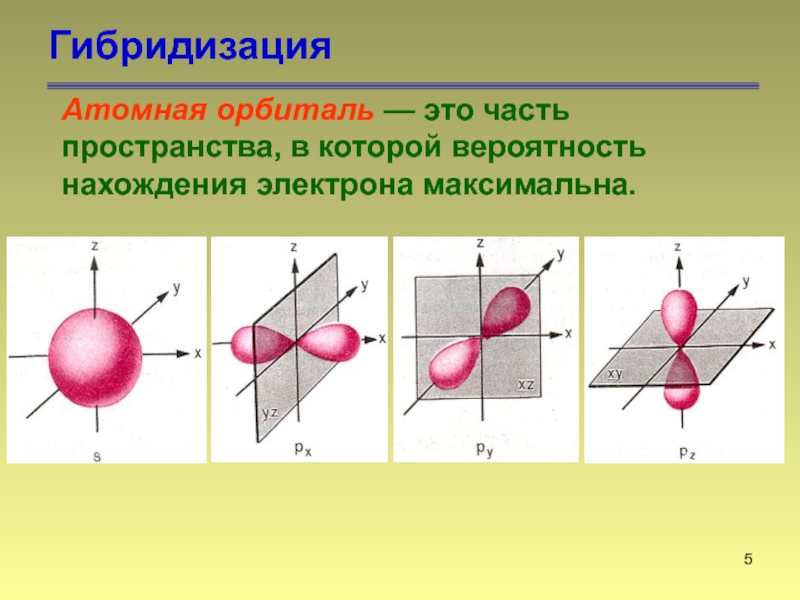
Слайд 5Гибридизация
Атомная орбиталь — это часть пространства, в которой вероятность нахождения
электрона максимальна.
Слайд 18Свойства ковалентной связи
Ковалентная связь характеризуется несколькими параметрами: полярностью, длиной, энергией и
направленностью в пространстве (углами между связями).
Слайд 21Поляризуемость
Ковалентная связь обладает поляризуемостью — способностью изменять свою полярность, например, под
влиянием внешнего воздействия.
π-связи поляризуются гораздо легче, чем σ-связи
π-связи поляризуются гораздо легче, чем σ-связи
Слайд 25Донорно-акцепторный механизм образования ковалентной связи
триметиламин
оксид триметиламина
семиполярная
ковалентная связь
Слайд 27Взаимное влияние атомов в молекуле
Индуктивный эффект
Смещение электронной плотности по
цепи σ-связей называется индуктивным эффектом и обозначается буквой I.
Слайд 29Взаимное влияние атомов в молекуле
Индуктивный эффект
Электроноакцепторные заместители,
т.е. атом
или группа атомов, смещающие электронную плотность σ-связи от атома углерода, проявляют отрицательный индуктивный эффект (-I-эффект).
Электронодонорные заместители, т. е. атом или группа атомов, смещающие электронную плотность к атому углерода, проявляют положительный индуктивный эффект (+I-эффект).
Электронодонорные заместители, т. е. атом или группа атомов, смещающие электронную плотность к атому углерода, проявляют положительный индуктивный эффект (+I-эффект).
Слайд 30Взаимное влияние атомов в молекуле
Индуктивный эффект
+I-Эффект проявляют алифатические углеводородные
радикалы, т.е. алкильные радикалы (–CH3, –C2H5 и т. д.).
Большинство функциональных групп проявляют -I-эффект: –Hal, –NH2, –OH, >С=O, –COOH.
Большинство функциональных групп проявляют -I-эффект: –Hal, –NH2, –OH, >С=O, –COOH.
пропен