- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция 5. Красные пигменты презентация
Содержание
- 1. Лекция 5. Красные пигменты
- 2. Красная охра природный пигмент, цвет придают соединения
- 3. Сурик свинцовый смешанный оксид Рb (II) и
- 4. Киноварь природный минерал или искусственно получаемый сульфид
- 5. Красные пигменты Свинцовый сурик Киноварь
- 6. Красные пигменты Реальгар (природный минерал состава As4S4)
- 7. Красные пигменты Киноварь, реальгар, и сурьмяная красная,
- 8. Красные пигменты Для перевода в раствор: киноварь
- 9. Красные пигменты: обнаружение Hg2+ К капле раствора,
- 10. Красные пигменты Обнаружение As(V): к капле
- 11. Красный кадмий твердый раствор сульфида и селенида
- 12. Красные пигменты Обнаружение Cd2+: в каплю
- 13. Элементарный Se Медленная Аморфная кристаллизация структура
- 14. Красный хром основной хромат свинца РbСrО4·РbО меняет
- 15. Обнаружение Сr2О72- частицу пигмента растворяют в 30%-ной
- 16. Зеленые пигменты
- 17. Глауконит натуральный пигмент K+(Fe3+, Fe2+, Al, Mg)2х
- 18. Ярь-медянка ацетаты меди различного химического состава и
- 19. Малахит CuCO3·Cu(OH)2 под действием минеральных кислот вспенивается,
- 20. Медьсодержащие зеленые пигменты Определение пигментов, содержащих медь,
- 21. Зеленая Шееле Оливенит – основной метаарсенит меди
- 22. Швейнфуртская зелень арсенит-ацетат меди Сu(СН3СОО)2·ЗСu(AsO2)2 легко растворима в кислотах и щелочах.
- 23. Медьсодержащие зеленые пигменты Все медные зеленые пигменты
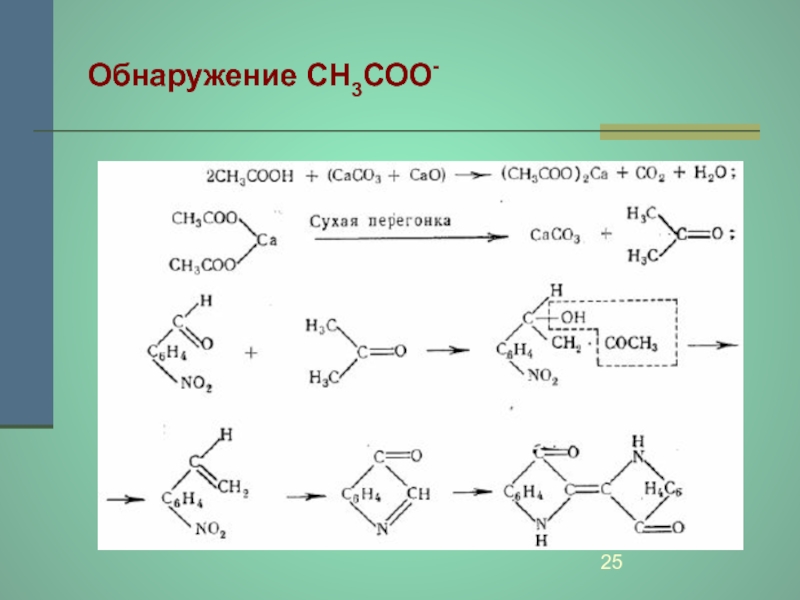
- 24. Зеленые пигменты Обнаружение СН3СОО-: частицу пигмента
- 25. Обнаружение СН3СОО-
- 26. Зеленый кобальт искусственный пигмент – твердый раствор
- 27. Хромовая зелень оксид хрома Сг2О3 трудно растворим
Слайд 2Красная охра
природный пигмент, цвет придают соединения Fe (III).
Красные железоокисные пигменты получают
также прокаливанием желтых охр при высоких температурах.
Пигмент термически устойчив при нагревании до 1000°С и не меняет окраску.
Плохо растворяется в кислотах. Для растворения частицу пигмента нагревают в конц. HCl.
Раствор анализируют на Fe3+ (см. берлинскую лазурь).
Пигмент термически устойчив при нагревании до 1000°С и не меняет окраску.
Плохо растворяется в кислотах. Для растворения частицу пигмента нагревают в конц. HCl.
Раствор анализируют на Fe3+ (см. берлинскую лазурь).
Слайд 3Сурик свинцовый
смешанный оксид Рb (II) и Рb (IV) 2РbО·РbО2 хорошо растворяется
в кислотах при нагревании.
При взаимодействии с HCl образуется белый творожистый осадок РbСl2.
При T 600° сурик переходит в желтый PbO.
Микрохимическое определение сурика заключается в обнаружении в растворе иона Рb2+ (см. свинцовые белила).
При взаимодействии с HCl образуется белый творожистый осадок РbСl2.
При T 600° сурик переходит в желтый PbO.
Микрохимическое определение сурика заключается в обнаружении в растворе иона Рb2+ (см. свинцовые белила).
Слайд 4Киноварь
природный минерал или искусственно получаемый сульфид ртути HgS
стойка по отношению к
кислотам и щелочам и растворяется только в царской водке (смесь одного объема конц. HNO3 с тремя объемами конц. НСl).
Слайд 6Красные пигменты
Реальгар (природный минерал состава As4S4) с трудом растворяется в концентрированных
кислотах и щелочах.
Сурьмяная красная (искусственный пигмент состава Sb2S3) плохо растворима в кислотах.
Сурьмяная красная (искусственный пигмент состава Sb2S3) плохо растворима в кислотах.
Слайд 7Красные пигменты
Киноварь, реальгар, и сурьмяная красная, являясь сульфидами, под действием кислот
выделяют H2S, обнаруживаемый по запаху и с помощью микрохимических реакций (см. ультрамарин).
При прокаливании реальгар и киноварь возгоняются, а сурьмяная красная разлагается с образованием желтого Sb2O5. Между собой эти пигменты различаются катионами:
Для идентификации киновари необходимо установить присутствие иона Hg2+,
реальгара – иона As3+,
сурьмяной красной – иона Sb3+.
При прокаливании реальгар и киноварь возгоняются, а сурьмяная красная разлагается с образованием желтого Sb2O5. Между собой эти пигменты различаются катионами:
Для идентификации киновари необходимо установить присутствие иона Hg2+,
реальгара – иона As3+,
сурьмяной красной – иона Sb3+.
Слайд 8Красные пигменты
Для перевода в раствор:
киноварь растворяют в царской водке при нагревании,
сурьмяную красную – в концентрированной HCl при нагревании,
реальгар – в концентрированной HNO3.
Слайд 9Красные пигменты: обнаружение Hg2+
К капле раствора, содержащего Hg2+, прибавляют каплю смеси
конц. растворов NH4CNS и Co(NO3)2 – образуются темносиние кристаллы Co[Hg(CNS)4] в виде игл, призм, сростков.
При работе с малыми количествами вещества, каплю раствора выпаривают досуха, а затем смачивают реагентом.
Предел обнаружения 0,04 мкг Hg (II), предельное разбавление 1:25000.
При работе с малыми количествами вещества, каплю раствора выпаривают досуха, а затем смачивают реагентом.
Предел обнаружения 0,04 мкг Hg (II), предельное разбавление 1:25000.
Слайд 10Красные пигменты
Обнаружение As(V):
к капле раствора, содержащего As(V), добавляют каплю HNO3
и крупинку молибдата аммония – образуется желтый кристаллический осадок (NH4)3AsO4·12MoO3 в виде мелких кубов и октаэдров.
Предел обнаружения 0,2 мкг As (V), предельное разбавление 1:15000.
Обнаружение Sb (III):
В каплю исследуемого раствора вводят кристаллик KI и через некоторое время кристаллик CsCl – образуются оранжево-красные кристаллы Cs2SbI5.
Предел обнаружения 0,01 мкг Sb (III), предельное разбавление 1:100000.
Предел обнаружения 0,2 мкг As (V), предельное разбавление 1:15000.
Обнаружение Sb (III):
В каплю исследуемого раствора вводят кристаллик KI и через некоторое время кристаллик CsCl – образуются оранжево-красные кристаллы Cs2SbI5.
Предел обнаружения 0,01 мкг Sb (III), предельное разбавление 1:100000.
Слайд 11Красный кадмий
твердый раствор сульфида и селенида кадмия CdS·n(CdSe) не растворяется в
разб. минеральных кислотах, а конц. растворяют пигмент с выделением H2S и H2Se. Чем больше в пигменте CdSe, тем более красный оттенок он приобретает
Сухую частицу испытывают на S2- (см. ультрамарин).
В растворе проводят обнаружение ионов Cd2+ и Se2-.
Сухую частицу испытывают на S2- (см. ультрамарин).
В растворе проводят обнаружение ионов Cd2+ и Se2-.
Слайд 12Красные пигменты
Обнаружение Cd2+:
в каплю нейтрального раствора помещают крупинку щавелевой кислоты
или оксалата аммония – образуется бесцветный кристаллический осадок оксалата кадмия CdC2O4·3H2O в виде призм и ромбов.
Предел обнаружения 0,35 мкг Cd2+, предельное разбавление 1:3000.
Обнаружение Se2-:
На фильтровальную бумагу помещают немного порошка тиомочевины, затем каплю исследуемого раствора – образуется оранжево-красный элементарный Se. Реакции мешают NO3-.
Предел обнаружения 0,05 мкг Se2-, предельное разбавление 1:1000000.
Предел обнаружения 0,35 мкг Cd2+, предельное разбавление 1:3000.
Обнаружение Se2-:
На фильтровальную бумагу помещают немного порошка тиомочевины, затем каплю исследуемого раствора – образуется оранжево-красный элементарный Se. Реакции мешают NO3-.
Предел обнаружения 0,05 мкг Se2-, предельное разбавление 1:1000000.
Слайд 14Красный хром
основной хромат свинца РbСrО4·РbО меняет цвет от светлооранжевого до красного
в зависимости от дисперсности частиц: чем больше размер частиц, тем темнее цвет.
Термостоек до 600°.
В неорг. кислотах и конц. щелочах растворяется полностью, к действию разбавленных щелочей стоек.
После растворения в кислоте проводят обнаружение ионов Рb2+ (см. свинцовые белила) и Сг2О72-.
Термостоек до 600°.
В неорг. кислотах и конц. щелочах растворяется полностью, к действию разбавленных щелочей стоек.
После растворения в кислоте проводят обнаружение ионов Рb2+ (см. свинцовые белила) и Сг2О72-.
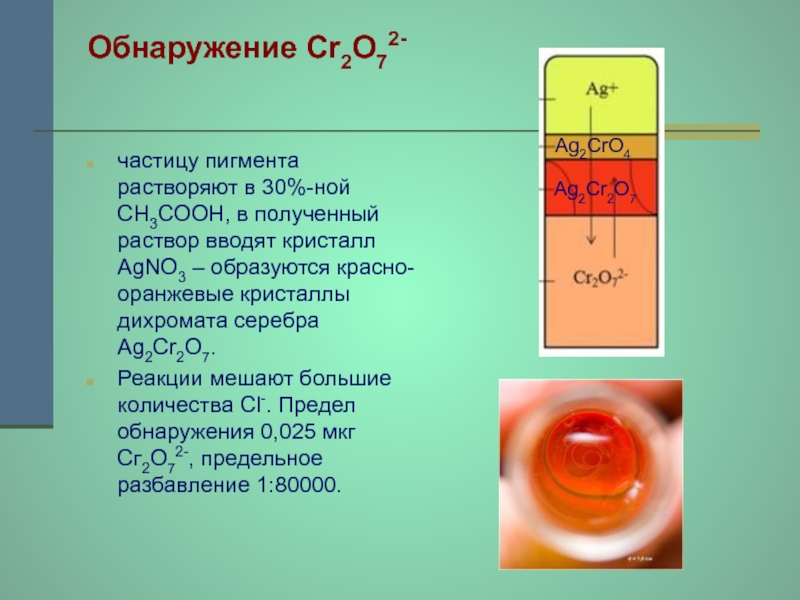
Слайд 15Обнаружение Сr2О72-
частицу пигмента растворяют в 30%-ной CH3COOH, в полученный раствор вводят
кристалл AgNO3 – образуются красно-оранжевые кристаллы дихромата серебра Ag2Cr2O7.
Реакции мешают большие количества Cl-. Предел обнаружения 0,025 мкг Сг2О72-, предельное разбавление 1:80000.
Реакции мешают большие количества Cl-. Предел обнаружения 0,025 мкг Сг2О72-, предельное разбавление 1:80000.
Ag2Cr2O7
Ag2CrO4
Слайд 17Глауконит
натуральный пигмент K+(Fe3+, Fe2+, Al, Mg)2х 3[Si3(Si,Al)O10]·[OH]2·H2O
при прокаливании меняет окраску на
красно-бурую,
растворяется в конц. HCl при нагревании.
Раствор анализируют на ионы Fe3+ (см. берлинскую лазурь).
растворяется в конц. HCl при нагревании.
Раствор анализируют на ионы Fe3+ (см. берлинскую лазурь).
Слайд 18Ярь-медянка
ацетаты меди различного химического состава и оттенков: зеленого, зелено-синего, голубого.
Хорошо
растворяется в разб. минеральных кислотах.
Щелочи образуют с ярь-медянкой Cu(OH)2 синего цвета.
Масла, смолы, протеины – зеленые соли жирных кислот, резинаты и протеинаты.
По составу многочисленные типы ярь-медянки можно разделить на две группы: основную и нейтральную (среднюю).
Нейтральная ярь-медянка Сu(СН3СОО)2·Н2O.
Щелочи образуют с ярь-медянкой Cu(OH)2 синего цвета.
Масла, смолы, протеины – зеленые соли жирных кислот, резинаты и протеинаты.
По составу многочисленные типы ярь-медянки можно разделить на две группы: основную и нейтральную (среднюю).
Нейтральная ярь-медянка Сu(СН3СОО)2·Н2O.
Слайд 19Малахит CuCO3·Cu(OH)2
под действием минеральных кислот вспенивается, выделяя CO2, что отличает его
от всех медных зеленых пигментов.
использовался целый ряд различных минералов меди:
атакамит и паратакамит CuCl2·Cu(OH)2
псевдомалахит Cu5(PO4)2(OH)4
хальконантронит Na2Cu(CO3)2·Н2O
калюметит Сu(ОН,Сl)2·Н2О
антлерит CuSO4·Cu(OH)2
боталлокит CuCl2·3Cu(OH)2·3H2O
герхардит Cu2(OH)3NO3
познякит Cu4SO4(OH)6·H2O
использовался целый ряд различных минералов меди:
атакамит и паратакамит CuCl2·Cu(OH)2
псевдомалахит Cu5(PO4)2(OH)4
хальконантронит Na2Cu(CO3)2·Н2O
калюметит Сu(ОН,Сl)2·Н2О
антлерит CuSO4·Cu(OH)2
боталлокит CuCl2·3Cu(OH)2·3H2O
герхардит Cu2(OH)3NO3
познякит Cu4SO4(OH)6·H2O
Слайд 20Медьсодержащие зеленые пигменты
Определение пигментов, содержащих медь, предполагает:
проведение микрохимических реакций на ион
Сu2+ (см. Синие пигменты),
на ионы Cl-, РО43-, SO42-.
Обнаружение Сl-: к капле азотнокислого раствора анализируемого пигмента добавляют кристалл AgNO3 – выпадает белый осадок AgCl.
на ионы Cl-, РО43-, SO42-.
Обнаружение Сl-: к капле азотнокислого раствора анализируемого пигмента добавляют кристалл AgNO3 – выпадает белый осадок AgCl.
Слайд 21Зеленая Шееле
Оливенит – основной метаарсенит меди Сu(AsO2)3·nCu(OH)2·mH2O, где n = 1,
2, 3, а содержание воды изменяется в определенных пределах)
легко растворяется в кислотах и щелочах.
легко растворяется в кислотах и щелочах.
Слайд 22Швейнфуртская зелень
арсенит-ацетат меди Сu(СН3СОО)2·ЗСu(AsO2)2
легко растворима в кислотах и щелочах.
Слайд 23Медьсодержащие зеленые пигменты
Все медные зеленые пигменты при нагревании до высоких температур
разлагаются c образованием CuO черного цвета;
растворы их дают положительную реакцию на Сu2+.
Для идентификации зеленой Шееле необходимо определить As (III) (см. реальгар);
ярь-медянки – CH3COO-;
швейнфуртской зеленой – и As (III), и СН3СОО-.
растворы их дают положительную реакцию на Сu2+.
Для идентификации зеленой Шееле необходимо определить As (III) (см. реальгар);
ярь-медянки – CH3COO-;
швейнфуртской зеленой – и As (III), и СН3СОО-.
Слайд 24Зеленые пигменты
Обнаружение СН3СОО-:
частицу пигмента смешивают со смесью равных частей CaO
и CaCO3, помещают в стеклянную трубку, запаянную с одного конца;
открытый конец трубки накрывают фильтровальной бумагой, пропитанной свежеприготовленным щелочным раствором ортонитробензальдегида, и постепенно нагревают трубку.
В присутствии CH3COO- бумага становится синей или сине-зеленой. При малых количествах рекомендуется после перегонки смочить бумагу каплей 2 моль/л соляной кислоты.
открытый конец трубки накрывают фильтровальной бумагой, пропитанной свежеприготовленным щелочным раствором ортонитробензальдегида, и постепенно нагревают трубку.
В присутствии CH3COO- бумага становится синей или сине-зеленой. При малых количествах рекомендуется после перегонки смочить бумагу каплей 2 моль/л соляной кислоты.
Слайд 26Зеленый кобальт
искусственный пигмент – твердый раствор оксида кобальта Со (II) в
оксиде цинка СоO·ZnO
хорошо растворяется в горячей H2SO4 и HCl.
Цвет пигмента зависит от соотношения СоО и ZnO: чем больше СоО, тем темнее.
Определение пигмента заключается в обнаружении ионов Со2+ (см. смальту) и Zn2+ (см. цинковые белила).
хорошо растворяется в горячей H2SO4 и HCl.
Цвет пигмента зависит от соотношения СоО и ZnO: чем больше СоО, тем темнее.
Определение пигмента заключается в обнаружении ионов Со2+ (см. смальту) и Zn2+ (см. цинковые белила).
Слайд 27Хромовая зелень
оксид хрома Сг2О3 трудно растворим во всех кислотах и щелочах.
Для растворения пробу сначала сплавляют с безводными К2СО3, Na2CO3 и Na2O2 – образуется смесь хроматов Na2CrO4 и К2СгО4, которую обрабатывают раствором 2 моль/л CH3COOH.
Полученный раствор исследуют на присутствие Сг2О72- (см. красный хром).
Изумрудная зелень (Сг2О3·2Н2О). Микрохимическое определение аналогично хромовой зеленой.















![Глауконитнатуральный пигмент K+(Fe3+, Fe2+, Al, Mg)2х 3[Si3(Si,Al)O10]·[OH]2·H2Oпри прокаливании меняет окраску на красно-бурую, растворяется в конц.](/img/tmb/3/269531/cf3d9c544d9fe45023b34d9c3b5d0d25-800x.jpg)