- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Сульфаты и оксиды металлов презентация
Содержание
- 1. Сульфаты и оксиды металлов
- 2. Оксиды. Оксиды металлов - это соединения металлов с кислородом. Многие из них могут соединяться с одной или несколькими молекулами воды с образованием гидроксидов. Большинство оксидов являются основными, так как их гидроксиды ведут себя как основания. Однаконекоторые оксиды (кислотные оксиды, или ангидриды) образуют соли только в реакциях со щелочами илидругими основаниями, в то же время достаточно распространенным классом оксидов являются амфотерныеоксиды, которые проявляют как кислотные, так и основные свойства. Эти два последних класса оксидовдолжны рассматриваться как оксиды, или ангидриды, кислот, реальных или гипотетических, соответствующихих гидроксидам. Некоторые оксиды (солеподобные) можно рассматривать как результат взаимодействия основного оксида скислотным оксидом..."
- 3. К оксидам 1-ой группы относят: Медный купорос
- 4. Опыт № 1.
- 5. Опыт « Оксидирование CuSO₄ с хлоридом натрия.
- 6. Опыт № 2.
- 7. Опыт « Выделение железа из FeSO₄, путем
- 8. Подведем итоги!
Слайд 2Оксиды.
Оксиды металлов - это соединения металлов с кислородом. Многие из них могут соединяться с одной или несколькими молекулами воды с образованием гидроксидов.
Большинство оксидов являются основными, так как их гидроксиды ведут себя как основания. Однаконекоторые оксиды (кислотные оксиды, или ангидриды) образуют соли только в реакциях со щелочами илидругими основаниями, в то же время достаточно распространенным классом оксидов являются амфотерныеоксиды, которые проявляют как кислотные, так и основные свойства. Эти два последних класса оксидовдолжны рассматриваться как оксиды, или ангидриды, кислот, реальных или гипотетических, соответствующихих гидроксидам.
Некоторые оксиды (солеподобные) можно рассматривать как результат взаимодействия основного оксида скислотным оксидом..."
Слайд 3К оксидам 1-ой группы относят: Медный купорос CuSO₄ , Железный купорос
FeSO₄ , Цинковый купорос ZnSO₄ , свинцовый купорос PbSО4 .
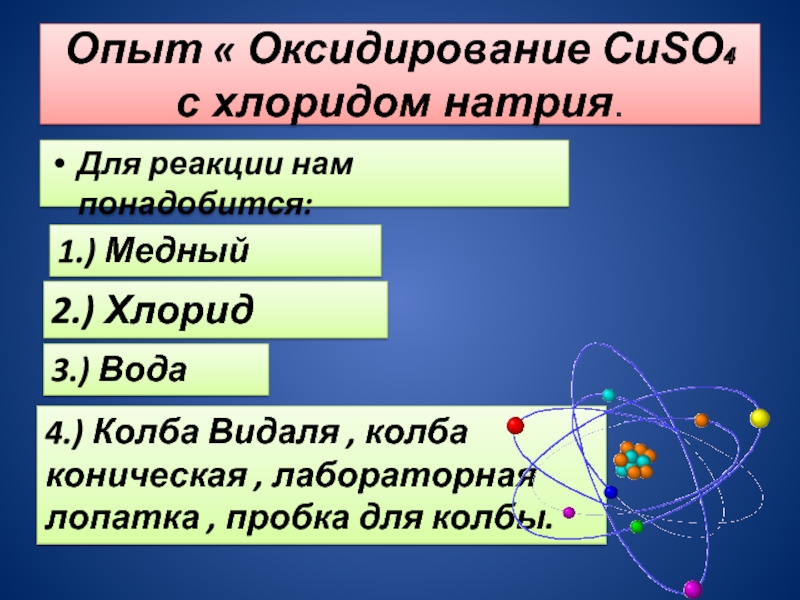
Слайд 5Опыт « Оксидирование CuSO₄ с хлоридом натрия.
Для реакции нам понадобится:
1.) Медный
купорос
2.) Хлорид натрия
3.) Вода
4.) Колба Видаля , колба коническая , лабораторная лопатка , пробка для колбы.
Слайд 7Опыт « Выделение железа из FeSO₄, путем резкого охлаждения
Для реакции нам
понадобиться.
1.) FeSO₄
2.) H₂O
3.) H₂O₂
4.) Колба узкогорлая , колба широкогорлая.