- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химическая связь презентация
Содержание
- 1. Химическая связь
- 2. Что читать? Карапетьянц М. Х., Дракин С.
- 3. Сближение атомов Перекрывание 1s-АО при сближении атомов
- 4. Кулоновские силы При сближении двух атомов водорода
- 5. Силы в природе Гравитационное взаимодействие Слабое ядерное
- 6. Сложение потенциалов электромагнитного и сильного ядерного взаимодействий Кулоновское взаимодействие Сильное ядерное взаимодействие
- 7. Уравнение Шредингера энергия связи молекулы водорода для состояний
- 8. Диаграмма сближения атомов водорода
- 9. Химическая связь Химическая связь это энергетически выгодное
- 10. Молекула Моле́кула (новолат. molecula, уменьшительное от лат.
- 11. Таблица типов связи
- 12. Свойства химической связи Длина Около 1
- 13. Прочность энергия гомолитического разрыва. гомо -
- 14. Ковалентные связи Ковалентные химические связи обычно образуются
- 15. Ковалентные связи Донорно-акцепторный механизм образования ковалентной связи
- 16. Примеры донорно-акцепторной связи H3O+ H2O
- 17. Электронные пары Участвующие в образовании связи обобществлённые
- 18. Электронные пары
- 19. Радикалы Частицы с неспаренными электронами называются радикалами.
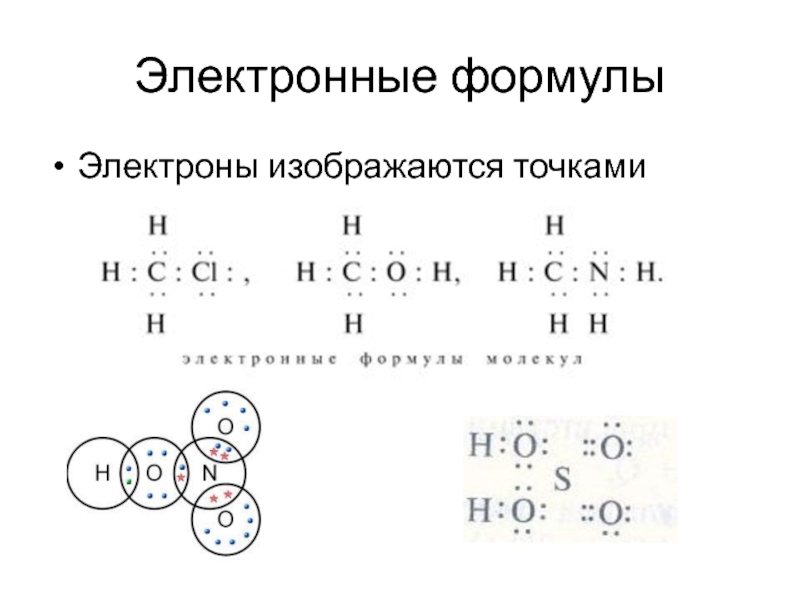
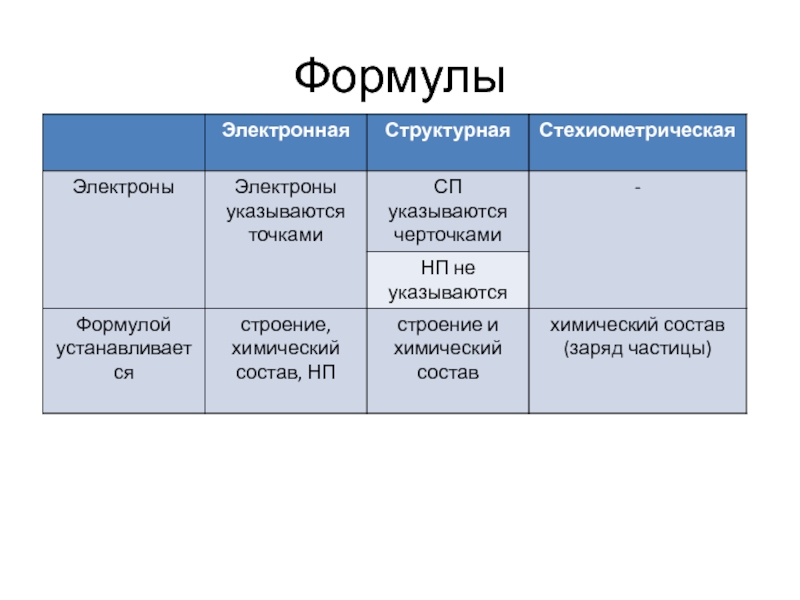
- 20. Электронные формулы Электроны изображаются точками
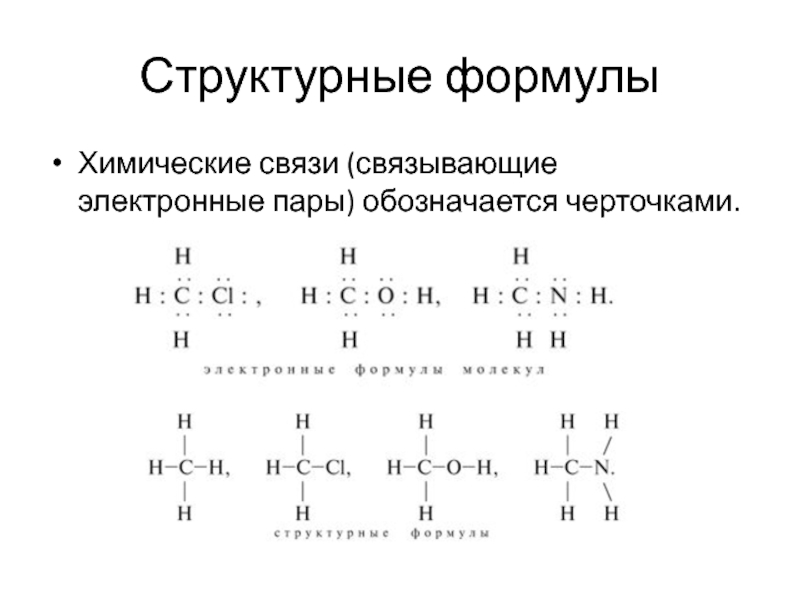
- 21. Структурные формулы Химические связи (связывающие электронные пары) обозначается черточками.
- 22. Стехиометрические формулы В стехиометрических формулах, (HCl, BCl3,
- 23. Формулы
- 24. Химическое соединение Химическое соединение – вещество, состоящее
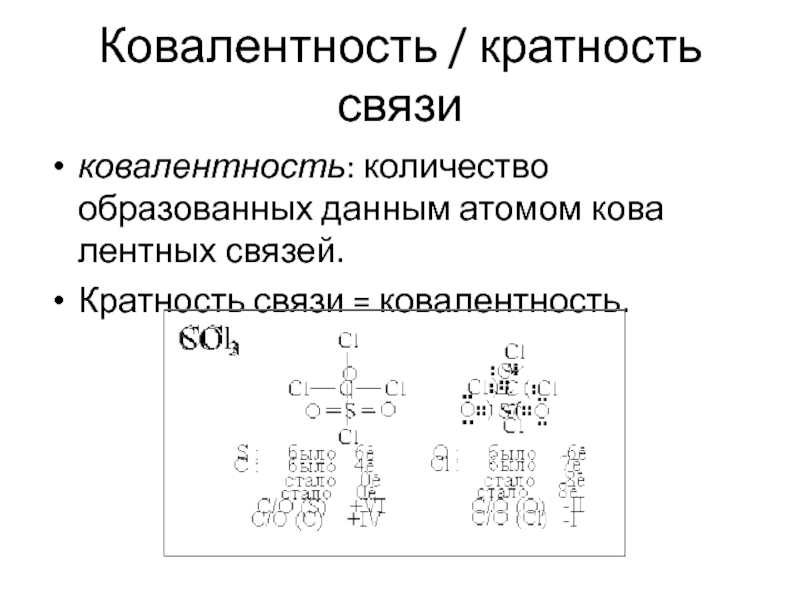
- 25. Ковалентность / кратность связи ковалентность: количество образованных
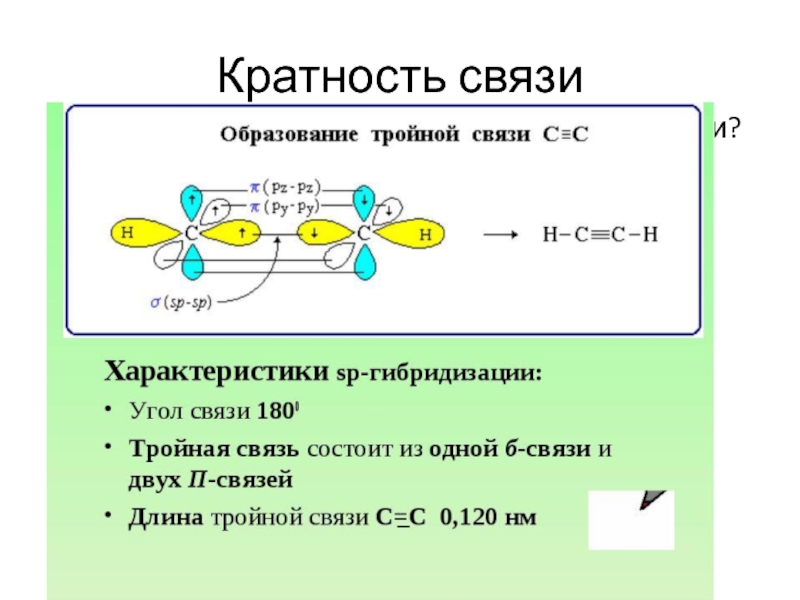
- 26. Кратность связи Откуда так много электронов между
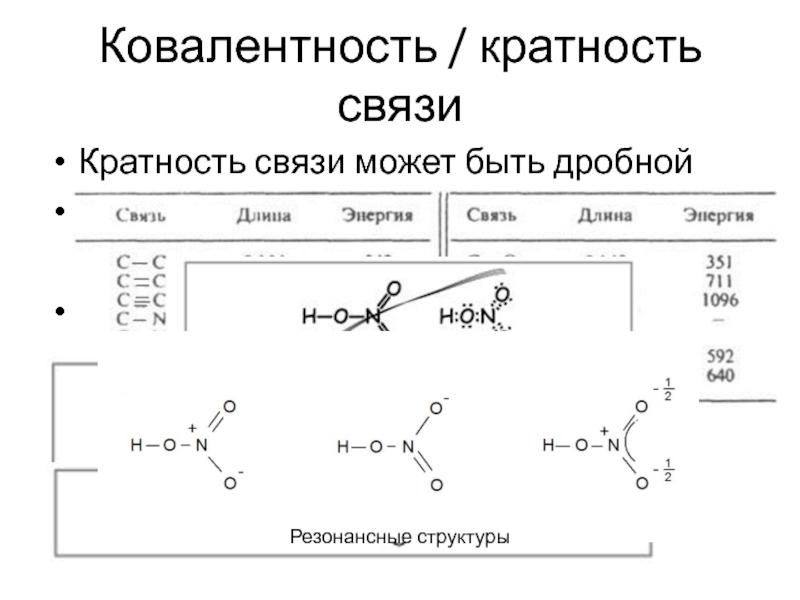
- 27. Ковалентность / кратность связи Кратность связи может
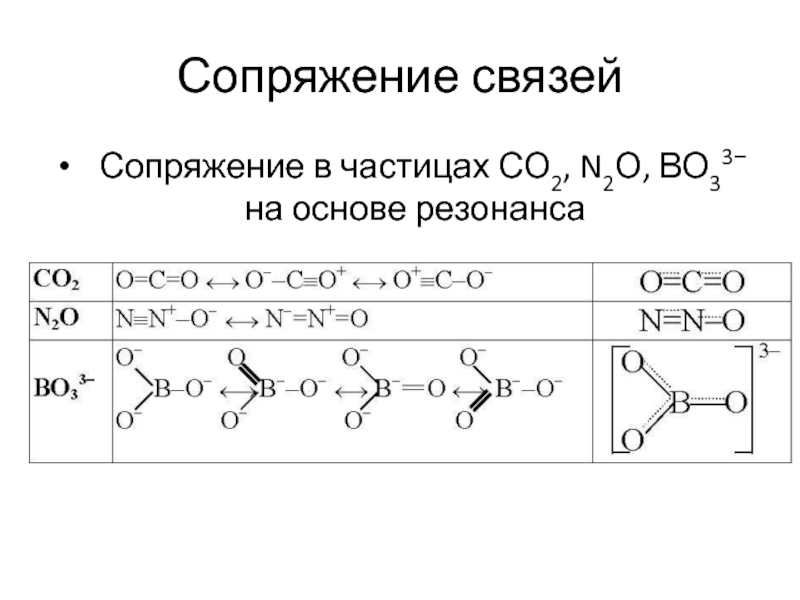
- 28. Сопряжение связей Сопряжение в частицах СО2, N2О, ВО33− на основе резонанса
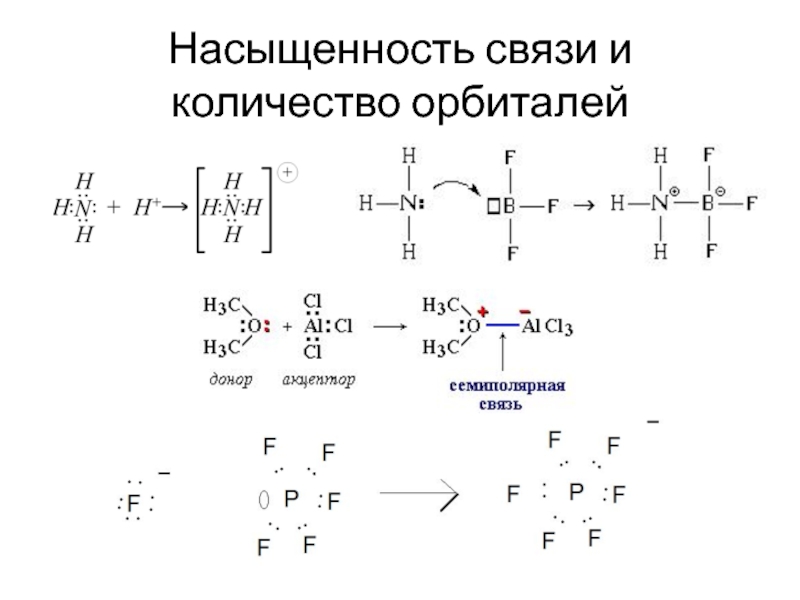
- 29. Насыщенность связи Насыщенность связи - максимально возможная
- 30. Насыщенность связи и количество электронов Переход электронов
- 31. Насыщенность связи и количество электронов N([He]2s22p3) →N*([He]2s12p33s1) Нужно много энергии. Да и валентность 1.
- 32. Насыщенность связи и количество электронов P([Ne]3s23p3) →P*([Ne]3s13p33d1)
- 33. Насыщенность связи и количество электронов O([He]2s22p6) →
- 34. Насыщенность связи и количество орбиталей
- 35. КЧ Количество ближайших к выделенному атому соседних
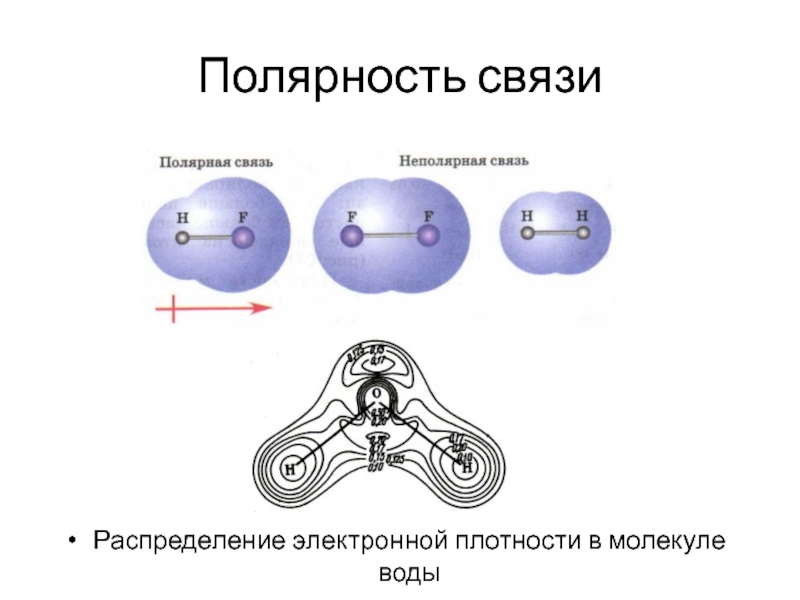
- 36. Полярность связи Распределение электронной плотности в молекуле воды
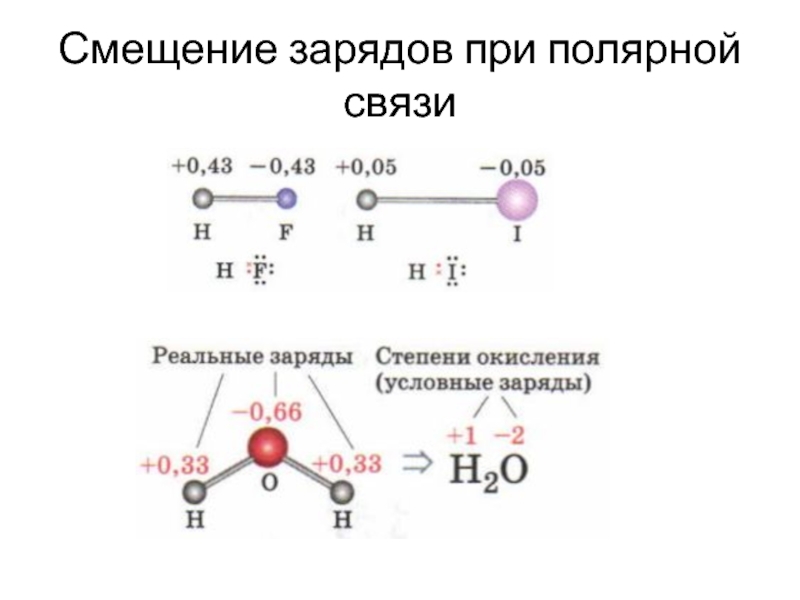
- 37. Смещение зарядов при полярной связи
- 38. Электроотрицательность Кто у кого забирает электроны? Электроотрицательность
- 39. Степень окисления Степень окисления (СО) – условный
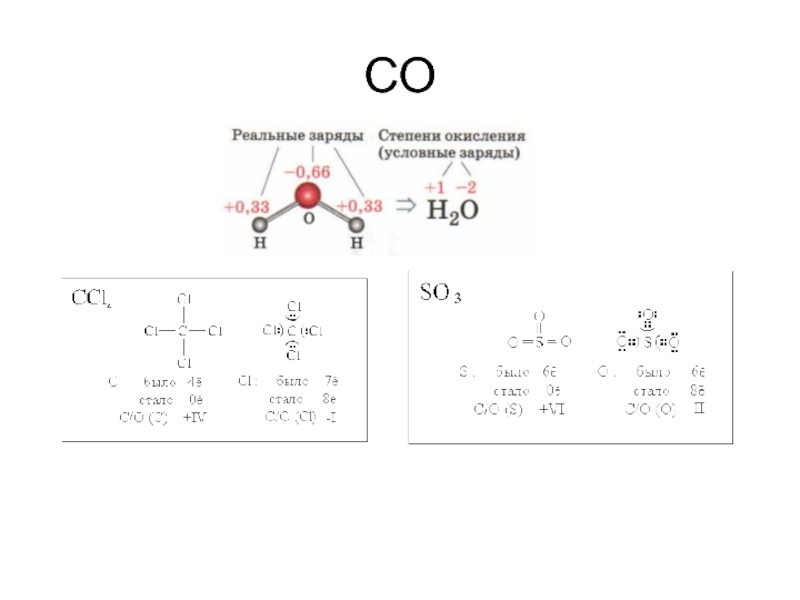
- 40. СО
- 41. Дипольный момент
- 42. Дипольный момент Дипольные моменты молекул обычно измеряют в дебаях (D): 1D = 3,34·10-30 Кл·м.
- 43. Дипольный момент
Слайд 2Что читать?
Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия.
Ахметов Н. С. Общая и неорганическая химия.
Чупахин А. П. Общая химия. Химическая связь и строение вещества.
Глинка Н.Л. Общая химия.
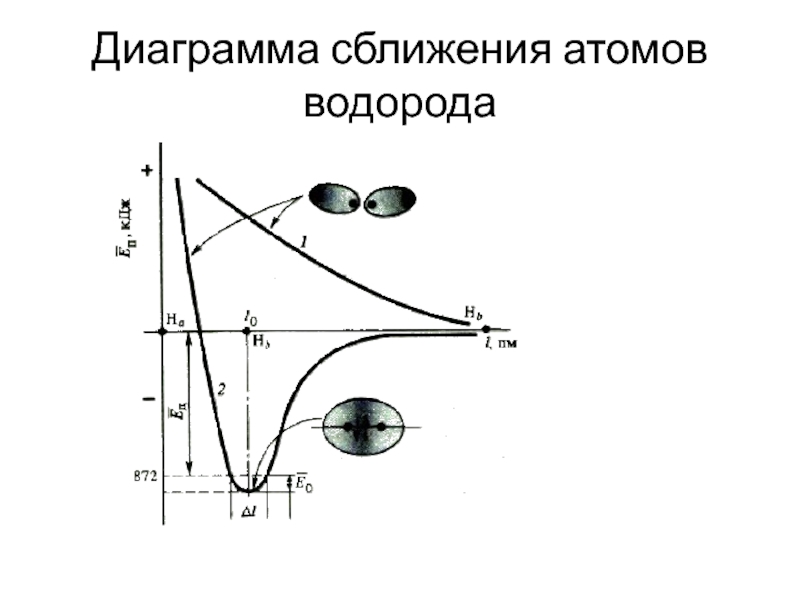
Слайд 3Сближение атомов
Перекрывание 1s-АО
при сближении атомов водорода
Образование молекулярной орбитали
в результате перекрывания двух
Слайд 4Кулоновские силы
При сближении двух атомов водорода электрон атома A притягивается к
Потенциальная энергия E этого процесса
Слайд 5Силы в природе
Гравитационное взаимодействие
Слабое ядерное взаимодействие
Электромагнитное взаимодействие
Сильное ядерное взаимодействие
При сближении ядер
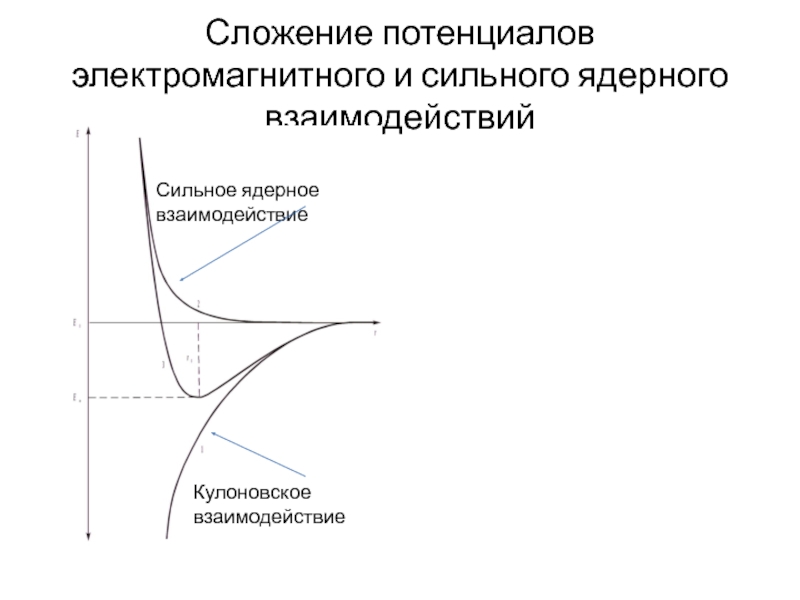
Слайд 6Сложение потенциалов электромагнитного и сильного ядерного взаимодействий
Кулоновское взаимодействие
Сильное ядерное взаимодействие
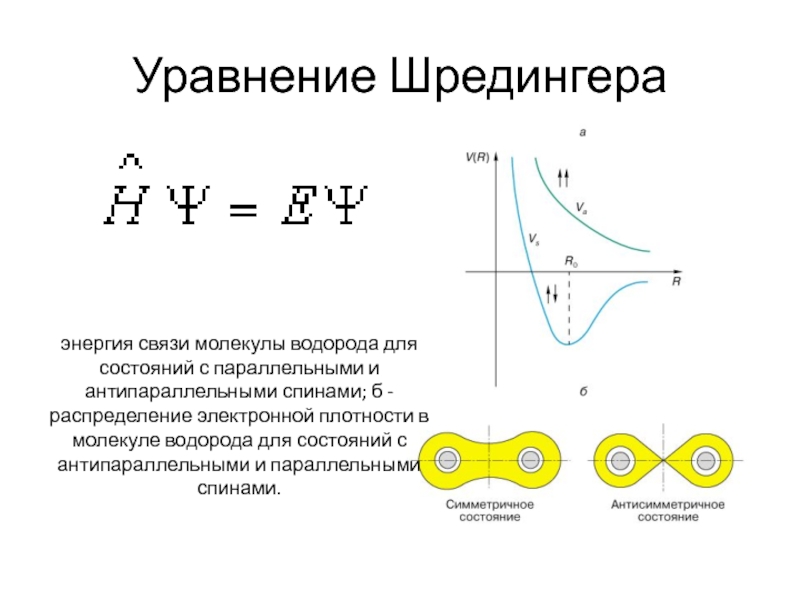
Слайд 7Уравнение Шредингера
энергия связи молекулы водорода для состояний с параллельными и антипараллельными спинами;
Слайд 9Химическая связь
Химическая связь это энергетически выгодное взаимодействие атомов, приводящие к образованию
Взаимодействия, скрепляющие в единое целое молекулы, полимеры (а часто – кристаллы и жидкости,), принято называть химической связью.
Слайд 10Молекула
Моле́кула (новолат. molecula, уменьшительное от лат. moles — масса) — электрически
Слайд 12Свойства химической связи
Длина
Около 1 Å (10-10 м или 0,1 нм)
Если
r(A−B) < r(A) + r(B)
Радиус атома водорода составляет 53 пм, атома фтора − 71 пм, а расстояние между ядрами атомов в молекуле HF равно 92 пм:
Слайд 13
Прочность
энергия гомолитического разрыва. гомо - AB → А +
Полярность.
Смещение электронной плотности в сторону одного из атомов
Слайд 14Ковалентные связи
Ковалентные химические связи обычно образуются при обобществлении принадлежащих первоначально разным
А↑+ ↓В = А↑↓В
или А· + ·В = А··В,
или А· + ·В = А–В.
Вступающие в связь атомы как бы обмениваются электронами – такой механизм образования ковалентной связи называется обменным.
Слайд 15Ковалентные связи
Донорно-акцепторный механизм образования ковалентной связи когда один из пары образующих
А↑↓ + □ В = А↑↓В
А: + □ В = А··В
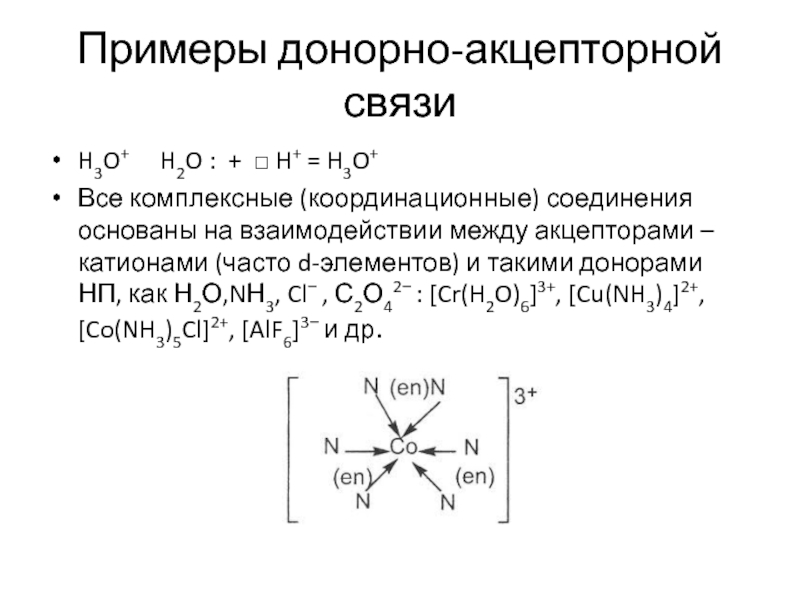
Слайд 16Примеры донорно-акцепторной связи
H3O+ H2O : + □ H+ =
Все комплексные (координационные) соединения основаны на взаимодействии между акцепторами – катионами (часто d-элементов) и такими донорами НП, как Н2О,NН3, Cl− , С2О42− : [Cr(H2O)6]3+, [Cu(NH3)4]2+, [Co(NH3)5Cl]2+, [AlF6]3− и др.
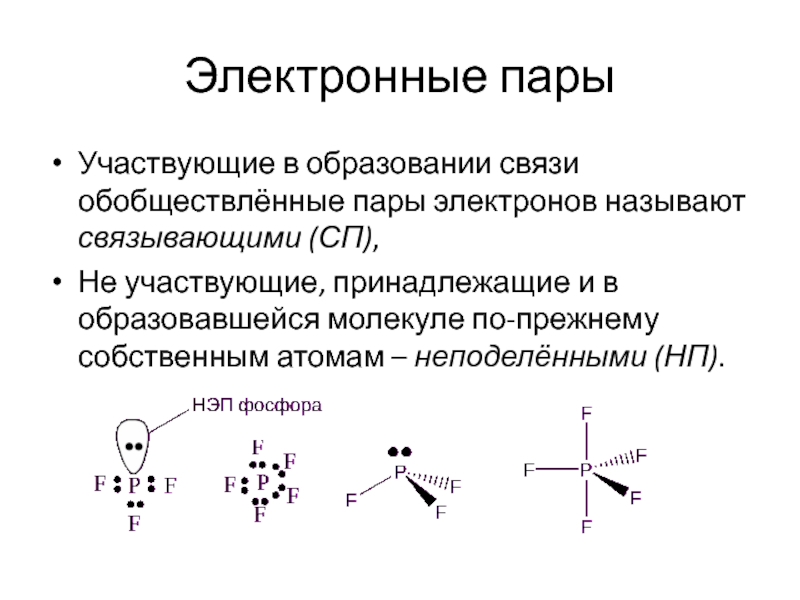
Слайд 17Электронные пары
Участвующие в образовании связи обобществлённые пары электронов называют связывающими (СП),
Не участвующие, принадлежащие и в образовавшейся молекуле по-прежнему собственным атомам – неподелёнными (НП).
Слайд 19Радикалы
Частицы с неспаренными электронами называются радикалами.
Примеры радикалов: Н·, Сl·, ·ОН, ·СН3.
Стабильные радикалы редки, из неорганических отметим ·NO и ·NО2.
Слайд 22Стехиометрические формулы
В стехиометрических формулах, (HCl, BCl3, H2O, H2S2, SO32– ит. п.),
Слайд 24Химическое соединение
Химическое соединение – вещество, состоящее из разных элементов в определенных
Вещества, состоящие из атомов одного элемента, называют простыми веществами (например, двухатомный кислород О2, озон О3; алмаз, графит, карбин, фуллерены – различные модификации углерода, С).
Слайд 25Ковалентность / кратность связи
ковалентность: количество образованных данным атомом ковалентных связей.
Кратность
Слайд 27Ковалентность / кратность связи
Кратность связи может быть дробной
H2+ H • H+ H …
HNO3
Резонансные структуры
Слайд 29Насыщенность связи
Насыщенность связи - максимально возможная ковалентность/кратность. Определяется:
количеством орбиталей. Взаимодействие
количеством электронов.
Слайд 30Насыщенность связи и количество электронов
Переход электронов на более высокие уровни (промотирование):
Be([He]2s2)
B([He]2s22p1) → B*([He]2s12p2);
С([He]2s22p2) →С*([He]2s12p3)
Слайд 31Насыщенность связи и количество электронов
N([He]2s22p3) →N*([He]2s12p33s1)
Нужно много энергии.
Да и валентность 1.
Слайд 33Насыщенность связи и количество электронов
O([He]2s22p6) → O*([He]2s12p43s1);
F([He]2s22p1) → F*([He]2s12p53s1)
Слишком большие энергии.
Cl([Ne]3s23p5)
Слайд 35КЧ
Количество ближайших к выделенному атому соседних атомов (ближайших соседей) называют координационным
Для частиц с ковалентными связями КЧ равно числу σ-связей.
Слайд 38Электроотрицательность
Кто у кого забирает электроны?
Электроотрицательность (ЭО) это свойство атомов оттягивать на
Существует несколько количественных шкал ЭО.
По Малликену, ЭО = (IА+ ЕА)/2, где IА – энергия ионизации и ЕА – сродство к электрону
Электроотрицательность атомов элементов по Полингу
Слайд 39Степень окисления
Степень окисления (СО) – условный заряд атома в соединении, если
Степень окисления (СО) – условный заряд, который бы возник на атоме в случае полного перехода электронов при образовании связи.
С использованием степени окисления записывается последовательность элементов в химических формулах, названия соединений, уравниваются окислительно восстановительные реакции.
Именно соотношение ЭО атомов определяет CO.
















![Насыщенность связи и количество электроновПереход электронов на более высокие уровни (промотирование):Be([He]2s2) → Be*([He]2s12p1);B([He]2s22p1) → B*([He]2s12p2);С([He]2s22p2) →С*([He]2s12p3)](/img/tmb/5/437609/ac1a8e14a38cca6f0b44211f3aed9259-800x.jpg)
![Насыщенность связи и количество электроновN([He]2s22p3) →N*([He]2s12p33s1)Нужно много энергии.Да и валентность 1.](/img/tmb/5/437609/ab2d279933f8d9031674575c35146f4e-800x.jpg)
![Насыщенность связи и количество электроновP([Ne]3s23p3) →P*([Ne]3s13p33d1)](/img/tmb/5/437609/e414616aa3352bff0889719afde85cb7-800x.jpg)
![Насыщенность связи и количество электроновO([He]2s22p6) → O*([He]2s12p43s1);F([He]2s22p1) → F*([He]2s12p53s1)Слишком большие энергии.Cl([Ne]3s23p5) →Cl*([Ne]3s13p33d3)](/img/tmb/5/437609/240469db213283450c3d435b57011fad-800x.jpg)