- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Спирты (алканолы) презентация
Содержание
- 1. Спирты (алканолы)
- 2. Спирты Спирты (алканолы) – это органические вещества,
- 3. Виды спиртов Одноатомные спирты, например: CH3-OH
- 4. По характеру углеводородного радикала выделяют следующие спирты
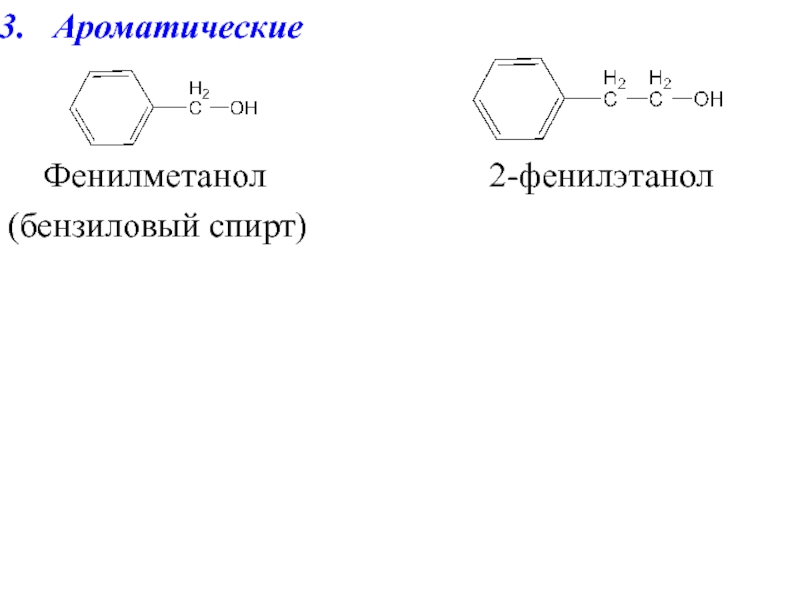
- 5. Ароматические Фенилметанол
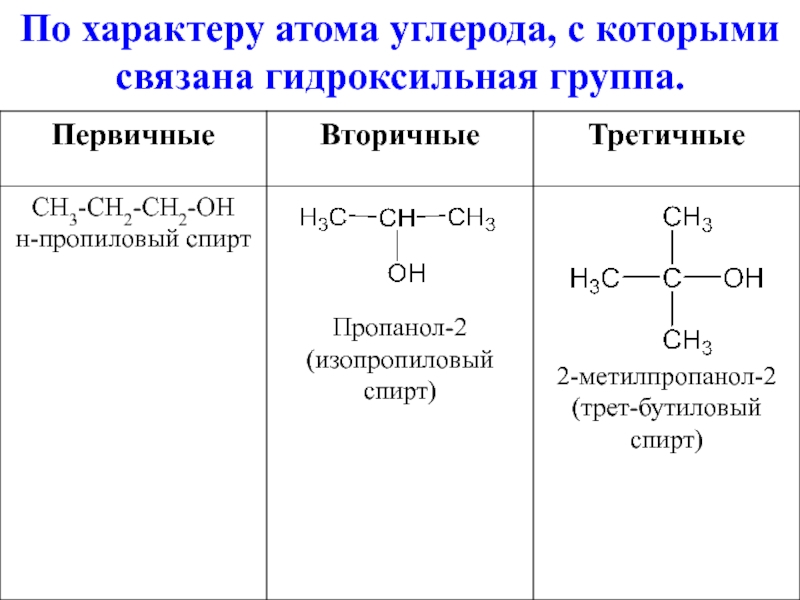
- 6. По характеру атома углерода, с которыми связана гидроксильная группа.
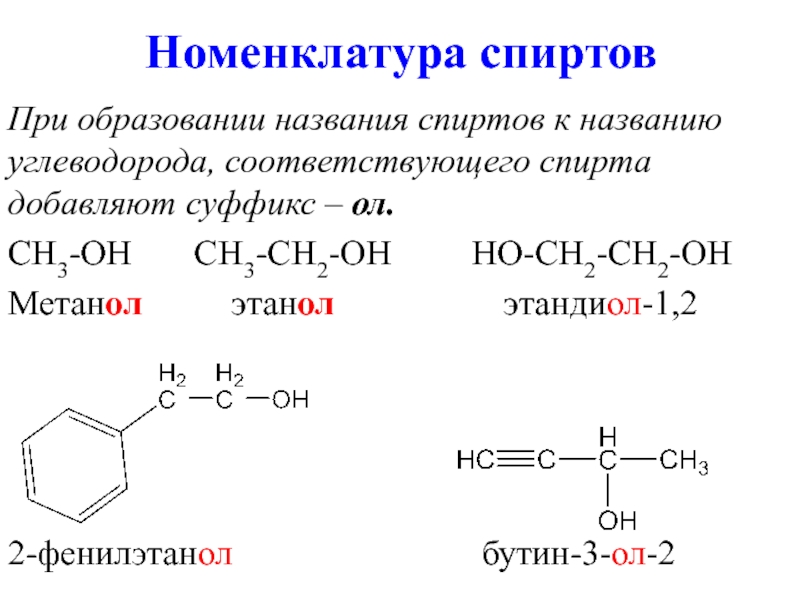
- 7. Номенклатура спиртов При образовании названия спиртов к
- 8. Изомерия спиртов Изомерия положения OH-группы (начиная
- 9. Изомерия спиртов Межклассовая изомерия с простыми эфирами:
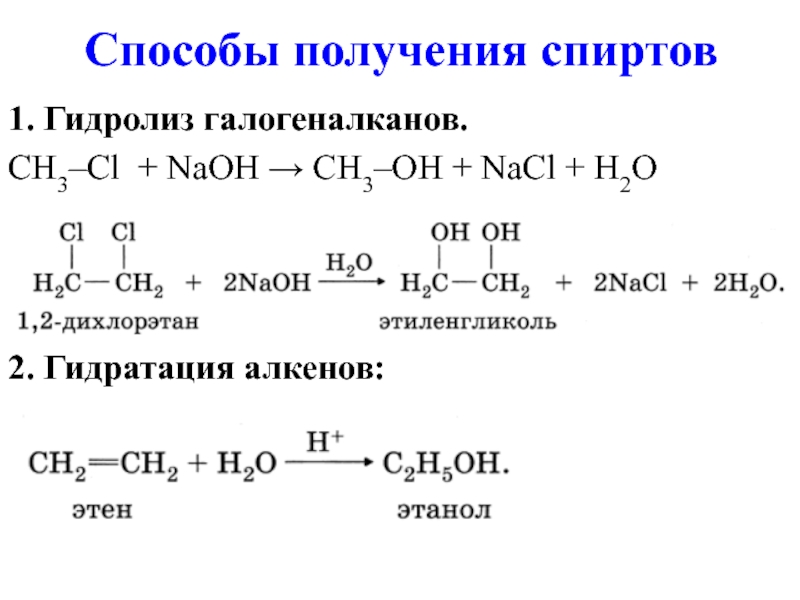
- 10. Способы получения спиртов 1. Гидролиз галогеналканов. CH3–Cl
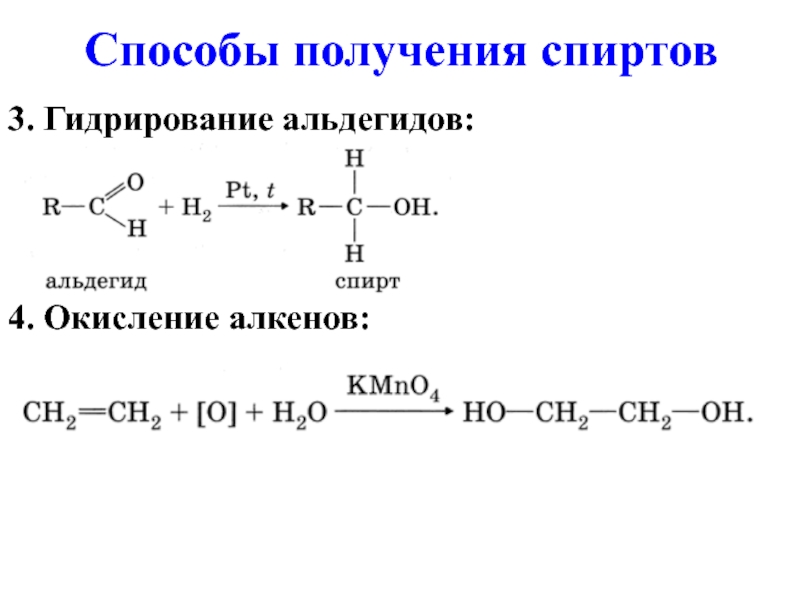
- 11. 3. Гидрирование альдегидов: 4. Окисление алкенов: Способы получения спиртов
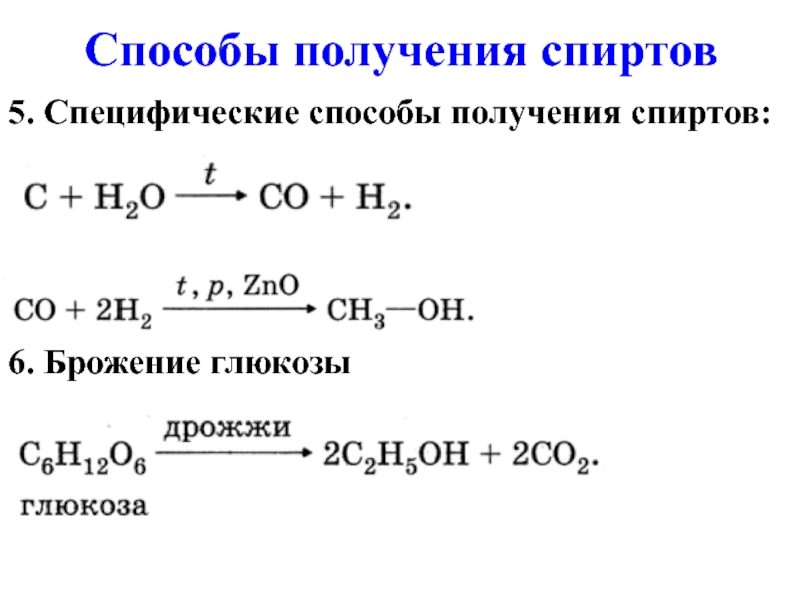
- 12. 5. Специфические способы получения спиртов:
- 13. Химические свойства спиртов 1. Взаимодействие спиртов со
- 14. 4. Внутримолекулярная дегидратация спиртов:
- 15. 7. Дегидратация спиртов: (R-СH3)
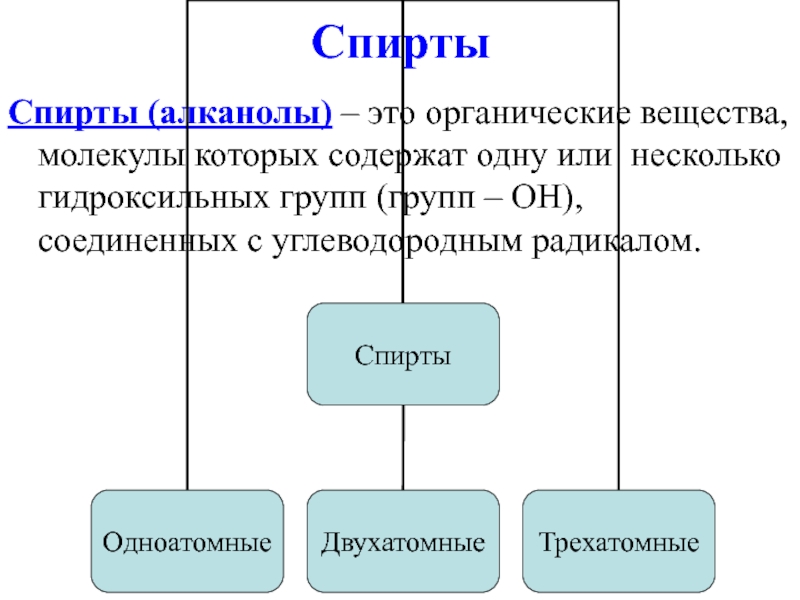
Слайд 2Спирты
Спирты (алканолы) – это органические вещества, молекулы которых содержат одну или
несколько гидроксильных групп (групп – OH), соединенных с углеводородным радикалом.
Слайд 3Виды спиртов
Одноатомные спирты, например:
CH3-OH метанол или метиловый спирт,
CH3-CH2-OH этанол
или этиловый спирт.
Двухатомные (гликоли), например:
HO-CH2-CH2-OH этандиол-1,2 или этиленгликоль.
Трехатомные спирты, например:
Пропантриол-1,2,3 или глицерин.
Двухатомные (гликоли), например:
HO-CH2-CH2-OH этандиол-1,2 или этиленгликоль.
Трехатомные спирты, например:
Пропантриол-1,2,3 или глицерин.
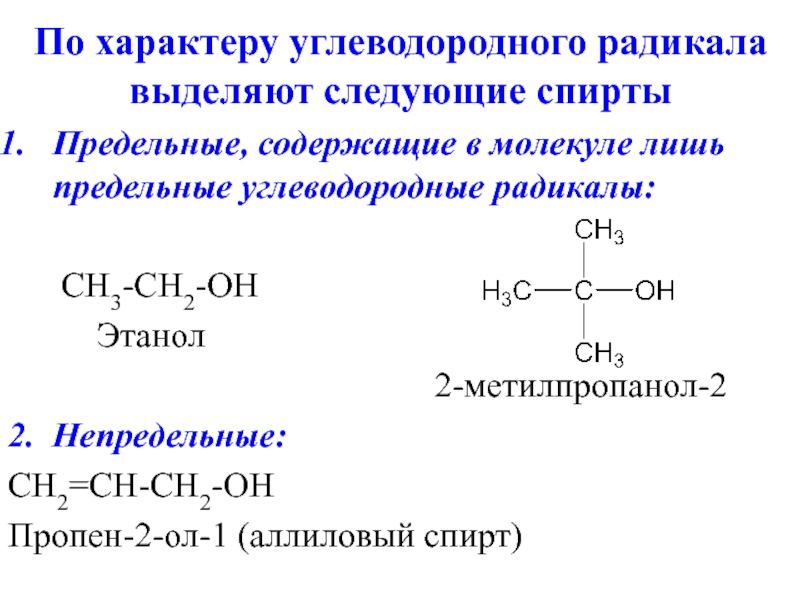
Слайд 4По характеру углеводородного радикала выделяют следующие спирты
Предельные, содержащие в молекуле лишь
предельные углеводородные радикалы:
CH3-CH2-OH
Этанол
2-метилпропанол-2
2. Непредельные:
CH2=CH-CH2-OH
Пропен-2-ол-1 (аллиловый спирт)
CH3-CH2-OH
Этанол
2-метилпропанол-2
2. Непредельные:
CH2=CH-CH2-OH
Пропен-2-ол-1 (аллиловый спирт)
Слайд 7Номенклатура спиртов
При образовании названия спиртов к названию углеводорода, соответствующего спирта добавляют
суффикс – ол.
CH3-OH CH3-CH2-OH HO-CH2-CH2-OH
Метанол этанол этандиол-1,2
2-фенилэтанол бутин-3-ол-2
CH3-OH CH3-CH2-OH HO-CH2-CH2-OH
Метанол этанол этандиол-1,2
2-фенилэтанол бутин-3-ол-2
Слайд 8Изомерия спиртов
Изомерия положения OH-группы (начиная с С3):
Углеродного скелета (начиная
с С4):
Слайд 10Способы получения спиртов
1. Гидролиз галогеналканов.
CH3–Cl + NaOH → CH3–OH + NaCl
+ H2O
2. Гидратация алкенов:
2. Гидратация алкенов:
Слайд 13Химические свойства спиртов
1. Взаимодействие спиртов со щелочными и щелочноземельными металлами:
2Na +
2C2H5OH → 2C2H5ONa + H2
2. Взаимодействие спиртов с галогеноводородами:
C2H5OH + HBr → C2H5Br + H2O
3. Межмолекулярная дегидратация спиртов:
H2SO4
CH3OH + HOCH3 → CH3 – O – CH3 + H2O
2. Взаимодействие спиртов с галогеноводородами:
C2H5OH + HBr → C2H5Br + H2O
3. Межмолекулярная дегидратация спиртов:
H2SO4
CH3OH + HOCH3 → CH3 – O – CH3 + H2O
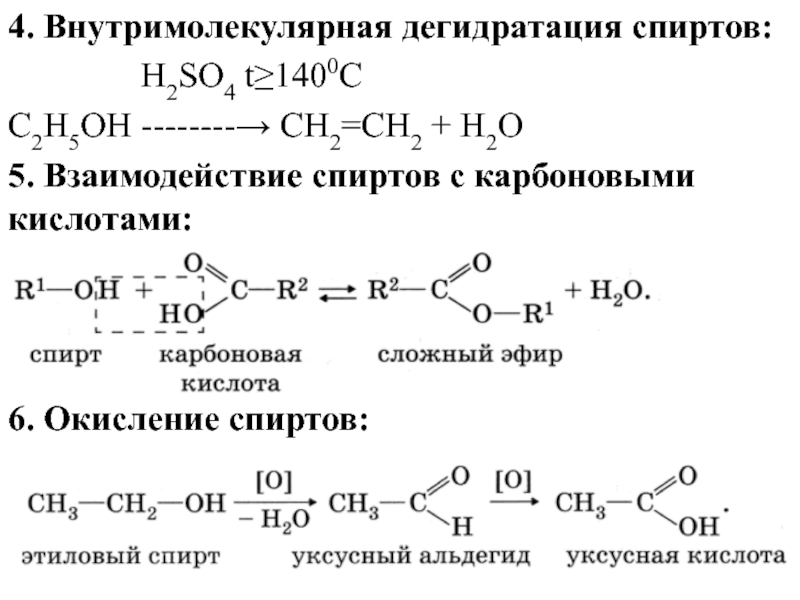
Слайд 144. Внутримолекулярная дегидратация спиртов:
H2SO4 t≥1400C
С2H5OH --------→ CH2=CH2 + H2O
5. Взаимодействие спиртов с карбоновыми кислотами:
6. Окисление спиртов:
С2H5OH --------→ CH2=CH2 + H2O
5. Взаимодействие спиртов с карбоновыми кислотами:
6. Окисление спиртов:
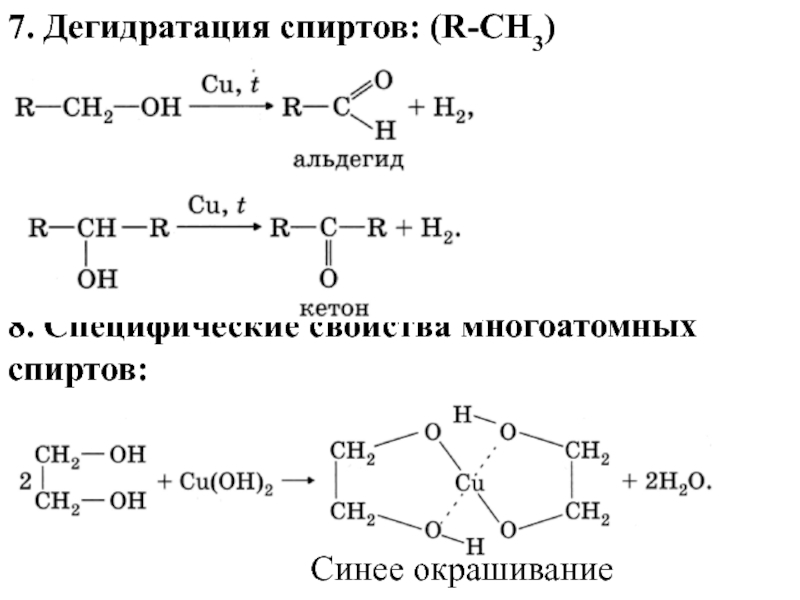
Слайд 157. Дегидратация спиртов: (R-СH3)
8. Специфические свойства многоатомных спиртов:
Синее окрашивание