- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
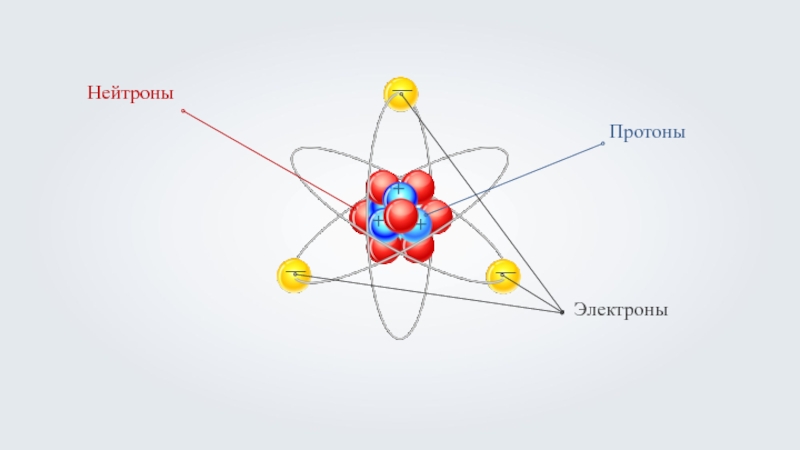
Строение электронных оболочек атомов. (Тема 9) презентация
Содержание
- 1. Строение электронных оболочек атомов. (Тема 9)
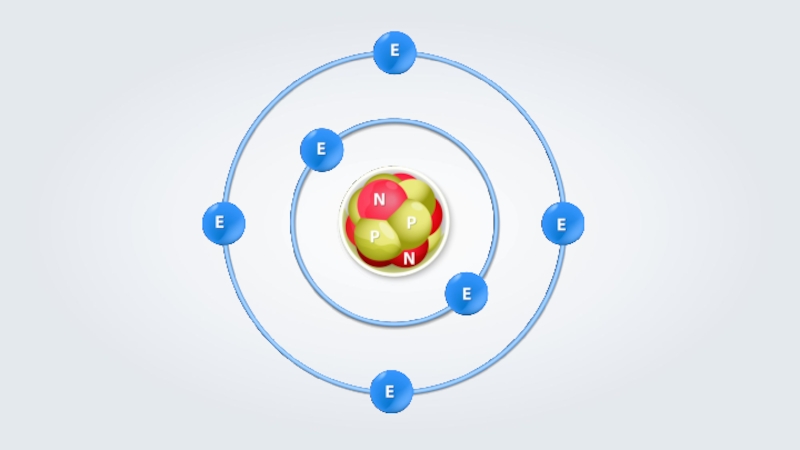
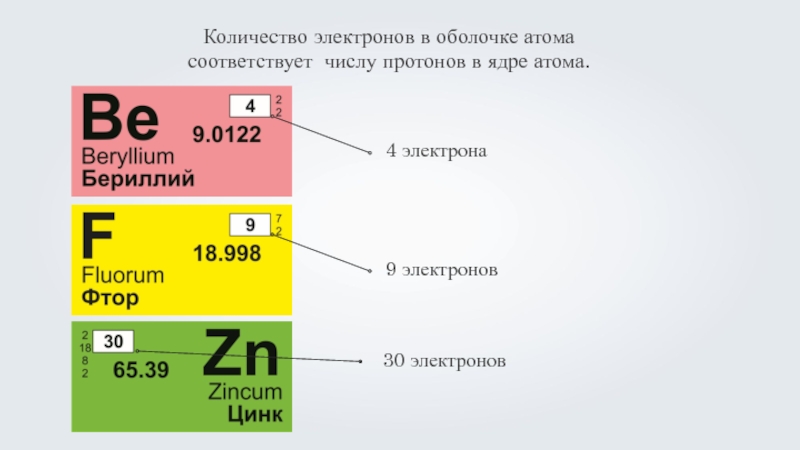
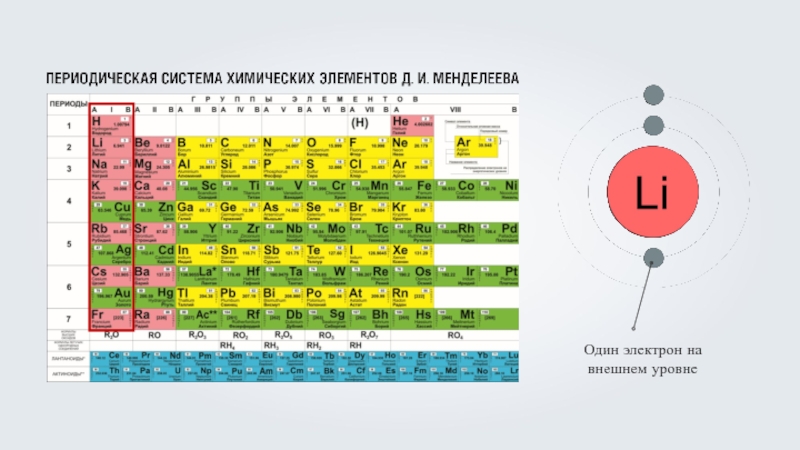
- 3. Количество электронов в оболочке атома соответствует числу протонов в ядре атома.
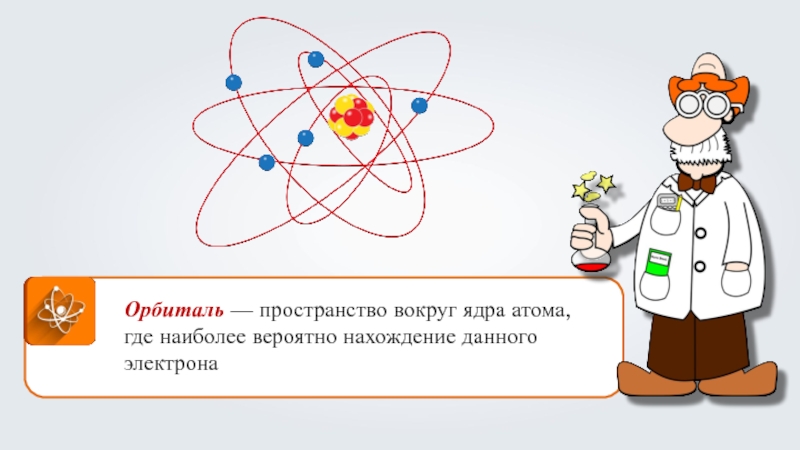
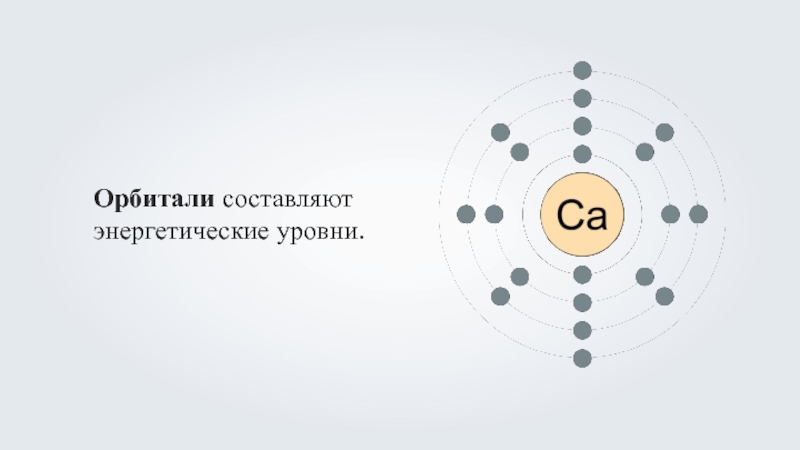
- 5. Орбиталь — пространство вокруг ядра атома, где наиболее вероятно нахождение данного электрона
- 6. Орбитали составляют энергетические уровни.
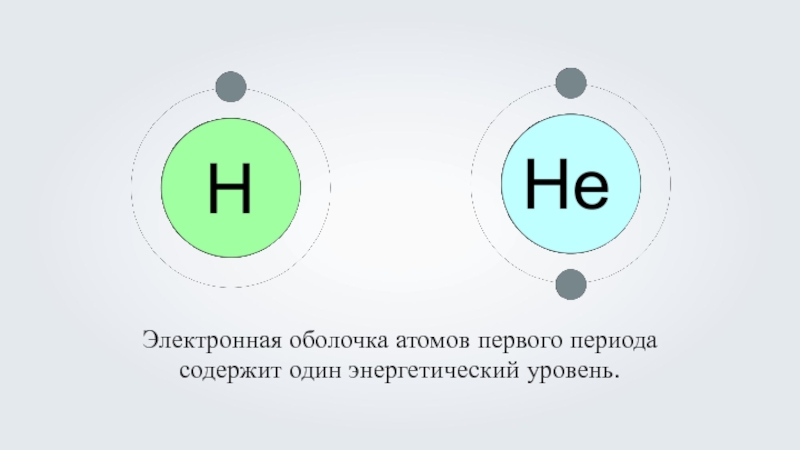
- 8. Электронная оболочка атомов первого периода содержит один энергетический уровень.
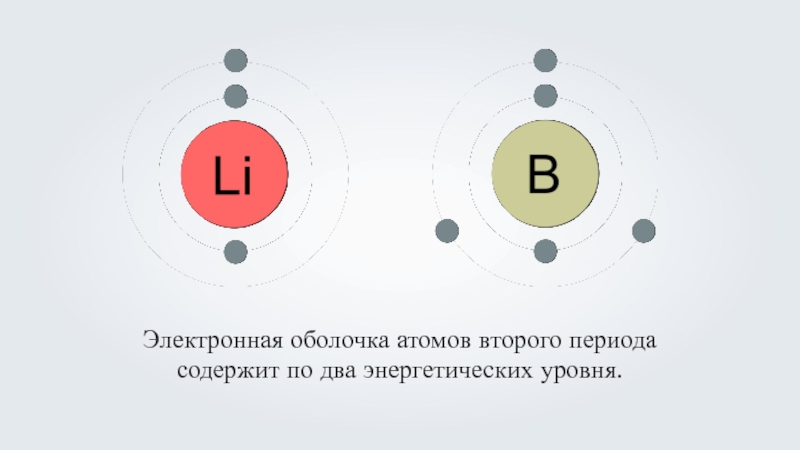
- 9. Электронная оболочка атомов второго периода содержит по два энергетических уровня.
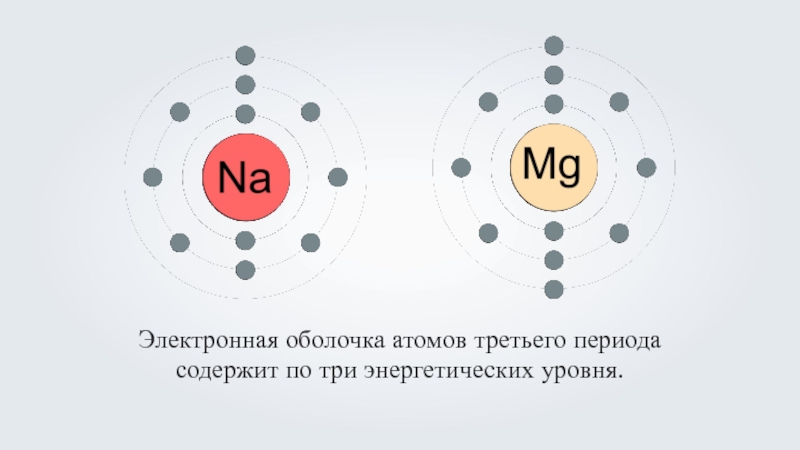
- 10. Электронная оболочка атомов третьего периода содержит по три энергетических уровня.
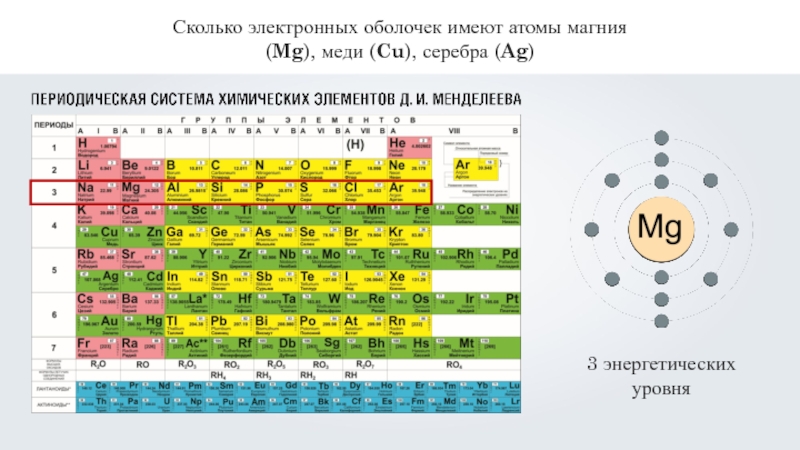
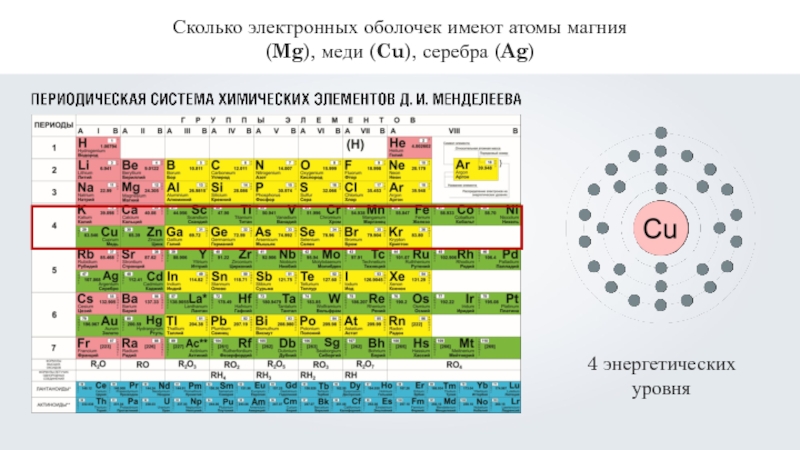
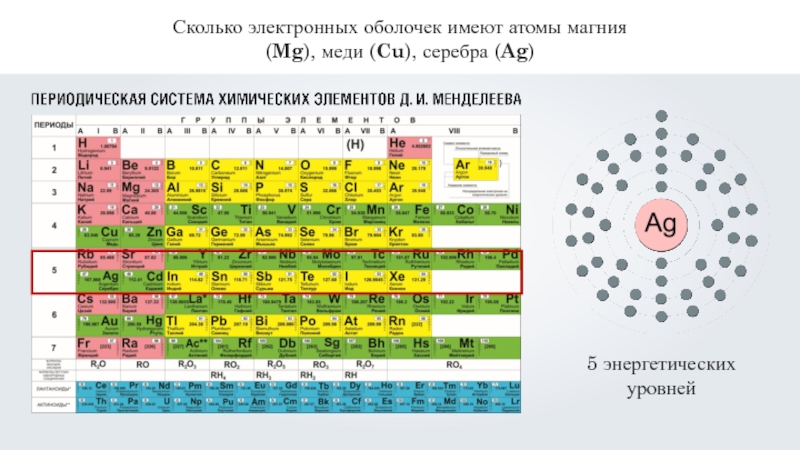
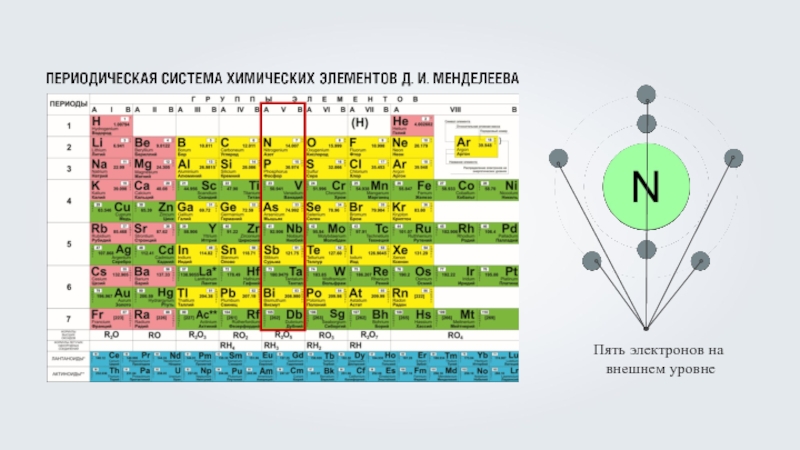
- 11. Сколько электронных оболочек имеют атомы магния (Mg), меди (Cu), серебра (Ag)
- 12. Сколько электронных оболочек имеют атомы магния (Mg), меди (Cu), серебра (Ag)
- 13. Сколько электронных оболочек имеют атомы магния
- 14. Максимальное число электронов, находящихся на энергетическом уровне можно определить по следующей формуле: 2n2
- 15. Максимальное количество электронов на первом уровне: 2⋅12=
- 22. Построение схемы строения электронных оболочек на
- 23. Построение схемы строения электронных оболочек на
- 24. Построение схемы строения электронных оболочек на
- 25. Построение схемы строения электронных оболочек на
- 26. Построение схемы строения электронных оболочек на
- 27. Построение схемы строения электронных оболочек на
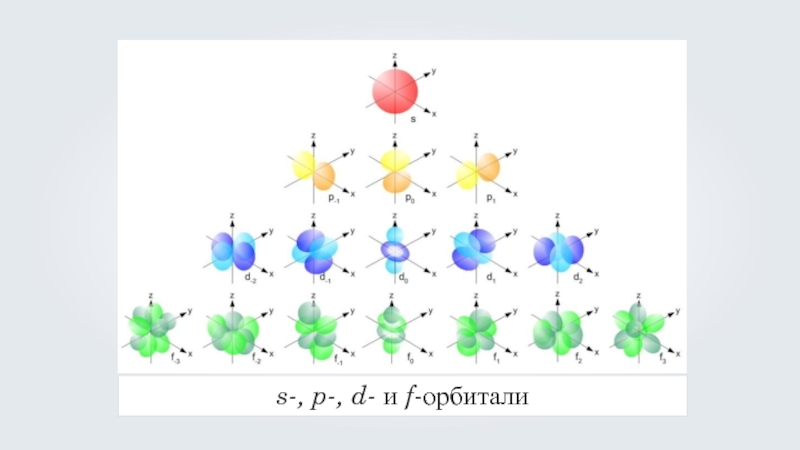
- 28. s-, p-, d- и f-орбитали
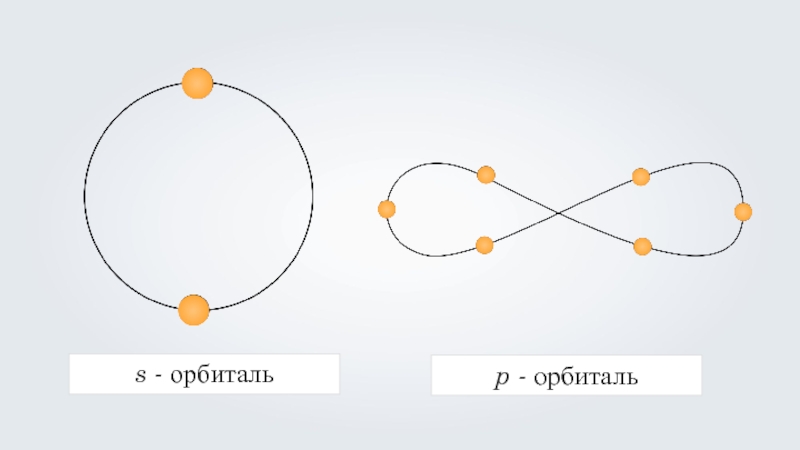
- 29. s - орбиталь
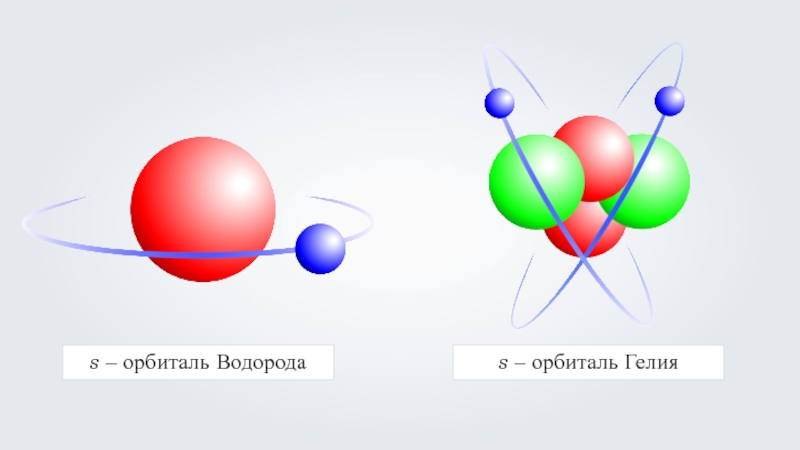
- 30. s – орбиталь Водорода s – орбиталь Гелия
- 31. Н – 1S1 He – 1S2 Li
- 32. Электронные формулы химических элементов первых трёх
Слайд 5
Орбиталь — пространство вокруг ядра атома, где наиболее вероятно нахождение данного
Слайд 13
Сколько электронных оболочек имеют атомы магния (Mg), меди (Cu), серебра (Ag)
5
уровней
Слайд 14Максимальное число электронов, находящихся на энергетическом уровне можно определить по следующей
2n2
Слайд 15Максимальное количество электронов на первом уровне:
2⋅12= 2
Максимальное количество электронов на втором
2⋅22= 8
Максимальное количество электронов на третьем уровне:
2⋅32= 18
Максимальное количество электронов на четвёртом уровне:
2⋅42= 32
Слайд 22
Построение схемы строения электронных оболочек
на примере гелия (Не), бора (B), кислорода
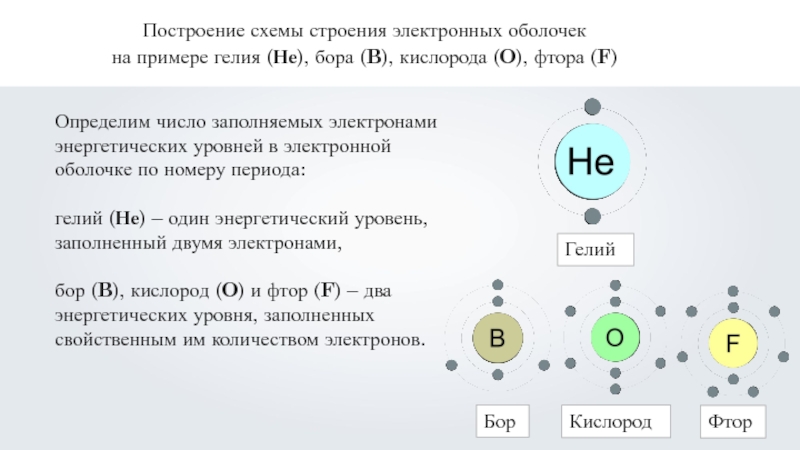
1. Определим общее число электронов в электронной оболочке по порядковому номеру элемента в Периодической таблице:
гелий (Не) – имеет два электрона,
бор (B) – имеет пять электронов,
кислород (O) – имеет восемь электронов,
фтор (F) – имеет девять электронов.
Слайд 23
Построение схемы строения электронных оболочек
на примере гелия (Не), бора (B), кислорода
Определим число заполняемых электронами энергетических уровней в электронной оболочке по номеру периода:
гелий (Не) – один энергетический уровень, заполненный двумя электронами,
бор (B), кислород (O) и фтор (F) – два энергетических уровня, заполненных свойственным им количеством электронов.
Слайд 24
Построение схемы строения электронных оболочек
на примере гелия (Не), бора (B), кислорода
А теперь определим число электронов на каждом энергетическом уровне на наших примерах:
Гелий (Не) – два электрона на единственном энергетическом уровне.
Слайд 25
Построение схемы строения электронных оболочек
на примере гелия (Не), бора (B), кислорода
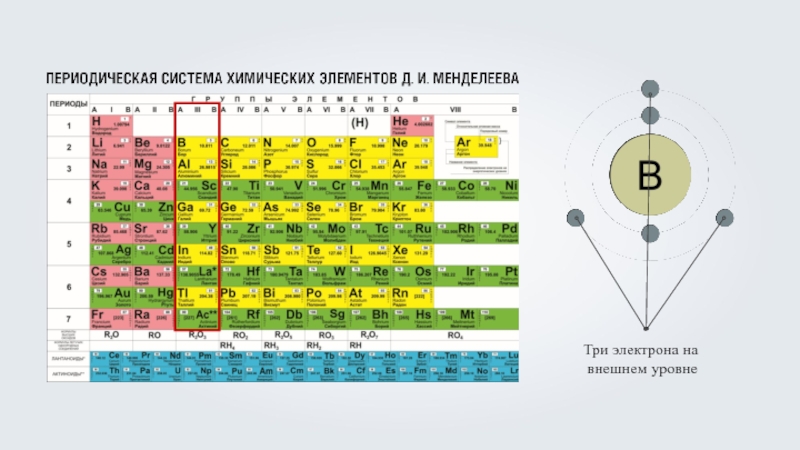
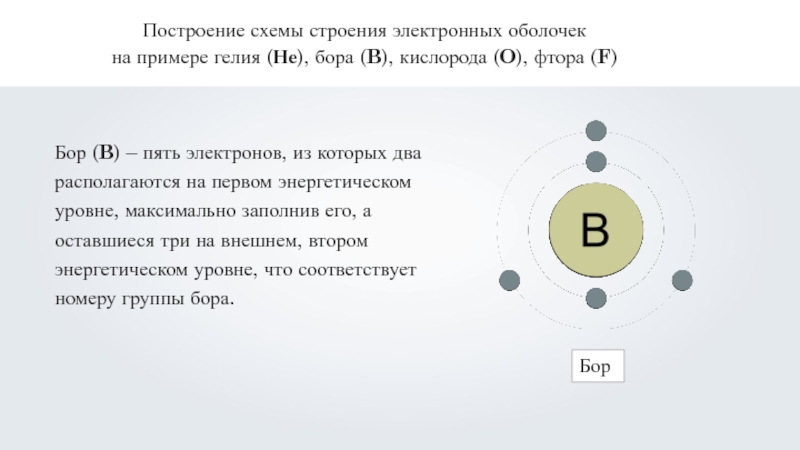
Бор (B) – пять электронов, из которых два располагаются на первом энергетическом уровне, максимально заполнив его, а оставшиеся три на внешнем, втором энергетическом уровне, что соответствует номеру группы бора.
Бор
Слайд 26
Построение схемы строения электронных оболочек
на примере гелия (Не), бора (B), кислорода
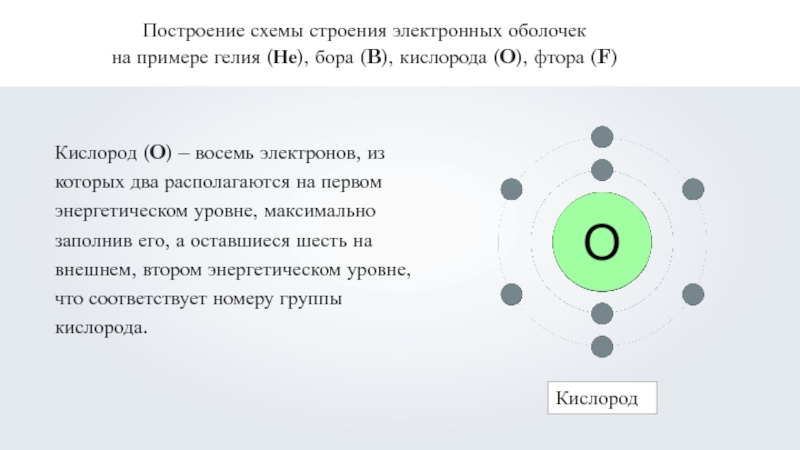
Кислород (O) – восемь электронов, из которых два располагаются на первом энергетическом уровне, максимально заполнив его, а оставшиеся шесть на внешнем, втором энергетическом уровне, что соответствует номеру группы кислорода.
Кислород
Слайд 27
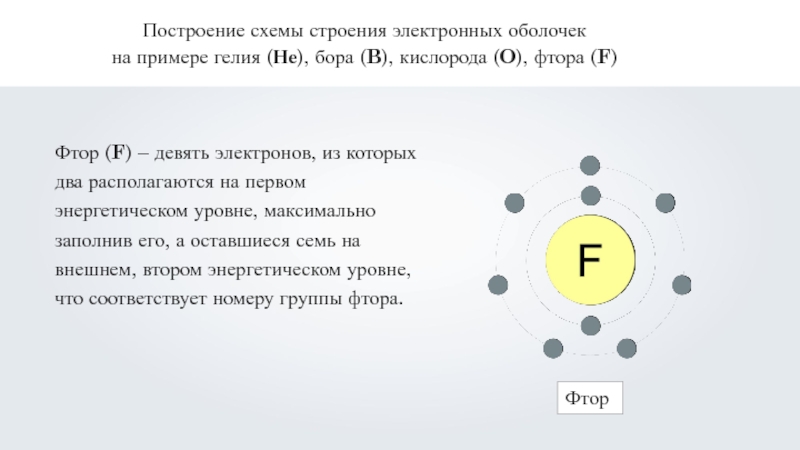
Построение схемы строения электронных оболочек
на примере гелия (Не), бора (B), кислорода
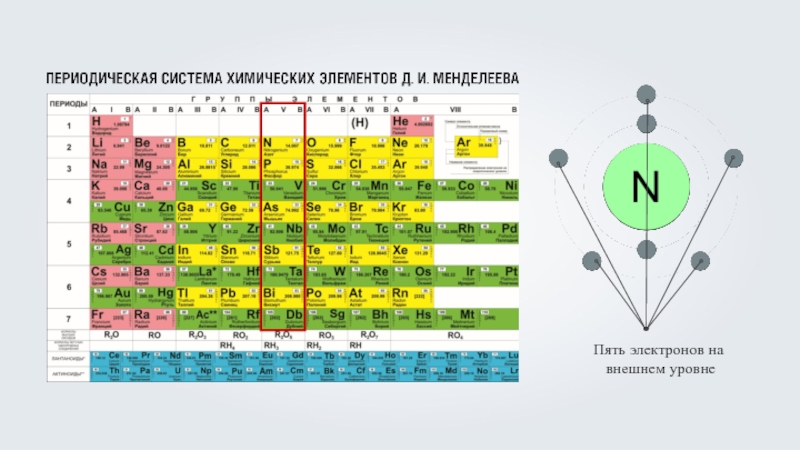
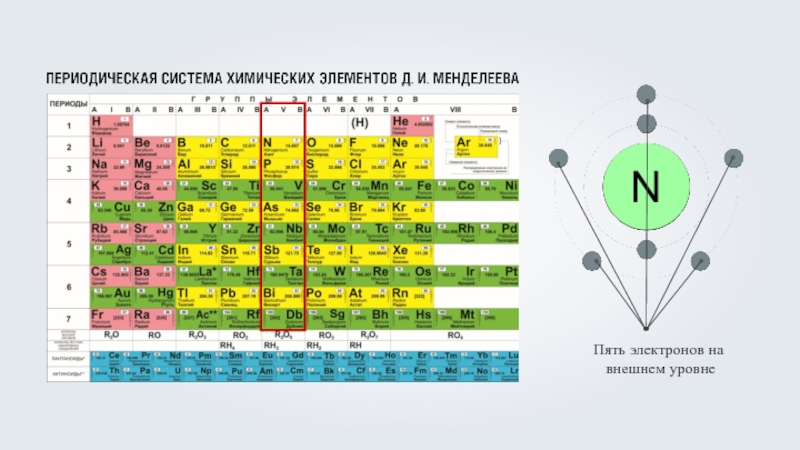
Фтор (F) – девять электронов, из которых два располагаются на первом энергетическом уровне, максимально заполнив его, а оставшиеся семь на внешнем, втором энергетическом уровне, что соответствует номеру группы фтора.
Фтор
Слайд 31Н – 1S1
He – 1S2
Li – 1S22S1
Mg – 1S22S22p63S2
B – 1S22S22p1
Электронные
Слайд 32
Электронные формулы химических элементов первых трёх периодов
Н – 1S1
Li – 1S22S1 Ne – 1S22S22p6
Be – 1S22S2 Ar – 1S22S22p63S23p6
B – 1S22S22p1 AI – 1S22S22p63S23p1
C – 1S22S22p2 Si – 1S22S22p63S23p2
N – 1S22S22p3 P – 1S22S22p63S23p3
O – 1S22S22p4 S – 1S22S22p63S23p4
F – 1S22S22p5 CI – 1S22S22p63S23p5