- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Состав обычной воды презентация
Содержание
- 1. Состав обычной воды
- 2. Состав обычной воды. Обычная вода- это
- 3. Это растворы
- 4. Тема: Растворы. Растворение. Растворимость
- 5. «Растворы – это живая кровь, которая
- 6. «В первичном океане ( во время появления
- 7. Сложные физико-химические процессы, происходящие в организмах
- 9. http://flavite.ru/Иммунитет и наше здоровье. Ольга Побудей
- 10. Растворитель-это вещество растворяющее другие вещества В воде
- 11. Раствор – однородная система, состоящая из частиц
- 12. Процесс растворения сочетает в себе: физический процесс(дробление
- 14. Молекулы сахара (белые кружочки), находящиеся на
- 15. Растворение – результат диффузии, т.е. проникновение растворенного вещества в промежутки между молекулами воды.
- 18. Физико-химическая теория растворов Ивана Алексеевич Каблуков – сторонник физико-химической теории растворов
- 19. Растворение – это физико-химический процесс, а растворы
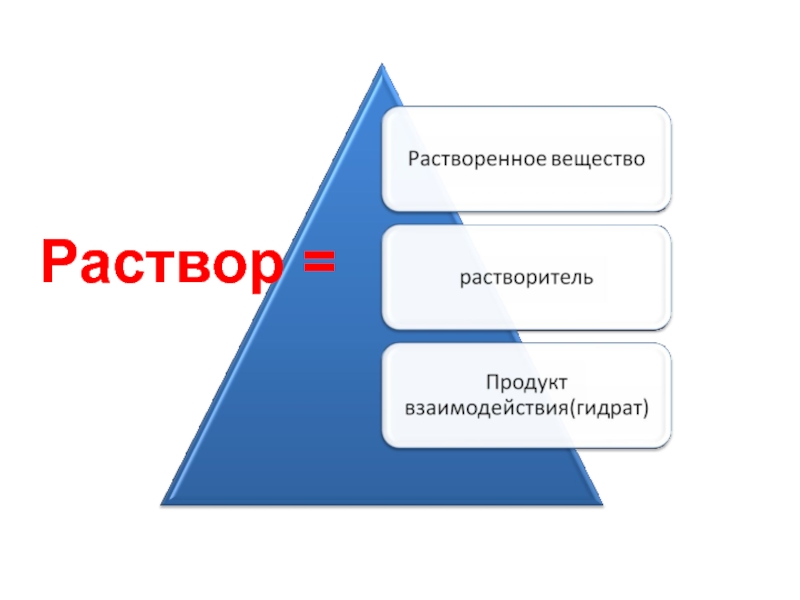
- 20. Раствор =
- 21. гидраты В растворах непостоянный состав. В кристаллогидратах
- 22. Растворимость – способность веществ растворяться в каком-либо
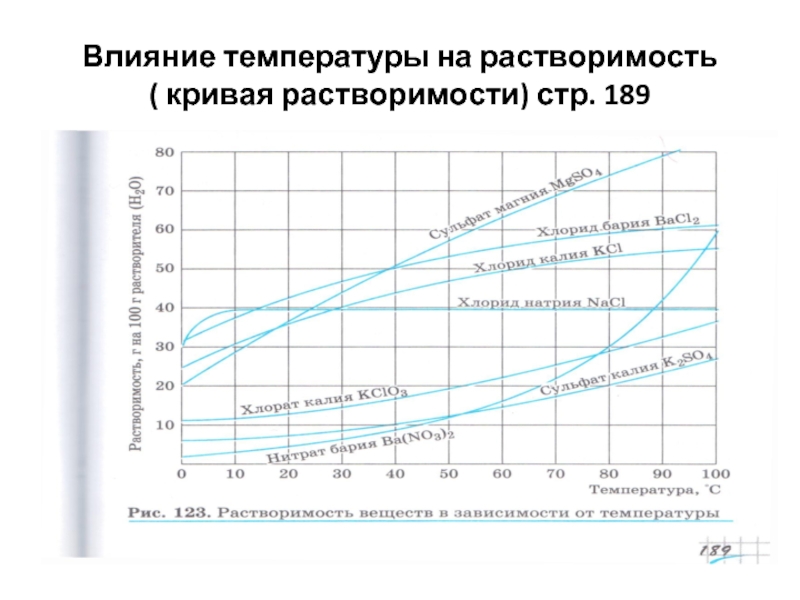
- 23. Влияние температуры на растворимость ( кривая растворимости) стр. 189
- 24. Влияние давления на растворимость Давление не оказывает
- 25. Обозначения в таблице растворимости Н – нерастворимые
- 26. Задание делаем все вместе Задание. Определить растворимость
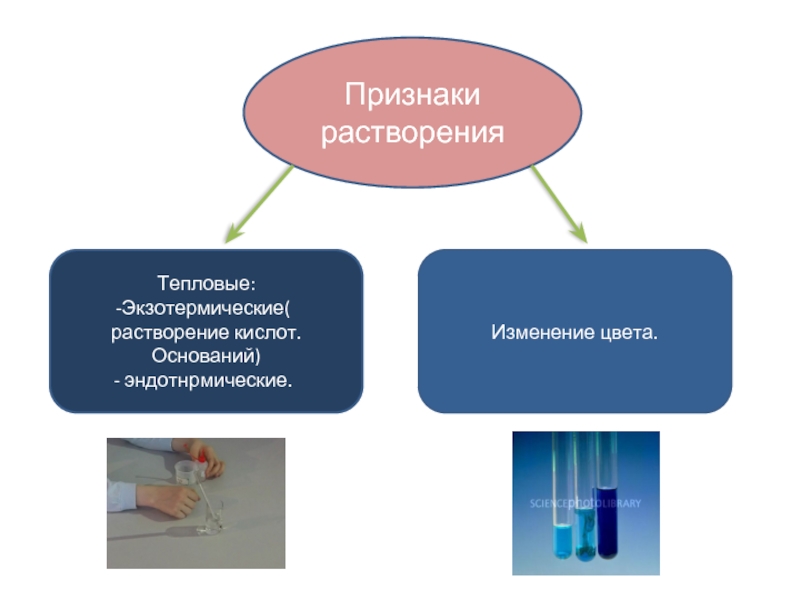
- 27. Признаки растворения Тепловые: Экзотермические( растворение кислот. Оснований) эндотнрмические. Изменение цвета.
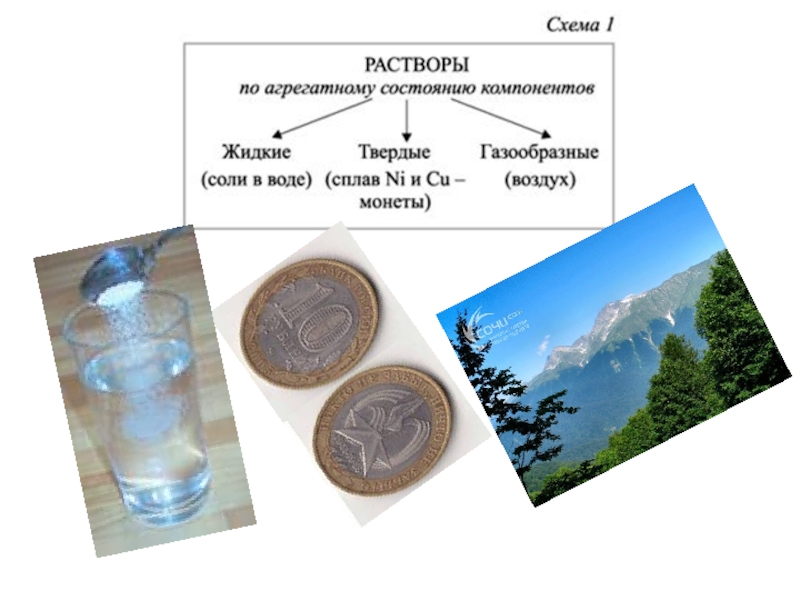
- 29. Классификация растворов
- 31. ОПРЕДЕЛЕНИЯ по теме «Растворы» Раствор
- 32. Решение задач с применением понятия растворимость Пользуясь
Слайд 2Состав обычной воды.
Обычная вода- это раствор
В этой воде растворены газы:
Кроме того, в ней взвешены мельчайшие частицы пыли.
Вот что мы называем
ч и с т о й в о д о й!
Слайд 5«Растворы – это живая кровь, которая создаёт жизнь там, где её
Слайд 6«В первичном океане ( во время появления жизни на Земле) массовая
Лайнус Полинг- американский химик, лауреат Нобелевской премии
Слайд 7
Сложные физико-химические процессы, происходящие в организмах человека и животных, также протекают
Слайд 10Растворитель-это вещество растворяющее другие вещества
В воде хорошо растворяются многие газы, жидкие
Вода- универсальный растворитель
Слайд 11Раствор – однородная система, состоящая из частиц растворителя, растворённого вещества, продуктов
Как происходит процесс растворения с точки зрения атомно-молекулярного учения?
Слайд 12Процесс растворения сочетает в себе: физический процесс(дробление до молекул) и химическое взаимодействие
Сторонники физической теории растворов
Сторонники химической теории растворов
Сванте Август Аррениус, шведский физикохимик
Немецкий химик Фридрих Вильгельм Оствальд
Нидерландский химик Якоб Генрик Вант-Гофф
Д. И. Менделеев не отрицал огульно физическую теорию( электролитической диссоциации), а в большей степени указывал на потребность её развития и понимания с учётом последовательно разработанной теории взаимодействия растворителя и растворённого вещества.
Слайд 14 Молекулы сахара (белые кружочки), находящиеся на поверхности кристалла сахара, окружены
Это явление называется диффузией.
Диффузия происходит медленно, поэтому около поверхности кристаллов находится избыток уже оторванных от кристалла, но еще не диффундировавших в раствор молекул сахара. Они мешают новым молекулам воды подойти к поверхности кристалла, чтобы связаться с его молекулами водородными или другими межмолекулярными связями.
Если раствор перемешивать, то диффузия происходит интенсивнее и растворение сахара идет быстрее.
При растворении перманганата калия диффузию частиц в растворе можно наблюдать визуально благодаря интенсивной малиновой окраске этого вещества.
Слайд 15Растворение – результат диффузии, т.е. проникновение растворенного вещества в промежутки между
Слайд 16 Химическая теория
Растворение - это процесс химического взаимодействия растворяемого вещества с водой – процесс гидратации, а растворы – это соединения гидратов.
Слайд 18Физико-химическая теория растворов
Ивана Алексеевич Каблуков – сторонник физико-химической теории растворов
Слайд 19Растворение – это физико-химический процесс, а растворы – это однородная (гомогенные)
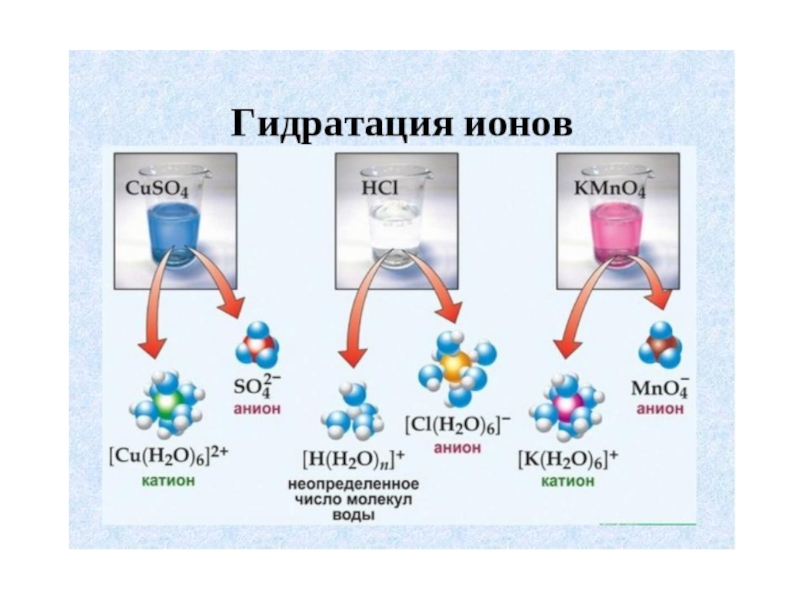
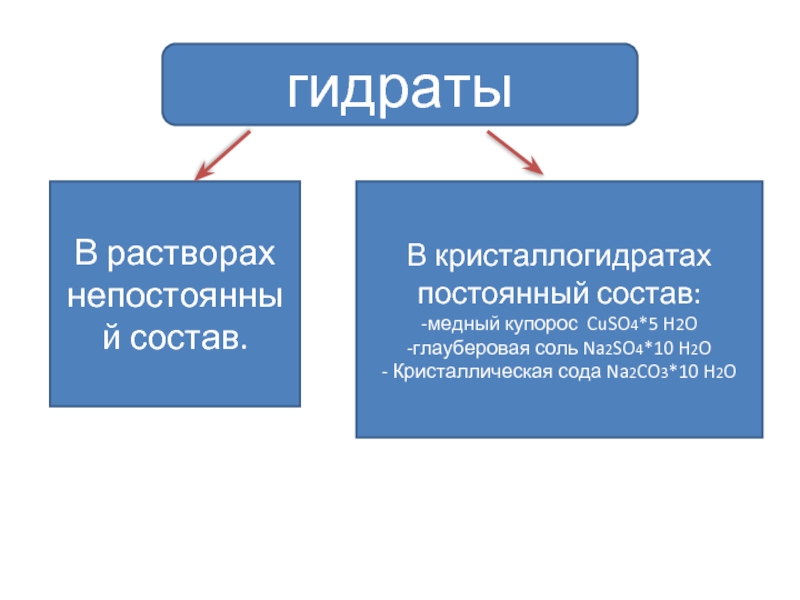
Слайд 21гидраты
В растворах непостоянный состав.
В кристаллогидратах постоянный состав:
-медный купорос CuSO4*5 H2O
-глауберовая соль
- Кристаллическая сода Na2CO3*10 H2O
Слайд 22Растворимость – способность веществ растворяться в каком-либо растворителе.
Растворимость показывает сколько грамм
От чего зависит растворимость?
От природы растворимого вещества и растворителя.
От температуры
От давления
Слайд 24Влияние давления на растворимость
Давление не оказывает заметного влияния на растворимость твердых
Слайд 25Обозначения в таблице растворимости
Н – нерастворимые вещества (меньше 0,01 г в
М – малорастворимые (0,01–10 г в 100 г воды),
Р – растворимые (более 10 г в 100 г воды).
Слайд 26Задание делаем все вместе
Задание. Определить растворимость следующих веществ по таблице растворимости
AgNO3------------Р
Fe(OH)2----------Н
MgCO3----------Н
Слайд 27Признаки растворения
Тепловые:
Экзотермические( растворение кислот. Оснований)
эндотнрмические.
Изменение цвета.
Слайд 31ОПРЕДЕЛЕНИЯ по теме «Растворы»
Раствор – однородная система, состоящая из молекул растворителя
Насыщенный раствор – это раствор, в котором данное вещество при данной температуре больше не растворяется.
Ненасыщенный раствор - это раствор, в котором при данной температуре вещество ещё может растворяться.
Суспензией называют взвесь, в которой мелкие частицы твёрдого вещества равномерно распределены между молекулами воды.
Эмульсией называют взвесь, в которой мелкие капельки какой-либо жидкости распределены между молекулами другой жидкости.
Разбавленные растворы - растворы с небольшим содержанием растворенного вещества.
Концентрированные растворы - растворы с большим содержанием растворенного вещества.
Слайд 32Решение задач с применением понятия растворимость
Пользуясь кривой растворимости определите массовую долю
Дано: w % =m вещ./ m (раствора)
При 20°С- 35г KCl m (раствора) =m вещ.+ m ( воды)
в 100г растворителя w% = 35/ 100+35=0,259 или в %
по кривой растворимости 25,9%
___________
Найти:w% Ответ: 25,9%