- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Соединения железа презентация
Содержание
- 1. Соединения железа
- 2. Оксид железа (Оксид железа (II) Гидроксид
- 3. Оксид железа (II) FeO не растворяется в
- 4. При взаимодействии оксида железа (II) с сильными окислителями образуются соединения железа (III).
- 5. Оксид железа (II) восстанавливается до железа водородом, углеродом (коксом).
- 6. Оксид железа (II) получают нагреванием Fe(OH)2:
- 7. Гидроксид железа (II) Образуется в виде
- 8. Гидроксид железа (II) проявляет основные свойства, поэтому
- 9. Гидроксид железа (II) очень легко окисляется
- 10. Соли железа (II) образуются и при растворении
- 11. С щелочами соли двухвалентного железа образуют белый
- 12. Оксид железа (III)
- 13. Оксид железа (III) получают: нагреванием Fe(OH)3:
- 15. Гидроксид железа (III) Представляет собой бурый
- 16. Fe (ОН) 3 + NaOH = NaFeO2
- 17. Растворимые соли железа (III) подвергаются гидролизу.
- 18. Качественные реакции Качественными реакциями на ион
- 19. Реактивом на ион Fe2+ является: образование
Слайд 2
Оксид железа (Оксид железа (II)
Гидроксид железа Гидроксид железа (II)
Соли железа Соли
железа (II)
Оксид железа (Оксид железа (III)
Гидроксид железа Гидроксид железа (III)
Соли железа Соли железа (III)
Качественные реакции на Качественные реакции на Fe2+ ии Fe3+
Оксид железа (Оксид железа (III)
Гидроксид железа Гидроксид железа (III)
Соли железа Соли железа (III)
Качественные реакции на Качественные реакции на Fe2+ ии Fe3+
Слайд 3Оксид железа (II) FeO не растворяется в воде и щелочах. По
химическим свойствам он близок к основным оксидам. Легко взаимодействует с кислотами.
Со щелочами реакция возможна лишь при сплавлении.
Со щелочами реакция возможна лишь при сплавлении.
Оксид железа (II)
Слайд 4При взаимодействии оксида железа (II) с сильными окислителями образуются соединения железа
(III).
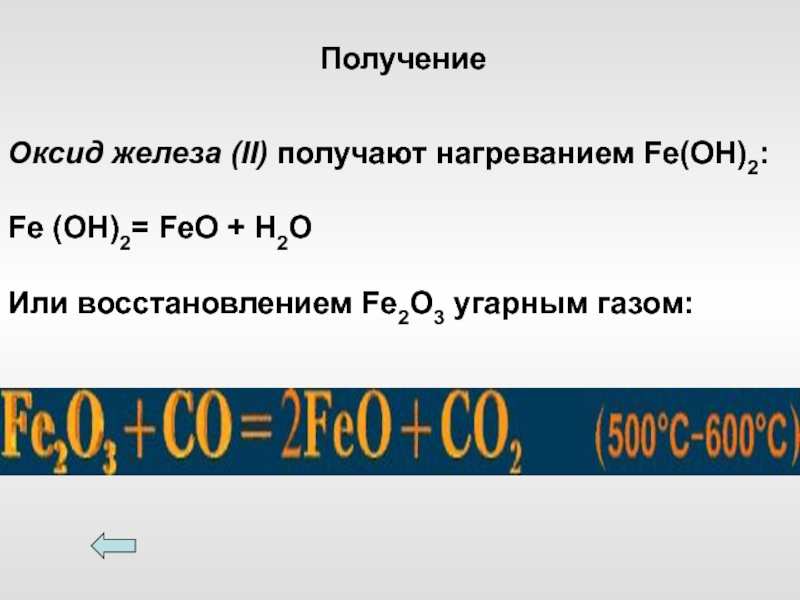
Слайд 6Оксид железа (II) получают нагреванием Fe(OH)2:
Fe (OH)2= FeO + H2O
Или восстановлением
Fe2O3 угарным газом:
Получение
Слайд 7Гидроксид железа (II)
Образуется в виде мелких бледно-зелёных хлопьев при реакции
солей железа (II) со щелочами. Быстро окисляется на воздухе.
Слайд 8Гидроксид железа (II) проявляет основные свойства, поэтому легко реагирует с кислотами:
Легко
разлагается при нагревании на оксид и воду:
Слайд 9
Гидроксид железа (II) очень легко окисляется кислородом воздуха и другими окислителями:
Гидроксид
железа (II) очень может реагировать
с концентрированными щелочами в жёстких условиях:
Слайд 10Соли железа (II) образуются и при растворении железа в кислотах:
Fe +
H2SO4 = FeSO4 + H2
Соли двухвалентного железа неустойчивы и на воздухе или под действием окислителей окисляются до трехвалентного железа.
Соли двухвалентного железа неустойчивы и на воздухе или под действием окислителей окисляются до трехвалентного железа.
Соли Fe2+
Слайд 11С щелочами соли двухвалентного железа образуют белый осадок гидроксида железа (II):
Fe2+
+ 2OH- = Fe(ОН)2
Fe(OH)2 со щелочам не реагирует, но легко взаимодействует с кислотами, образуя соли железа (II):
Fe (ОН)2 + 2HCl = FeCl2 + 2H2O
Растворы солей двухвалентного железа в реакциях гидролиза проявляют слабокислую реакцию:
Fe2+ + HOH ↔ FeOH+ + H+
Fe(OH)2 со щелочам не реагирует, но легко взаимодействует с кислотами, образуя соли железа (II):
Fe (ОН)2 + 2HCl = FeCl2 + 2H2O
Растворы солей двухвалентного железа в реакциях гидролиза проявляют слабокислую реакцию:
Fe2+ + HOH ↔ FeOH+ + H+
Слайд 13Оксид железа (III) получают:
нагреванием Fe(OH)3:
2Fe(OH)3 = Fe2O3 + 3H2O
разложением
солей Fe3+:
Слайд 15Гидроксид железа (III)
Представляет собой бурый аморфный осадок. Его получают действием
щелочей на растворы солей трехвалентного железа:
Fe2(SO4)3 + 6NаОН = 2Fe (ОН)3 + 3Na2SO4
Fe2(SO4)3 + 6NаОН = 2Fe (ОН)3 + 3Na2SO4
Слайд 16Fe (ОН) 3 + NaOH = NaFeO2 + 2H2O
Гидроксид железа (III),
как и соответствующие гидроксиды алюминия
и хрома, амфотерен и взаимодействует с концентрированными растворами щелочей, образуя ферриты:
Слайд 18Качественные реакции
Качественными реакциями на ион Fe3+ являются: образование кроваво-красной окраски
роданида железа (III) и тёмно-синего осадка (берлинская лазурь) в реакции с гексацианоферратом (II) калия.
Слайд 19
Реактивом на ион Fe2+ является: образование синего осадка (турнбулева синь) с
гексацианоферратом (III) калия (красная кровяная соль).