- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Алкены. Строение, номенклатура, изомерия, физические и химические свойства алкенов презентация
Содержание
- 1. Алкены. Строение, номенклатура, изомерия, физические и химические свойства алкенов
- 3. ТЕМА УРОКА : АЛКЕНЫ. СТРОЕНИЕ, НОМЕНКЛАТУРА,ИЗОМЕРИЯ, ФИЗИЧЕСКИЕ
- 4. Гомологический ряд этилена Названия алкенов по системати-
- 5. Алгоритм составления названия разветвлённого алкена СH3 CH2
- 6. Строение этилена В молекуле этилена между атомами
- 7. Атом углерода в sp2-гибридном состоянии далее
- 8. Образование молекулы этилена далее
- 9. π-Связи образуются между атомами, уже соединенными
- 10. Виды изомерии алкенов Структурная изомерия Углеродного скелета Положения двойной связи Межклассовая Пространственная изомерия далее(физические свойства)
- 11. ИЗОМЕРИЯ УГЛЕРОДНОГО СКЕЛЕТА C4H8 H2 H3 H3 далее
- 12. ИЗОМЕРИЯ УГЛЕРОДНОГО СКЕЛЕТА C5H10 H2 H3 H3
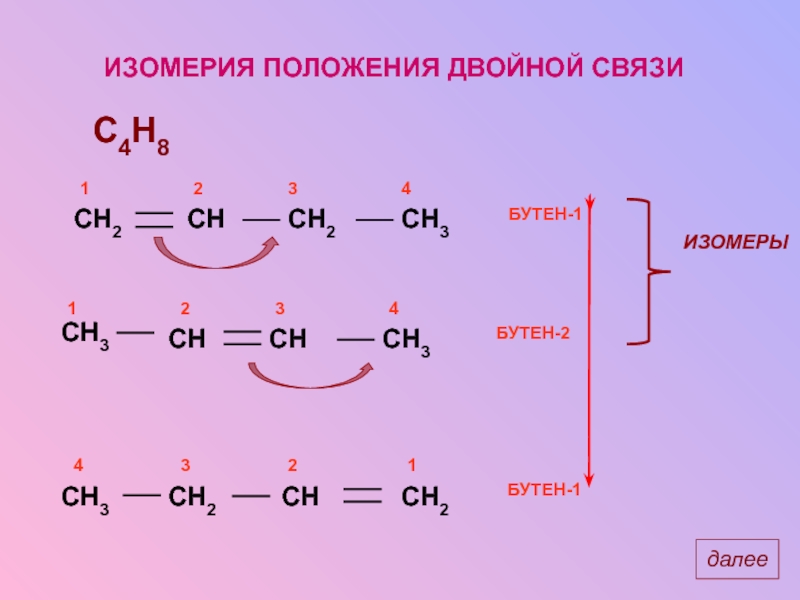
- 13. ИЗОМЕРИЯ ПОЛОЖЕНИЯ ДВОЙНОЙ СВЯЗИ C4H8 далее
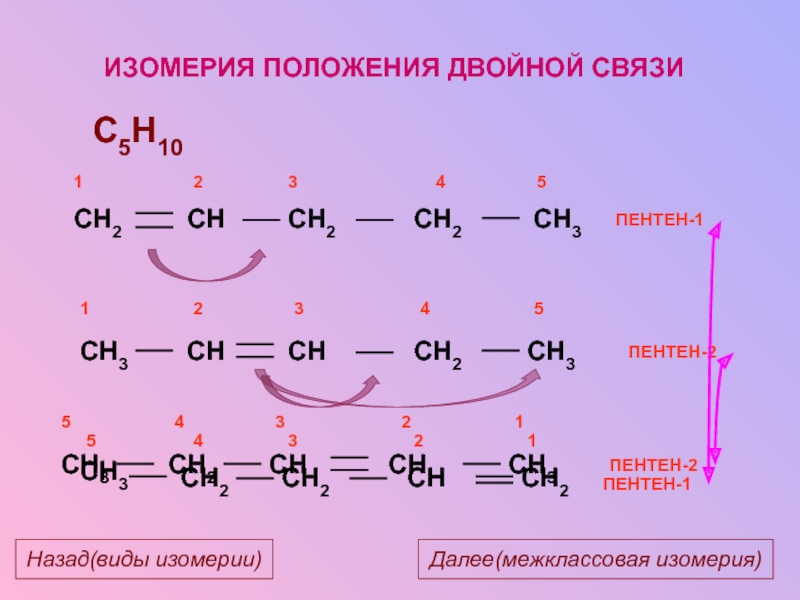
- 14. ПЕНТЕН-2 C5H10 ПЕНТЕН-1 ИЗОМЕРИЯ ПОЛОЖЕНИЯ ДВОЙНОЙ СВЯЗИ
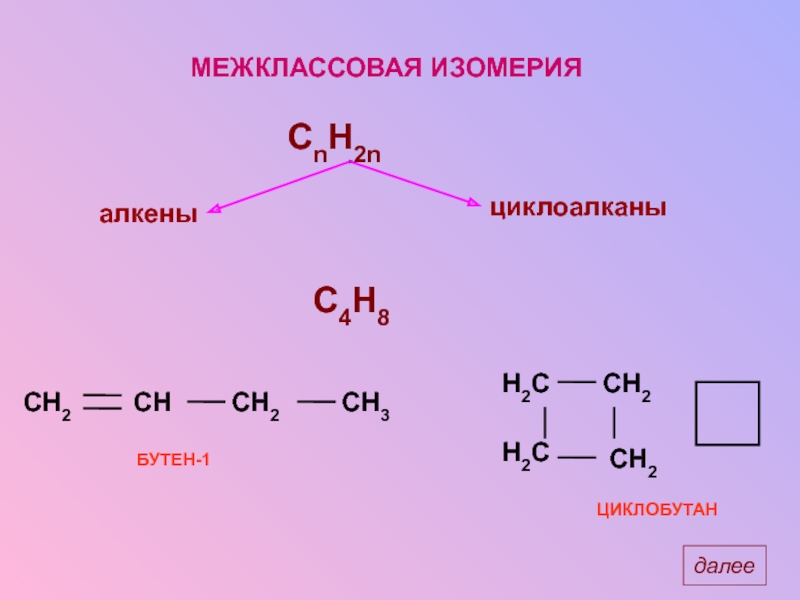
- 15. МЕЖКЛАССОВАЯ ИЗОМЕРИЯ C4H8 БУТЕН-1 ЦИКЛОБУТАН далее
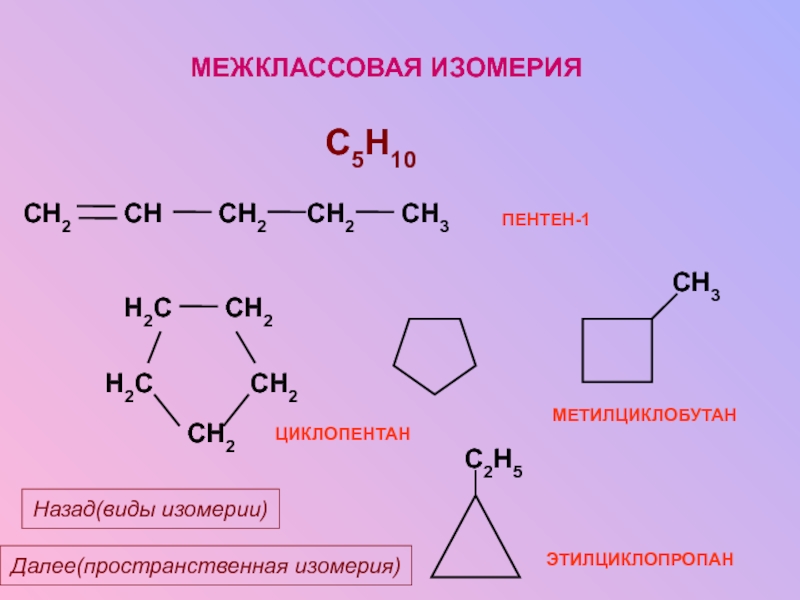
- 16. МЕЖКЛАССОВАЯ ИЗОМЕРИЯ C5H10 ЭТИЛЦИКЛОПРОПАН Далее(пространственная изомерия) Назад(виды изомерии)
- 17. НОМЕНКЛАТУРА АЛКЕНОВ Пространственная изомерия далее(физические свойства) Назад(виды изомерии)
- 18. Физические свойства алкенов закономерно изменяются
- 19. Химические свойства алкенов Химические свойства алкенов
- 20. Реакции присоединения Для алкенов также характерны реакции:
- 21. Правило Марковникова При присоединении полярных молекул типа
- 22. H Cl C CH2 CH H Введение
- 23. Реакции окисления Полное окисление. Горение. Строение
- 24. Реакции окисления Мягкое окисление алкенов водным
- 25. далее(гидрирование) выбор свойства Реакция Вагнера (качественная реакция)
- 26. CH3 CH3 CH2 CH2 H
- 27. CH2 CH2 CH2Br CH2Br Br
- 28. CH3 - CH CH2 CH3 -
- 29. CH3 - CH CH2 CH3 -
- 30. Реакции изомеризации Алкены вступают в реакцию изомеризации
- 31. Реакции полимеризации Полимеризация – реакция образования высокомолекулярного
- 32. Содежание Классификация углеводородов….………………………………2 Тема урока……………….……………………………………...….3 Гомологический ряд
Слайд 3ТЕМА УРОКА :
АЛКЕНЫ. СТРОЕНИЕ,
НОМЕНКЛАТУРА,ИЗОМЕРИЯ,
ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ
СВОЙСТВА АЛКЕНОВ.
АЛКЕНЫ-
ЭТО УГЛЕВОДОРОДЫ НЕЦИКЛИЧЕСКОГО
СТРОЕНИЯ,
МЕЖДУ АТОМАМИ УГЛЕРОДА ОБРАЗУЕТСЯ
ОДНА ДВОЙНАЯ СВЯЗЬ.
Общая формула
CnH2n (n>1)
далее
Слайд 4Гомологический ряд этилена
Названия алкенов по системати-
ческой номенклатуре образуются
от названий соответствующих
алканов
атомов углерода) путём замены
суффикса -ан на –ен.
эт
ан
ен
проп
ан
ен
бут
ан
ен-1
Некоторые простейшие алкены имеют тривиальные названия
пент
ан
ен-1
(этилен)
(пропилен)
(бутилен)
далее
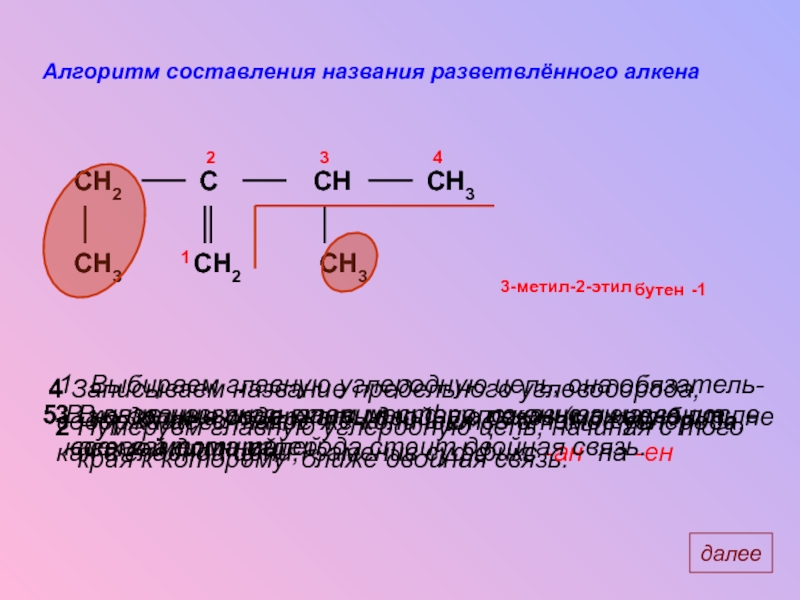
Слайд 5Алгоритм составления названия разветвлённого алкена
СH3
CH2
C
CH
CH2
СH3
СH3
Выбираем главную углеродную цепь, она обязатель-
2 Нумеруем главную углеродную цепь, начиная с того
края к которому ближе двойная связь.
1
3 В названии указываем местоположение и название
всех заместителей.
3-метил-2-этил
4 Записываем название предельного углеводорода,
содержащего такое же количество атомов углерода,
как в главной цепи, заменив суффикс -ан на -ен
бутен
5 В конце названия ставим цифру, показывающую после
какого атома углерода стоит двойная связь.
-1
далее
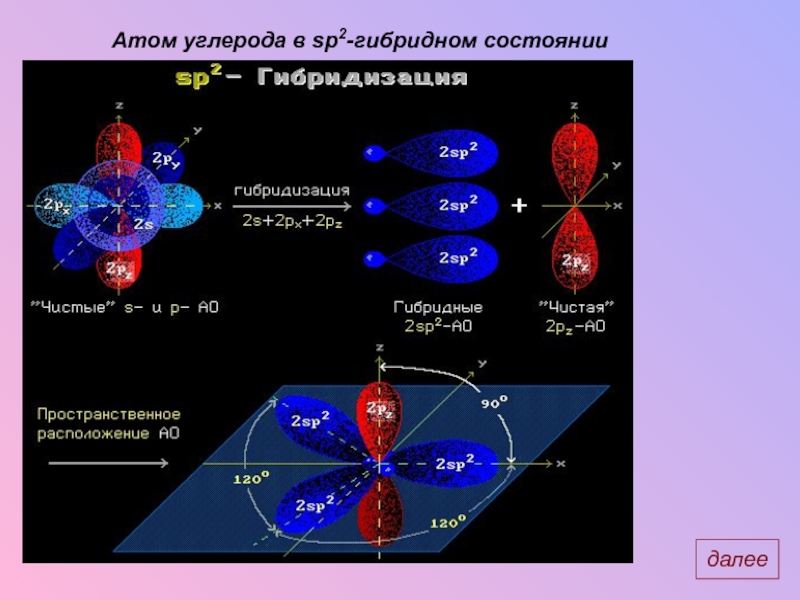
Слайд 6Строение этилена
В молекуле этилена между атомами углерода образуется двойная связь,
которая является
осевом перекрывании гибридных орбиталей, а для образования
π-связи необходимы «чистые» р-орбитали. Поэтому атомы углерода,
связанные двойной связью находятся в sp2 -гибридном состоянии.
σ
π
далее
Слайд 9 π-Связи образуются между атомами, уже соединенными σ-связью.
Эта связь слабее
Различное строение σ- и π-молекулярных орбиталей определяет
характерные особенности σ- и π-связей.
σ-Связь прочнее π-связи. Это обусловлено более эффективным
перекрыванием атомных орбиталей при образовании σ-связи и
нахождением σ-электронов между ядрами.
2. По σ-связям возможно внутримолекулярное вращение атомов
без разрыва связи. Вращение по π-связи невозможно без ее разрыва!
3. Электроны π-связи, находясь вне межъядерного пространства,
обладают большей подвижностью по сравнению с σ-электронами
Особенности σ- и π-связей
далее
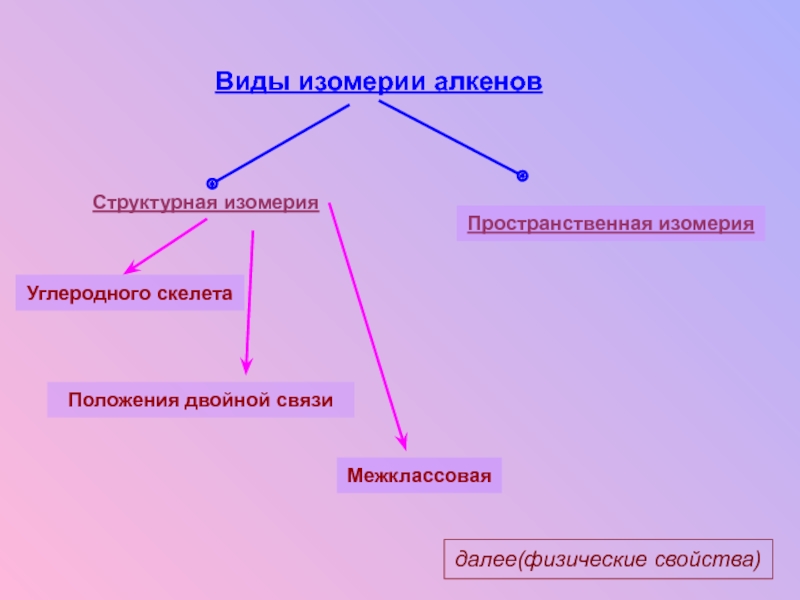
Слайд 10Виды изомерии алкенов
Структурная изомерия
Углеродного скелета
Положения двойной связи
Межклассовая
Пространственная изомерия
далее(физические свойства)
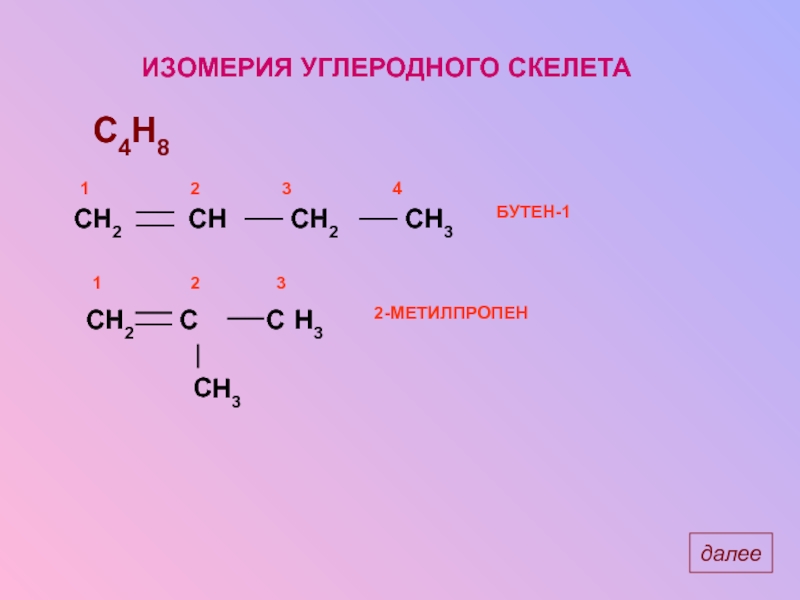
Слайд 12ИЗОМЕРИЯ УГЛЕРОДНОГО СКЕЛЕТА
C5H10
H2
H3
H3
2-МЕТИЛБУТЕН-1
H2
H
H
H3
H2
H3
3-МЕТИЛБУТЕН-1
Далее(изомерия положения связи)
Назад(виды изомерии)
Слайд 14ПЕНТЕН-2
C5H10
ПЕНТЕН-1
ИЗОМЕРИЯ ПОЛОЖЕНИЯ ДВОЙНОЙ СВЯЗИ
ПЕНТЕН-2
ПЕНТЕН-1
Далее(межклассовая изомерия)
Назад(виды изомерии)
Слайд 16МЕЖКЛАССОВАЯ ИЗОМЕРИЯ
C5H10
ЭТИЛЦИКЛОПРОПАН
Далее(пространственная изомерия)
Назад(виды изомерии)
Слайд 18 Физические свойства алкенов закономерно изменяются в
гомологическом ряду: от
начиная с С5Н10 – жидкости,
с С18Н36 – твердые вещества.
Алкены практически нерастворимы в воде, но хорошо растворяются в органических растворителях.
Физические свойства алкенов
далее
Слайд 19Химические свойства алкенов
Химические свойства алкенов определяются строением и свойствами двойной
Алкены химически более активны, чем алканы.
далее
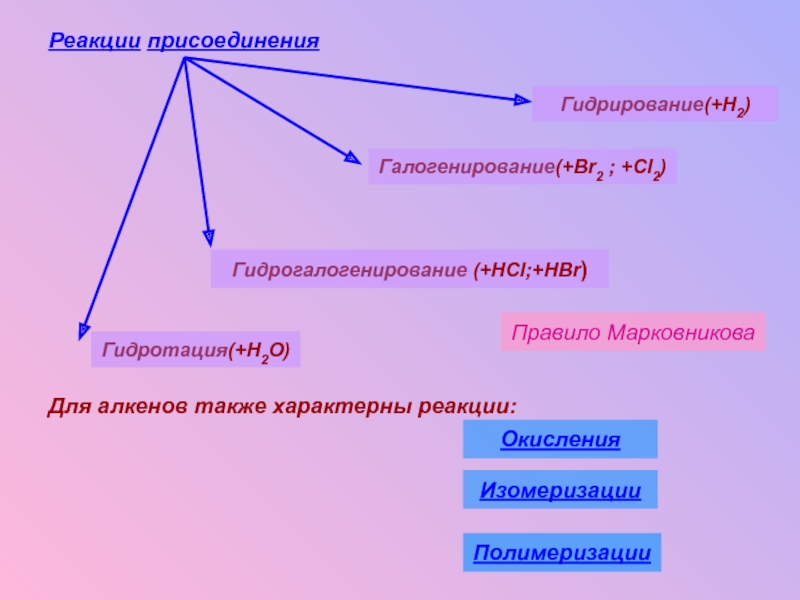
Слайд 20Реакции присоединения
Для алкенов также характерны реакции:
Правило Марковникова
Гидрирование(+H2)
Галогенирование(+Br2 ; +Cl2)
Гидрогалогенирование (+HCl;+HBr)
Гидротация(+H2O)
Полимеризации
Изомеризации
Окисления
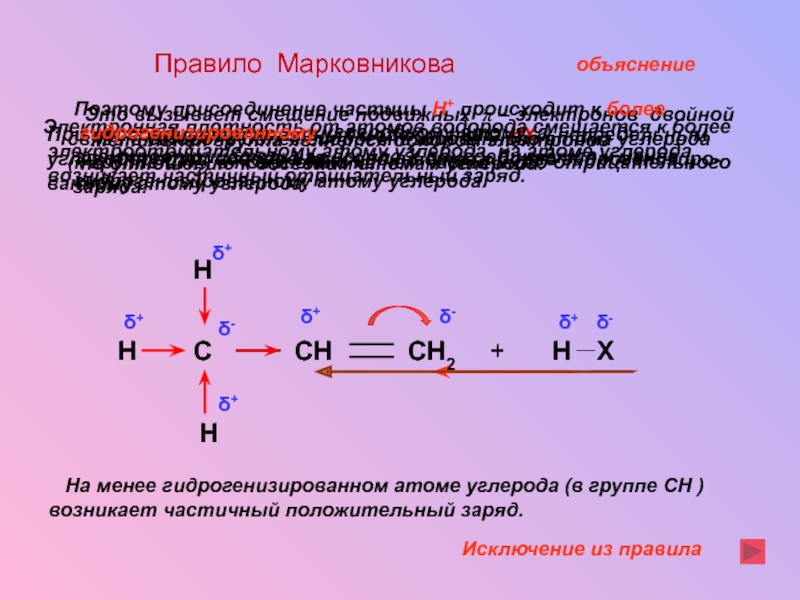
Слайд 21Правило Марковникова
При присоединении полярных молекул типа НХ к непредельным
углеводородам, водород
ванному атому углерода.
C
H
CH2
CH
H
H
δ-
δ+
δ+
δ+
Электронная плотность от атомов водорода смещается к более
электроотрицательному атому углерода, на атоме углерода
возникает частичный отрицательный заряд.
Метильная группа является донором электронов
по отношению к соседним атомам углерода.
объяснение
Это вызывает смещение подвижных π – электронов двойной
связи в сторону более гидрогенизированного атома углерода
(к группе СН2 ) и появлению на нём частичного отрицательного
заряда.
δ-
На менее гидрогенизированном атоме углерода (в группе СН )
возникает частичный положительный заряд.
δ+
Поэтому присоединение частицы Н+ происходит к более
гидрогенизированному углеродному атому, а электроотрицательная группа Х присоединяется к менее гидрогенизированному атому углерода.
Слайд 22H
Cl
C
CH2
CH
H
Введение в радикал электроотрицательного элемента приводит к изменению направления реакции присоединения.
δ-
δ+
δ-
δ+
выбор
Слайд 23
Реакции окисления
Полное окисление. Горение.
Строение продуктов окисления алкенов зависит
от условий реакции
далее
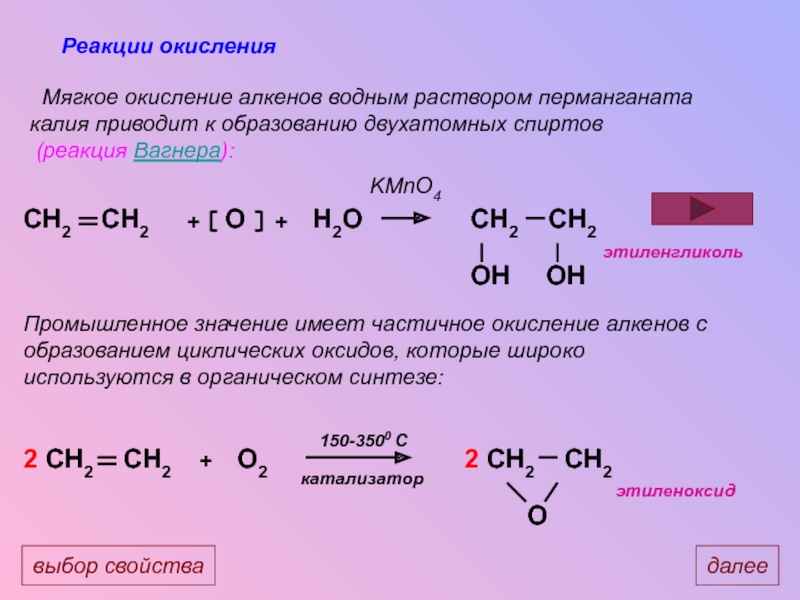
Слайд 24Реакции окисления
Мягкое окисление алкенов водным раствором перманганата калия
(реакция Вагнера):
Промышленное значение имеет частичное окисление алкенов с образованием циклических оксидов, которые широко используются в органическом синтезе:
2 CH2 CH2
+
O2
2 CH2 CH2
O
этиленоксид
150-3500 С
катализатор
далее
выбор свойства
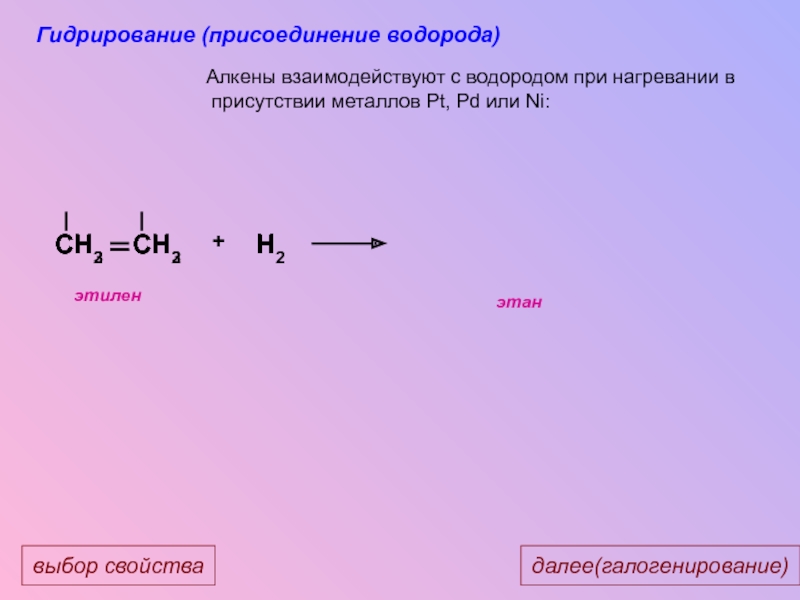
Слайд 26CH3 CH3
CH2 CH2
H
H2
H
+
Алкены взаимодействуют с водородом при нагревании в
Гидрирование (присоединение водорода)
далее(галогенирование)
выбор свойства
Слайд 27CH2 CH2
CH2Br CH2Br
Br
Br2
Br
+
Галогенирование (присоединение галогенов)
Присоединение галогенов происходит легко
условиях (при комнатной температуре, без катализатора).
далее
выбор свойства
Слайд 28CH3 - CH CH2
CH3 - CH CH3
H
HBr
Br
+
далее (гидротация)
выбор свойства
Гидрогалогенирование
присоединение протекает по правилу Марковникова
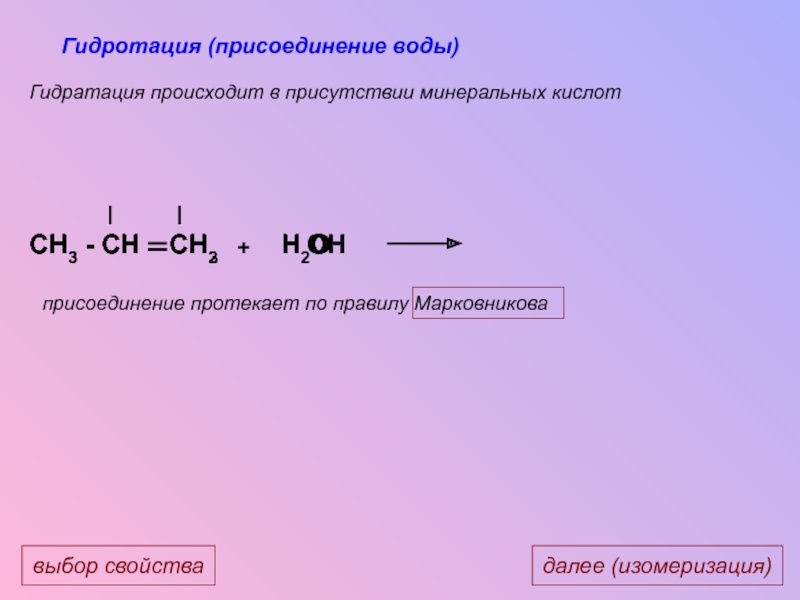
Слайд 29CH3 - CH CH2
CH3 - CH CH3
H
H2O
OH
+
далее (изомеризация)
выбор свойства
Гидротация
присоединение протекает по правилу Марковникова
Гидратация происходит в присутствии минеральных кислот
Слайд 30Реакции изомеризации
Алкены вступают в реакцию изомеризации при нагревании в
присутствии катализаторов
Изомеризация алкенов приводит или к перемещению π–связи:
или к перестройке углеродного скелета:
далее (полимеризация)
выбор свойства
Слайд 31Реакции полимеризации
Полимеризация – реакция образования высокомолекулярного соединения (полимера) путем последовательного присоединения
Число n называется степенью полимеризации.
Реакции полимеризации алкенов идут в результате присоединения по
кратным связям:
выбор свойства
Слайд 32Содежание
Классификация углеводородов….………………………………2
Тема урока……………….……………………………………...….3
Гомологический ряд этилена….………………………………..4
Номенклатура алкенов….….……………………………..….….5
Строение этилена ………..………………………………..........6
особенности сигма- и пи- связей…………….…..…..….9
6. Виды изомерии алкенов…….……………………………..…..….10
изомерия углеродного скелета (С4Н10 ;С5Н12)……11-12
изомерия положения двойной связи (С4Н10 ;С5Н12)…13-14
межклассовая изомерия (С4Н10 ;С5Н12).…………..…..15-16
пространственная изомерия...…..…….…………..…17
7. Физические свойства алкенов……….…..…..……….…………18
8. Химические свойства алкенов……..….……..……….…………19
типы реакций………….……..…………..………..…….….20
правило Марковникова………..………………….….….21-22
реакции окисления……………..………………..………23-25
реакция гидрирования …………………………..…………26
реакция галогенирования………………………...…..…….27
реакция гидррогалогенирования …………………….…..28
реакция гидротации………………………………………..29
реакции изомеризации…………..……………….…......….30
реакции полимеризации………..………………..….…......31
9. Содержание….…………………………..…………..……….…...….32
Слайд №