- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
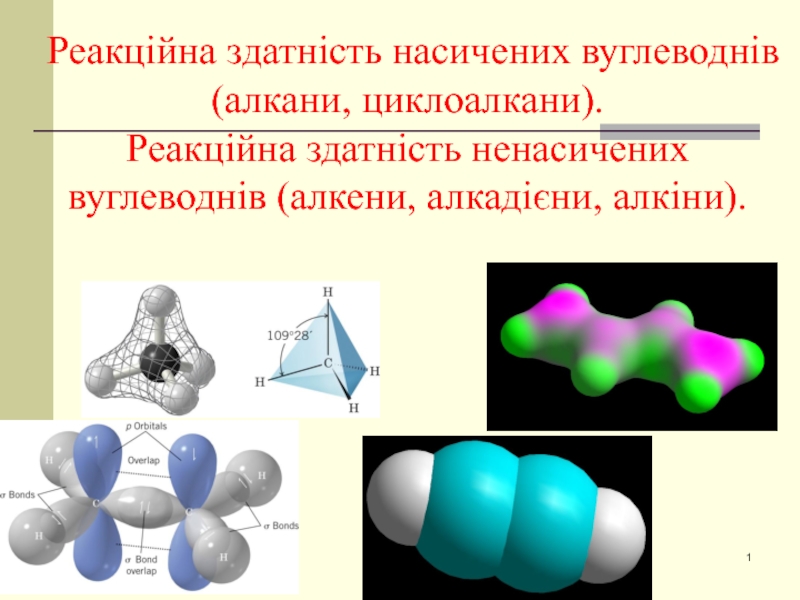
Реакційна здатність насичених вуглеводнів. Реакційна здатність ненасичених вуглеводнів (алкени, алкадієни, алкіни) презентация
Содержание
- 1. Реакційна здатність насичених вуглеводнів. Реакційна здатність ненасичених вуглеводнів (алкени, алкадієни, алкіни)
- 2. Вуглеводні: аліфатичні та аліциклічні Назва класу вуглеводню
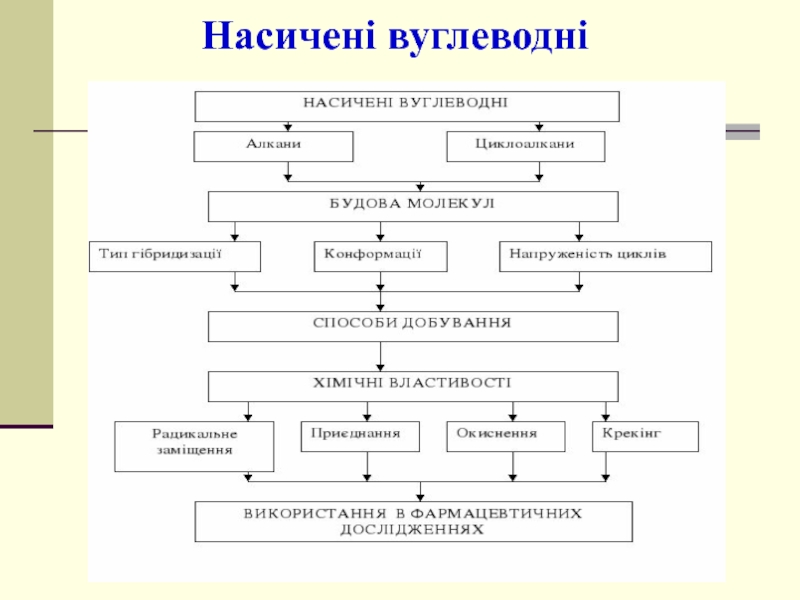
- 3. Насичені вуглеводні
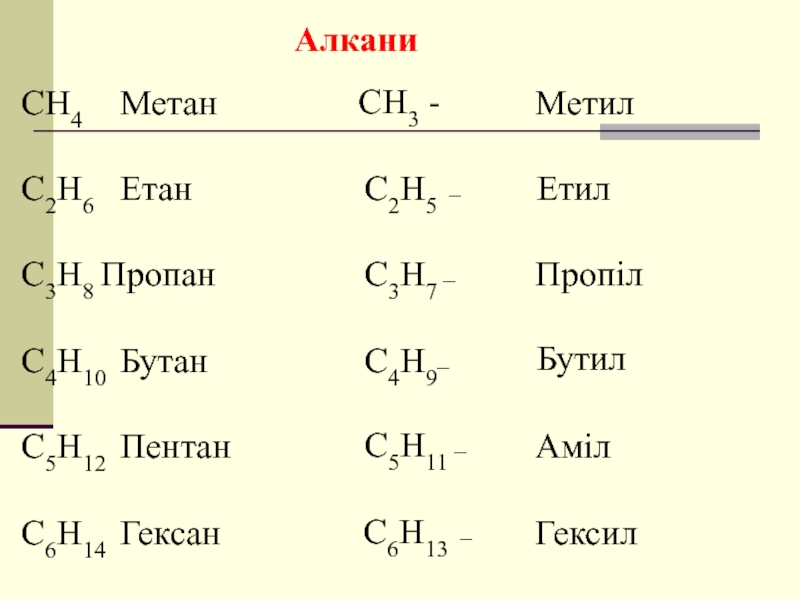
- 4. Алкани
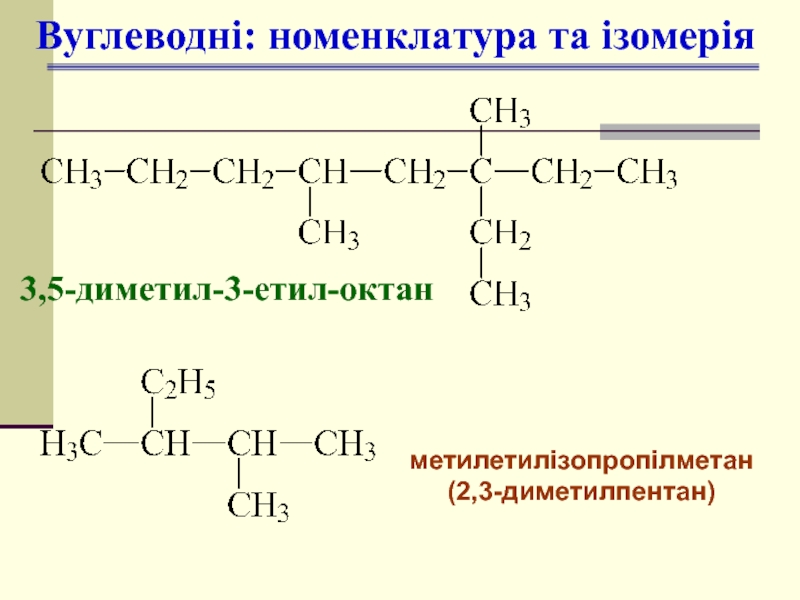
- 5. Вуглеводні: номенклатура та ізомерія 3,5-диметил-3-етил-октан метилетилізопропілметан (2,3-диметилпентан)
- 6. Вуглеводні: номенклатура та ізомерія 2-етилпентен-1 пентадієн-1,3
- 7. Вуглеводні: номенклатура та ізомерія 3-метилбутин-1 1-фенілпропін (метилфенілацетилен) етиніл пропаргіл
- 8. Вуглеводні: номенклатура та ізомерія Структурна ізомерія С5Н12
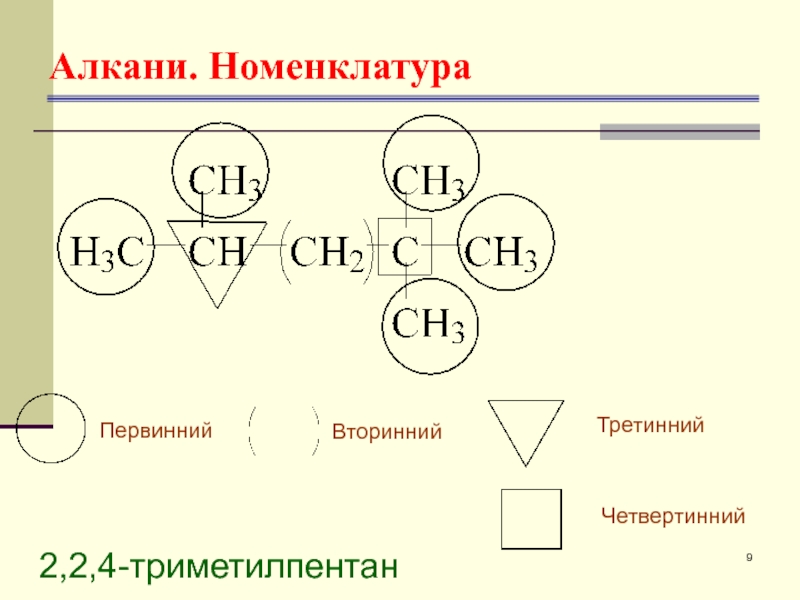
- 9. Алкани. Номенклатура 2,2,4-триметилпентан Первинний Вторинний Третинний Четвертинний
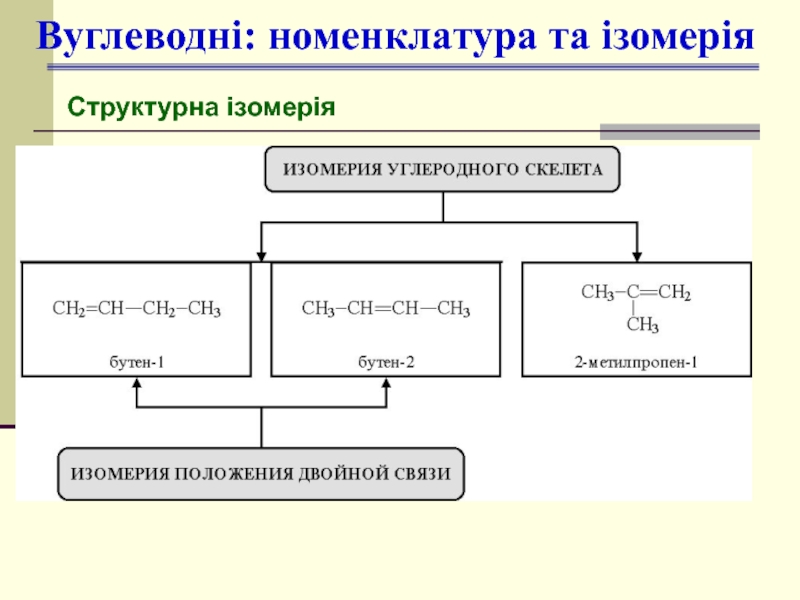
- 10. Вуглеводні: номенклатура та ізомерія Структурна ізомерія
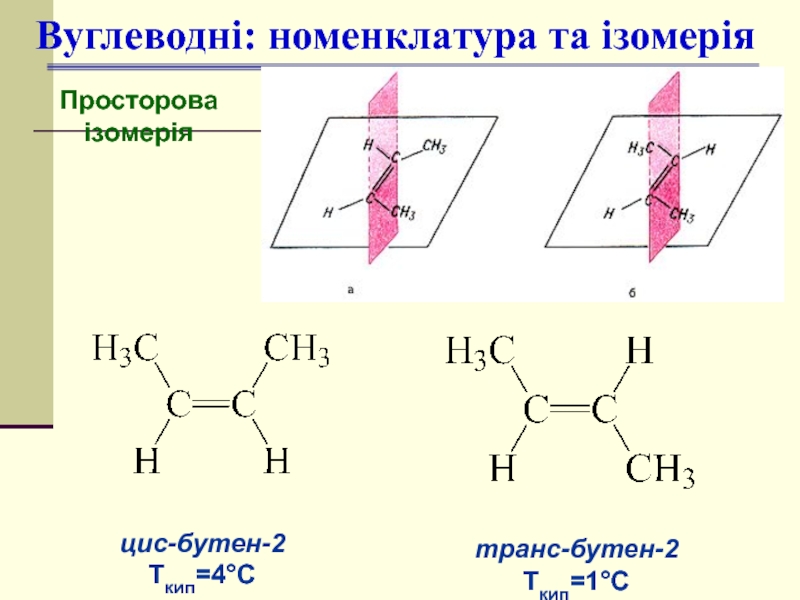
- 11. Вуглеводні: номенклатура та ізомерія Просторова ізомерія цис-бутен-2 Ткип=4°С транс-бутен-2 Ткип=1°С
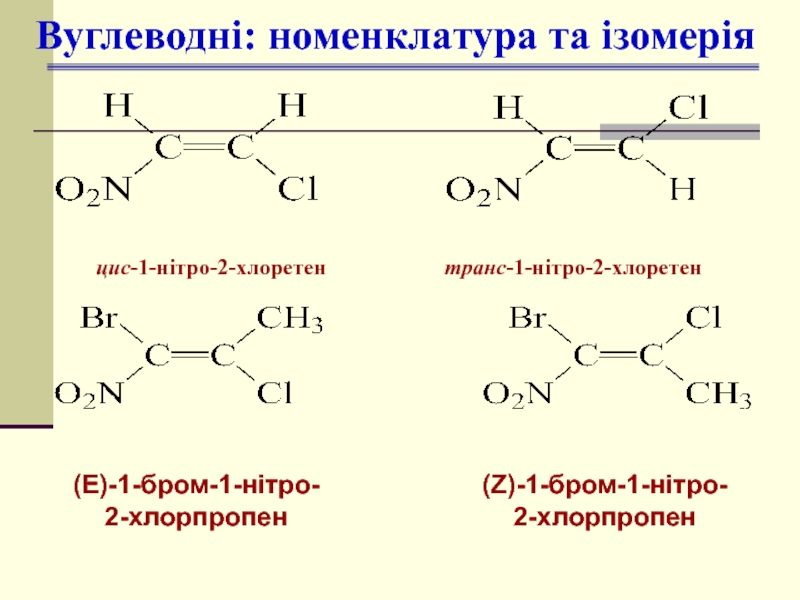
- 12. Вуглеводні: номенклатура та ізомерія (Е)-1-бром-1-нітро- 2-хлорпропен (Z)-1-бром-1-нітро- 2-хлорпропен
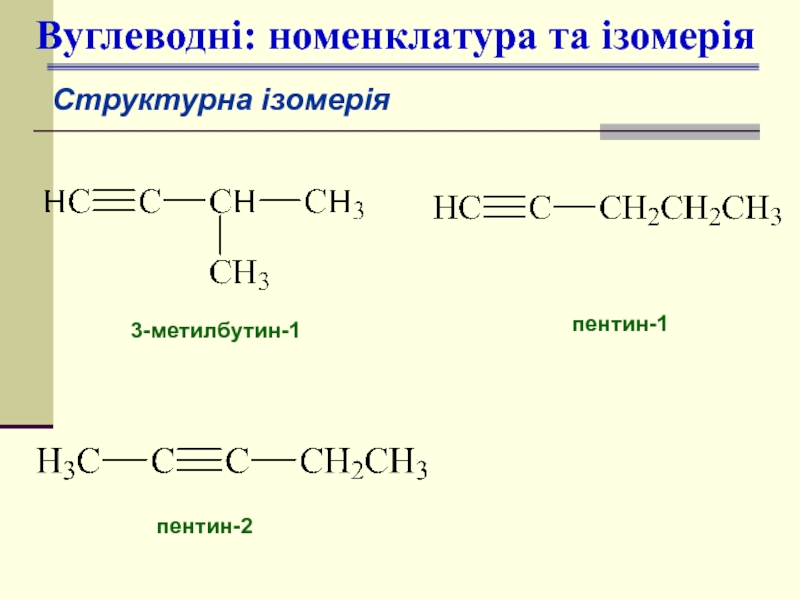
- 13. 3-метилбутин-1 пентин-1 пентин-2 Вуглеводні: номенклатура та ізомерія Структурна ізомерія
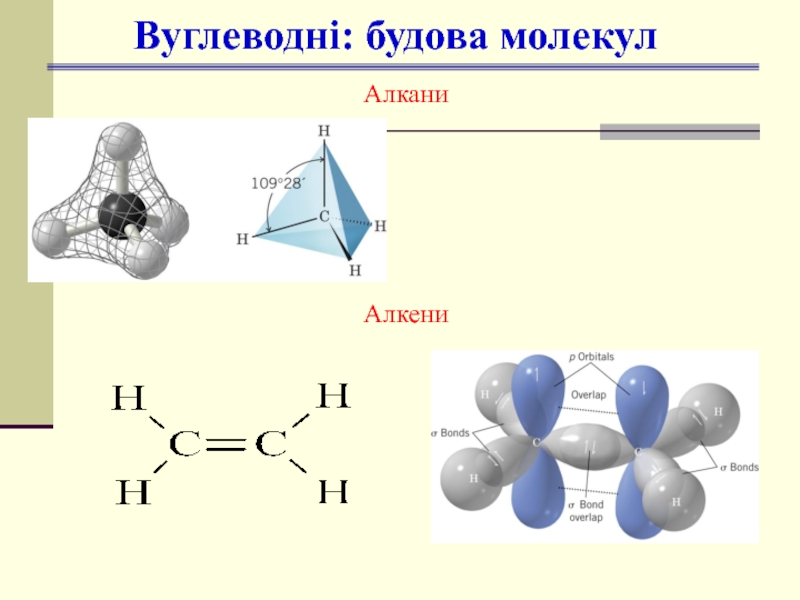
- 14. Вуглеводні: будова молекул Алкани Алкени
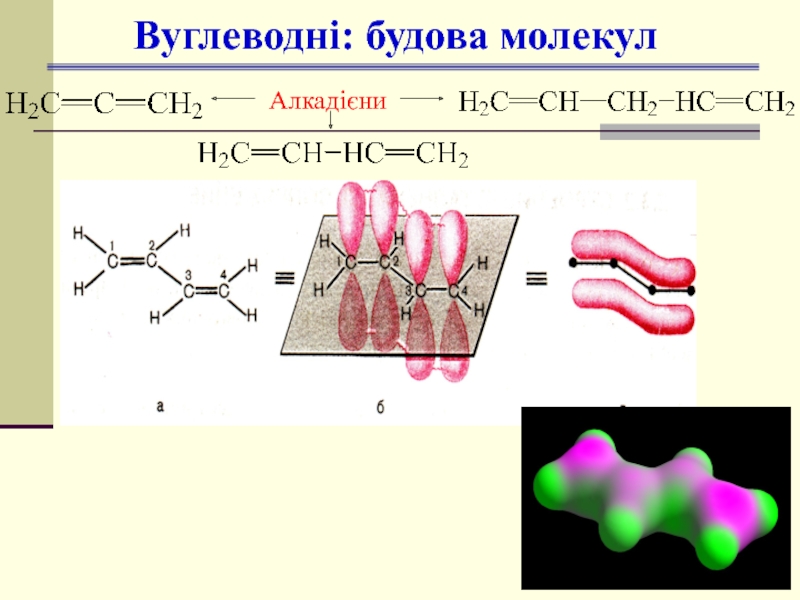
- 15. Вуглеводні: будова молекул Алкадієни
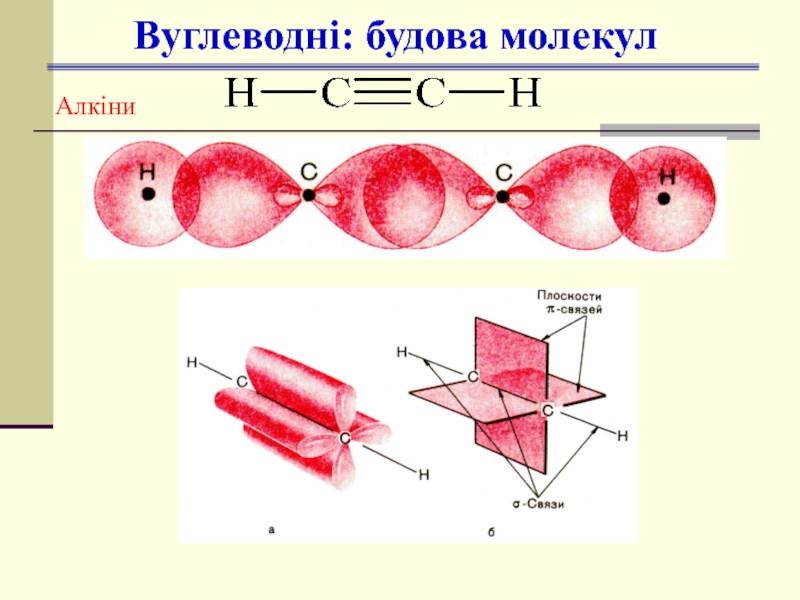
- 16. Вуглеводні: будова молекул Алкіни
- 17. Методи одержання алканів Лабораторні: 1. Лужне
- 18. 4. Реакція Кольбе
- 19. 3. Реакція В’юрца–Шоригіна: R–Hal + 2Na
- 20. 5.
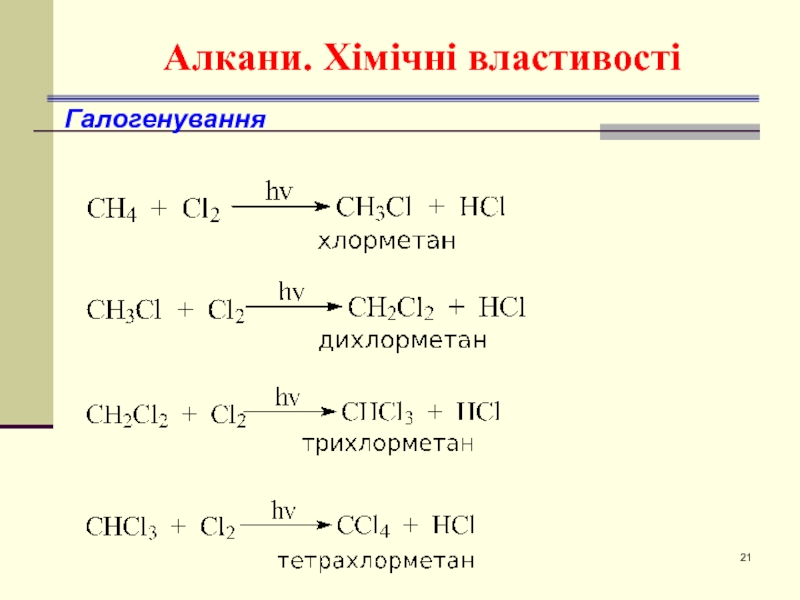
- 21. Алкани. Хімічні властивості Галогенування
- 22. Хімічні властивості: алкани Галогенування
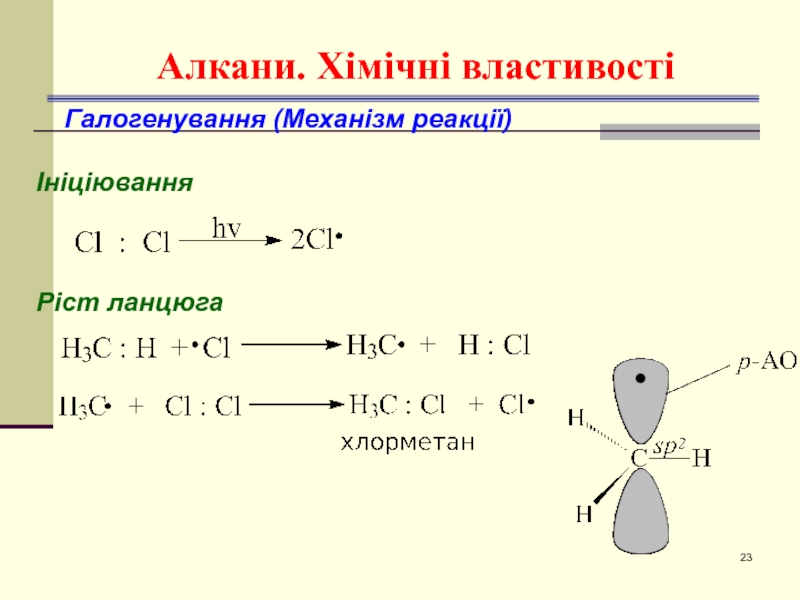
- 23. Алкани. Хімічні властивості Галогенування (Механізм реакції) Ініціювання Ріст ланцюга
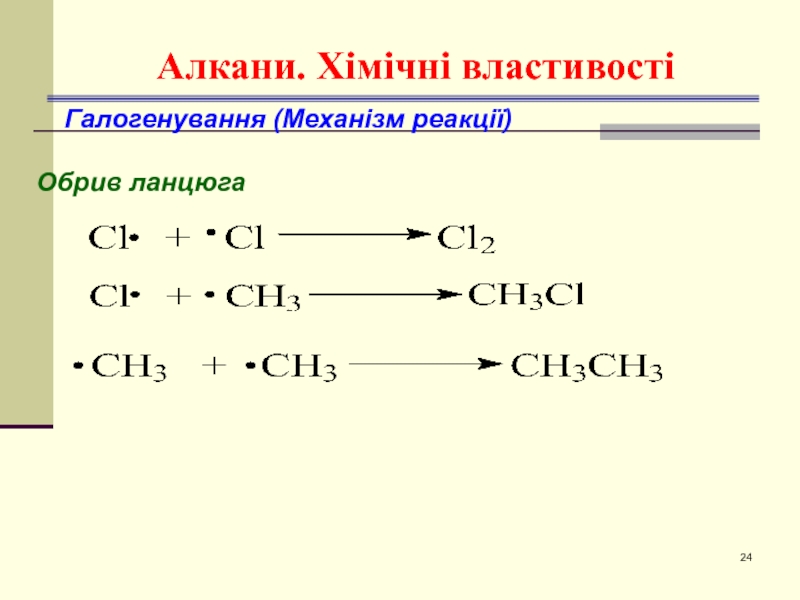
- 24. Алкани. Хімічні властивості Галогенування (Механізм реакції) Обрив ланцюга
- 25. Алкани. Хімічні властивості Галогенування (Механізм реакції)
- 26. Алкани. Хімічні властивості Галогенування (Механізм реакції)
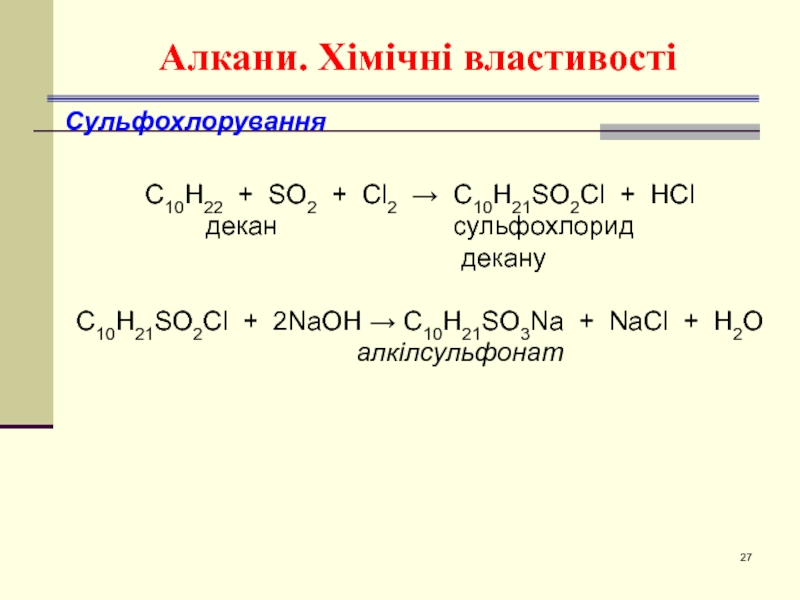
- 27. Алкани. Хімічні властивості Сульфохлорування
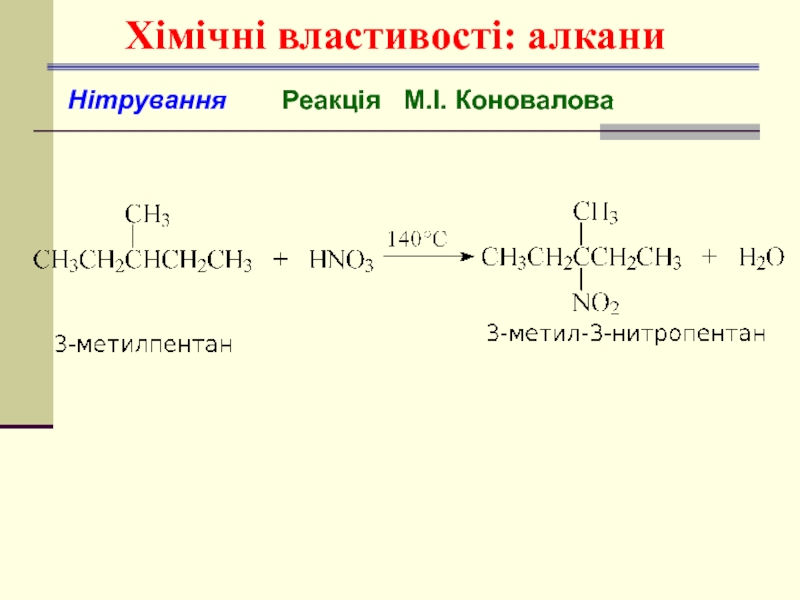
- 28. Хімічні властивості: алкани Нітрування Реакція М.І. Коновалова
- 29. Алкани. Хімічні властивості Термічний розклад
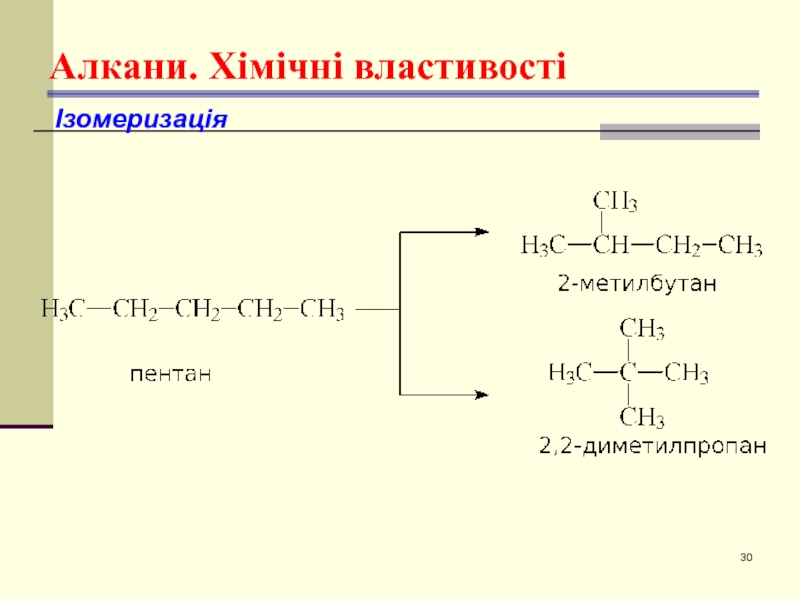
- 30. Алкани. Хімічні властивості Ізомеризація
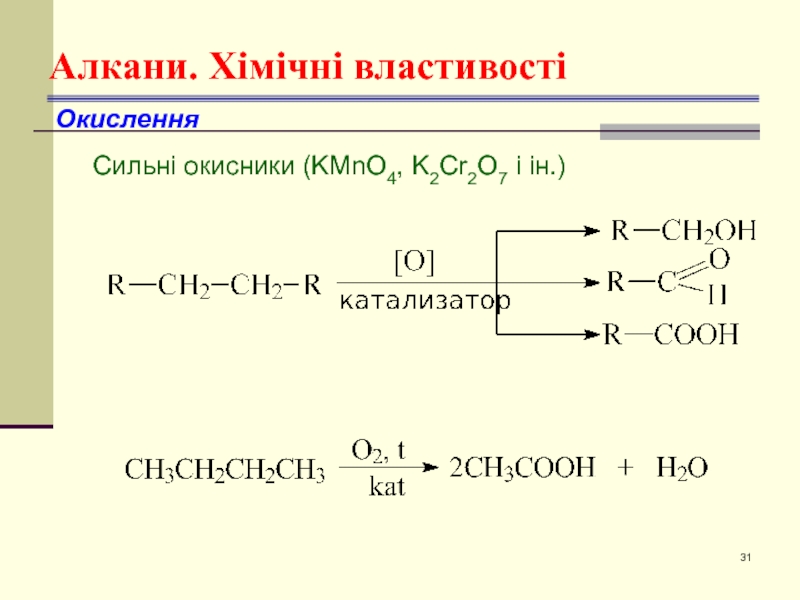
- 31. Алкани. Хімічні властивості Окислення Сильні окисники (KMnO4, K2Cr2O7 і ін.)
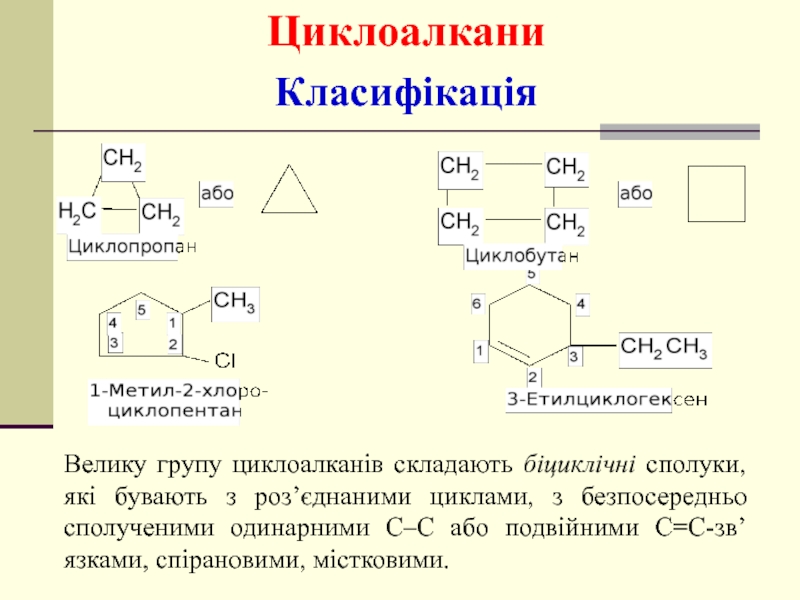
- 32. Велику групу циклоалканів складають біциклічні сполуки,
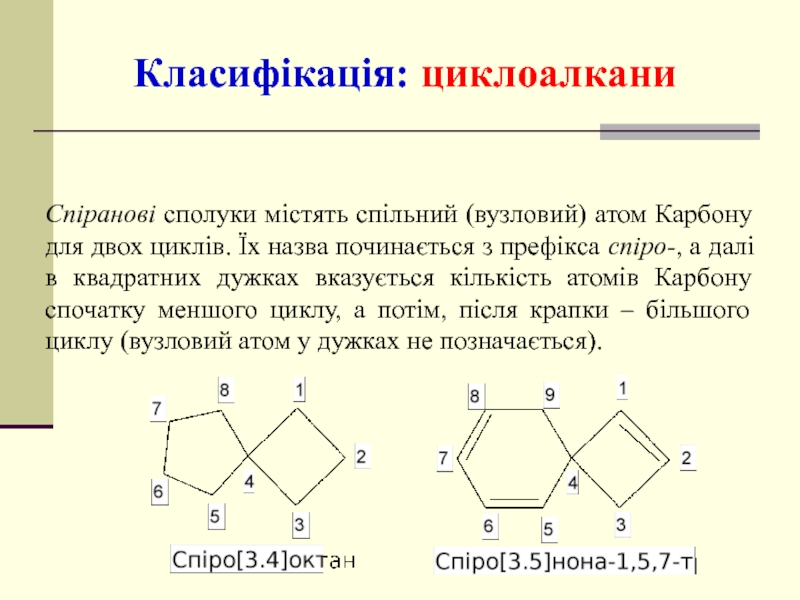
- 33. Спіранові сполуки містять спільний (вузловий) атом Карбону
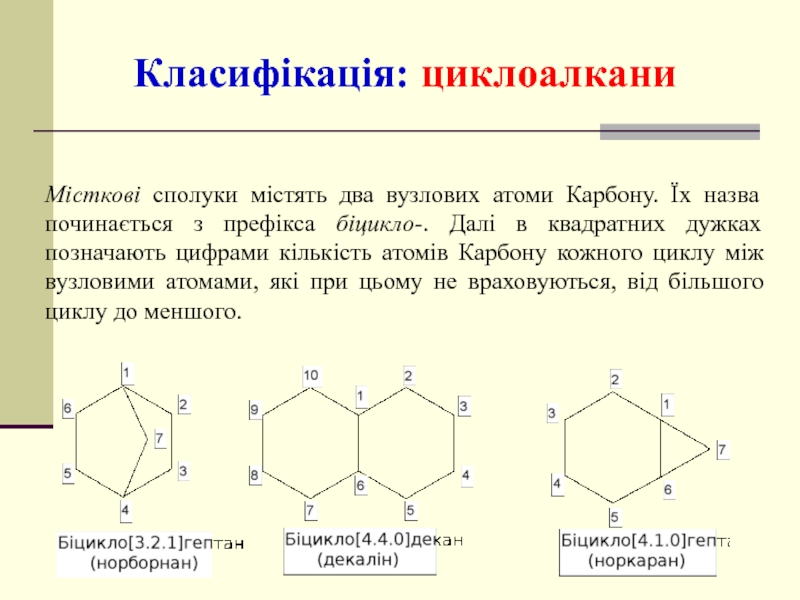
- 34. Місткові сполуки містять два вузлових атоми Карбону.
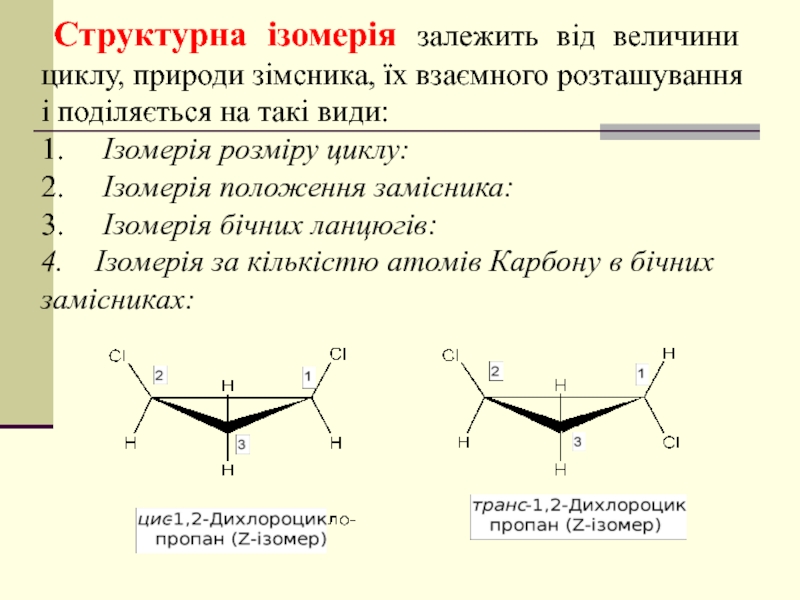
- 35. Структурна ізомерія залежить від величини циклу,
- 36. Енантіомерія аліциклічних сполук виникає при наявності хірального
- 37. Конформаційна ізомерія циклоалканів пов’язана з особливостями їх
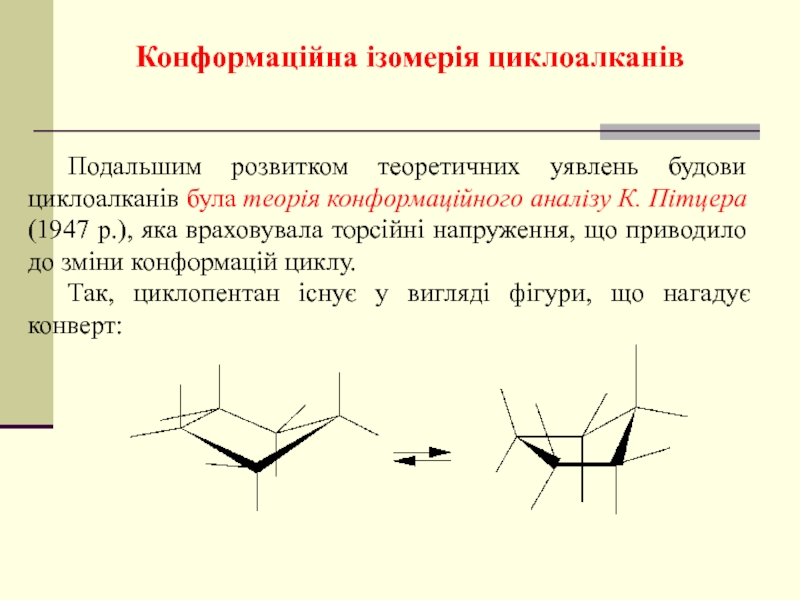
- 38. Конформаційна ізомерія циклоалканів Подальшим розвитком
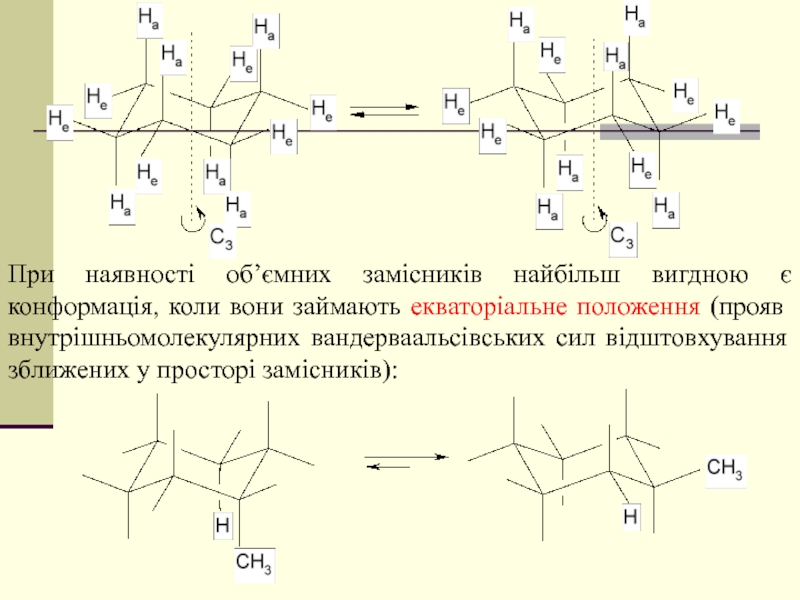
- 39. При наявності об’ємних замісників найбільш вигдною
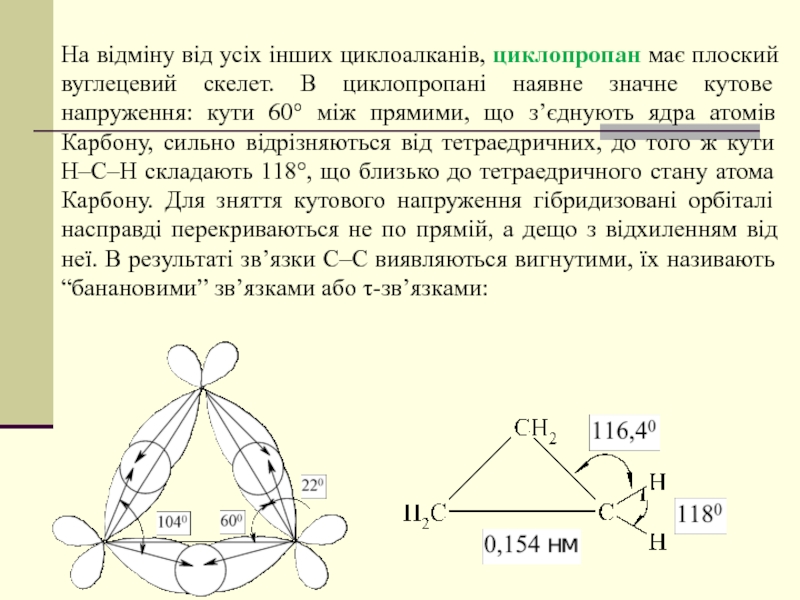
- 40. На відміну від усіх інших циклоалканів, циклопропан
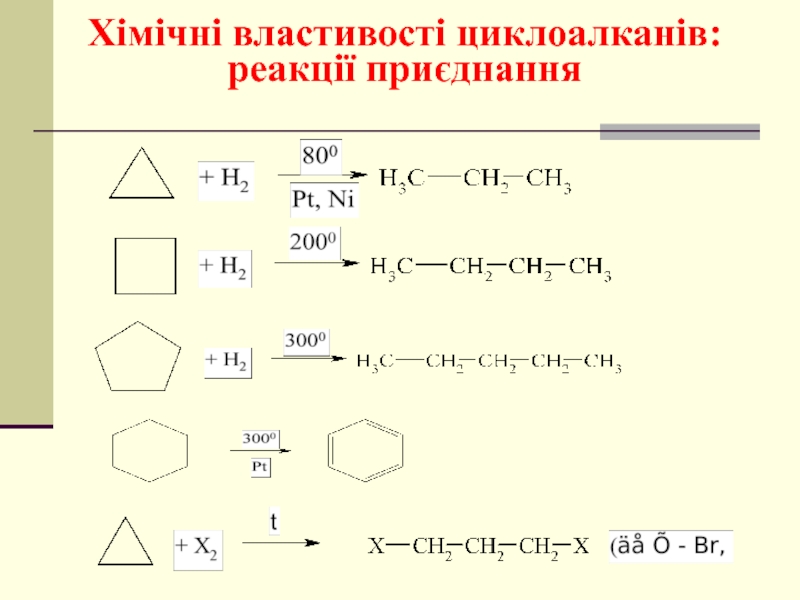
- 41. Хімічні властивості циклоалканів: реакції приєднання
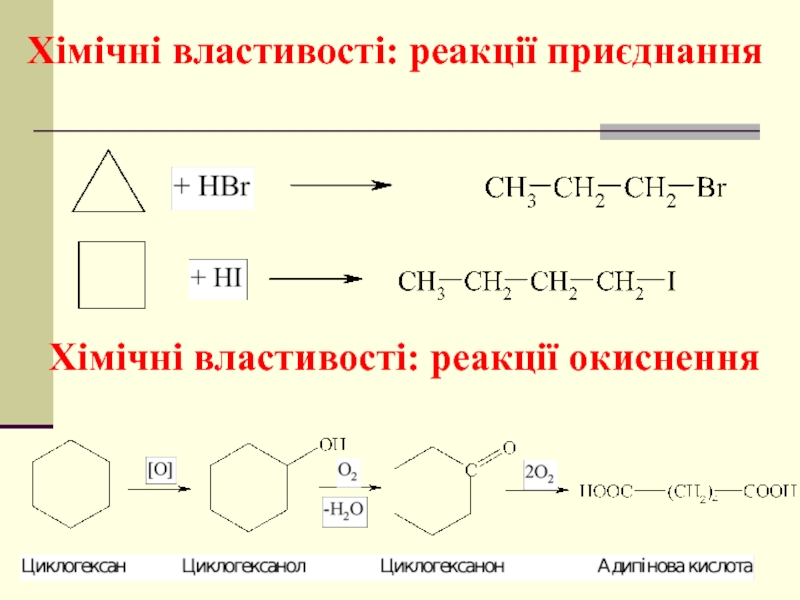
- 42. Хімічні властивості: реакції приєднання Хімічні властивості: реакції окиснення
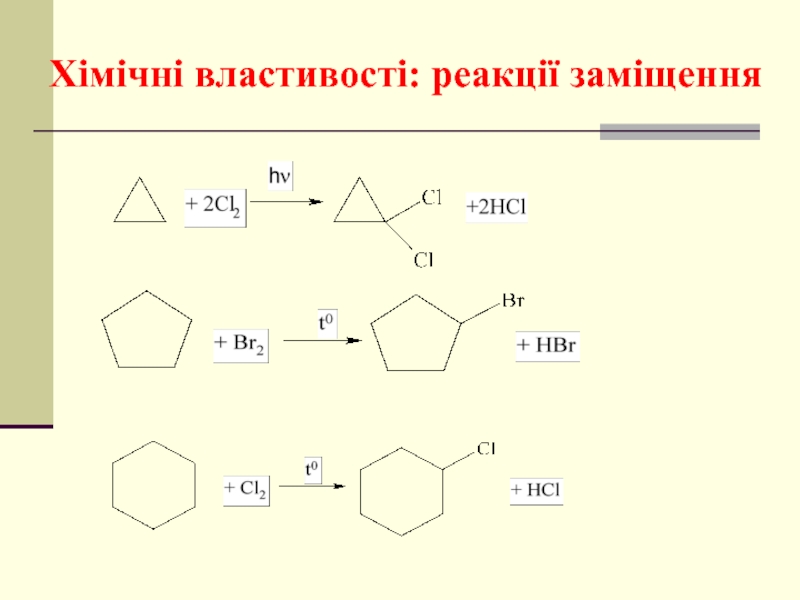
- 43. Хімічні властивості: реакції заміщення
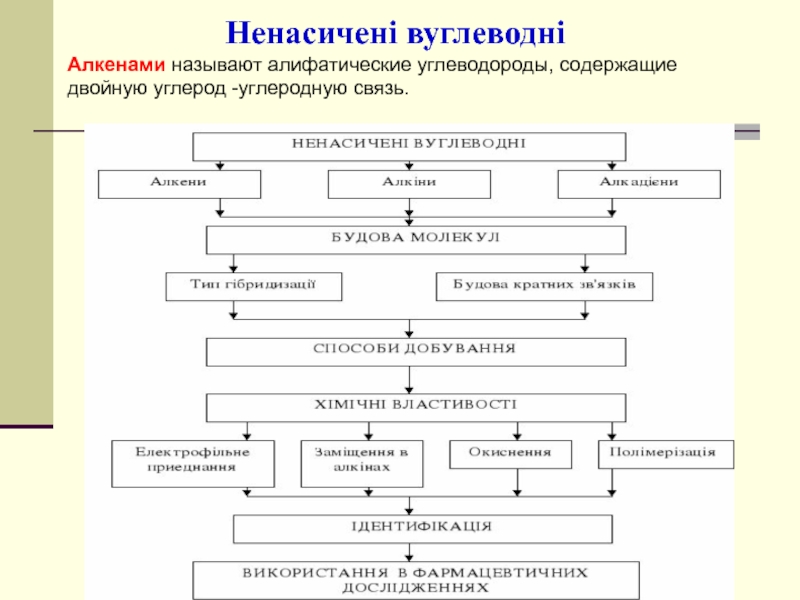
- 44. Ненасичені вуглеводні Алкенами называют алифатические углеводороды, содержащие двойную углерод -углеродную связь.
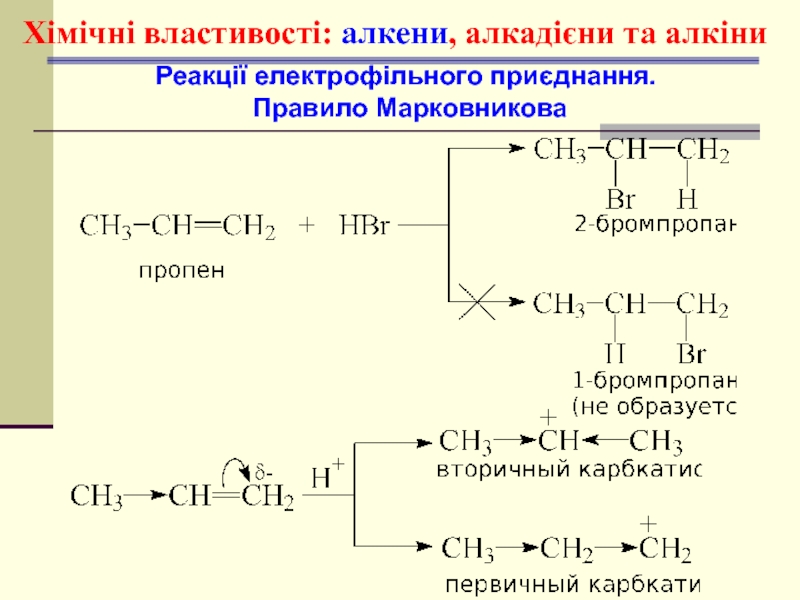
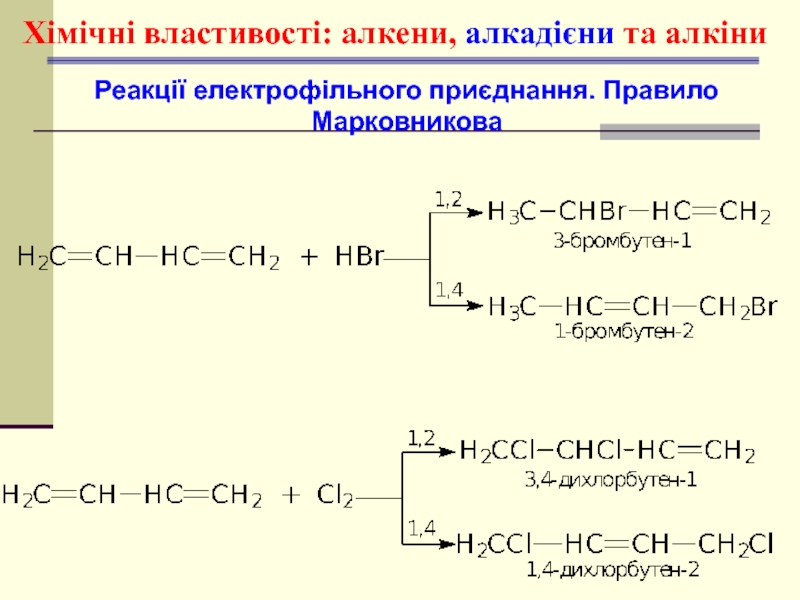
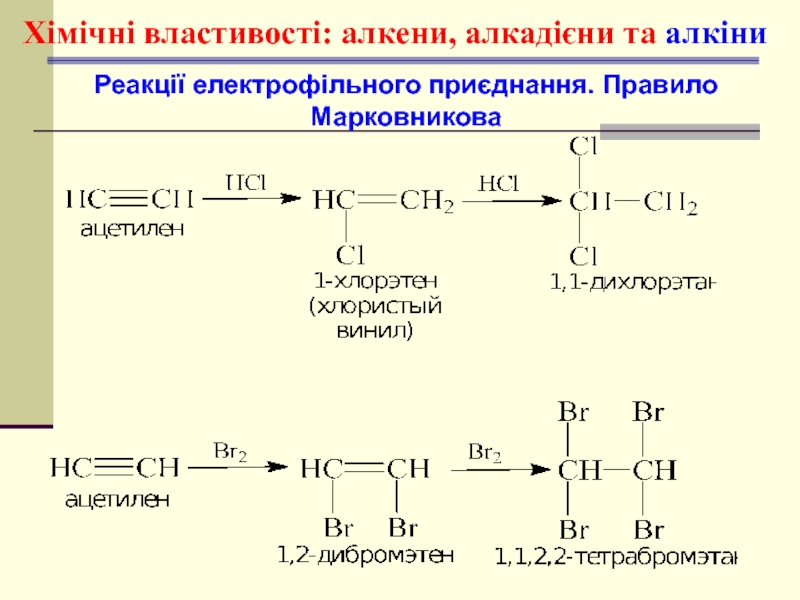
- 45. Хімічні властивості: алкени, алкадієни та алкіни Реакції електрофільного приєднання. Правило Марковникова
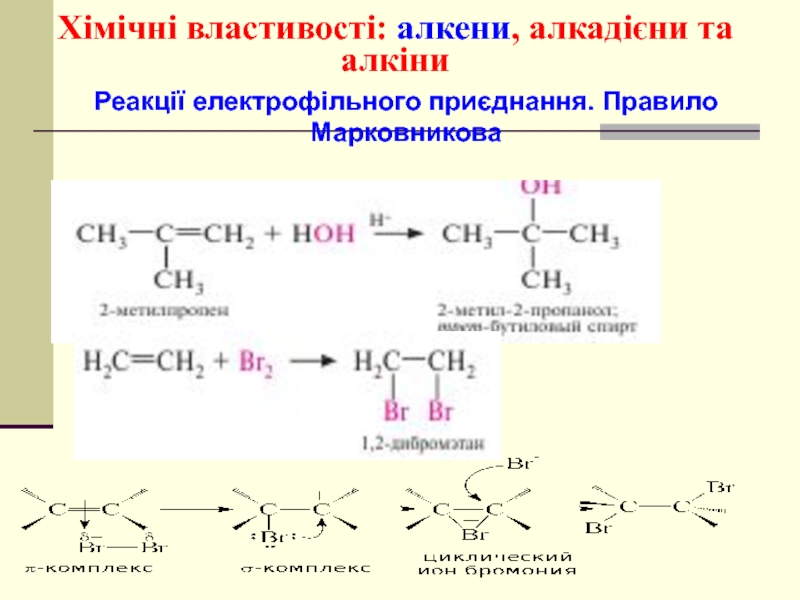
- 46. Хімічні властивості: алкени, алкадієни та алкіни Реакції електрофільного приєднання. Правило Марковникова
- 47. Хімічні властивості: алкени, алкадієни та алкіни Реакції електрофільного приєднання. Правило Марковникова
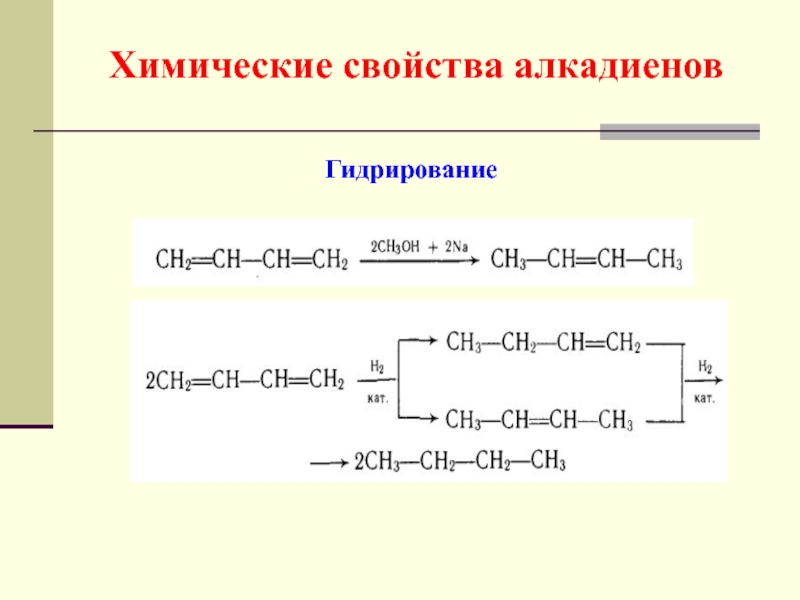
- 48. Химические свойства алкадиенов Гидрирование
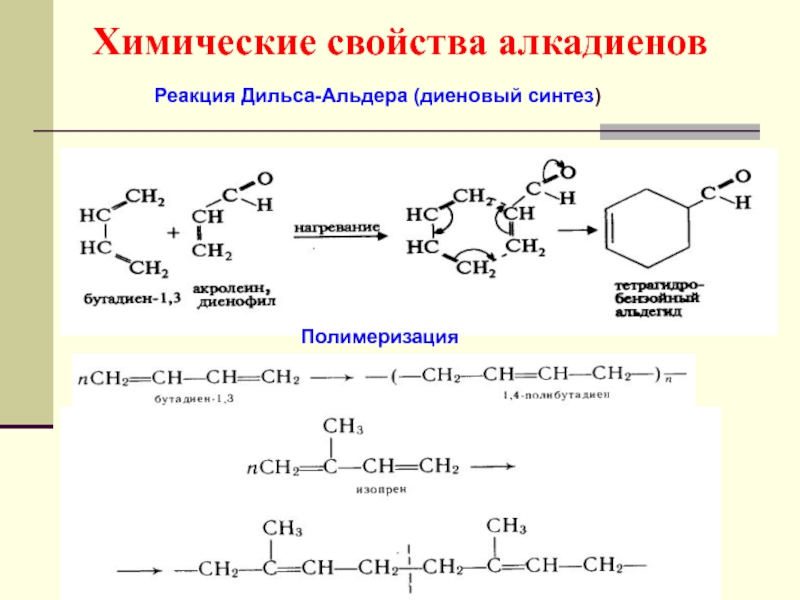
- 49. Химические свойства алкадиенов Реакция Дильса-Альдера (диеновый синтез) Полимеризация
- 50. Хімічні властивості: алкени, алкадієни та алкіни Реакції електрофільного приєднання. Правило Марковникова
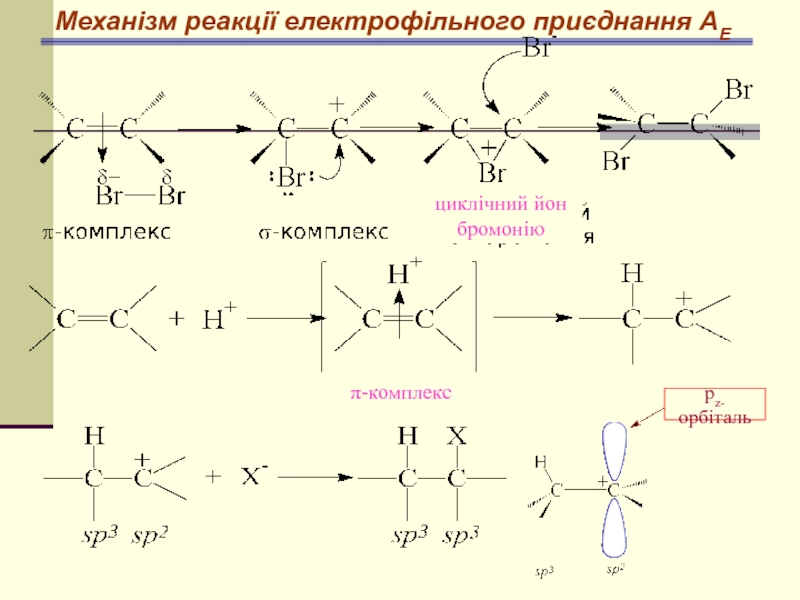
- 51. Механізм реакції електрофільного приєднання АЕ циклічний йон бромонію рz-орбіталь π-комплекс
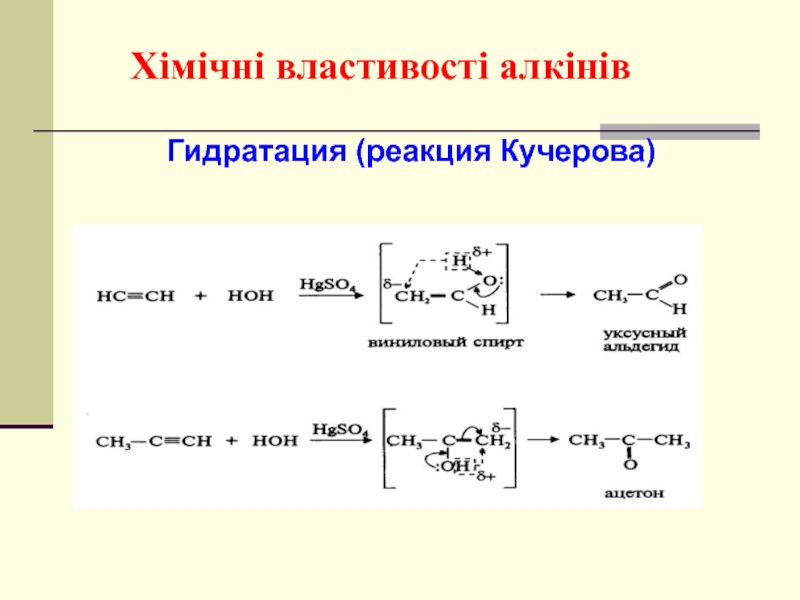
- 52. Гидратация (реакция Кучерова) Хімічні властивості алкінів
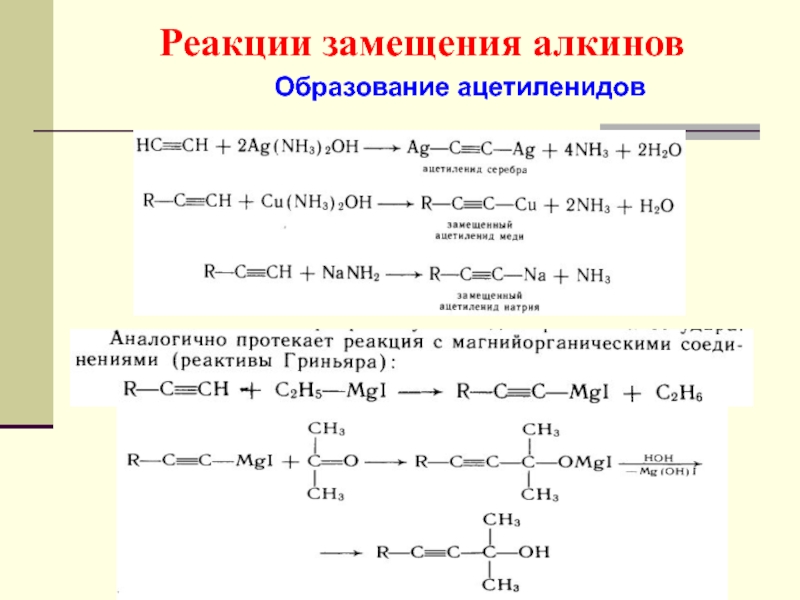
- 53. Реакции замещения алкинов Образование ацетиленидов
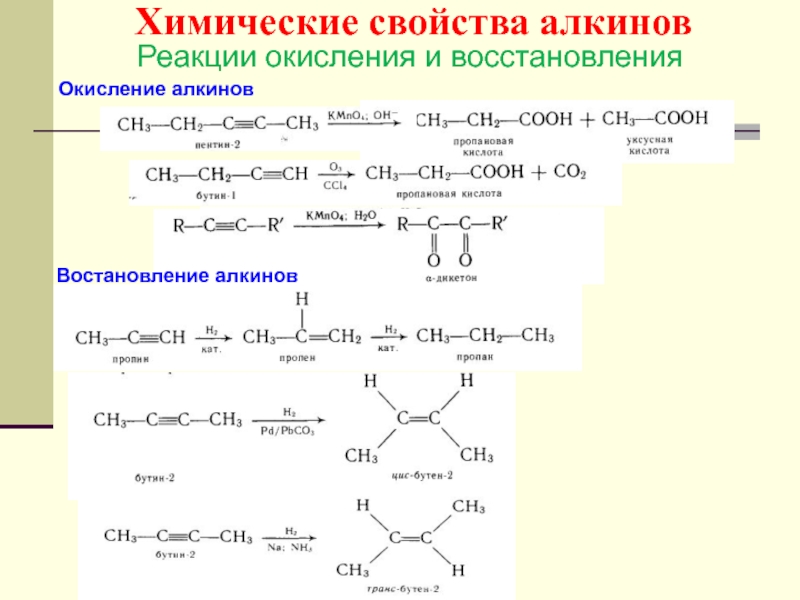
- 54. Химические свойства алкинов Реакции окисления и восстановления Окисление алкинов Востановление алкинов
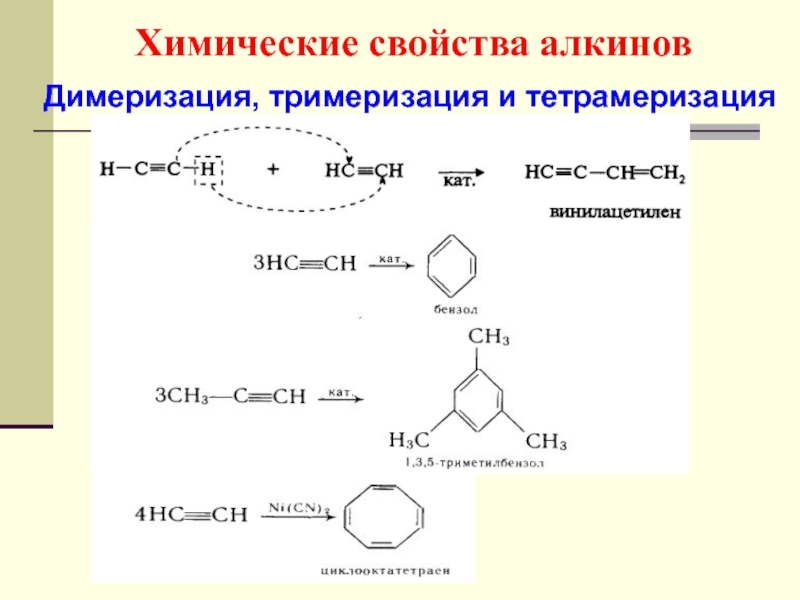
- 55. Химические свойства алкинов Димеризация, тримеризация и тетрамеризация
- 56. Дякую за увагу!
Слайд 1 Реакційна здатність насичених вуглеводнів (алкани, циклоалкани). Реакційна здатність ненасичених вуглеводнів (алкени, алкадієни,
Слайд 2Вуглеводні: аліфатичні та аліциклічні
Назва класу
вуглеводню
Загальна
формула
Тип гібридизації
атома Карбону
Основний
тип реакції
Особливості
будови, закінчення
в назві
Алкани
Алкени
Алкадієни
Алкіни
Цикло-
алкани
СnН2n
СnН2n-2
СnН2n-2
СnН2n
СnН2n+2
sp3, тетраедр,
∠109028/
sp2, площинна,
∠1200
sp2, площинна,
∠1200
sp, лінійна,
∠1800
sp3, тетраедр,
∠ 109028/
Усі σ(С-С)
- ан
1 С=С, 1π,
усі інші σ;
- ен
2 С=С, 2π,
усі інші σ;
- дієн
1 С≡С, 2π,
усі інші σ;
- ин (-ін)
Атоми С
замкнуті в цикл,
Цикло -ан
SR; крекінг
ізомеризація,
окислення
AE;
полімеризація,
окислення
1,2- та 1,4 AE;
полімеризація,
окислення
AE;
полімеризація,
СН-кислотні власт.
окислення
SR;
приєднання
окислення
Слайд 5Вуглеводні: номенклатура та ізомерія
3,5-диметил-3-етил-октан
метилетилізопропілметан
(2,3-диметилпентан)
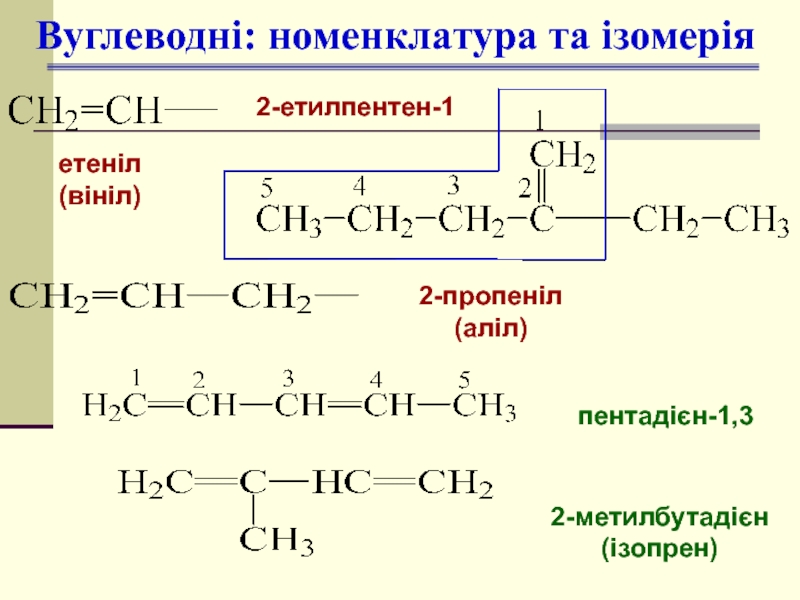
Слайд 6Вуглеводні: номенклатура та ізомерія
2-етилпентен-1
пентадієн-1,3
2-метилбутадієн
(ізопрен)
етеніл
(вініл)
2-пропеніл
(аліл)
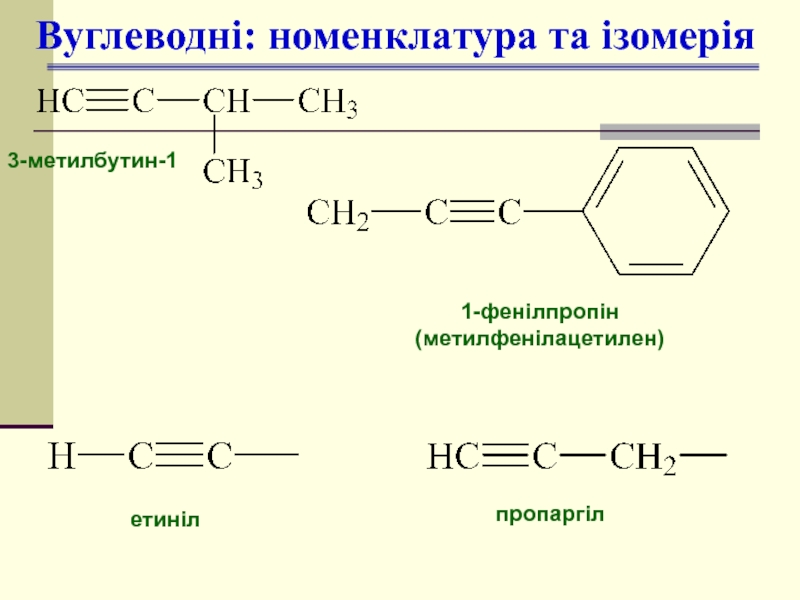
Слайд 7Вуглеводні: номенклатура та ізомерія
3-метилбутин-1
1-фенілпропін
(метилфенілацетилен)
етиніл
пропаргіл
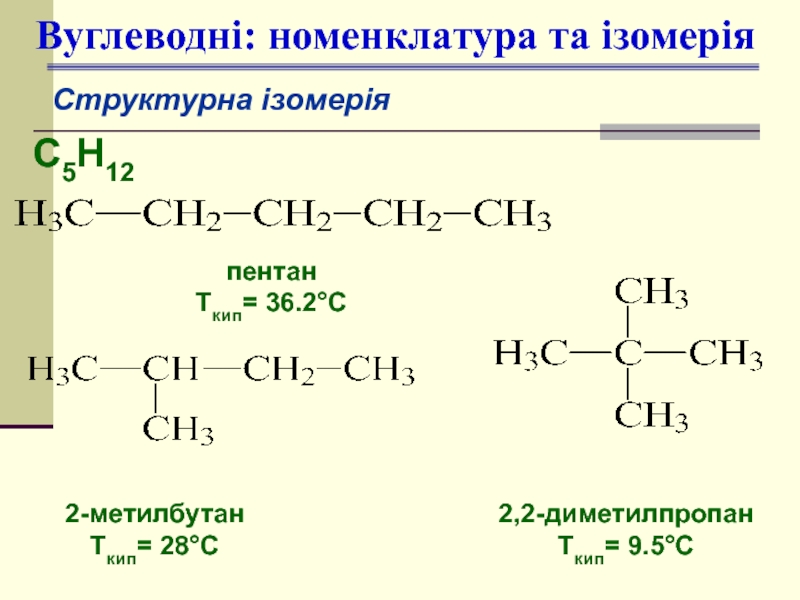
Слайд 8Вуглеводні: номенклатура та ізомерія
Структурна ізомерія
С5Н12
пентан
Ткип= 36.2°С
2-метилбутан
Ткип= 28°С
2,2-диметилпропан
Ткип= 9.5°С
Слайд 11Вуглеводні: номенклатура та ізомерія
Просторова
ізомерія
цис-бутен-2
Ткип=4°С
транс-бутен-2
Ткип=1°С
Слайд 12Вуглеводні: номенклатура та ізомерія
(Е)-1-бром-1-нітро-
2-хлорпропен
(Z)-1-бром-1-нітро-
2-хлорпропен
Слайд 17Методи одержання алканів
Лабораторні:
1. Лужне плавлення (синтез Дюма)
RCOONa + NaOH
Наприклад, для одержання бутану потрібно взяти:
СН3-СН2-СН2-СН2-СООNa + NaOH
→ СН3-СН2-СН2-СН2–H + Na2CO3
2. Гідроліз магнійорганічних сполук:
R-Mg-Hal + HOH → R–H + Mg(OH)Hal
Наприклад, для одержання бутану потрібно взяти:
СН3-СН2-СН2-СН2-Mg-Hal + HOH →
→ СН3-СН2-СН2-СН2–H + Mg(OH)Hal
Алканами называют алифатические углеводороды, в молекулах которых атомы углерода связаны простыми ковалентными σсвязями.
Слайд 18
4. Реакція Кольбе (електроліз)
RCOONa ⇔ RCOO– +
RCOO– – 1е → R∙ + СО2
R∙ + R∙ → R – R
Наприклад, для одержання гексану потрібно взяти:
СН3-СН2-СН2-COONa ⇔ СН3-СН2-СН2-COO– + Na+
СН3- СН2-СН2-COO– – 1е → СН3-СН2-СН2∙ + СО2
СН3- СН2-СН2∙ + СН3-СН2-СН2∙ → СН3-СН2-СН2–СН2-СН2-СН3
Методи одержання алканів
Слайд 193. Реакція В’юрца–Шоригіна:
R–Hal + 2Na + Hal–R → 2NaHal + R–R
Механізм:
R–Hal
RNa + Hal–R → NaHal + R–R
Наприклад, для одержання гексану потрібно взяти:
СН3-СН2-СН2–Сl + 2Na + Сl–СН2-СН2-СН3 → 2NaСl + СН3-СН2-СН2–СН2-СН2-СН3
Методи одержання алканів
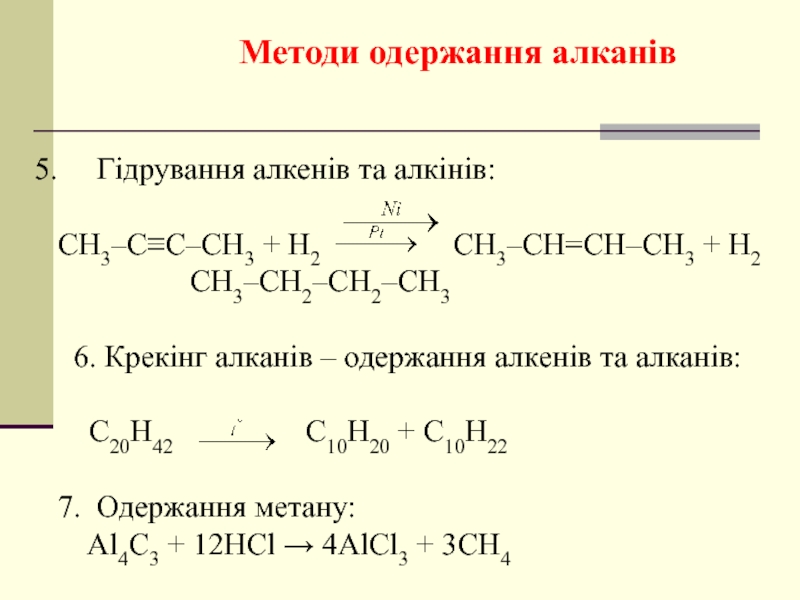
Слайд 20
5. Гідрування алкенів та алкінів:
СН3–С≡С–СН3
СН3–СН2–СН2–СН3
6. Крекінг алканів – одержання алкенів та алканів:
C20H42 C10H20 + C10H22
7. Одержання метану:
Al4C3 + 12HCl → 4AlCl3 + 3CH4
Методи одержання алканів
Слайд 25Алкани. Хімічні властивості
Галогенування (Механізм реакції)
1.Галогенування розпочинається тільки під дією ініціатора радикальних
2. Реакційна здатність галогенів зменшується в ряді:
F2 > Cl2 > Br2 > I2
3. Галогенування під дією фтору і хлору може вийти з під контролю і набути взривного характеру.
Слайд 26Алкани. Хімічні властивості
Галогенування (Механізм реакції)
4. Реакційна здатність Гідрогену у третинного атома
376 кДж/моль
390 кДж/моль
415 кДж/моль
Слайд 27Алкани. Хімічні властивості
Сульфохлорування
С10H22 + SO2 + Cl2 → C10H21SO2Cl +
декан сульфохлорид
декану
C10H21SO2Cl + 2NaOH → C10H21SO3Na + NaCl + H2O
алкілсульфонат
Слайд 29Алкани. Хімічні властивості
Термічний розклад (Крекінг)
В.Г. Шухов (1891)
Температура – 470—650°С;
Тиск – 7 МПа
Слайд 32
Велику групу циклоалканів складають біциклічні сполуки, які бувають з роз’єднаними циклами,
Класифікація
Циклоалкани
Слайд 33Спіранові сполуки містять спільний (вузловий) атом Карбону для двох циклів. Їх
Класифікація: циклоалкани
Слайд 34Місткові сполуки містять два вузлових атоми Карбону. Їх назва починається з
Класифікація: циклоалкани
Слайд 35 Структурна ізомерія залежить від величини циклу, природи зімсника, їх взаємного
1. Ізомерія розміру циклу:
2. Ізомерія положення замісника:
3. Ізомерія бічних ланцюгів:
4. Ізомерія за кількістю атомів Карбону в бічних замісниках:
Слайд 36Енантіомерія аліциклічних сполук виникає при наявності хірального атома Карбону і відсутності
Слайд 37Конформаційна ізомерія циклоалканів пов’язана з особливостями їх будови. Передумовою сучасного трактування
Слайд 38Конформаційна ізомерія циклоалканів
Подальшим розвитком теоретичних уявлень будови циклоалканів була теорія конформаційного
Так, циклопентан існує у вигляді фігури, що нагадує конверт:
Слайд 39
При наявності об’ємних замісників найбільш вигдною є конформація, коли вони займають
Слайд 40На відміну від усіх інших циклоалканів, циклопропан має плоский вуглецевий скелет.