- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Сера. Свойства серы презентация
Содержание
- 1. Сера. Свойства серы
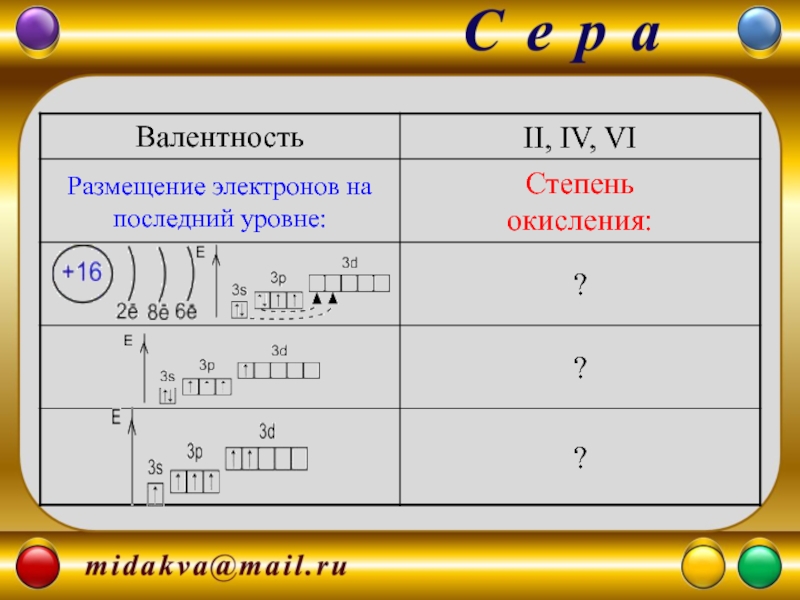
- 2. Знак в таблице – ? Группа, подгруппа
- 4. Твердое вещество. При 113°C cера превращается
- 5. Самородная сера, серный колчедан FeS2, медный
- 6. Медный блеск CuS Цинковая обманка ZnS Пирит FeS∙S Свинцовый блеск PbS
- 7. Сера ромбическая Сера пластическая
- 8. Сера реагирует с металлами (кроме Au, Pt):
- 9. Восстановительные свойства: S - 2ē →
- 10. S0 + KOH → K2S+4O3 +
- 11. 1.Na2SO4 + 2C = Na2S + 2CO2
- 12. Производство серной кислоты Медицина
Слайд 2Знак в таблице – ?
Группа, подгруппа – ?
Порядковый номер -
Атомная масса - ?
Электроотрицательность - ?
Электронная формула - ?
Слайд 4Твердое вещество.
При 113°C cера превращается в жидкость, которая выше 160°С
Сера – диэлектрик. В воде она нерастворима.
S + H2O = H2S +SO2
Хорошо растворяется в ОР.
Плотность (кг/м³) – 2070
Температура кипения - 444°С
Вывод -?
Физические свойства
Слайд 7Сера
ромбическая
Сера
пластическая
Сера моноклинная
Цвет – лимонно-желтый;
tпл. = 112,8ºС;
Цвет – медово-желтый;
tпл. = 119,3ºС; ρ = 1,96г/см3
Цвет – темно-коричневый;
tпл. = 444,6ºС; ρ = 1,96г/см3
Аллотропные модификации
Слайд 8Сера реагирует с металлами (кроме Au, Pt):
2Na + S
Zn + S t°→ ZnS
Hg + S t°→ HgS
И с некоторыми неметаллами:
H2 + S → H2S 2P + 3S → P2S3
C + 2S → CS2
Кроме азота (N2), йода (I2) и благородных газов.
Слайд 9Восстановительные свойства:
S - 2ē → S+2; S - 4ē →
S + O2 t→ S+4O2
S + O2 t°;Рt→ S+6O3
C галогенами при t (кроме йода): S + Cl2 → S+2Cl2
C кислотами - окислителями:
S + H2SO4(конц.) → S+4O2 + H2O
S + HNO3(конц.) → H2S+6O4 + NO2 + H2O
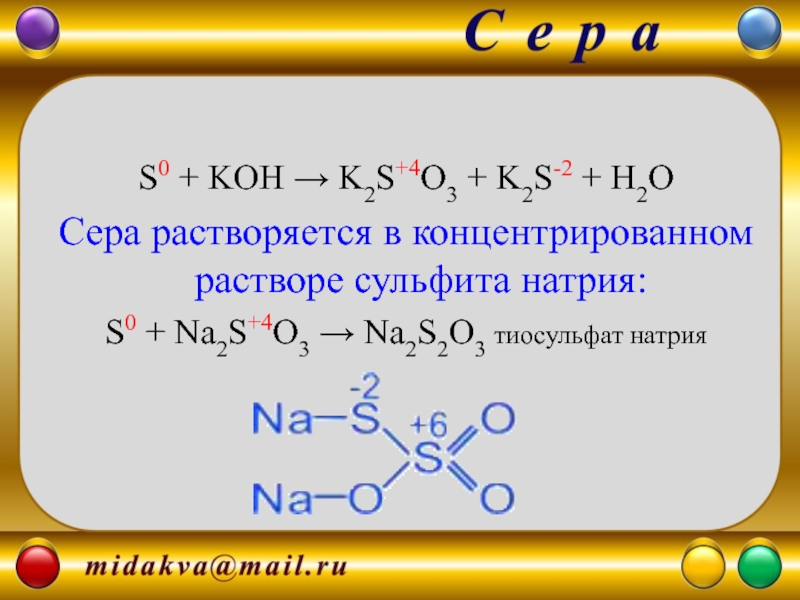
Слайд 10
S0 + KOH → K2S+4O3 + K2S-2 + H2O
Сера растворяется в
S0 + Na2S+4O3 → Na2S2O3 тиосульфат натрия
Слайд 111.Na2SO4 + 2C = Na2S + 2CO2
2. Na2S + CaCO3 =
3. CaS + CO2 + H2O = CaCO3 + H2S
4. 2H2S + O2 = 2H2O +2S
Получение
Слайд 12Производство
серной кислоты
Медицина
Производство
спичек
Бумажная промышленность
Резиновая
промышленность
Применение
Сельское
Получения черного пороха