- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Растворы: состав и их коллигативные свойства презентация
Содержание
- 1. Растворы: состав и их коллигативные свойства
- 2. План: 1. Количественный состав растворов. Типы концентраций. 2. Коллигативные свойства.
- 3. Важнейшим биогенным растворителем является вода. Вода -
- 4. По отношению к воде различают гидрофильные и
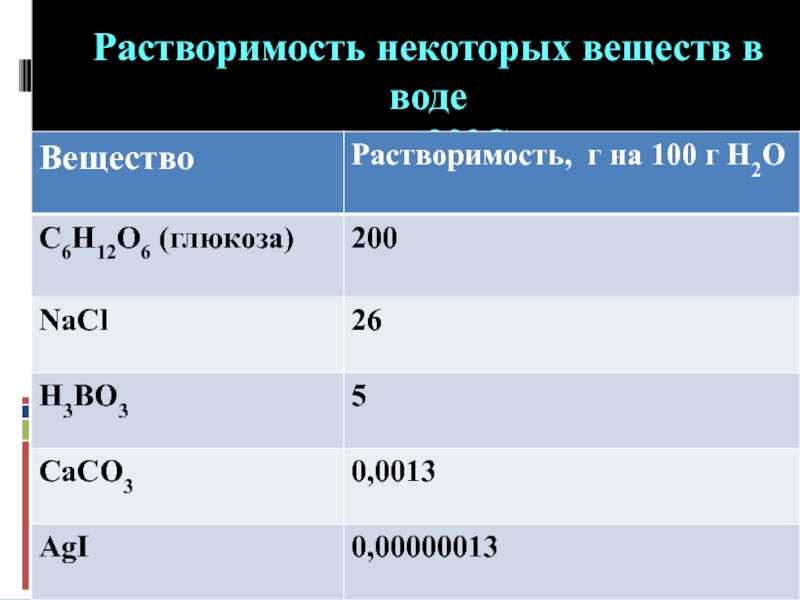
- 5. Растворимость некоторых веществ в воде при 20°С
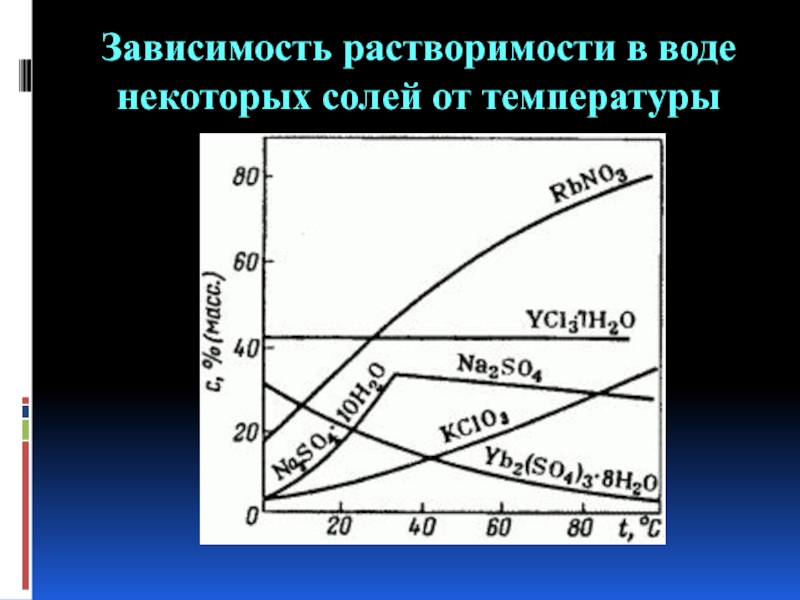
- 6. Зависимость растворимости в воде некоторых солей от температуры
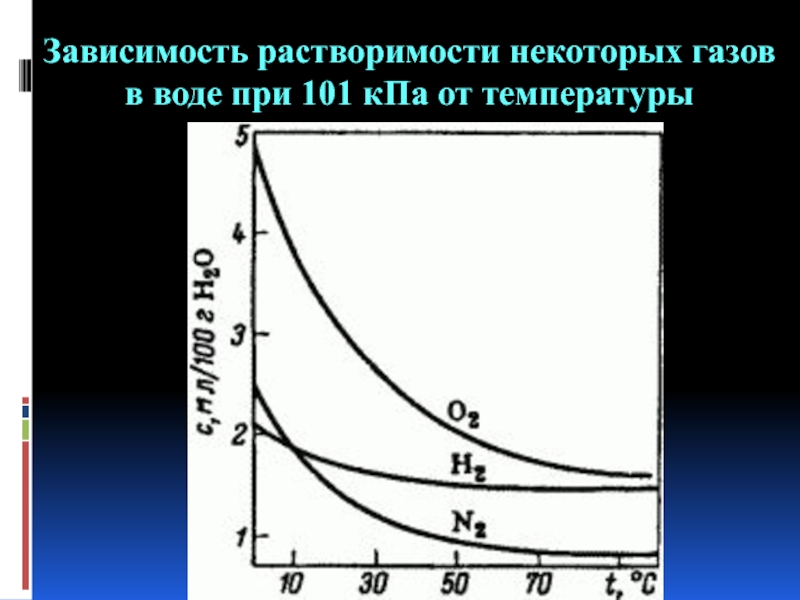
- 7. Зависимость растворимости некоторых газов в воде при 101 кПа от температуры
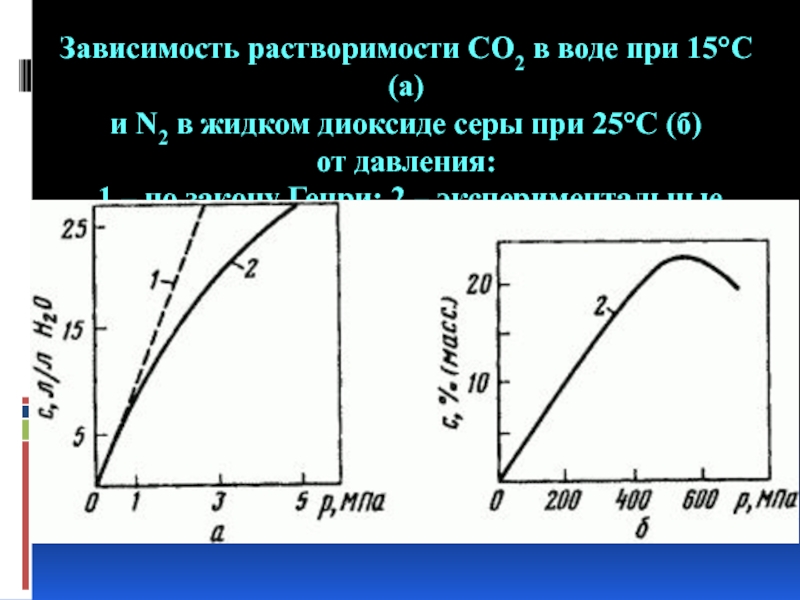
- 8. Зависимость растворимости СO2 в воде при 15°С
- 9. Растворение - самопроизвольный процесс, поэтому ΔGрастворения< 0.
- 10. Например, при растворении гидроксида калия в воде
- 11. 1. Количественный состав растворов. Типы концентраций.
- 12. Массовая доля вещества (ω) – отношение массы
- 13. Молярная доля растворённого вещества (χ) численно равна
- 14. Моляльность раствора (b или Сm) – это
- 15. 2. Коллигативные свойства Коллигативными свойствами
- 16. Коллигативными свойствами растворов являются: диффузия, осмос,
- 17. Диффузией в растворе называется самопроизвольный направленный
- 18. Количество вещества, переносимого за счет диффузии через
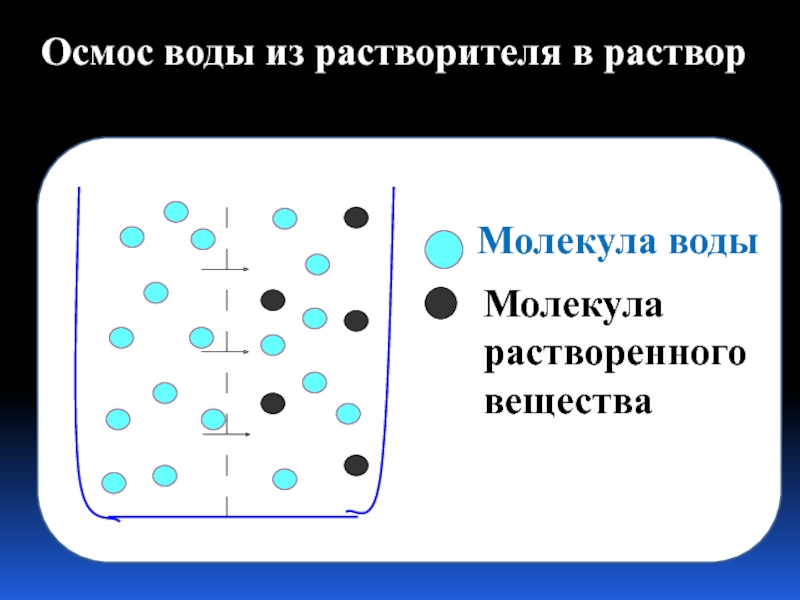
- 19. Осмос – это односторонняя диффузия молекул
- 20. Молекула воды Молекула растворенного
- 22. Осмос в системе растворитель — раствор, разделенные мембраной с избирательной проницаемостью
- 23. Осмотическим давлением (π(Росм)) называют избыточное гидростатическое давление,
- 24. Прибор для определения осмотического давления
- 25. Осмотическая ячейка - это система, отделенная от
- 26. ЭНДООСМОС - движение растворителя в осмотическую ячейку
- 27. В результате эндоосмоса вода диффундирует в клетку,
- 28. ЭКЗООСМОС – движение растворителя из осмотической ячейки
- 29. В результате экзоосмоса вода диффундирует из клетки
- 30. Растворы, которые имеют одинаковое осмотическое давление,
- 31. Изменение эритроцита в растворах с различным осмотическим
- 32. Давление насыщенного пара над раствором Давление
- 33. Устанавливается динамическое физико-химическое равновесие, при котором число
- 34. Понижение давления насыщенного пара (ДНП)
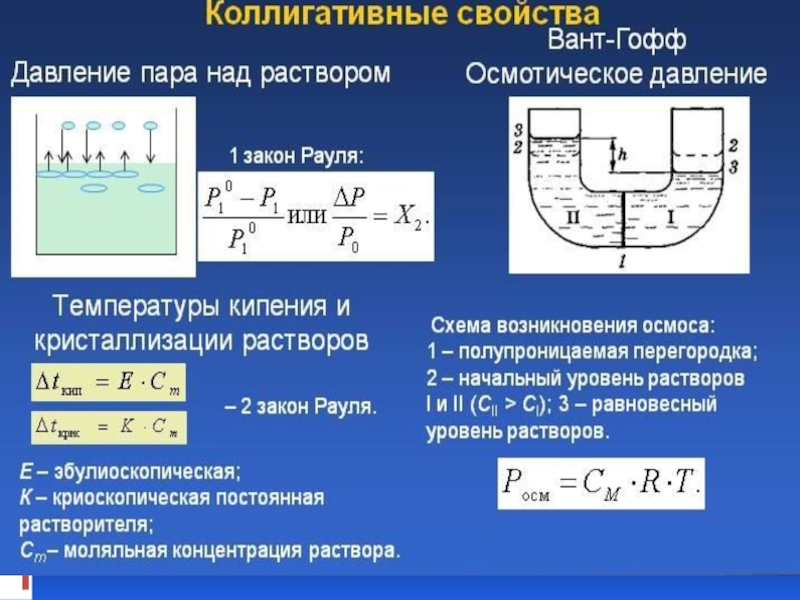
- 35. Первый закон Рауля: При постоянной температуре относительное
- 36. Под стеклянный колпак ставят стакан с растворителем
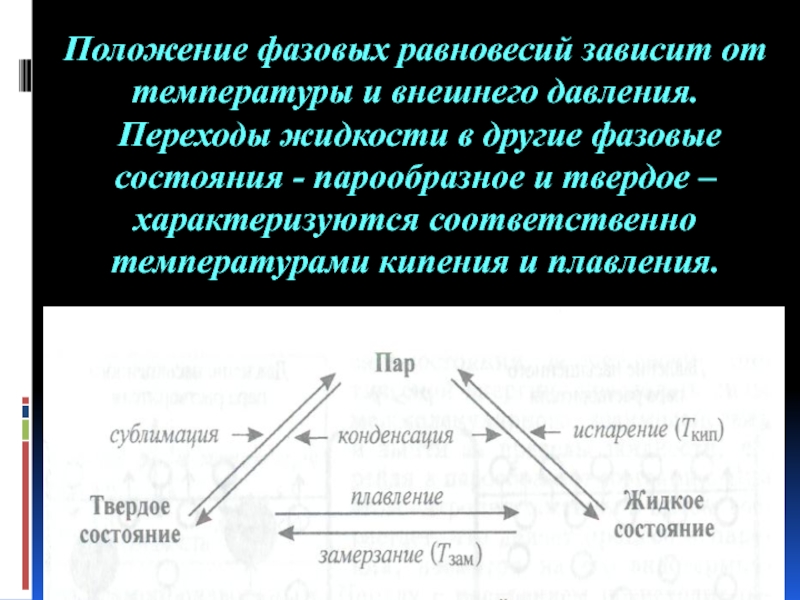
- 37. Положение фазовых равновесий зависит от температуры и
- 38. Температура кипения жидкости – это температура,
- 39. Температура замерзания жидкости - это температура, при
- 40. Второй закон Рауля: Повышение температуры кипения или
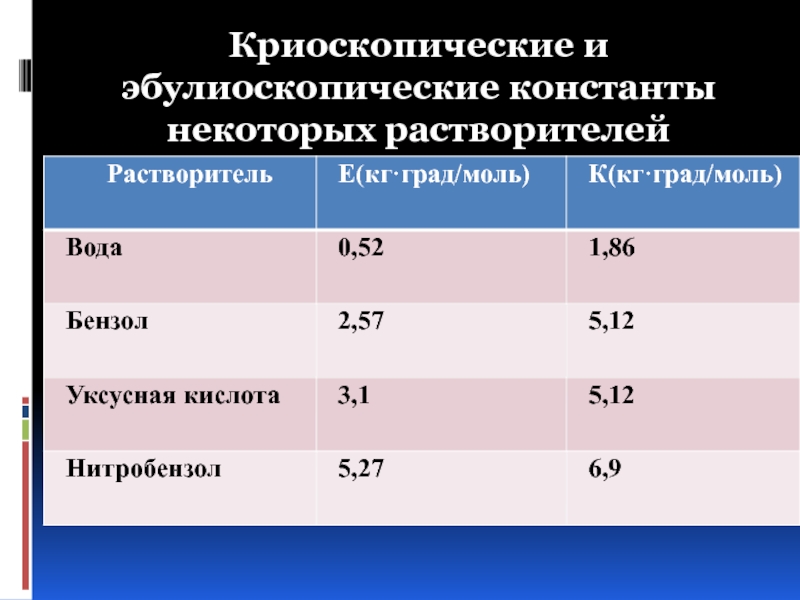
- 41. Криоскопические и эбулиоскопические константы некоторых растворителей
- 42. Эбулиоскопия и криоскопия - это методы, позволяющие
- 43. Схема криоскопа
- 44. Для учета межмолекулярных взаимодействий в реальных растворах
- 45. При приготовлении физиологических растворов необходимо учитывать их
- 46. Для сильных электролитов (α≈1): α=(i-1)/(n-1) NaCl
- 48. Спасибо за внимание!
Слайд 3Важнейшим биогенным растворителем является вода.
Вода - самое распространенное на Земле вещество.
Общий объем воды в биосфере 1,5 × 109км3.
В живых организмах - 2,3 × 103км3.
Считают, что большая часть воды имеет биогенное происхождение, т.е. проходит через метаболические превращения организмов.
Слайд 4По отношению к воде различают гидрофильные и гидрофобные вещества.
По агрегатному состоянию
∙ газообразные;
∙ жидкие;
∙ твёрдые.
Слайд 8Зависимость растворимости СO2 в воде при 15°С (a) и N2 в
Слайд 9Растворение - самопроизвольный процесс, поэтому ΔGрастворения< 0. Величина и знак ΔGрастворения определяются
Слайд 10Например, при растворении гидроксида калия в воде наблюдается сильное разогревание раствора.
KOH
Экзотермический: растворение NaOH, AgNО3, H2SО4, ZnSО4.
а при растворении нитрата аммония - охлаждение:
NH4NО3+ ag = NH4NО3 • ag (Δ Н° = 25кДж)
При внесении в почву азотных удобрений почва охлаждается.
Эндотермический: NaNО3, KCl, K2SО4, KNО2, NH4Cl.
Слайд 111. Количественный состав растворов. Типы концентраций.
Содержание компонентов в растворе может
Концентрация – это количество растворенного вещества, содержащееся в единице массы или объеме раствора.
Слайд 12Массовая доля вещества (ω) – отношение массы данного вещества m(х) в
Объёмная доля вещества (φ) выражается в долях единицы или % и численно равна отношению объёма жидкого или газообразного вещества к общему объёму раствора или смеси.
φ(х) = V(x)/V(р-ра).
Слайд 13Молярная доля растворённого вещества (χ) численно равна отношению химического количества растворённого
Молярная концентрация С(х) - это химическое количество (моль) растворенного вещества, которое содержится в 1 л раствора.
С(х) = n(х)/V(р-ра), моль/л
m(x) = C(x) · M(x) · V(x)
Слайд 14Моляльность раствора (b или Сm) – это число молей растворенного вещества
Молярная концентрация эквивалента С(1/z(х)) (нормальность) показывает химическое количество эквивалента растворенного вещества в молях, которое содержится в 1 л раствора.
С(1/z(х)) = n(1/z(х))/V(р-ра), моль/л
Слайд 152. Коллигативные свойства
Коллигативными свойствами называются свойства растворов, которые не
Разбавленные растворы характеризуются отсутствием взаимодействия между частицами растворенного вещества.
Слайд 16Коллигативными свойствами растворов являются:
диффузия, осмос, осмотическое давление;
давление насыщенного пара растворителя над
температура кристаллизации (замерзания) раствора;
температура кипения раствора.
Слайд 17Диффузией в растворе
называется самопроизвольный направленный процесс переноса частиц растворенного вещества
Слайд 18Количество вещества, переносимого за счет диффузии через единичную площадь поверхности в
Все растворы обладают способностью к диффузии.
Диффузия - это равномерное распределение вещества по всему объему раствора, протекающая по всем направлениям.
Ее движущая сила - стремление к максимуму энтропии.
Слайд 19Осмос – это односторонняя диффузия молекул растворителя сквозь мембрану с избирательной
Слайд 21
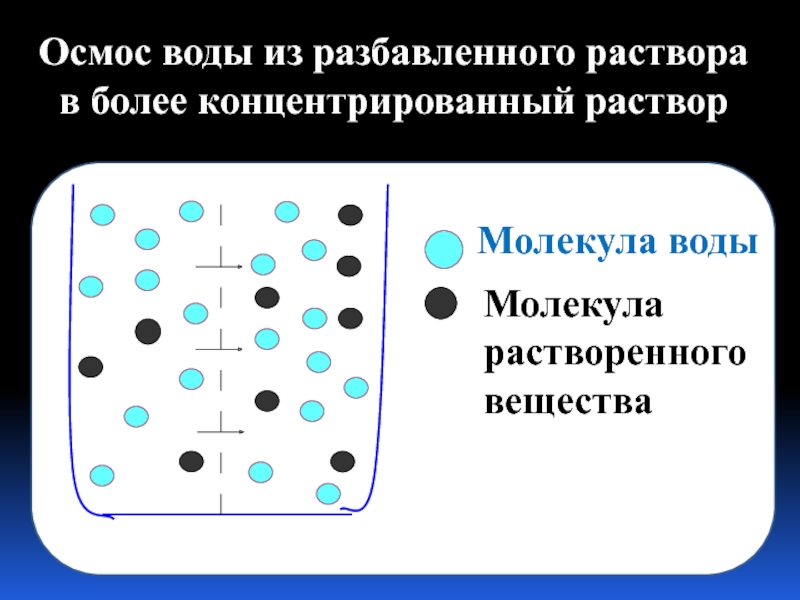
Молекула воды
Молекула растворенного вещества
Осмос воды из разбавленного раствора в более концентрированный
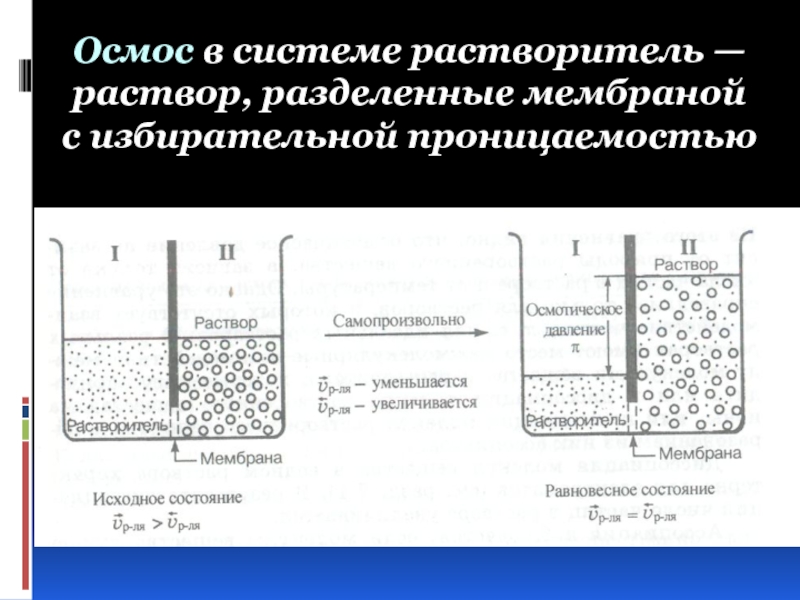
Слайд 22Осмос в системе растворитель — раствор, разделенные мембраной с избирательной проницаемостью
Слайд 23Осмотическим давлением (π(Росм)) называют избыточное гидростатическое давление, возникающее в результате осмоса
Количественная зависимость осмотического давления от внешних факторов подчиняется объединенному газовому
закону Менделеева - Клапейрона:
π(Росм) = cRT
Слайд 25Осмотическая ячейка - это система, отделенная от окружающей среды мембраной с
Все клетки живых существ являются осмотическими ячейками, которые способны всасывать растворитель из окружающей среды или, наоборот, его отдавать, в зависимости от концентраций растворов, разделенных мембраной.
Клеточные мембраны животных и растительных организмов являются проницаемыми для воды и небольших ионов.
Проходя через них вода создает осмотическое давление.
Слайд 26ЭНДООСМОС - движение растворителя в осмотическую ячейку из окружающей среды. Условие
Слайд 27В результате эндоосмоса вода диффундирует в клетку, происходит набухание клетки с
В растительном мире тургор помогает растению сохранять вертикальное положение и определенную форму.
Если разница в концентрациях наружного и внутреннего раствора достаточно велика, а прочность оболочки клетки небольшая, то эндоосмос приводит к разрушению клеточной мембраны и лизису клетки.
Именно эндоосмос является причиной гемолиза эритроцитов крови с выделением гемоглобина в плазму. Эндоосмос происходит, если клетка оказывается в гипотоническом растворе
Слайд 28ЭКЗООСМОС – движение растворителя из осмотической ячейки в окружающую среду. Условие
Слайд 29В результате экзоосмоса вода диффундирует из клетки в плазму и происходит
Экзоосмос имеет место если клетка оказывается в гипертонической среде. Явление экзосмоса наблюдается, например, при посыпании ягод или фруктов сахаром, а овощей, мяса или рыбы - солью. При этом происходит консервирование продуктов питания благодаря уничтожению микроорганизмов вследствие их плазмолиза
Слайд 30 Растворы, которые имеют одинаковое осмотическое давление, называются изотоническими по отношению
Если два раствора имеют различное осмотическое давление, то раствор с большим осмотическим давлением называется гипертоническим, по отношению ко второму,
а раствор с меньшим осмотическим давлением - гипотоническим по отношению к первому.
Слайд 31Изменение эритроцита в растворах с различным осмотическим давлением : а - изотонический
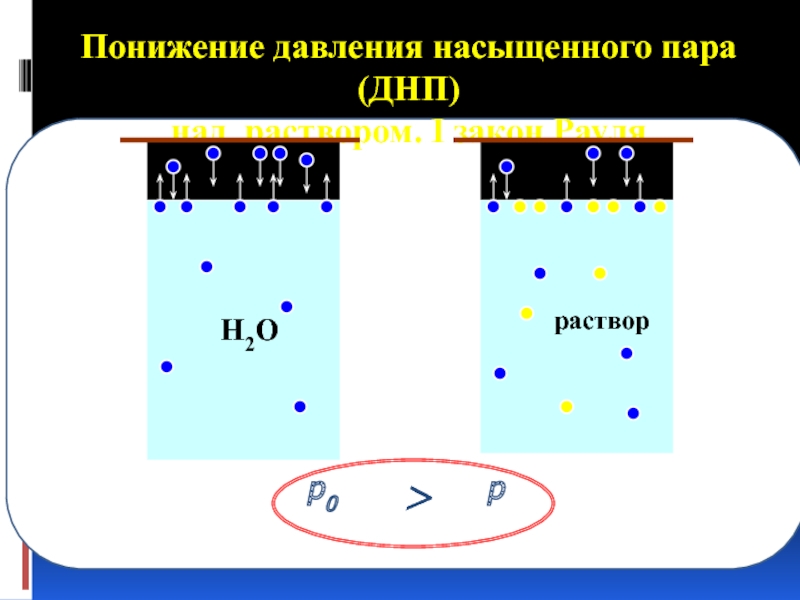
Слайд 32Давление насыщенного пара
над раствором
Давление пара, при котором при данной температуре
(υ исп = υ конд), называется
давлением насыщенного пара.
Слайд 33Устанавливается динамическое физико-химическое равновесие, при котором число молекул, переходящих в единицу
Схема равновесия двухфазной системы раствор - пар
Слайд 35Первый закон Рауля: При постоянной температуре относительное понижение давления насыщенного пара растворителя
. Испарение чистого растворителя и испарение растворителя из раствора
Слайд 36Под стеклянный колпак ставят стакан с растворителем и другой стакан с
Схема измерения давления насыщенного пара
Слайд 37Положение фазовых равновесий зависит от температуры и внешнего давления. Переходы жидкости
Слайд 38Температура кипения жидкости – это температура, при которой давление насыщенного пара
При температуре кипения в равновесии
сосуществуют две фазы: жидкая и пар.
Слайд 39Температура замерзания жидкости - это температура, при которой давление насыщенного пара над
При температуре замерзания в равновесии сосуществуют три фазы:
твердая, жидкая и пар.
Слайд 40Второй закон Рауля: Повышение температуры кипения или понижение температуры замерзания растворов нелетучих
∆Тзам = К⋅Сm,
где К – криоскопическая постоянная растворителя;
Сm – моляльная концентрация раствора, моль/1000г раств-ля.
∆Ткип = Е⋅Сm,
где Е – эбулиоскопическая постоянная растворителя;
Сm – моляльная концентрация раствора, моль/1000г раств-ля
Слайд 42Эбулиоскопия и криоскопия - это методы, позволяющие экспериментально определить молярные массы
Слайд 43Схема криоскопа
1 - пробирка с боковым отростком, плотно закрытая пробкой
2-термометр (шкала
3- мешалка
4 - метка, показывающая уровень исследуемой жидкости
Слайд 44Для учета межмолекулярных взаимодействий в реальных растворах Вант-Гофф предложил использовать изотонический
Для молекул растворенного вещества физический смысл изотонического коэффициента:
i = число частиц растворенного вещества
число частиц исходного вещества
Для растворов неэлектролитов, молекулы которых не диссоциируют и мало склонны к ассоциации, i = 1.
Между α и i существует зависимость:
Слайд 45При приготовлении физиологических растворов необходимо учитывать их осмотические свойства, поэтому их
Осмолярная концентрация - суммарное молярное количество всех кинетически активных, т. е. способных к самостоятельному движению, частиц, содержащихся в 1 литре раствора, независимо от их формы, размера и природы.
Осмолярная концентрация раствора связана с его молярной концентрацией через изотонический коэффициент
Сосм= iС(X)
Слайд 46Для сильных электролитов (α≈1):
α=(i-1)/(n-1)
NaCl ↔ Na+ + Cl-
2 иона => n=2,
CaCl2 ↔ Ca2+ + 2Cl-
3 иона => n=3, i=3 при α =1