- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Азотсодержащие соединения. (Лекция 13) презентация
Содержание
- 1. Азотсодержащие соединения. (Лекция 13)
- 2. Нитросоединения – это производные углеводо-родов, в которых
- 3. Способы получения нитросоединений Нитрование алканов
- 4. Первичные и вторичные нитросоединения являются СН-кислотами и
- 5. Первичные нитросоединения Образуют бесцветные нитроловые
- 6. При нагревании эритронитролаты изомеризуются в бесцветные лейконитролаты
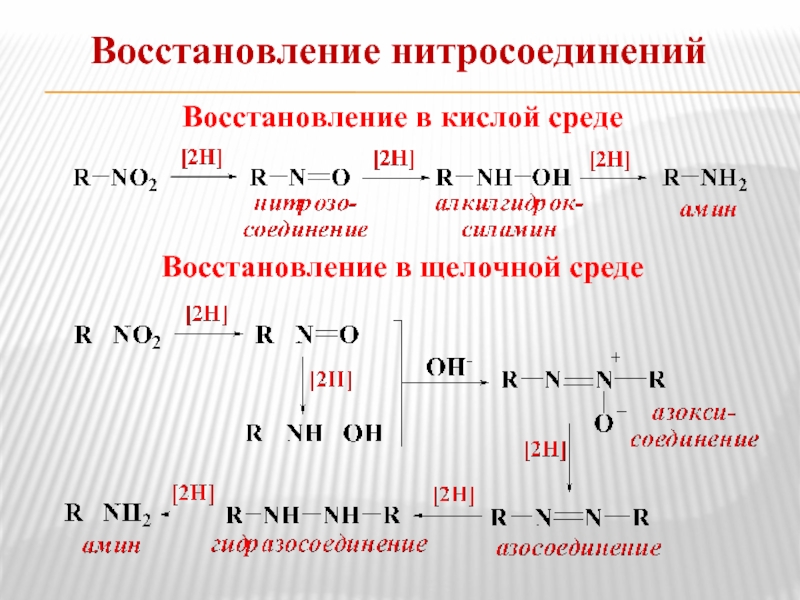
- 7. Восстановление в кислой среде Восстановление в щелочной среде Восстановление нитросоединений
- 8. Амины – это производные аммиака, в которых
- 9. Способы получения аминов Восстановление амидов
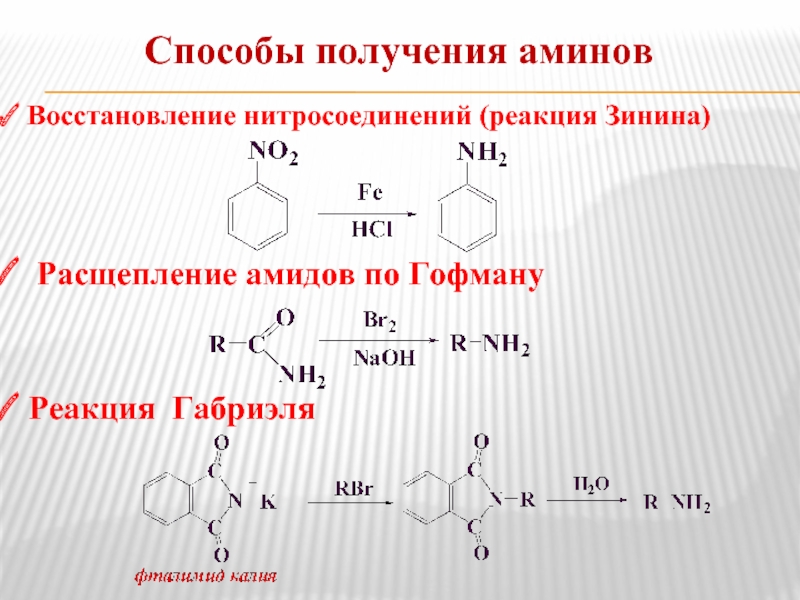
- 10. Способы получения аминов Восстановление нитросоединений (реакция
- 11. Способы получения аминов Алкилирование аммиака
- 12. Реакционные центры в аминах NН-кислотный центр n-Основный и нуклеофильный центры
- 13. Основные свойства аминов
- 14. Нуклеофильные свойства аминов Взаимодействие с алкилгалогенидами
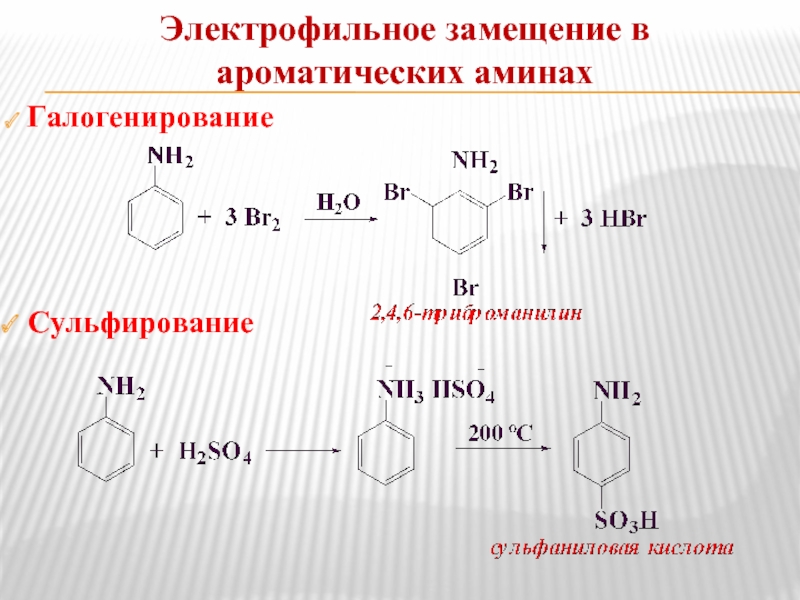
- 15. Электрофильное замещение в ароматических аминах Галогенирование
- 16. Реакции аминов с азотистой кислотой Первичные
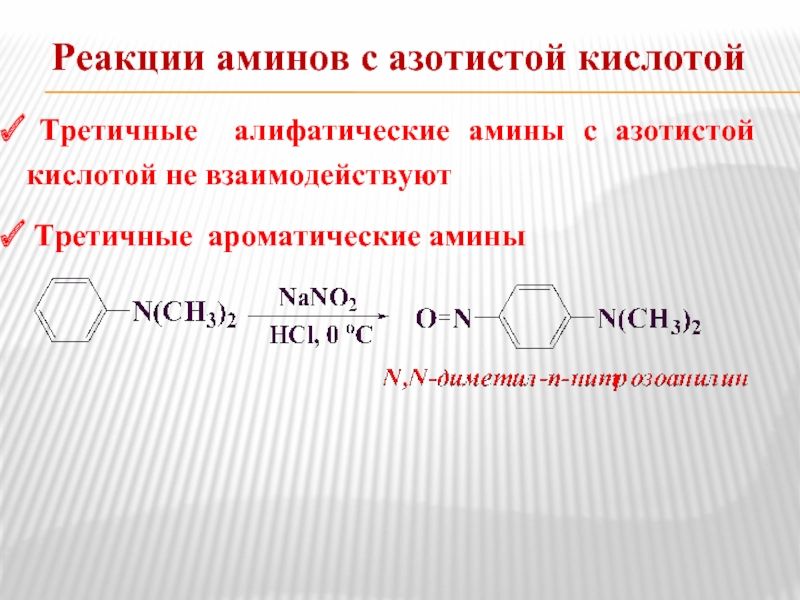
- 17. Реакции аминов с азотистой кислотой Третичные
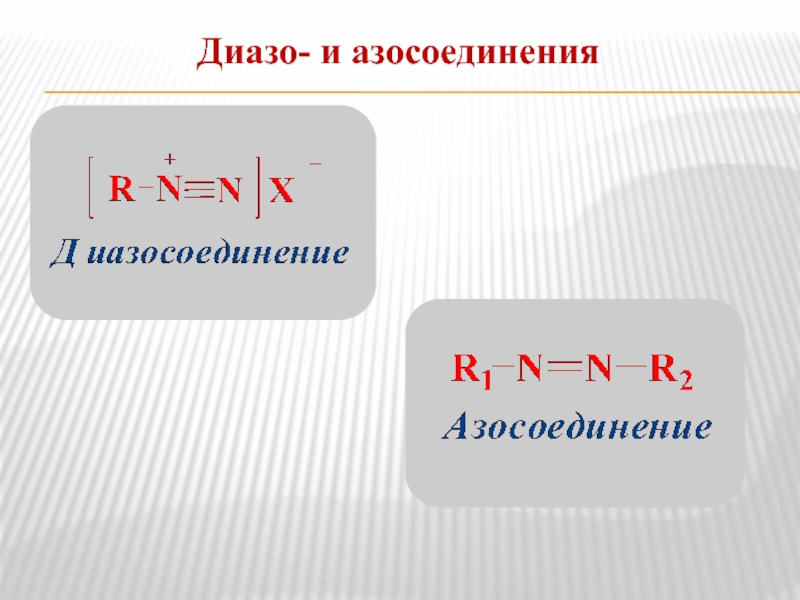
- 18. Диазо- и азосоединения
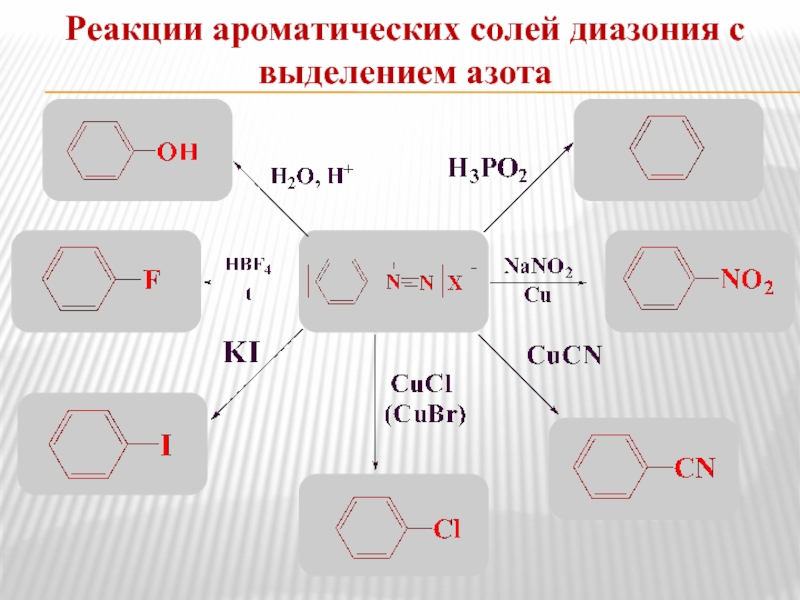
- 19. Реакции ароматических солей диазония с выделением азота
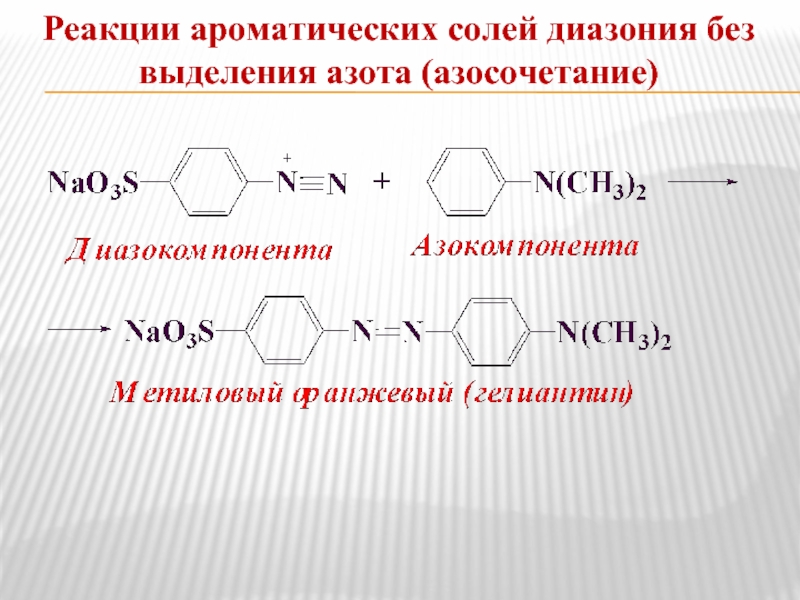
- 20. Реакции ароматических солей диазония без выделения азота
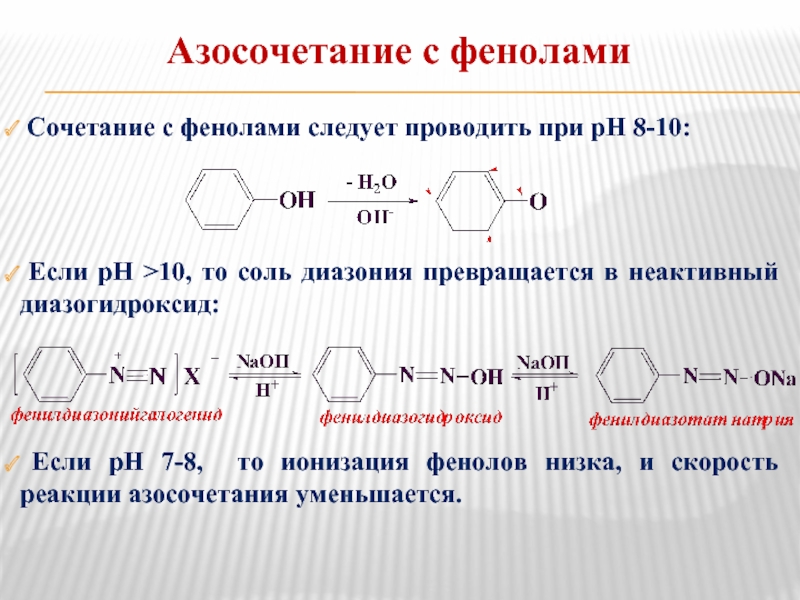
- 21. Сочетание с фенолами следует проводить при
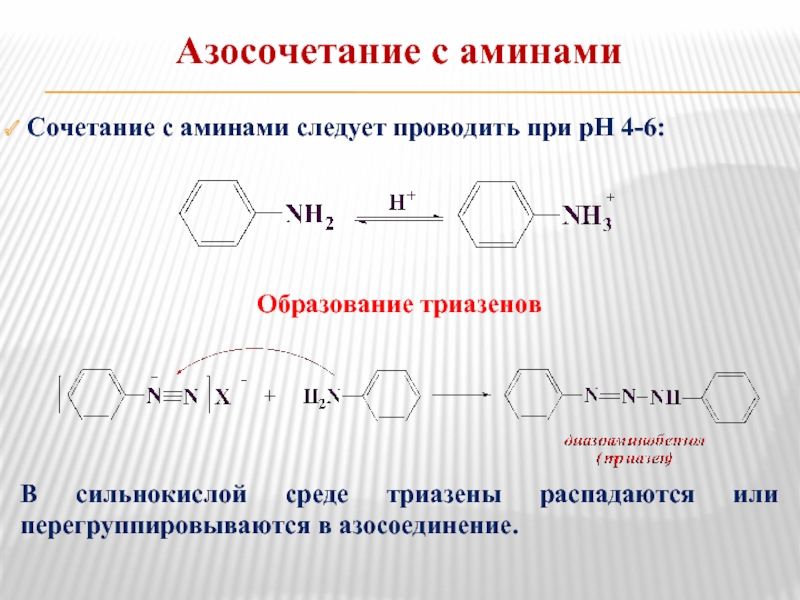
- 22. Азосочетание с аминами Сочетание с аминами
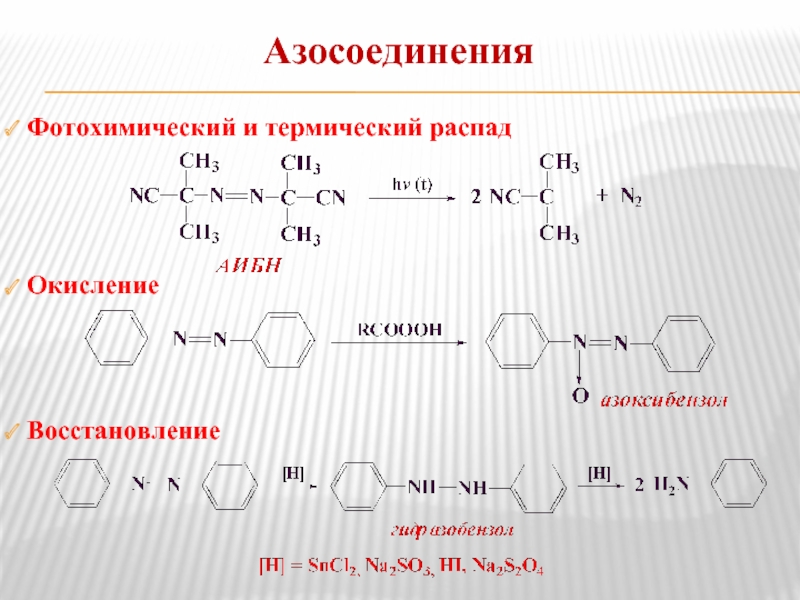
- 23. Азосоединения Фотохимический и термический распад
Слайд 2Нитросоединения – это производные углеводо-родов, в которых один или несколько атомов
Строение нитрогруппы
Слайд 3Способы получения нитросоединений
Нитрование алканов
Нитрование аренов
Взаимодействие галогеналканов с нитритами
Окисление первичных аминов
Слайд 4Первичные и вторичные нитросоединения являются СН-кислотами и в растворах щелочей образуют
Кислотные свойства нитросоединений
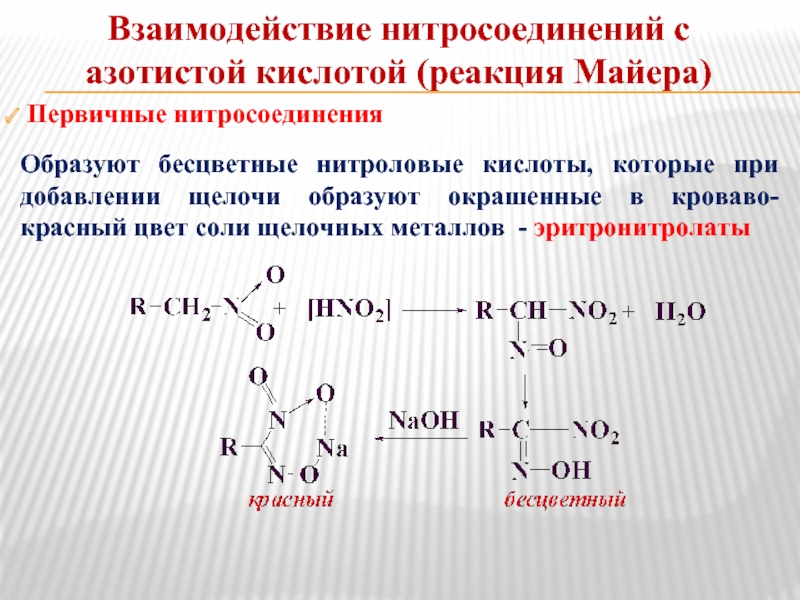
Слайд 5 Первичные нитросоединения
Образуют бесцветные нитроловые кислоты, которые при добавлении щелочи образуют
Взаимодействие нитросоединений с азотистой кислотой (реакция Майера)
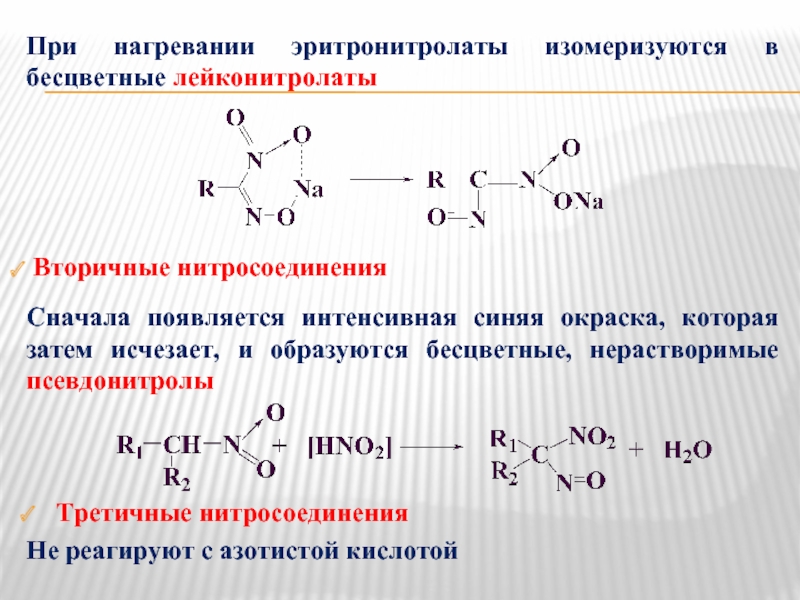
Слайд 6При нагревании эритронитролаты изомеризуются в бесцветные лейконитролаты
Вторичные нитросоединения
Сначала появляется интенсивная
Третичные нитросоединения
Не реагируют с азотистой кислотой
Слайд 8Амины – это производные аммиака, в которых один или несколько атомов
Вторичные
Первичные
Третичные
алифатические
ароматические
Природа радикала
Количество радикалов
Амины
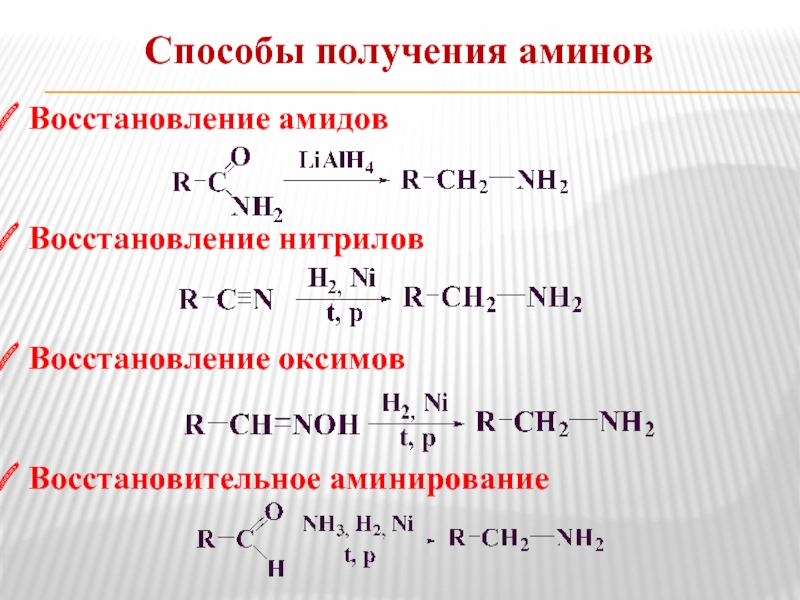
Слайд 9Способы получения аминов
Восстановление амидов
Восстановление нитрилов
Восстановление оксимов
Восстановительное аминирование
Слайд 10Способы получения аминов
Восстановление нитросоединений (реакция Зинина)
Расщепление амидов по Гофману
Слайд 14Нуклеофильные свойства аминов
Взаимодействие с алкилгалогенидами
Взаимодействие с хлорангидридами
Взаимодействие с
Взаимодействие с эпоксидами
Правило Красуского: в замещенных эпоксидах нуклеофильная атака происходит по наименее замещенному атому углерода эпоксидного цикла.
Слайд 16Реакции аминов с азотистой кислотой
Первичные алифатические амины
Первичные ароматические амины
Слайд 17Реакции аминов с азотистой кислотой
Третичные алифатические амины с азотистой кислотой
Третичные ароматические амины
Слайд 21 Сочетание с фенолами следует проводить при рН 8-10:
Если рН
Если рН 7-8, то ионизация фенолов низка, и скорость реакции азосочетания уменьшается.
Азосочетание с фенолами
Слайд 22Азосочетание с аминами
Сочетание с аминами следует проводить при рН 4-6:
Образование
В сильнокислой среде триазены распадаются или перегруппировываются в азосоединение.