- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
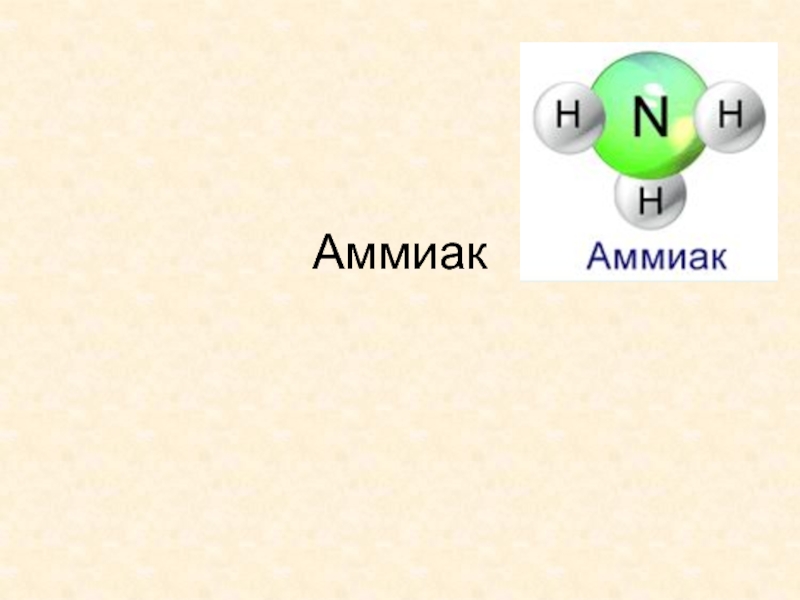
Аммиак. Химические свойства презентация
Содержание
- 1. Аммиак. Химические свойства
- 2. Аммиак (в европейских языках его название
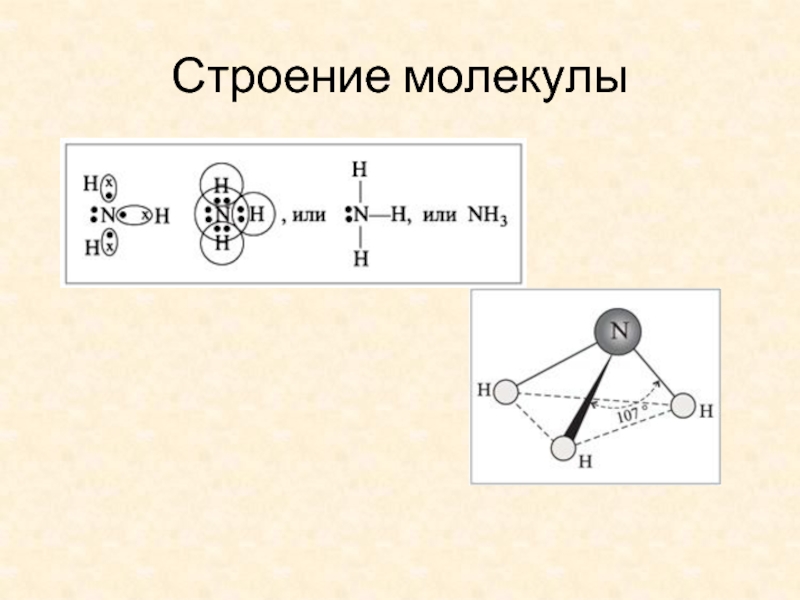
- 3. Строение молекулы
- 4. Получение промышленный способ Промышленный способ получения
- 5. Производство аммиака Колонна синтеза аммиака: 1-люк
- 6. В лаборатории Для получения аммиака в лаборатории
- 7. Химические свойства 1. Горение аммиака (при нагревании)
- 8. с оксидами металлов 2 NH3 +
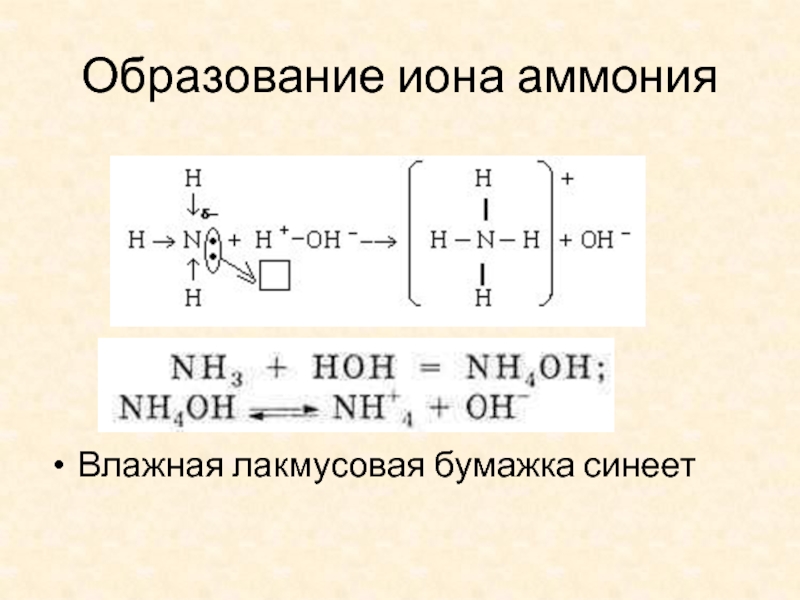
- 9. Образование иона аммония Влажная лакмусовая бумажка синеет
- 10. Получение 1 способ- Аммиак + кислота:
- 11. Соли аммония NH4Cl – хлорид аммония (NH4)2SO4
- 12. СПЕЦИФИЧЕСКИЕ 1. Разложение при нагревании. a)
Слайд 2
Аммиак (в европейских языках его название звучит как «аммониак») своим названием
обязан оазису Аммона в Северной Африке, расположенному на перекрестке караванных путей. В жарком климате мочевина (NH2)2CO, содержащаяся в продуктах жизнедеятельности животных, разлагается особенно быстро. Одним из продуктов разложения и является аммиак. По другим сведениям, аммиак получил своё название от древнеегипетского слова амониан. Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали нашатырь NH4Cl, который при нагревании испаряет аммиак.
Слайд 4Получение промышленный способ
Промышленный способ получения аммиака основан на прямом взаимодействии
водорода и азота:
N2(г) + 3H2(г) ↔ 2NH3(г) + 45,9 кДж
Условия:
катализатор – пористое железо
температура – 450 – 500 ˚С
давление – 25 – 30 МПа
Это так называемый процесс Габера (немецкий физик, разработал физико-химические основы метода).
N2(г) + 3H2(г) ↔ 2NH3(г) + 45,9 кДж
Условия:
катализатор – пористое железо
температура – 450 – 500 ˚С
давление – 25 – 30 МПа
Это так называемый процесс Габера (немецкий физик, разработал физико-химические основы метода).
Слайд 5Производство аммиака
Колонна синтеза аммиака:
1-люк для выгрузки катализатора;
2-центр, труба;
3-корпус;
4-люк для загрузки катализатора;
5 -теплообменник;
6-трубы для ввода холодного газа;
7 - катализатор.
Слайд 6В лаборатории
Для получения аммиака в лаборатории используют действие сильных щелочей на
соли аммония:
NH4Cl + NaOH = NH3↑ + NaCl + H2O
(NH4)2SO4 + Ca(OH)2 = 2NH3↑ + CaSO4 + 2H2O
Внимание! Гидроксид аммония неустойчивое основание, разлагается: NH4OH ↔ NH3↑ + H2O
При получении аммиака держите пробирку - приёмник дном кверху, так как аммиак легче воздуха:
NH4Cl + NaOH = NH3↑ + NaCl + H2O
(NH4)2SO4 + Ca(OH)2 = 2NH3↑ + CaSO4 + 2H2O
Внимание! Гидроксид аммония неустойчивое основание, разлагается: NH4OH ↔ NH3↑ + H2O
При получении аммиака держите пробирку - приёмник дном кверху, так как аммиак легче воздуха:
Слайд 7Химические свойства
1. Горение аммиака (при нагревании)
4NH3 + 3O2 → 2N2 +
6H20
2. Каталитическое окисление амииака (катализатор Pt – Rh, температура)
4NH3 + 5O2 → 4NO + 6H2O
2. Каталитическое окисление амииака (катализатор Pt – Rh, температура)
4NH3 + 5O2 → 4NO + 6H2O
Слайд 8
с оксидами металлов
2 NH3 + 3CuO = 3Cu + N2 +
3 H2O
С окислителями
2NH3 + 3Cl2 = N2 + 6HCl (при нагревании)
аммиак – непрочное соединение, при нагревании разлагается
2NH3↔ N2 + 3H2
С окислителями
2NH3 + 3Cl2 = N2 + 6HCl (при нагревании)
аммиак – непрочное соединение, при нагревании разлагается
2NH3↔ N2 + 3H2
Слайд 10Получение
1 способ- Аммиак + кислота:
NH3 + HNO3 → NH4NO3
2
способ- Аммиачная вода + кислота:
2NH4OH + H2SO4 → (NH4)2SO4+ 2Н2O
2NH4OH + H2SO4 → (NH4)2SO4+ 2Н2O
Слайд 11Соли аммония
NH4Cl – хлорид аммония
(NH4)2SO4 - сульфат аммония
NH4NO3 – нитрат аммония
(NH4)3PO4
– ортофосфат аммония
(NH4)2HPO4 – гидроортофосфат аммония
NH4H2PO4 – дигидроортофосфат аммония
(NH4)2HPO4 – гидроортофосфат аммония
NH4H2PO4 – дигидроортофосфат аммония
Слайд 12СПЕЦИФИЧЕСКИЕ
1. Разложение при нагревании.
a) если кислота летучая
NH4Cl → NH3 + HCl
(при нагревании)
NH4HCO3 → NH3 + Н2O + CO2
б) если анион проявляет окислительные свойства
NH4NO3 → N2O + 2Н2O (при нагревании)
(NH4)2Cr2O7 → N2 + Cr2O3 + 4Н2O (при нагревании)
2. Качественная реакция на NH4+ - ион аммония. При нагревании со щелочами выделяется газ аммиак
NH4Cl + NaOH → NaCl + NH3 + Н2O (при нагревании)
3. Соли аммония подвергаются гидролизу (как соль слабого основания и сильной кислоты) – среда кислая:
NH4Cl + Н2O → NH4OH + HCl
NH4+ + Н2O → NH4OH + H+
NH4HCO3 → NH3 + Н2O + CO2
б) если анион проявляет окислительные свойства
NH4NO3 → N2O + 2Н2O (при нагревании)
(NH4)2Cr2O7 → N2 + Cr2O3 + 4Н2O (при нагревании)
2. Качественная реакция на NH4+ - ион аммония. При нагревании со щелочами выделяется газ аммиак
NH4Cl + NaOH → NaCl + NH3 + Н2O (при нагревании)
3. Соли аммония подвергаются гидролизу (как соль слабого основания и сильной кислоты) – среда кислая:
NH4Cl + Н2O → NH4OH + HCl
NH4+ + Н2O → NH4OH + H+