- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Растворы и их классификация презентация
Содержание
- 1. Растворы и их классификация
- 2. Определение Аналити́ческая хи́мия — раздел химии, изучающий
- 3. АНАЛИТИЧЕСКАЯ ХИМИЯ
- 4. АНАЛИТИЧЕСКАЯ ХИМИЯ Количественный анализ — совокупность
- 6. Аналитическая химия
- 7. РАСТВОРЫ
- 9. Растворы и их классификация Раствор –
- 10. По размеру частиц растворенного вещества: а) истинные
- 11. В медицинской практике широко используются плазмозамещающие (инфузионные)
- 12. Типы растворов, используемых в медицине - гипертонические
- 13. Типы растворов, используемых в медицине - гипертонические
- 14. Функции воды Универсальный растворитель органических и
- 15. Свойства воды Строение – водородные связи
- 16. Структурные свойства воды Ассоциаты – 70%, из
- 17. Аномальность воды Вода, как все вещества
- 18. Термодинамически устойчив, образуется самопроизвольно Δ G <
- 19. Свойства воды Строение – водородные связи
- 20. Электролиты биосред Клетка концентрированнее плазмы Обязательно присутствие
- 22. Параметры изотонических растворов неэлектролитов, используемых
- 23. Принципы гомеостаза человеческого организма ΔТзам =
- 24. Принципы гомеостаза человеческого организма ΔТзам =
- 25. Применение в медицине
Слайд 2Определение
Аналити́ческая хи́мия — раздел химии, изучающий химический состав и структуру веществ;
Предмет её как науки : совершенствование существующих и разработка новых методов анализа, их практическое применение, исследование теоретических основ аналитических методов.
Слайд 4АНАЛИТИЧЕСКАЯ ХИМИЯ
Количественный анализ — совокупность методов аналитической химии для определения количества
Качественный анализ — совокупность химических, физико-химических и физических методов, применяемых для обнаружения элементов, радикалов и соединений, входящих в состав анализируемого вещества или смеси веществ. В качественном анализе используют легко выполнимые, характерные химические реакции, при которых наблюдается появление или исчезновение окрашивания, выделение или растворение осадка, образование газа и др
Слайд 9Растворы и их классификация
Раствор – гомогенная система переменного состава, состоящая
Растворитель – компонент, агрегатного состояние которого не изменяется при образовании раствора. При одинаковых агрегатных состояниях компонентов растворителем считают то вещество, содержание которого в растворе больше.
Растворенное вещество – компонент, молекулы или ионы которого равномерно распределены в объеме растворителя.
В р-рах электролитов вне зависимости от соотношения компонентов растворенным в-вом считаются электролит.
Слайд 10По размеру частиц растворенного вещества:
а) истинные растворы – это однородные гомогенные
б) коллоидные растворы – это неоднородные ультрамикрогетерогенные системы с размером частиц 10–7-10–9 м (1–100 нм). Например: плазма крови, лимфа.
в) грубодисперсные (микрогетерогенные) системы – это неоднородные гетерогенные системы с размером частиц 10–6-10–4 м. Например: эмульсии, суспензии, порошки, мази, кремы и т.д.
1. По наличию или отсутствию электролитической диссоциации:
а) растворы электролитов – это растворы веществ, диссоциирующих на ионы. В растворе присутствуют катионы и анионы солей, кислот, оснований. Например: р-ры сильных электрол-тов NaCl, HCl, NaOH ( = 1) и растворы слабых элект-тов CH3COOH и др;
б) растворы неэлектролитов – растворы веществ, практически не диссо- циирующих в воде. Например: глю-зы, мочевины, глиц-на и т.д.;
в) растворы амфолитов – растворы веществ, которые могут диссоцииро- вать как по кислотному, так и по основному типу. Например: аминокислоты, Zn(OH)2 и т.д.
По агрегатному состоянию: а) жидкие, б) газообразные (смеси газов); в) твердые (сплавы металлов).
По содержанию растворенного вещества: а) разбавленные – с относительно низким содержанием растворенного вещества; б) концентрированные – с относительно высоким содержанием растворенного вещества.
Классификации растворов
Слайд 11В медицинской практике широко используются плазмозамещающие (инфузионные) растворы, которые по медицинскому
Комплексные (полифункциональные) растворы, обладающие широким диапазоном действия, которые могут состоять из нескольких групп плазмозамещающих растворов.
Переносчики кислорода, восстанавливающие дыхательную функцию крови (растворы модифицированного гемоглобина.
Растворы для парентерального питания, которые служат для обеспечения энергетических ресурсов организма, доставки питательных веществ к органам и тканям.
Регуляторы водно-солевого баланса и кислотно-основного состояния: солевые растворы (растворы электролитов), осмотические диуретики (глицерол, маннитол и мочевина).
Дезинтоксикационные растворы, применяемые при интоксикации различной этиологии.
Гемодинамические (противошоковые) растворы – предназначены для ле- чения шока различного происхождения и восстановления гемодинамики, в том числе микроциркуляции, при использовании аппаратов искусственного кровообращения для разведения крови во время операций.
Слайд 12Типы растворов, используемых в медицине
- гипертонические (росм > pосм крови)
- гипотонические
- изотонические (pосм = pосм крови = 7.62 атм)
При контакте с кровью наблюдается плазмолиз –
сжатие эритроцитов
При контакте с кровью наблюдается гемолиз –
разрыв эритроцитов (если Росм < 3.6- 4.0 атм)
Используются в тех случаях, когда необходимо
обеспечить отток жидкости из тканей
Используются в тех случаях, когда необходимо
обеспечить приток жидкости к тканям
Используются для внутривенных вливаний
Слайд 13Типы растворов, используемых в медицине
- гипертонические (росм > pосм крови)
- гипотонические
- изотонические (pосм = pосм крови = 7.62 атм)
При контакте с кровью наблюдается плазмолиз –
сжатие эритроцитов
При контакте с кровью наблюдается гемолиз –
разрыв эритроцитов (если Росм < 3.6- 4.0 атм)
Используются в тех случаях, когда необходимо
обеспечить отток жидкости из тканей
Используются в тех случаях, когда необходимо
обеспечить приток жидкости к тканям
Используются для внутривенных вливаний
Слайд 14Функции воды
Универсальный растворитель органических и неорганических веществ
Среда, в которой
Активный участник процессов жизнедеятельности
Определяет физико-химическое состояние коллоидных систем
Участвует в процессах терморегуляции
Потеря 20% воды ⇒ гибель организма
Потребность 35 г на 1 кг массы тела
Слайд 15Свойства воды
Строение – водородные связи
—О⋅⋅⋅ Н—О⋅⋅⋅ Н— Вода -
Высокая теплоемкость 75,3 Дж⁄моль⋅K
Большая теплота испарения 40,8 кДж/моль
Высокая диэлектрическая проницаемость воды ε = 78,5
Высокий дипольный момент -1,82 Д ⇒ 4 водородные связи ⇒ ассоциаты
Высокое поверхностное натяжение ⇒ смачивание
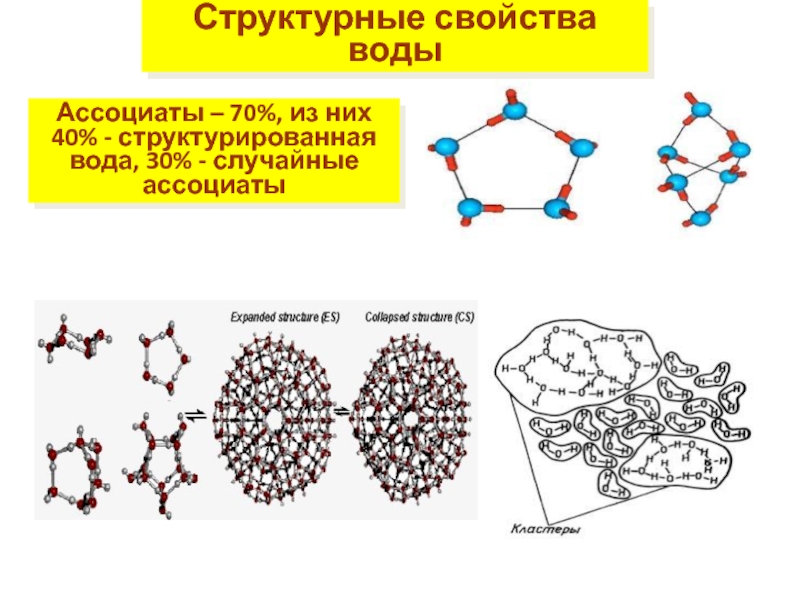
Слайд 16Структурные свойства воды
Ассоциаты – 70%, из них 40% - структурированная вода,
Слайд 17Аномальность воды
Вода, как все вещества в природе, при охлаждении от
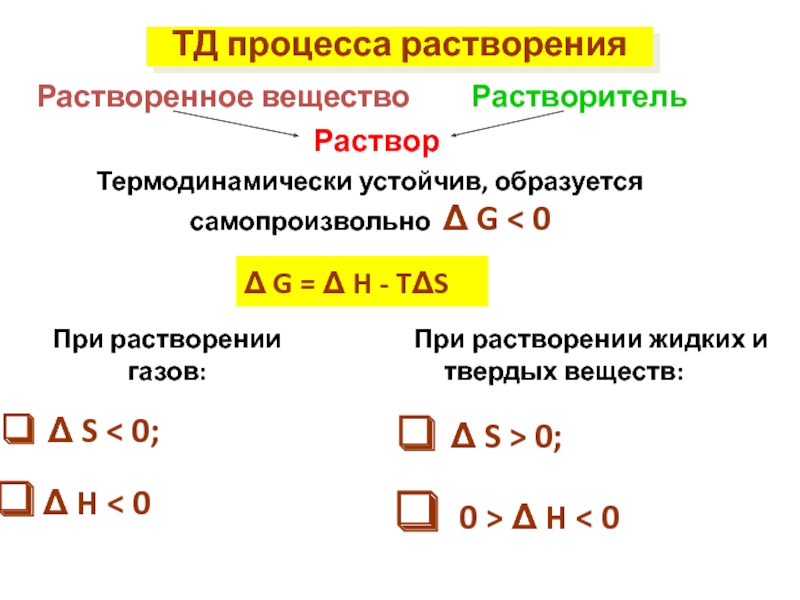
Слайд 18Термодинамически устойчив, образуется самопроизвольно Δ G < 0
Δ G = Δ
При растворении газов:
Δ S < 0;
Δ H < 0
При растворении жидких и твердых веществ:
Δ S > 0;
0 > Δ H < 0
Растворенное вещество
Растворитель
ТД процесса растворения
Раствор
Слайд 19Свойства воды
Строение – водородные связи
—О⋅⋅⋅ Н—О⋅⋅⋅ Н— Вода -
Высокая теплоемкость 75,3 Дж⁄моль⋅K
Большая теплота испарения 40,8 кДж/моль
Высокая диэлектрическая проницаемость воды ε = 78,5
Высокий дипольный момент -1,82 Д ⇒ 4 водородные связи ⇒ ассоциаты
Высокое поверхностное натяжение ⇒ смачивание
Слайд 20Электролиты биосред
Клетка концентрированнее плазмы
Обязательно присутствие катионов Na, K, Mg, Ca
В плазме
В клетке K > Na, Mg > Ca
Плазма ~ NaCl
Клетка ~ K2HPO4
Важнейшие закономерности
Слайд 21
Na
K
Ca
Ca
Na
Mg
Mg
HCO3-
HCO3-
Cl
K
HPO42-
белок
SO42-
белок
142
103
160
100
Плазма
Внутриклеточная
жидкость
Σк = Σа = 153 ммоль/л
Σк = Σа = 200 ммоль/л
Электролитный
состав
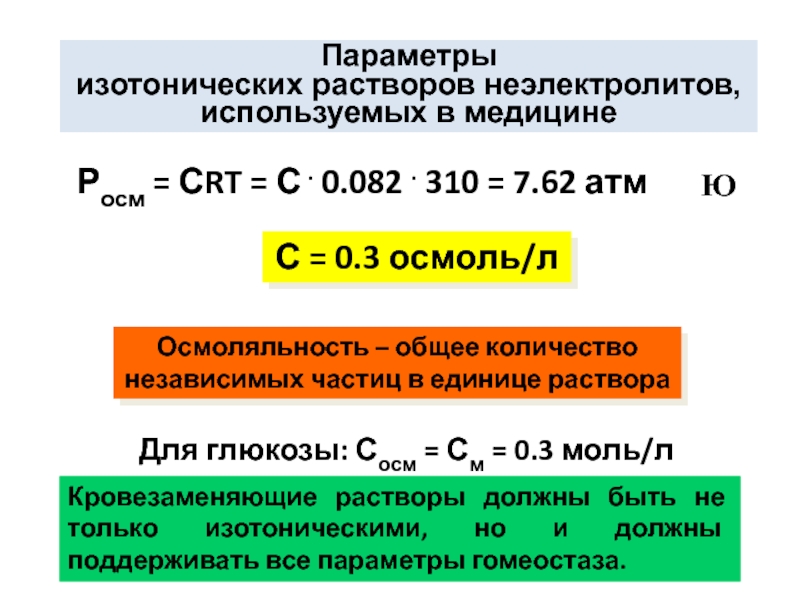
Слайд 22Параметры
изотонических растворов неэлектролитов,
используемых в медицине
Росм = СRT = С
Ю
С = 0.3 осмоль/л
Осмоляльность – общее количество
независимых частиц в единице раствора
Для глюкозы: Сосм = См = 0.3 моль/л
Кровезаменяющие растворы должны быть не только изотоническими, но и должны поддерживать все параметры гомеостаза.
Слайд 23Принципы гомеостаза
человеческого организма
ΔТзам = 0.56 0
Росм = 7.6- 8.1 (7.62)
Ронк = 0.03 – 0.04 атм
Iплазмы = 0.15
Iвнутрикл. = 0.25
Сосм = 0.3 моль/л
Слайд 24Принципы гомеостаза
человеческого организма
ΔТзам = 0.56 0
Росм = 7.6- 8.1 (7.62)
Ронк = 0.03 – 0.04 атм
Iплазмы = 0.15
Iвнутрикл. = 0.25
Сосм = 0.3 моль/л
Слайд 25Применение в медицине
Количественный анализ (реакции осаждения)
Анализ питьевой воды , фармпрепаратов