ішінде химиялық құрамы жағынан таза кездесетіні сирек. Олардың құрылымдарына әртүрлі химиялық қосындылар енеді.
Кейбір минералдарда мұндай қосындылар өте аз. Сондықтан да біз оларды тұрақты құрамды минералдар деп атаймыз.
Мұндай минералдар қатарына кварц SiO2 (қосындылары Al, Fe, Na мөлшері 0,01 %-дан аспайды), пирит FeS2 (мұндағы Co және т.б. қосындылар мөлшері 0,5-1 %-дан аспайды, галит NaCl (оның тазалығы көп жағдайда 99,9 %).
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Изоморфизм, изоморфизмнің түрлері. Полиморфизм. Сульфидтер класының жалпы сипаттамасы презентация
Содержание
- 1. Изоморфизм, изоморфизмнің түрлері. Полиморфизм. Сульфидтер класының жалпы сипаттамасы
- 2. Сфалериттің құрамында темірдің қосындысы 0-25% жетеді. Мұндай
- 3. Изоморфизм бір минералдардың атомдарының (иондарының) басқа минералдардың
- 4. Табиғи изоморфтық қоспалардың құрамын құрылымдық формулада көрсетеді,
- 5. Осы ауысулардың жағдайында химиялық байланыстардың және ауысатын
- 6. Изоморфизм құбылысы кезінде мынадай жағдай сақталуы тиіс:
- 7. Изиоморфизмнің түрлері. Изоморфизм құбылысы былайша жүйеленеді:
- 8. Бұл қатардың шеткі мүшелері анортит Ca[Al2Si2O8] және альбит Na[AlSi3O8]. Плагиоклаздардың үздіксіз изоморфизм қатары
- 9. Плагиоклаздардың изоморфтық қатарындағы қасиеттерінің өзгеруі
- 10. Құрамы өзгергенде плагиоклаздардың қасиеттері де өзгереді, мысалы,
- 11. 3. Изоморфизм құбылысының толық өтуіне байланысты:
- 12. Изоморфтық ауысулар жоғары температуралық жағдайда жеңіл өтеді.
- 13. Температураның ролі. Изоморфтық ауысулар жоғары температуралық жағдайда
- 14. Полиморфизм «Полиморфизм» грек тілінен аударғанда
- 15. Мысалы, кубтық сингонияда кристалданатын алмас, гексагондық сингониядағы
- 16. Екінші түрі – монотропия. Бір
- 17. Минералдардың химиялық құрамы және формуласы (эмпирикалық және
- 18. Минералдардың формулалары эмпирикалық және құрылымдық болып екі
- 19. Құрылымдық формула минералдың химиялық құрамын, оны құрайтын
- 20. Мысалы, сидерит Fe[СО3], микроклин К[А1Si3О8], апатит Ca5[PO4]3(F,Cl,OH)
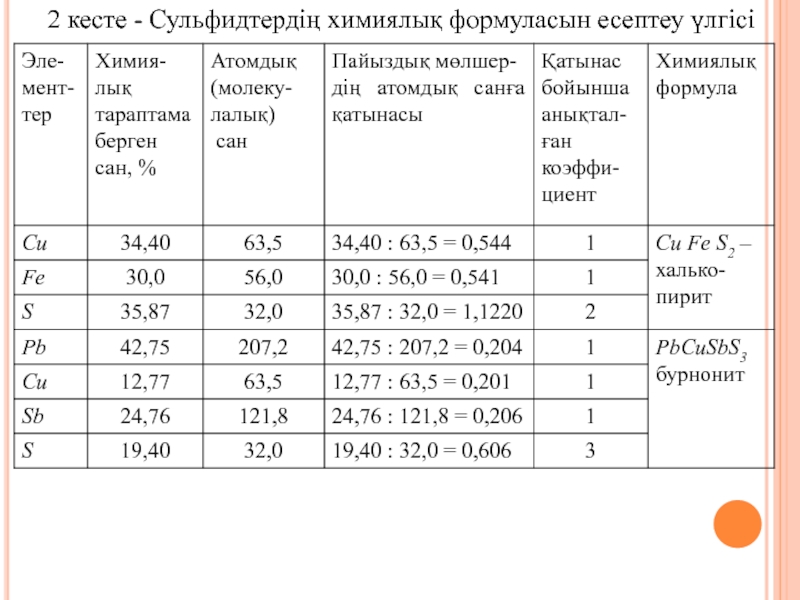
- 21. 2 кесте - Сульфидтердің химиялық формуласын есептеу үлгісі
- 22. Коллоидтық жүйелер Жер қыртысында жаратылысы әлі де
- 23. Егер жүйеде дисперстік орта басым болса ондай
- 24. Мицелдердің таңбалары ертінді құрамының ерекшелігіне қарай, мысалы,
- 25. Коллоидтық жүйелердің пайда болуы минералдардың жаратылу жағдайына,
- 26. Олар өздерінің сырт пішіндері мен іш құрылымына
- 27. Минералдардағы су. Минералдар табиғатта сусыз және сулы
- 28. Конституциялық су – минерал ішіндегі ең берік
- 29. Осындай жағдайда кристаллизация суын цеолиттік су деп
- 30. Сульфидтер класының жалпы сипаттамасы Сульфидтердің 250 аса
- 31. Нақты күкіртпен қоспалар түзетін темір, мырыш, қорғасын,
- 32. Жаратылыстары (генезистері): гидротермалық, магмалық (халькопирит, пирит, пирротин,
- 33. аурипигмент As2S3, реальгар AsS), молибден (молибденит MoS2),
Слайд 1 6 Дәріс. Изоморфизм, изоморфизмнің түрлері. Полиморфизм. Сульфидтер класының жалпы сипаттамасы
Табиғи минералдардың
Слайд 2Сфалериттің құрамында темірдің қосындысы 0-25% жетеді. Мұндай минералдарды құрамы өзгергіш минералдар
деп атайды.
Олардың құрамының өзгергіштігінің басты себебі – изоморфизм құбылысы.
Изоморфизм терминің минералогиялық әдебиетке 1819 ж. Аустрия ғалымы Э. Митчерлих еңгізді. Ол химиялық құрамы әртүрлі кристалдық заттардың сырт пішіні ұқсас болатынын байқаған. Мысалы, NaNO3 кристалдары CaNO3 кристалдарымен.
Изоморфизм құбылысы минералдар арасында кен тараған.
Олардың құрамының өзгергіштігінің басты себебі – изоморфизм құбылысы.
Изоморфизм терминің минералогиялық әдебиетке 1819 ж. Аустрия ғалымы Э. Митчерлих еңгізді. Ол химиялық құрамы әртүрлі кристалдық заттардың сырт пішіні ұқсас болатынын байқаған. Мысалы, NaNO3 кристалдары CaNO3 кристалдарымен.
Изоморфизм құбылысы минералдар арасында кен тараған.
Слайд 3Изоморфизм бір минералдардың атомдарының (иондарының) басқа минералдардың кристалдық торында атомдарын (иондарын)
ауыстыру құбылысын атайды.
Температура изоморфтық қоспалардың шектелуін көрсететін ең маңызды себепкер болады.
Жоғарғы температурада өскен кристалдарда иондық ауысудын шектелуі үдейеді.
Температура төмендегенде изоморфтық құрылымның көлемі азаяды және қатты ерітінділердің ыдырауы байқалады
Температура изоморфтық қоспалардың шектелуін көрсететін ең маңызды себепкер болады.
Жоғарғы температурада өскен кристалдарда иондық ауысудын шектелуі үдейеді.
Температура төмендегенде изоморфтық құрылымның көлемі азаяды және қатты ерітінділердің ыдырауы байқалады
Слайд 4 Табиғи изоморфтық қоспалардың құрамын құрылымдық формулада көрсетеді, жай жақшаның ішінде изоморфтық
элементтер бір-бірінен үтірмен бөледі.
Мысалы, вольфрамиттін химиялық құрамы (Fe,Mn)[WO4] формуласымен көрсетіледі. Ол изоморфтық қоспа боп табылады, оның кұрылымда марганец атомдары темір атомдарын ауыстырады, және керісінше.
Осы қатардың шеткі мүшелері:
ферберит Fe[WO4] гюбнерит Mn[WO4] Оливин (Mg,Fe)2[SiO4] изоморфтық қоспа болады, оның құрылымында магний атомдары темір атомдарымен ауысады.
Бұл үздіксіз қатардың шеткі мүшелері:
форстерит Mg2[SiO4] фаялит Fe2[SiО4]
Мысалы, вольфрамиттін химиялық құрамы (Fe,Mn)[WO4] формуласымен көрсетіледі. Ол изоморфтық қоспа боп табылады, оның кұрылымда марганец атомдары темір атомдарын ауыстырады, және керісінше.
Осы қатардың шеткі мүшелері:
ферберит Fe[WO4] гюбнерит Mn[WO4] Оливин (Mg,Fe)2[SiO4] изоморфтық қоспа болады, оның құрылымында магний атомдары темір атомдарымен ауысады.
Бұл үздіксіз қатардың шеткі мүшелері:
форстерит Mg2[SiO4] фаялит Fe2[SiО4]
Слайд 5Осы ауысулардың жағдайында химиялық байланыстардың және ауысатын атомдардың өлшемі жақын болу
керек.
Демек иондардың радиустарымен қатар поляризациялық қасиеттер ұқсас болу қажет. Егер поляризация деңгейі әртүрлі болса, ал радиустары тен болғандада иондардың арасында изоморфизм болмайды (мысалы, Na+ және Сu+ арасында изоморфизм жоқ.
Демек иондардың радиустарымен қатар поляризациялық қасиеттер ұқсас болу қажет. Егер поляризация деңгейі әртүрлі болса, ал радиустары тен болғандада иондардың арасында изоморфизм болмайды (мысалы, Na+ және Сu+ арасында изоморфизм жоқ.
Слайд 6Изоморфизм құбылысы кезінде мынадай жағдай сақталуы тиіс:
изоморфизмге қатысатын атомдардың
радиустары жақын болуы керек, Гримм-Гольдшмидт заңы бойынша – иондар мен атомдардың радиус мөлшерінің айырмашылығы 15 % - дан аспауы керек;
2) изоморфизмге қатысатын элементтердің химиялық құрамы, бір-біріне ұксас болуы керек;
3) минералдардың химиялық құрамында, электробейтараптық сақталуы керек.
2) изоморфизмге қатысатын элементтердің химиялық құрамы, бір-біріне ұксас болуы керек;
3) минералдардың химиялық құрамында, электробейтараптық сақталуы керек.
Слайд 7Изиоморфизмнің түрлері. Изоморфизм құбылысы былайша жүйеленеді:
Валенттіліктердің ауысу деңгейіне қарай:
а)
изоваленттік изоморфизм – ауысуға түсетін элементтердің валенттілігі бірдей, мысалы, вольфрамит, онда Mn+2, Fe+2 аысады;
б) гетероваленттік изоморфизм – кристалдық құрылымдарда қарапайым ауысумен қатар күрделі кешенді ауысу өтуі мүмкін, классикалық мысал боп далашпаттар тобынын минералдары плагиоклаздар саналады, олар минералдардың үздіксіз қатары болады, онда Са2+ және А13+ жұпы Na+ және Si4+(CaAl↔NaSi) жұпына ауысады.
б) гетероваленттік изоморфизм – кристалдық құрылымдарда қарапайым ауысумен қатар күрделі кешенді ауысу өтуі мүмкін, классикалық мысал боп далашпаттар тобынын минералдары плагиоклаздар саналады, олар минералдардың үздіксіз қатары болады, онда Са2+ және А13+ жұпы Na+ және Si4+(CaAl↔NaSi) жұпына ауысады.
Слайд 8Бұл қатардың шеткі мүшелері анортит Ca[Al2Si2O8] және альбит Na[AlSi3O8].
Плагиоклаздардың үздіксіз
изоморфизм қатары
Слайд 10Құрамы өзгергенде плагиоклаздардың қасиеттері де өзгереді, мысалы, тығыздық, оптикалық қасиеттер және
т.б.
Изоморфизм нәтижесінде пайда болған ауыспалы химиялық құрамды қоспалар қатты ерітінділер деп аталады.
2. Изоморфтық қоспалардың құрылымдық жағдайына қарай: а) орын ауыстырудағы қатты ерітінділер; б) азайтудағы қатты ерітінділер (бос орындардың болуымен сипатталады); в) ендіру қатты ертінділер (аралық изоморфизм пайда болу нәтижесінде өтеді).
Изоморфизм нәтижесінде пайда болған ауыспалы химиялық құрамды қоспалар қатты ерітінділер деп аталады.
2. Изоморфтық қоспалардың құрылымдық жағдайына қарай: а) орын ауыстырудағы қатты ерітінділер; б) азайтудағы қатты ерітінділер (бос орындардың болуымен сипатталады); в) ендіру қатты ертінділер (аралық изоморфизм пайда болу нәтижесінде өтеді).
Слайд 11 3. Изоморфизм құбылысының толық өтуіне байланысты:
а) жетілген немесе шектелген изоморфизм
– ауысуға мүмкіндігі белгілі бір шектен аспайтындығы (мысалы, корундта хромның алюминиймен ауысу мөлшері 1,5 - 2 % - бен шектеледі);
б) жетілмеген изоморфизм – ауысуға түсетін атомдардың бір-бірімен толық ауысуы (мысалы, магнезит-сидерит қатары);
в) бағытталған полярлық изоморфизм (мысалы, алтынға кіретін мыстың мөлшері 20 % - ға дейін, ал алтынның мыстағы изоморфтық қосындысының мөлшері 2 – 3 % - дан аспайды).
б) жетілмеген изоморфизм – ауысуға түсетін атомдардың бір-бірімен толық ауысуы (мысалы, магнезит-сидерит қатары);
в) бағытталған полярлық изоморфизм (мысалы, алтынға кіретін мыстың мөлшері 20 % - ға дейін, ал алтынның мыстағы изоморфтық қосындысының мөлшері 2 – 3 % - дан аспайды).
Слайд 12Изоморфтық ауысулар жоғары температуралық жағдайда жеңіл өтеді.
Егер қысым жоғары болса,
заттардың изоморфтық ауысуы шектеледі, егер төмен болса, ұлғаяды.
Изоморфизм құбылысына әсер ететін басты факторлар минерал пайда болатын процестер ортасының химизмі, температурасы және қысымы.
Химиялық жағдай.
Табиғатта бұл жағдай минералдық ортада бір-біріне ауыстыратын элементердің біркелкілігіне немесе біреуі аз екіншісінің көп болуына байланысты.
Изоморфизм құбылысына әсер ететін басты факторлар минерал пайда болатын процестер ортасының химизмі, температурасы және қысымы.
Химиялық жағдай.
Табиғатта бұл жағдай минералдық ортада бір-біріне ауыстыратын элементердің біркелкілігіне немесе біреуі аз екіншісінің көп болуына байланысты.
Слайд 13 Температураның ролі. Изоморфтық ауысулар жоғары температуралық жағдайда жеңіл өтеді. Мысалы, магмадан
кристаллизациялану кезінде калийлі далашпаттары өз құрамына натрийді сініріп алады, кристаллизация өткеннен кейін (K, Na)(AlSi2O8) 2 фазаға ыдырайды: (K)(AlSi2O8) және (Na)(AlSi2O8).
Қысымның ролі. Егер көлемдік әсер және оған байланысты қысым жоғары болса заттардың изоморфтық ауысуы шектеледі, егер төмен болса ұлғаяды.
Заттың химиялық құрамы өзгеруімен қатар, соған сәйкес құрылымы да, өзгеруін морфотропизм дейді.
Қысымның ролі. Егер көлемдік әсер және оған байланысты қысым жоғары болса заттардың изоморфтық ауысуы шектеледі, егер төмен болса ұлғаяды.
Заттың химиялық құрамы өзгеруімен қатар, соған сәйкес құрылымы да, өзгеруін морфотропизм дейді.
Слайд 14Полиморфизм
«Полиморфизм» грек тілінен аударғанда «көп пішінді» деген ұғым береді.
Бұл
құбылыс бойынша химиялық құрамы бірдей заттар әртүрлі кристалдық құрылымға ие.
Полиморфизм құбылысына әртүрлі элементтер және күрделі қосылыстар ұшырауы мүмкін.
Химиялық құрамы бірдей, бірақ кристалдық құрылысы мен сингониясы бір-бірінен өзгеше келетін минералдардың тобын полиморфтық модификациялар деп атайды.
Полиморфизм құбылысына әртүрлі элементтер және күрделі қосылыстар ұшырауы мүмкін.
Химиялық құрамы бірдей, бірақ кристалдық құрылысы мен сингониясы бір-бірінен өзгеше келетін минералдардың тобын полиморфтық модификациялар деп атайды.
Слайд 15Мысалы, кубтық сингонияда кристалданатын алмас, гексагондық сингониядағы – графит, олардың формуласы
– С, физикалық қасиеттері әртүрлі.
Полиморфизм модификациялары: кальцит (тригондық) – арагонит (ромбылық), формулалары CaCO3; пирит (кубтық) – марказит (ромбылық), формулалары – FeS2; кварцта 7 полиморфтық модификациялары бар.
Полиморфизм 2 түрге бөлінеді. Бірінші түрі – энантиотропия. Полиморфтық модификациялардың белгілі бір температура мен қысымда бір түрден екінші түріне ауысуы. Мысалы, кварцтың тридимитке, алмастың графитке ауысуы.
Полиморфизм модификациялары: кальцит (тригондық) – арагонит (ромбылық), формулалары CaCO3; пирит (кубтық) – марказит (ромбылық), формулалары – FeS2; кварцта 7 полиморфтық модификациялары бар.
Полиморфизм 2 түрге бөлінеді. Бірінші түрі – энантиотропия. Полиморфтық модификациялардың белгілі бір температура мен қысымда бір түрден екінші түріне ауысуы. Мысалы, кварцтың тридимитке, алмастың графитке ауысуы.
Слайд 16
Екінші түрі – монотропия.
Бір полиморфтық модификация екінші түрге ауысуы, екінші
түрден бірінші түрге қайта ауысу мүмкін емес. Мысалы, марказиттің пиритке ауысуы, пириттен марказитке ауысу мүмкін емес.
Слайд 17Минералдардың химиялық құрамы және формуласы (эмпирикалық және құрылымдық). Минералдардың барлық физикалық
қасиеттері: тығыздығы, қаттылығы, түсі және т.б. – олардың химиялық құрамына байланысты болады. Минералдардың белгілі бір минералдық топқа жатқызу үшін пайдаланатын басты және тұрақты шама – оның кристаллохимиялық құрылымы. Бұл шама минералдың химиялық формуласын жазу арқылы анықталады. Минералдың химиялық құрамын анықтау үшін химиялық талдау жасайды. Осы талдаудын нәтижесін есептеп минералдың формуласын анықтайды.
Слайд 18Минералдардың формулалары эмпирикалық және құрылымдық болып екі түрге бөлінеді.
Эмпирикалық формула минералды
құрайтын әртүрлі элементтер сандық құрамын анықтағанымен, сол минерал түзетін элементтердің өз ара байланысы және ара қатынастары туралы мәліметтер бермейді.
Мысалы, мусковиттің эмпирикалық формуласы H2KAl3Si3O12, ал құрылымдық – KAl2[AlSi3O10](OH,F)2.
Мысалы, мусковиттің эмпирикалық формуласы H2KAl3Si3O12, ал құрылымдық – KAl2[AlSi3O10](OH,F)2.
Слайд 19Құрылымдық формула минералдың химиялық құрамын, оны құрайтын элементтердің өз ара байланыстарын,
толық көрсетеді.
Құрылымдық формуланы жазғанда минералдағы аниондық және катиондық кешендерді көрсету керек. Өзара жақын байланыстағы атомдар бөлек немесе жай жақшамен, ал радикалдар шаршы жақшамен бөлінеді. Элементтер және олардың изоморфтық қоспалары жай жақшаға алынып, бір-бірінен үтір арқылы бөлінеді. Кристаллохимиялық саны көп элементтер, бірінші орынға қойылады.
Құрылымдық формуланы жазғанда минералдағы аниондық және катиондық кешендерді көрсету керек. Өзара жақын байланыстағы атомдар бөлек немесе жай жақшамен, ал радикалдар шаршы жақшамен бөлінеді. Элементтер және олардың изоморфтық қоспалары жай жақшаға алынып, бір-бірінен үтір арқылы бөлінеді. Кристаллохимиялық саны көп элементтер, бірінші орынға қойылады.
Слайд 20Мысалы, сидерит Fe[СО3], микроклин К[А1Si3О8], апатит Ca5[PO4]3(F,Cl,OH) және т.б.
Көп тараған
әдістердің бірі – минералдардың формуласын оттек бойынша есептеу. Химиялық тараптамалардың мәліметтері бойынша, минералдардың химиялық формуласы шығарылады. Формуланы есептеу үшін оттекті қоспалардың оксидтерінің молекулалық массалар және сульфидтер элементтерінің атомдық массалар кесте анықтамалары қажет болады. Анықталған сульфидтер минералдарының элементтер пайыздық мөлшері, олардың атомдық немесе молекулалық сандарыңа бөледі. Осылай, әр элементке сәйкес, коэффициенті табады. Минерал формуласы осы коэффициентке сәйкес құрастыралады, кестеде үлгілері көрсетілген (2 кесте).
Слайд 22Коллоидтық жүйелер
Жер қыртысында жаратылысы әлі де болса толық ашылмаған коллоидты минералдар
деп аталатын түзілімдер кең тараған. Олардың ең басты диагностикалық белгісі – түйіршектерінің өлшемінде. Егер кристалды минералдардың ең ұсағы 10-4 см болса, коллоидтық минералдардың ұсақтығы 10-5-10-7 см.
Коллоидтық минералдарға тән тағы бір қасиет олардың гетерогендігі – көп фазалығы. Басқа сөзбен айтқанда олардың құрамында дисперстік фаза және дисперстік орта бар.
Дисперстік фаза коллоидтық көлемдегі минерал бөлшектерінен тұрса, дисперстік орта – су және сулы ерітінділер (гидрозольдер).
Коллоидтық минералдарға тән тағы бір қасиет олардың гетерогендігі – көп фазалығы. Басқа сөзбен айтқанда олардың құрамында дисперстік фаза және дисперстік орта бар.
Дисперстік фаза коллоидтық көлемдегі минерал бөлшектерінен тұрса, дисперстік орта – су және сулы ерітінділер (гидрозольдер).
Слайд 23Егер жүйеде дисперстік орта басым болса ондай қосындыларды коллоидтық ерітінділер деп
атайды.
Табиғатта коллоидтық ерітінділер таужыныстары мен минералдардың механикалық үгітілу процестерінде, минералдық бөлшектердің химиялық реакциялар нәтижесінде коллоидтық мөлшерге дейін ыдырауынан, мору процесінде тотығу, ыдырау, гидролиз белдемдерде пайда болады.
Коллоидтық түйіршектер мицелл деп аталады. Олар әдетте бір таңбалы электр ұшқынымен зарядталған. Ерітінді арқылы электр тоғын өткізгенде мицеллдер электродтарға жабысып бөлініп шығады. Бұл құбылыс электрофорез деп аталады.
Табиғатта коллоидтық ерітінділер таужыныстары мен минералдардың механикалық үгітілу процестерінде, минералдық бөлшектердің химиялық реакциялар нәтижесінде коллоидтық мөлшерге дейін ыдырауынан, мору процесінде тотығу, ыдырау, гидролиз белдемдерде пайда болады.
Коллоидтық түйіршектер мицелл деп аталады. Олар әдетте бір таңбалы электр ұшқынымен зарядталған. Ерітінді арқылы электр тоғын өткізгенде мицеллдер электродтарға жабысып бөлініп шығады. Бұл құбылыс электрофорез деп аталады.
Слайд 24Мицелдердің таңбалары ертінді құрамының ерекшелігіне қарай, мысалы, оң таңбалы – қышқыл
ортада, теріс таңбалы – сілтілі ортада өзгеріп отырады. Зарядтарын жоғалтқан кезде коллоидтық түйіршіктер бір-бірімен жабысып іріленеді. Мұндай процесс каогуляция (қоюлану) деп аталады. Белгілі мөлшерде каогуляция нәтижесінде қоюланып, қозғалысын тоқтатқан мицеллдерді гель деп атайды. Гельдердің ең басты қасиеті – ерітіндіден өз денесіне әртүрлі заттарды сорып алу қабілеттілігі (адсорбция).
Слайд 25Коллоидтық жүйелердің пайда болуы минералдардың жаратылу жағдайына, әсіресе, олардың пайда болу
температурасына, құрылымына және құрамына байланысты. Жоғары температурада коллоидтар түзілмейді. Уақыт өткен сайын гельдер сусызданып қатая бастайды. Аморфтық гельдер біртіндеп алдымен жасырын кристалды, содан соң толық кристалды қалыпқа келеді. Гельдерден пайда болған минералдарды метаколлоидтық минералдар деп атайды.
Слайд 26Олар өздерінің сырт пішіндері мен іш құрылымына қарай бөлінеді. Оларға саустанған,
бүйрек тәріздес және жұмыртқа тәріздес іш құрылымы ала, сақина тәріздес, радиалды – сәулелі минерал агрегаттары, оолиттер, тасберіштер, сталактиттер және т.б. жатады. Алуан түсті ақықтар қабат-қабат ритмикалық жолақтардан тұрады. Олар диффузиялық жолмен жаралған лизеганг сақиналары деп аталатын түзілімдер. Коллоидтық минералдардың ішіндегі табиғатта ең көп тарағаны: кремнезем гелі – опал, темірдің, марганецтің және т.б. металдардың сулы тотықтары.
Слайд 27 Минералдардағы су. Минералдар табиғатта сусыз және сулы болып 2 түрге бөлінеді.
Сулы минералдарға өзінің құрамында электрлік бейтарап жағдайда су молекуласы бар минералдар жатады.
Бос сулар минералдардың кристалдық торын құруға қатыспайды. Температуралық жағдайға байланысты олар минералдардың кристалдық торы құрылымына қатыспайды. Мысалы, цеолиттердегі су. Минералдардың ұсақ жарықшаларында сақталатын гигроскопиялық сулар, олар кристалдық торына қатыспайды. Минералды 110ºС қыздырған кезде олар буға айналып ұшып кетеді.
Бос сулар минералдардың кристалдық торын құруға қатыспайды. Температуралық жағдайға байланысты олар минералдардың кристалдық торы құрылымына қатыспайды. Мысалы, цеолиттердегі су. Минералдардың ұсақ жарықшаларында сақталатын гигроскопиялық сулар, олар кристалдық торына қатыспайды. Минералды 110ºС қыздырған кезде олар буға айналып ұшып кетеді.
Слайд 28Конституциялық су – минерал ішіндегі ең берік орналасқан су. Ол иондарға
жіктеліп, ОН-1, Н+1, H3O+1 түрінде кристалдық тордың құрылысынан орын алған су бөлшектері. Мысалы, тальк Mg3[Si4O10](OH)2, топаз Al2[SiO4](F,OH)2.
Кристаллизациялық су – кристалдық торға жіктелмеген тұтас су молекуласы (H2O) түрінде кірілген су. Ондай суы бар минералдарды, кристаллогидраттар деп атайды, 3000 қыздырғанда суы шығып кетеді. Кейбір кристалдың ішкі құрылысы кеуекті, қуысты болады, су молекуласы сол қуыстан орын алады. Су кепкеннен соң, минерал сол қалыбында қалады.
Кристаллизациялық су – кристалдық торға жіктелмеген тұтас су молекуласы (H2O) түрінде кірілген су. Ондай суы бар минералдарды, кристаллогидраттар деп атайды, 3000 қыздырғанда суы шығып кетеді. Кейбір кристалдың ішкі құрылысы кеуекті, қуысты болады, су молекуласы сол қуыстан орын алады. Су кепкеннен соң, минерал сол қалыбында қалады.
Слайд 29Осындай жағдайда кристаллизация суын цеолиттік су деп атайды, өйткені, цеолиттік су
минералдар тобында кристалл құрылысына әсер етпейтің су болады.
Мысалы, гипс Са[SO4]2H2O, сода Na2[C0]10H2O, гидроборацит CaMgB6O116H2O және т.б.
Абсорциялық су – минералға механикалық жолмен араласқан (сінген) су молекуласы. Ол тұрақты емес, минералды 1100 - қа қыздырғанда бөлініп кетеді. Ол, қабатты құрылымы бар, минералдар қабаттарының бетінен орын алады. Минерал ісініп және көлемі өседі, мысалы монтмориллонит (Аl2Mg3)[Si4O10](OH)2nH2O.
Адсорбциялық су сінгенде, оның жеке қабаттарының қалындығы 9,6 Ǻ нен 28,4 Ǻ -ге дейін өседі.
Мысалы, гипс Са[SO4]2H2O, сода Na2[C0]10H2O, гидроборацит CaMgB6O116H2O және т.б.
Абсорциялық су – минералға механикалық жолмен араласқан (сінген) су молекуласы. Ол тұрақты емес, минералды 1100 - қа қыздырғанда бөлініп кетеді. Ол, қабатты құрылымы бар, минералдар қабаттарының бетінен орын алады. Минерал ісініп және көлемі өседі, мысалы монтмориллонит (Аl2Mg3)[Si4O10](OH)2nH2O.
Адсорбциялық су сінгенде, оның жеке қабаттарының қалындығы 9,6 Ǻ нен 28,4 Ǻ -ге дейін өседі.
Слайд 30Сульфидтер класының жалпы сипаттамасы
Сульфидтердің 250 аса түрлері белгілі, ал Жер қойнауында
оның мөлшері 0,15 % құрайды. Кен тарағандары 20- ға жуық. Ең көп кездесетін пирит пен пирротин болады, олардың үлесіне барлық белгілі сульфидтердің арасынан 4/5 бөлігі кіреді.
Сульфидтердің рөлі өте маңызды, олар түсті, асыл және көптеген сирек металдардың шикізаты болады. Олардың электрофизикалық және оптикалық қасиеттеріне ерекше көніл бөлінеді. Оларды өткігіштер ретінде пайдалану үшін монокристалдар түрінде өсіреді. Химиялық көз қарастан, олар күкірт сутегінен жаралған болады.
Сульфидтердің рөлі өте маңызды, олар түсті, асыл және көптеген сирек металдардың шикізаты болады. Олардың электрофизикалық және оптикалық қасиеттеріне ерекше көніл бөлінеді. Оларды өткігіштер ретінде пайдалану үшін монокристалдар түрінде өсіреді. Химиялық көз қарастан, олар күкірт сутегінен жаралған болады.
Слайд 31Нақты күкіртпен қоспалар түзетін темір, мырыш, қорғасын, мыс, сурьма, молибден, сынап,
күшәла, кобальт, никель, және т.б. Сульфидтердің құрамына изоморфты қоспалар түрінде кіретіндер: кадмий, индий, галлий, рений, таллий.
Сульфидтердің барлығына металша жылтырлық, үлкен тығыздық тән, электро және жылу өткізгіштікпен және сипатталады, олар мортты болады. Жиі түйіршекті агрегаттар түрінде кездеседі және сеппелер түзеді.
Сульфидтердің барлығына металша жылтырлық, үлкен тығыздық тән, электро және жылу өткізгіштікпен және сипатталады, олар мортты болады. Жиі түйіршекті агрегаттар түрінде кездеседі және сеппелер түзеді.
Слайд 32 Жаратылыстары (генезистері): гидротермалық, магмалық (халькопирит, пирит, пирротин, пентландит), скарндық (халькопирит, галенит,
сфалерит, пирротин), экзогендік (галенит, сфалерит, пирит).
Сульфидтер тотыққан кезде бұзылады, олар тотығу белдемді сипаттайтын біріншіден сульфаттарды, кейін сулы тотықтарды, тотықтарды, карбонаттарды және сомтума металдарды түзеді.
Сульфидтер маңызды кендер болады, олардан қорғасын (галенит PbS), мырыш (сфалерит ZnS), мыс (халькопирит CuFeS2), сынап (киноварь HgS), сурьма (антимонит Sb2S3), күшәла (арсенопирит FeAsS,
Сульфидтер тотыққан кезде бұзылады, олар тотығу белдемді сипаттайтын біріншіден сульфаттарды, кейін сулы тотықтарды, тотықтарды, карбонаттарды және сомтума металдарды түзеді.
Сульфидтер маңызды кендер болады, олардан қорғасын (галенит PbS), мырыш (сфалерит ZnS), мыс (халькопирит CuFeS2), сынап (киноварь HgS), сурьма (антимонит Sb2S3), күшәла (арсенопирит FeAsS,
Слайд 33аурипигмент As2S3, реальгар AsS), молибден (молибденит MoS2), никель (пентландит (Fe,Ni)9S8), кадмий,
германий (сфалерит), рений (молибденит, халькопирит) шығарады. Одан басқа, сульфидтер күкірт қышқылын шығаратын көз болады (пирит FeS2) және бояу өндіруге пайдаланады (аурипигмент, киноварь).
Сульфид минералдары мен кендерді зерттегенде, оларды мөлдірлігінің нашарлығына және металша жылтырлығының күштілігіне қарай айырады. Дәл диагностика жасай алмаған кезде микроскопты қолданып зерттейді.
Сульфид минералдары мен кендерді зерттегенде, оларды мөлдірлігінің нашарлығына және металша жылтырлығының күштілігіне қарай айырады. Дәл диагностика жасай алмаған кезде микроскопты қолданып зерттейді.







![Бұл қатардың шеткі мүшелері анортит Ca[Al2Si2O8] және альбит Na[AlSi3O8]. Плагиоклаздардың үздіксіз изоморфизм қатары](/img/tmb/4/336373/b0b913722d1a1d5376b8357869355227-800x.jpg)











![Мысалы, сидерит Fe[СО3], микроклин К[А1Si3О8], апатит Ca5[PO4]3(F,Cl,OH) және т.б. Көп тараған әдістердің бірі – минералдардың](/img/tmb/4/336373/63481eaca720e762c06ec4f03e6a5dcf-800x.jpg)