- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Растворимость. Равновесие системы осадок-раствор презентация
Содержание
- 1. Растворимость. Равновесие системы осадок-раствор
- 2. Растворимость К нерастворимым относят вещества, растворимость которых
- 3. Равновесие системы «осадок-раствор» AgCl(тв)=Ag+(водн.) + Cl—(водн.) K
- 4. Ненасыщенный раствор Ненасыщенным называют раствор, концентрация которого меньше, чем у насыщенного (при данной температуре) раствора.
- 5. Насыщенный раствор Насыщенным (при данной температуре) называют
- 6. Пересыщенный раствор Пересыщенный раствор содержит растворенного вещества больше, чем требуется для насыщения при данной температуре.
- 7. Диаграмма растворимости ABC - кривая растворимости
- 8. Растворимость твердых веществ в жидкостях (Ж1 +
- 9. Виды диаграмм растворимости Возможно 3 случая: ΔHM
- 10. Взаимная растворимость жидкостей Неограниченная взаимная растворимость (вода
- 11. Ограниченная взаимная растворимость в системе вода –
- 12. Экстракция иода керосином из водного раствора
Слайд 2Растворимость
К нерастворимым относят вещества, растворимость которых меньше 0,001 моль/л:
сульфиды, гидроксиды, сульфиты,
к малорастворимым − вещества с растворимостью 0,001-0,1 моль/л:
Карбонат, фторид и фосфат лития
к растворимым − вещества с растворимостью более 0,1 моль/л.
почти все ацетаты, нитраты и тиоцианаты металлов и аммония, хлориды, бромиды и иодиды металлов и аммония, кроме галогенидов свинца(II), меди(I), ртути(I) и серебра(I); сульфаты металлов, за исключением сульфатов щелочноземельных металлов, свинца и серебра.
Количественно растворимость измеряется как концентрация насыщенного раствора
Растворимость – это способность вещества растворяться в данном растворителе при заданной температуре.
Слайд 3Равновесие системы «осадок-раствор»
AgCl(тв)=Ag+(водн.) + Cl—(водн.)
K = [Ag+][ Cl—]
Произведение растворимости равно произведению молярных
Слайд 4Ненасыщенный раствор
Ненасыщенным называют раствор, концентрация которого меньше, чем у насыщенного (при
Слайд 5Насыщенный раствор
Насыщенным (при данной температуре) называют раствор, который находится в равновесии
Устанавливается фазовое равновесие: растворяемое вещество ⇄ раствор
Слайд 6Пересыщенный раствор
Пересыщенный раствор содержит растворенного вещества больше, чем требуется для насыщения
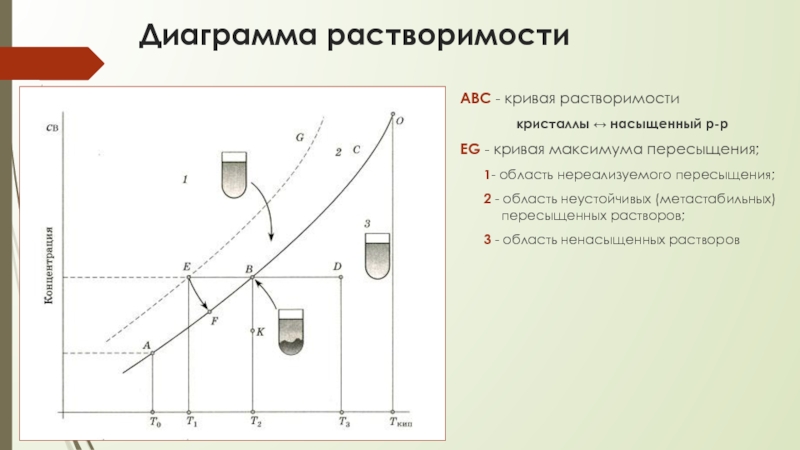
Слайд 7Диаграмма растворимости
ABC - кривая растворимости
кристаллы ↔ насыщенный р-р
EG - кривая
1- область нереализуемого пересыщения;
2 - область неустойчивых (метастабильных) пересыщенных растворов;
3 - область ненасыщенных растворов
Слайд 8Растворимость твердых веществ в жидкостях (Ж1 + Т2)
Для смешения: ΔGM =
Энтропийный фактор:
ΔSM • 0; если T↑, (TΔSM)↓
Энтальпийный фактор:
ΔHM = ΔHкр + ΔHс + ΔHр
ΔHкр – разрушение кристаллической решетки (эндотермич.)
ΔHс – сольватация (экзотермич.)
ΔHр – разрушение структуры растворителя (эндотермич.), ≈0
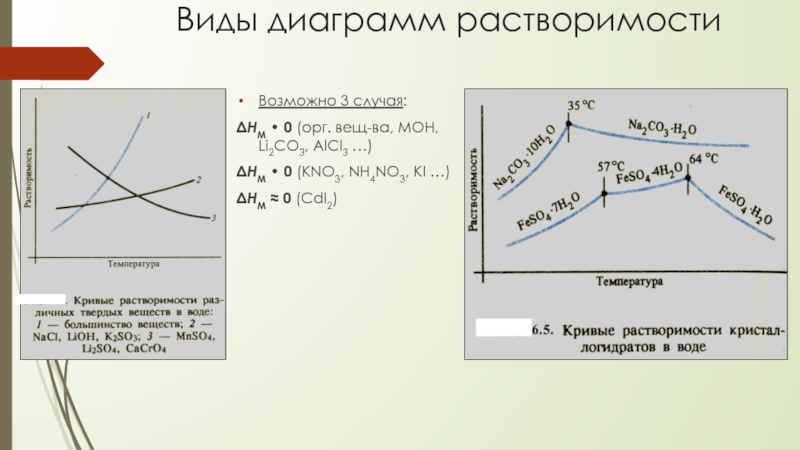
Слайд 9Виды диаграмм растворимости
Возможно 3 случая:
ΔHM • 0 (орг. вещ-ва, МОН, Li2CO3,
ΔHM • 0 (KNO3, NH4NO3, KI …)
ΔHM ≈ 0 (CdI2)
Слайд 10Взаимная растворимость жидкостей
Неограниченная взаимная растворимость (вода и этанол, вода и серная
Практически полная нерастворимость (вода и бензол, вода и CCl4 и др.)
Ограниченная взаимная растворимость
Закон распределения: Вещество, способное растворяться в двух несмешивающихся растворителях, распределяется между ними так, что отношение его концентраций в этих растворителях при постоянной температуре остается постоянным, независимо от общего количества растворенного вещества:
С1/С2 = К,
где С1 и С2 – концентрации вещества в двух жидкостях
К – коэффициент распределения.
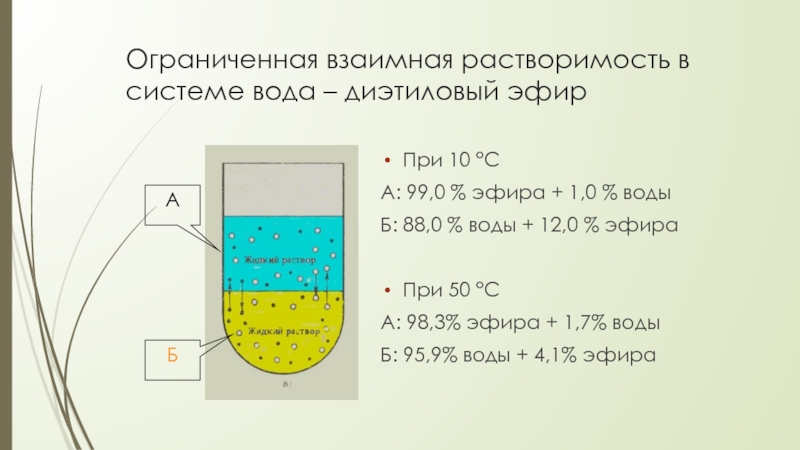
Слайд 11Ограниченная взаимная растворимость в системе вода – диэтиловый эфир
При 10 °С
А: 99,0 % эфира + 1,0 % воды
Б: 88,0 % воды + 12,0 % эфира
При 50 °С
А: 98,3% эфира + 1,7% воды
Б: 95,9% воды + 4,1% эфира
А
Б


![Равновесие системы «осадок-раствор»AgCl(тв)=Ag+(водн.) + Cl—(водн.)K = [Ag+][ Cl—] Произведение растворимости равно произведению молярных концентраций ионов, участвующих в](/img/tmb/2/181617/8a669526459e1e3b2b448b272d951c9e-800x.jpg)