- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Поверхневі явища. Адсорбція презентация
Содержание
- 1. Поверхневі явища. Адсорбція
- 2. План Поверхневі явища Поверхнева енергія Поверхневий натяг
- 3. Поверхневі явища Це процеси, які проходять на
- 4. Поверхневі молекули рідини завжди перебувають під дією
- 5. Поверхнева енергія Gs Важливою характеристикою поверхневої фази
- 6. Поверхневий натяг σ Для характеристики поверхні поділу,
- 8. Поверхнево-активні речовини (ПАР) ПАР - це
- 9. Поверхнево-активні речовини
- 10. полярна частина направлена в полярне середовище,
- 12. Правило Дюкло -Траубе Поверхнева активність дифільних молекул
- 13. Характеристика сорбції поглинання однієї речовини іншою речовиною
- 14. В розчинах поверхневоакти- вних речовин взаємодія між
- 15. Рівняння Гіббса поверхнева активність Якщо поверхнева
- 16. При T= const будується ізотерма адсорбції. При
- 17. Хімічна адсорбція здійснюється за хімічної взаємодії
- 18. Адсорбція газів на твердих поверхнях Виражають в
- 19. Адсорбція з розчинів: Молекулярна – залежить
- 20. Правило вирівнювання полярності фаз (правило Ребіндера): Розчинена
- 21. Правило Пескова-Фаянса або правило вибіркової адсорбції
- 22. Правило Пескова-Фаянса Друге правило. На твердій поверхні
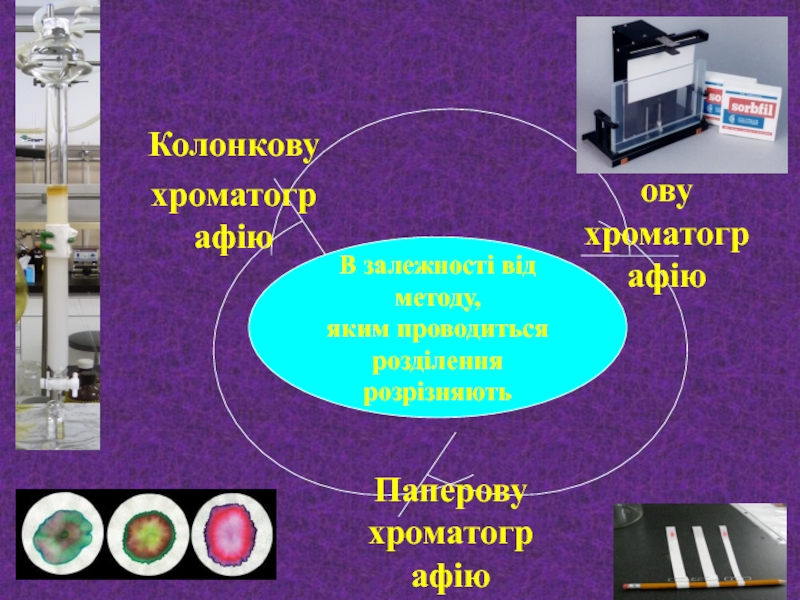
- 24. Хроматографічний метод Окрім свого головного завдання –
- 25. Залежно від агрегатного стану рухомої фази розрізняють рідинну хроматографію газову хроматографію
- 26. За механізмом розділення є такі види хроматографії: адсорбційна розподільна йонообмінна афінна
- 27. : В залежності від методу, яким проводиться розділення розрізняють
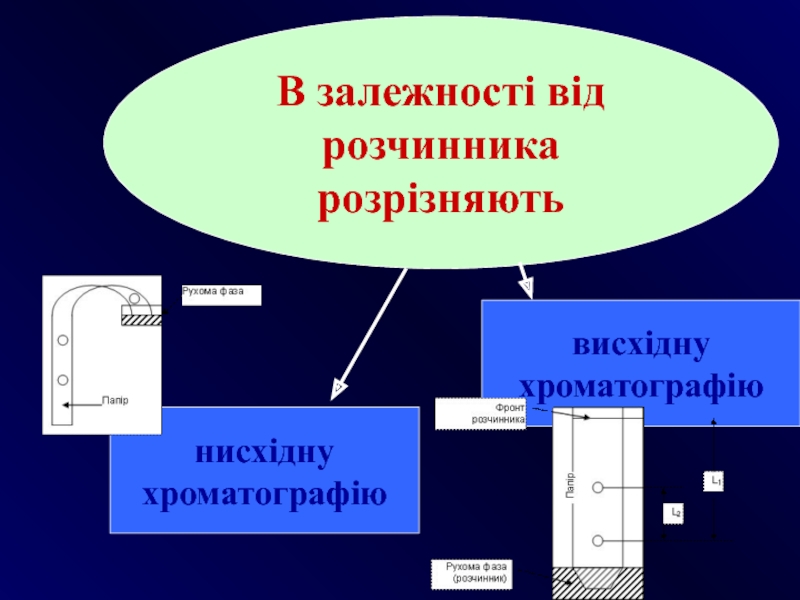
- 28. В залежності від розчинника розрізняють нисхідну хроматографію висхідну хроматографію
Слайд 2План
Поверхневі явища
Поверхнева енергія
Поверхневий натяг
Правило Дюкло – Траубе
Характеристика сорбції
Правило Пескова - Фаянса
Слайд 3Поверхневі явища
Це процеси, які проходять на межі розділення фаз в гетерогенних
Властивості молекул в поверхневому шарі і в об’ємі системи істотно відрізняються між собою.
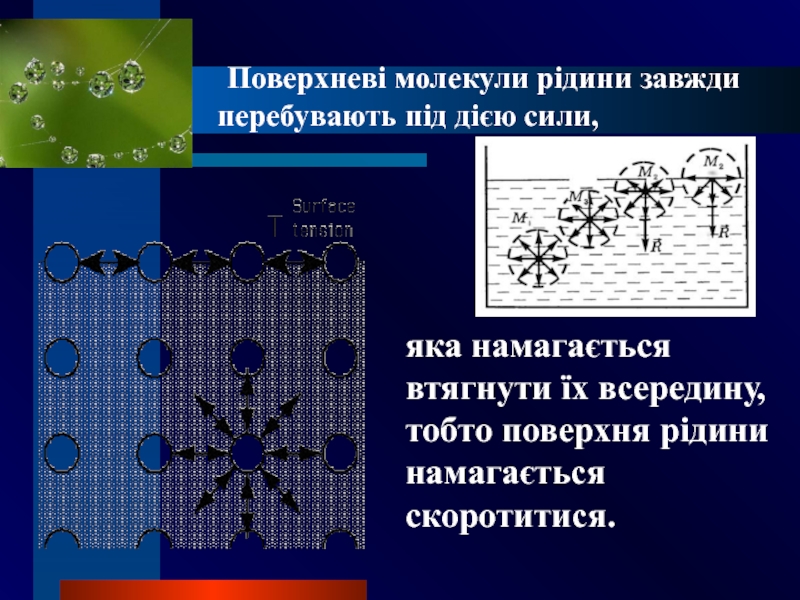
Слайд 4 Поверхневі молекули рідини завжди перебувають під дією сили,
яка намагається втягнути
Слайд 5Поверхнева енергія Gs
Важливою характеристикою поверхневої фази є поверхнева енергія Gs –
G = σ * S
Слайд 6Поверхневий натяг σ
Для характеристики поверхні поділу, що відділяє дану фазу від
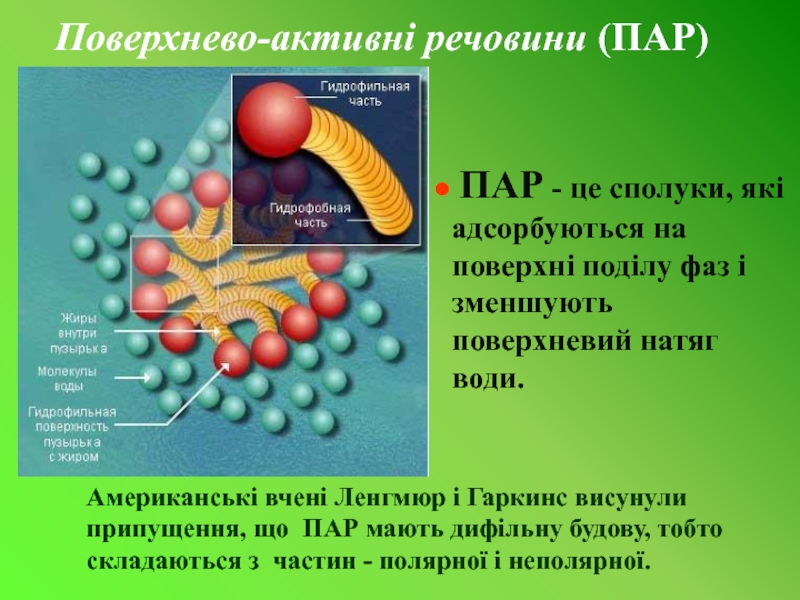
Слайд 8Поверхнево-активні речовини (ПАР)
ПАР - це сполуки, які адсорбуються на поверхні
Американські вчені Ленгмюр і Гаркинс висунули припущення, що ПАР мають дифільну будову, тобто складаються з частин - полярної і неполярної.
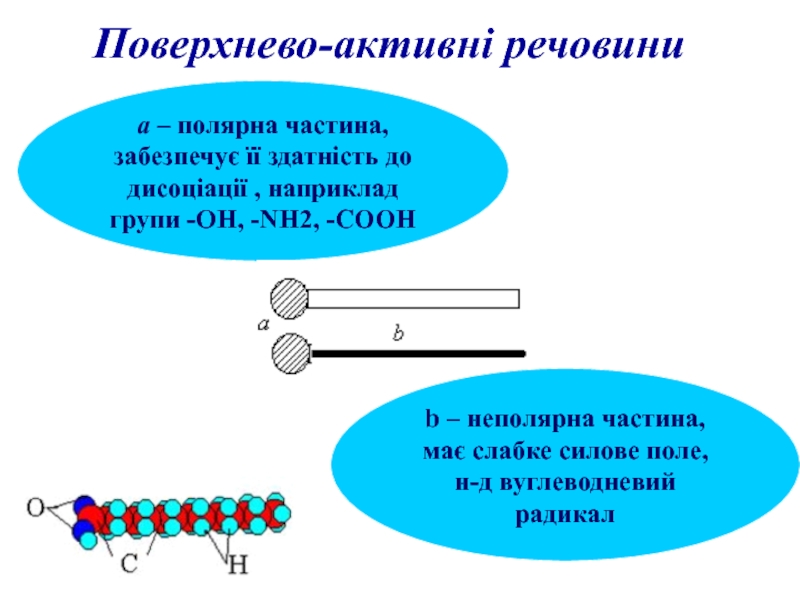
Слайд 9Поверхнево-активні речовини
а – полярна частина,
забезпечує її здатність до
дисоціації , наприклад
групи -ОН, -NH2, -СООН
b – неполярна частина,
має слабке силове поле,
н-д вуглеводневий радикал
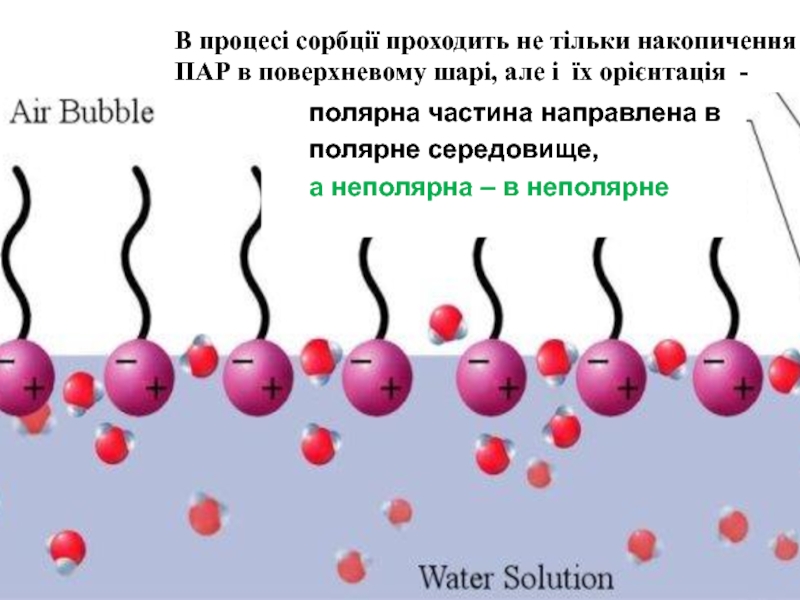
Слайд 10 полярна частина направлена в
полярне середовище,
а неполярна – в неполярне
В
Слайд 12Правило Дюкло -Траубе
Поверхнева активність дифільних молекул зі збільшенням вуглецевого ланцюга на
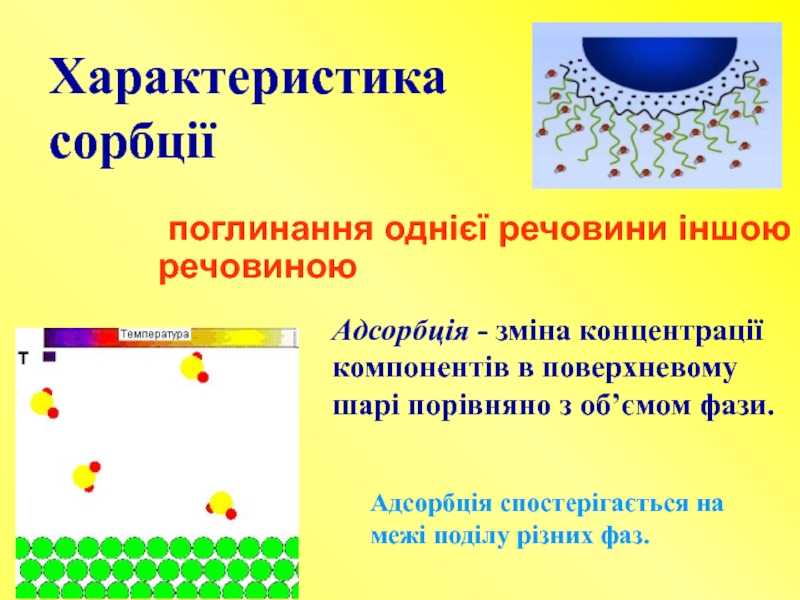
Слайд 13Характеристика сорбції
поглинання однієї речовини іншою речовиною
Адсорбція - зміна концентрації компонентів в
Адсорбція спостерігається на межі поділу різних фаз.
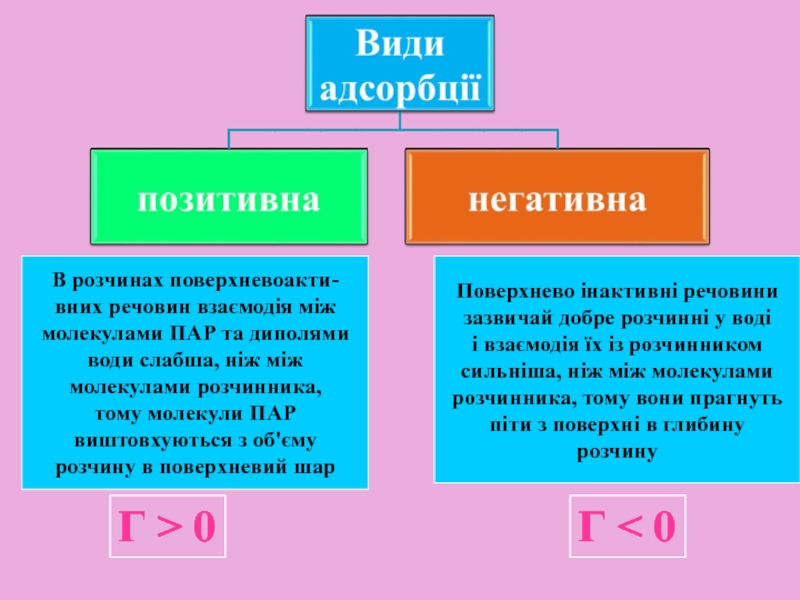
Слайд 14В розчинах поверхневоакти-
вних речовин взаємодія між
молекулами ПАР та диполями
води слабша,
молекулами розчинника,
тому молекули ПАР
виштовхуються з об'єму
розчину в поверхневий шар
Поверхнево інактивні речовини
зазвичай добре розчинні у воді
і взаємодія їх із розчинником
сильніша, ніж між молекулами
розчинника, тому вони прагнуть
піти з поверхні в глибину
розчину
Г > 0
Г < 0
Слайд 15Рівняння Гіббса
поверхнева
активність
Якщо поверхнева активність > 0, тоді адсорбція – негативна,
якщо вона <0, тоді адсорбція – позитивна
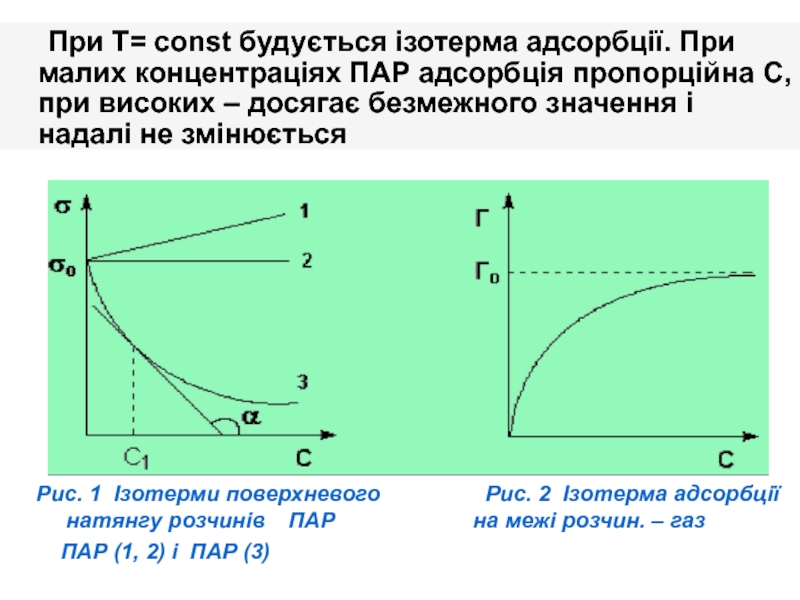
Слайд 16 При T= const будується ізотерма адсорбції. При малих концентраціях ПАР адсорбція
Рис. 1 Ізотерми поверхневого Рис. 2 Ізотерма адсорбції натянгу розчинів ПАР на межі розчин. – газ
ПАР (1, 2) і ПАР (3)
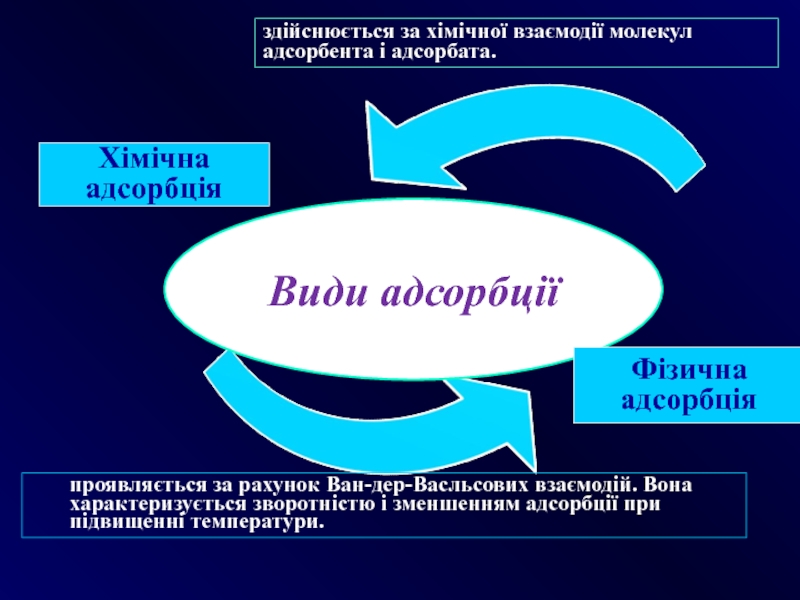
Слайд 17Хімічна
адсорбція
здійснюється за хімічної взаємодії молекул адсорбента і адсорбата.
проявляється за рахунок
Фізична
адсорбція
Слайд 18Адсорбція газів на твердих поверхнях
Виражають в молях адсорбтиву на одиницю маси
Г = Х / m
Х – кількість молей адсорбтиву
m – маса адсорбента
Адсорбція газів залежить від температури. Чим вища температура, тим менша адсорбція (молекули газу мають більшу кінетичну енергію та легше відриваються від молекули адсорбента).
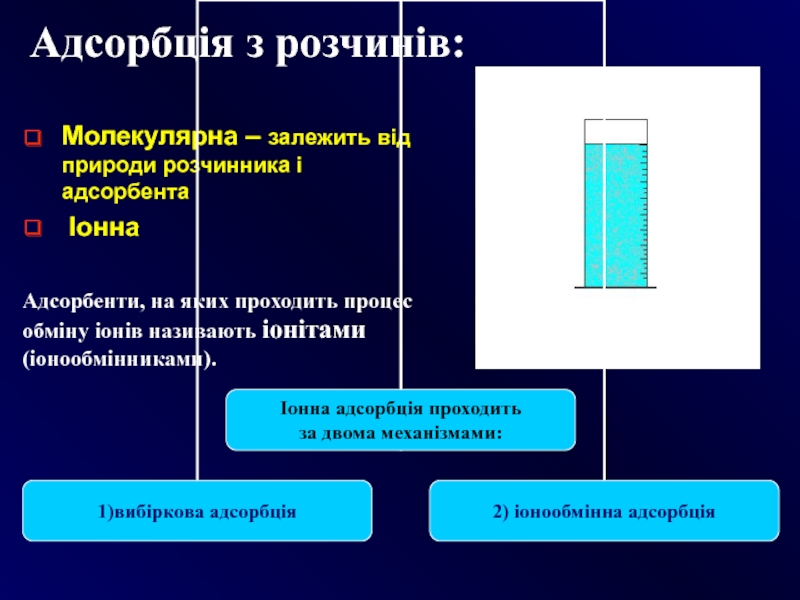
Слайд 19Адсорбція з розчинів:
Молекулярна – залежить від природи розчинника і адсорбента
Іонна
Адсорбенти,
Слайд 20Правило вирівнювання полярності фаз (правило Ребіндера):
Розчинена речовина тим краще адсорбується ,
ПАР з водних розчинів добре адсорбуються на гідрофобних поверхнях, а з неполярних чи малополярних розчинників – на гідрофільних