- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Элементы титан и хром презентация
Содержание
- 1. Элементы титан и хром
- 2. Положение титана в периодической системе химических элементов
- 3. Нахождение в природе Важнейшими
- 4. Получение Поскольку богатых титановых
- 5. Получение Полученный титан содержит примеси.
- 6. Физические свойства Титан — серебристо-белый
- 7. Химические свойства
- 8. Химические свойства При высокой температуре реагирует
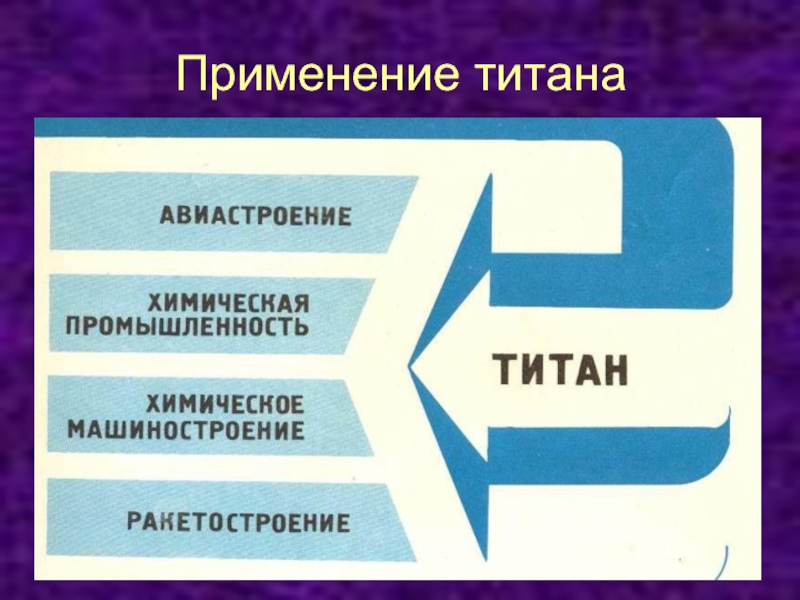
- 9. Применение титана
- 10. Применение Титан и его
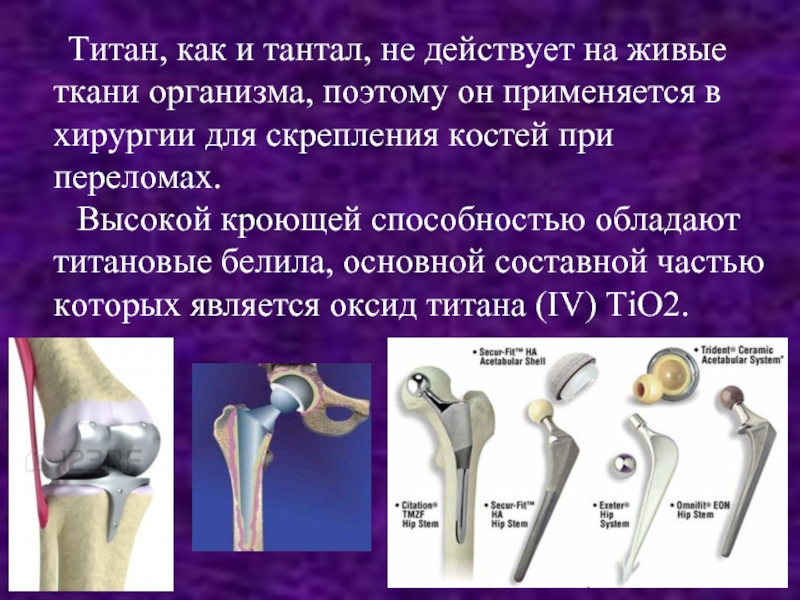
- 11. Титан, как и тантал,
- 18. Реакции происходят тяжело, так как, на поверхности образуется прочная оксидная пленка.
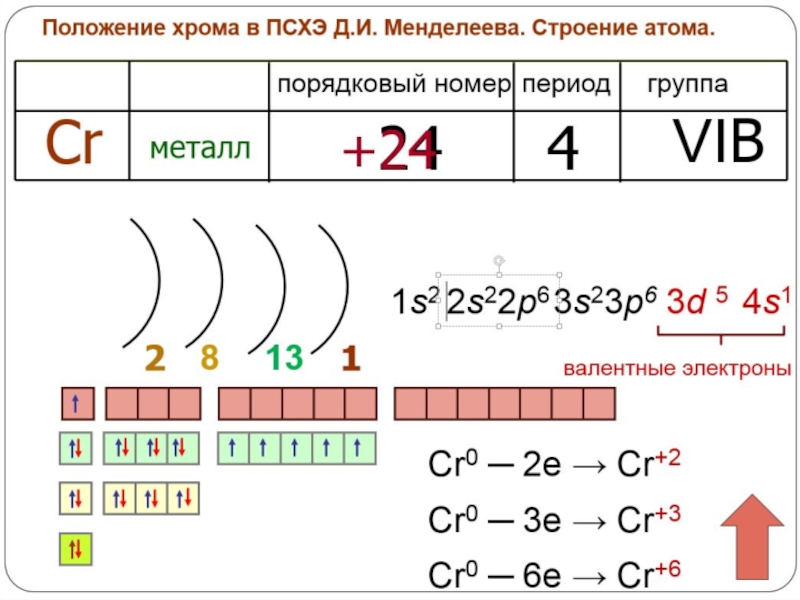
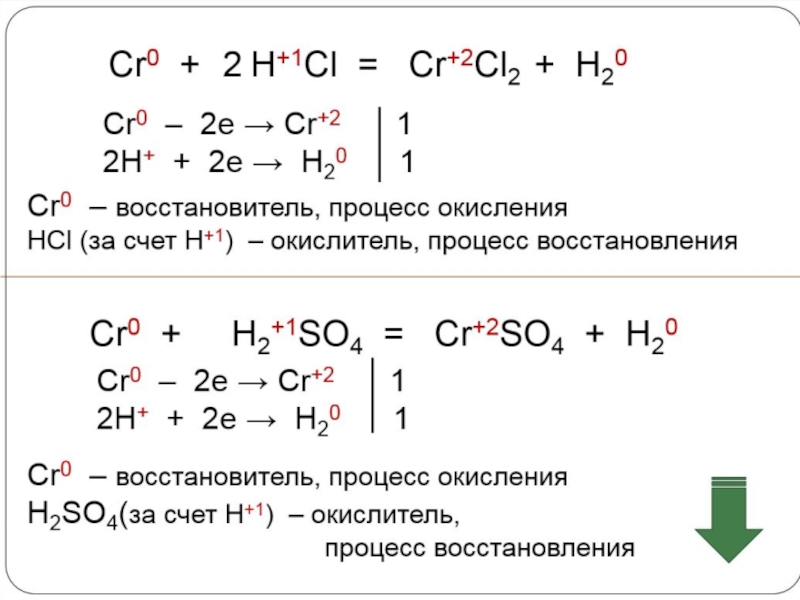
- 21. Хром - постоянная составная
- 22. Хром важный компонент во многих
- 23. Закрепление полученных знаний Найти простейшую формулу оксида хрома, содержащего 68,4 % (массовых) хрома.
Слайд 2Положение титана в периодической системе химических элементов и строение атома.
Титан — элемент главной подгруппы IV группы. Его электронная формула следующая: +22Тi 1s2|2s22p6|3s23p63d2|4s2
Как и у многих других d-элементов, в атоме титана Тi подвижными являются не только электроны наружного энергетического уровня, но и два электрона d-подуровня. Поэтому титан в соединениях проявляет степени окисления + 2 и +4 (реже +3).
Как и у многих других d-элементов, в атоме титана Тi подвижными являются не только электроны наружного энергетического уровня, но и два электрона d-подуровня. Поэтому титан в соединениях проявляет степени окисления + 2 и +4 (реже +3).
Слайд 3Нахождение в природе
Важнейшими минералами, содержащими титан, являются:
титаномагнетиты FeTiO3 *nFe3O4, ильменит FeTiO3, рутил TiO2 и др.
Титановые руды распространены относительно широко, но содержание в них титана небольшое.
Титановые руды распространены относительно широко, но содержание в них титана небольшое.
Слайд 4Получение
Поскольку богатых титановых руд в земной коре нет,
их приходится обогащать.
Для получения титана концентрат обогащенных руд обрабатывают хлором в присутствии углерода:
TiO2+2Cl2+2C=TiCl4+2CO
Затем титан из хлорида титана (IV) восстанавливают натрием или магнием:
Для получения титана концентрат обогащенных руд обрабатывают хлором в присутствии углерода:
TiO2+2Cl2+2C=TiCl4+2CO
Затем титан из хлорида титана (IV) восстанавливают натрием или магнием:
Слайд 5Получение
Полученный титан содержит примеси. Для выделения чистого титана образующуюся
смесь нагревают в вакууме. При этом магний и хлорид магния испаряются. Выделившийся титан переплавляют и получают компактный ковкий металл. Так как при этом производственном процессе используется дорогой металл магний Мg, себестоимость титана сравнительно велика.
Слайд 6Физические свойства
Титан — серебристо-белый металл.
Сравнительно легкий — немного
тяжелее алюминия, но примерно в три раза прочнее его.
Тугоплавкий (1665°С).
В обычных условиях отличается высокой прочностью и вязкостью.
Поддается различным видам обработки.
Тугоплавкий (1665°С).
В обычных условиях отличается высокой прочностью и вязкостью.
Поддается различным видам обработки.
Слайд 7Химические свойства
Титан, как и алюминий, довольно
активный металл. Однако благодаря образованию на поверхности металла плотной защитной оксидной пленки он обладает исключительно высокой стойкостью против коррозии превышающей стойкость нержавеющей стали.
При обычных условиях на титан не действуют ни кислород воздуха, ни морская вода, ни даже царская водка. При повышенной температуре его химическая активность повышается. Так, например, титан реагирует с хлором:
При обычных условиях на титан не действуют ни кислород воздуха, ни морская вода, ни даже царская водка. При повышенной температуре его химическая активность повышается. Так, например, титан реагирует с хлором:
Слайд 8Химические свойства
При высокой температуре реагирует с кислородом:
Азотная кислота на титан
не действует (кроме порошка), но разбавленная серная кислота реагирует с ним:
2Ti + 3H2SO4 → Ti2(SO4)3 + 3H2
Слайд 10Применение
Титан и его сплавы в связи с их
легкостью, прочностью, термической и коррозионной стойкостью применяются для изготовления
деталей самолетов, космических кораблей, ракет, подводных лодок, трубопроводов, котлов высокого давления, различных аппаратов для химической промышленности.
Титан широко используется в виде листов для обшивки корпусов судов, обеспечивающих высокую прочность и стойкость в морской воде.
деталей самолетов, космических кораблей, ракет, подводных лодок, трубопроводов, котлов высокого давления, различных аппаратов для химической промышленности.
Титан широко используется в виде листов для обшивки корпусов судов, обеспечивающих высокую прочность и стойкость в морской воде.
Слайд 11 Титан, как и тантал, не действует на живые
ткани организма, поэтому он применяется в хирургии для скрепления костей при переломах.
Высокой кроющей способностью обладают титановые белила, основной составной частью которых является оксид титана (IV) ТiO2.
Высокой кроющей способностью обладают титановые белила, основной составной частью которых является оксид титана (IV) ТiO2.
Слайд 21 Хром - постоянная составная часть растительных и животных
организмов. В крови содержится от 0,012 до 0,0035 % хрома. Хром имеет большое значение в метаболизме углеводов и жиров, а также участвует в процессе синтеза инсулина. Важнейшая его биологическая роль состоит в регуляции углеводного обмена и уровня глюкозы в крови Элемент способствует нормальному формированию и росту детского организма. Снижение содержания хрома в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови.
Слайд 22 Хром важный компонент во многих легированных сталях. Используется в
качестве износоустойчивых и красивых гальванических покрытий (хромирование) Хром применяется для производства сплавов: хром-30 и хром-90, незаменимых для производства сопел мощных плазмотронов и в авиакосмической промышленности.
Слайд 23Закрепление полученных знаний
Найти простейшую формулу оксида хрома, содержащего 68,4 % (массовых)
хрома.