и бензофурана.
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Гетероциклические соединения природного и синтетического происхождения. Производные фурана и бензофурана. (Лекция 1-2) презентация
Содержание
- 1. Гетероциклические соединения природного и синтетического происхождения. Производные фурана и бензофурана. (Лекция 1-2)
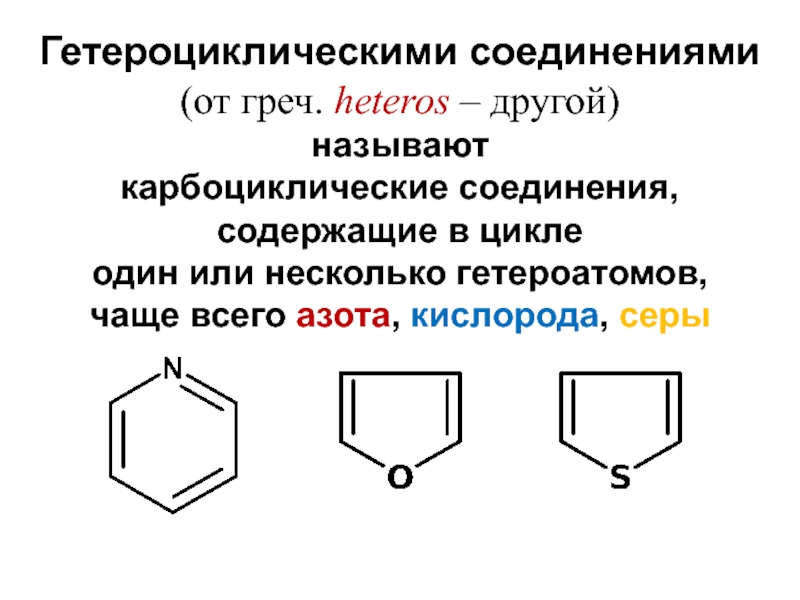
- 2. Гетероциклическими соединениями (от греч. heteros –
- 3. гетероциклы играют важную роль в
- 4. Классификация гетероциклических соединений классификацию гетероциклов
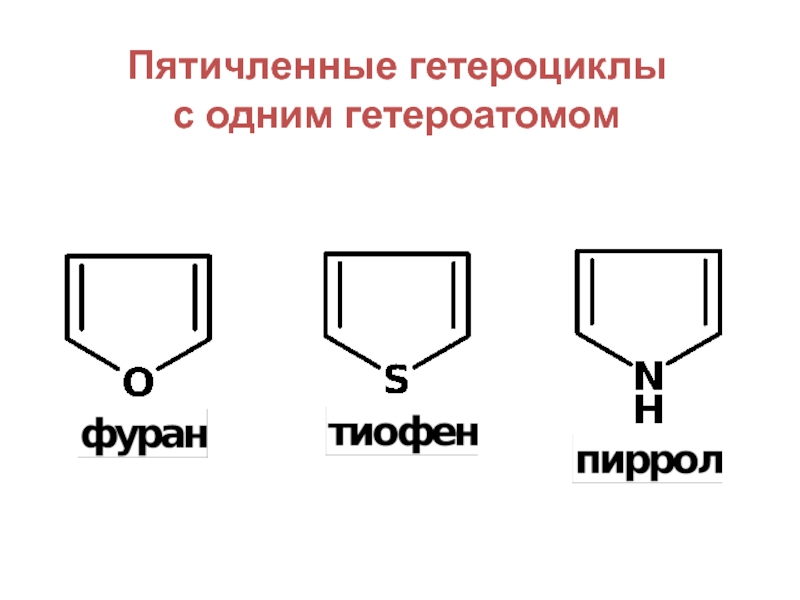
- 5. Пятичленные гетероциклы с одним гетероатомом
- 6. Пятичленные гетероциклы с несколькими гетероатомами
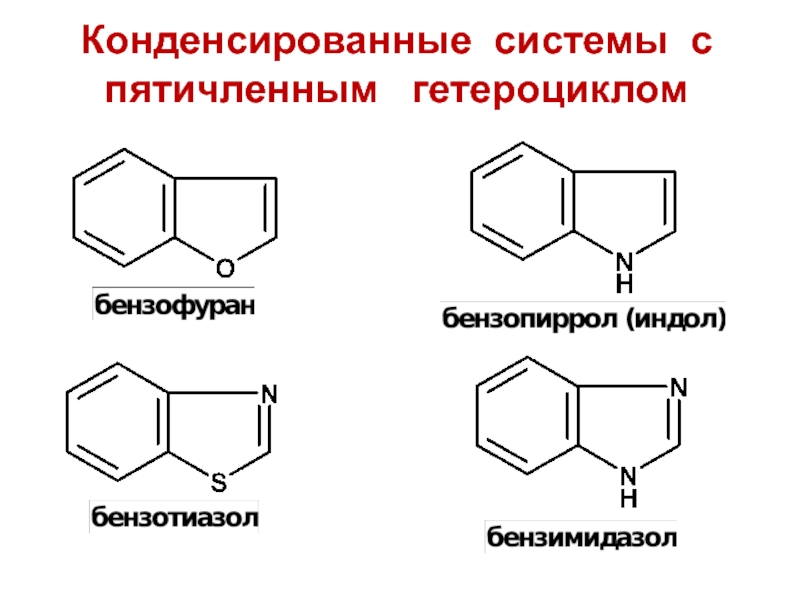
- 7. Конденсированные системы с пятичленным гетероциклом
- 8. Шестичленные гетероциклы
- 9. Для циклов с одинаковыми гетероатомами могут существовать
- 10. Конденсированные системы с шестичленным гетероциклом Многие
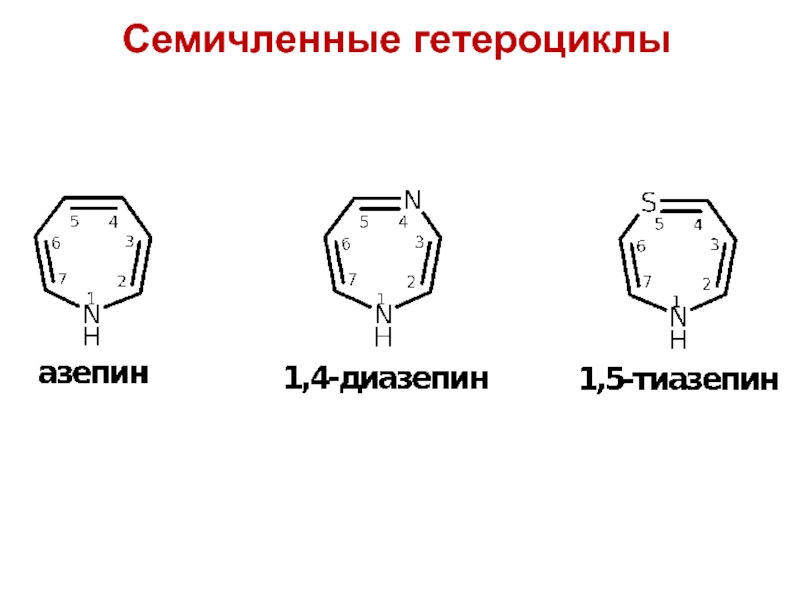
- 12. Семичленные гетероциклы
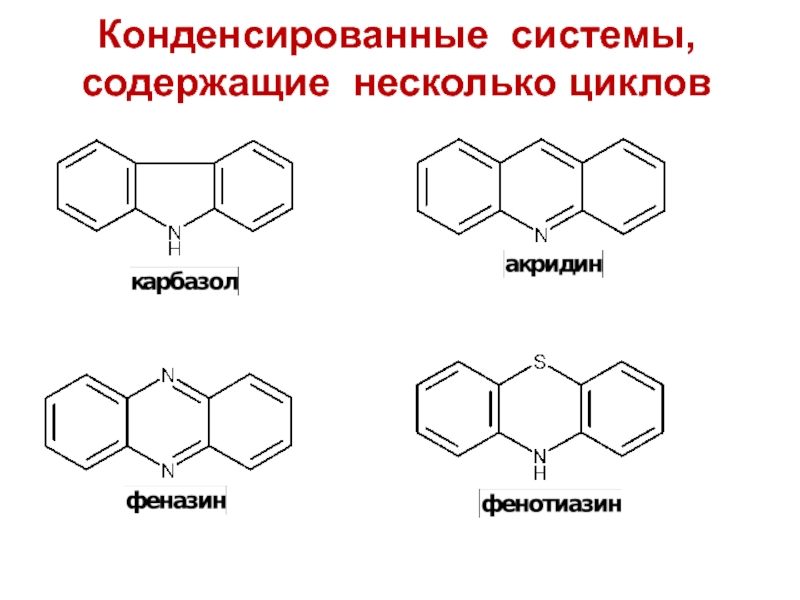
- 13. Конденсированные системы, содержащие несколько циклов
- 14. По химическим свойствам гетероциклические соединения
- 15. Производные фурана По физическим свойствам
- 16. Лекарственные средства, производные фурана Медицинское значение имеют
- 17. Производные 5-нитрофурана
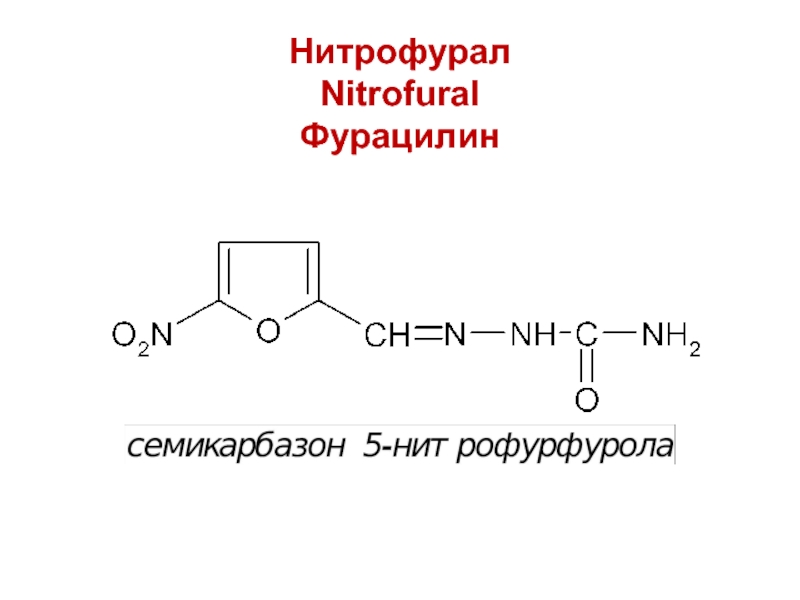
- 18. Нитрофурал Nitrofural Фурацилин
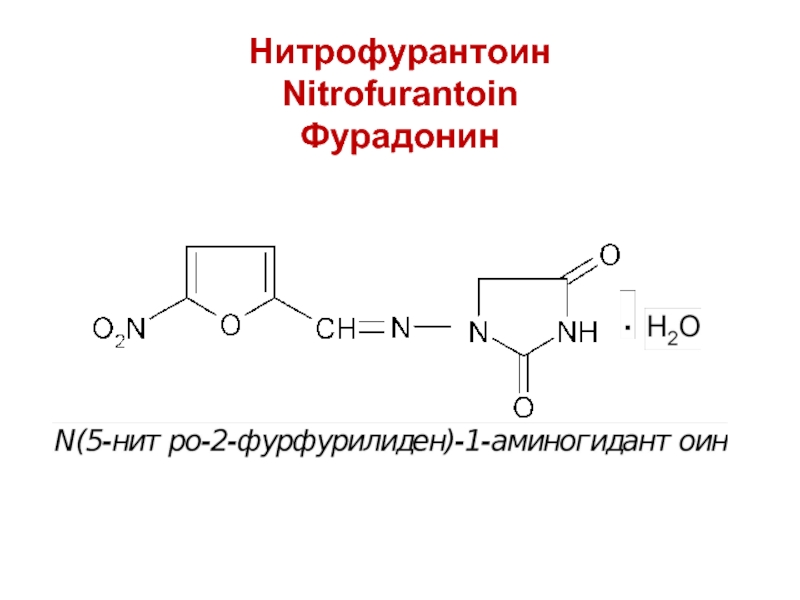
- 19. Нитрофурантоин Nitrofurantoin Фурадонин
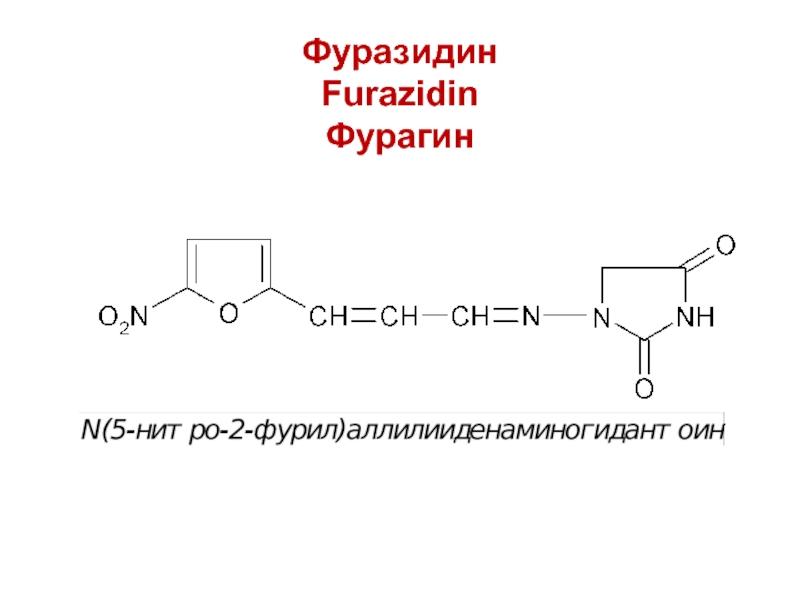
- 20. Фуразидин Furazidin Фурагин
- 21. Нифуроксазид Nifuroxazide
- 22. Исходный продукт синтеза производных 5-нитрофурана
- 23. Далее проводят конденсацию 5-нитрофурфурола с
- 24. Если R-NH2:
- 25. При синтезе фуразидина, у которого азометиновая группа
- 26. Физические свойства Желтые с зеленоватым оттенком
- 27. Кислотно-основные свойства Производные 5-нитрофурана являются веществами
- 28. Нитрофурантоин (фурадонин) проявляет кислотные свойства за
- 29. Кислотные свойства лекарственных веществ группы 5-нитрофурана
- 30. При растворении фурацилина в 10% растворе
- 31. Образование темно-красного окрашивания при действии раствора
- 32. 2. За счет кислотных свойств производные
- 33. Гидролитическое расщепление Данное свойство связано с
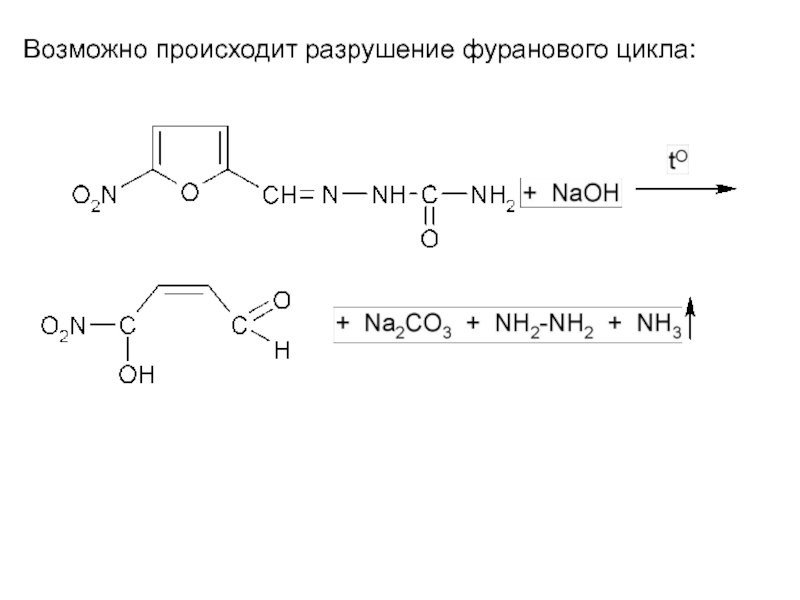
- 34. Возможно происходит разрушение фуранового цикла:
- 35. Окислительно-восстановительные реакции После щелочного гидролиза, сопровождающегося
- 36. Производные 5-нитрофурана можно идентифицировать с помощью
- 37. Методы количественного анализа 1. Кислотно-основное титрование
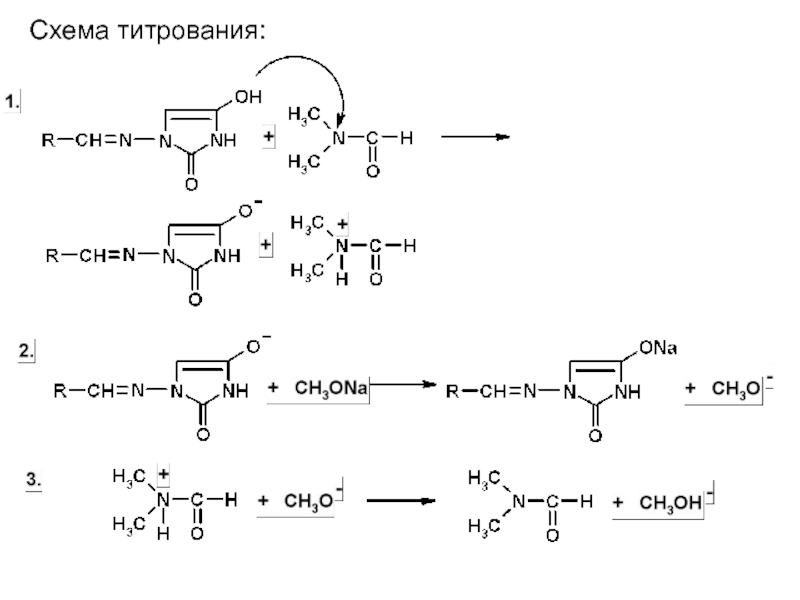
- 38. Схема титрования:
- 39. 2. Йодометрическое определение нитофурала (фурацилина). Определение
- 40. 3. После
- 41. Физико-химические методы анализа Подлинность. 1. ИК-спектры,
- 42. 2. УФ-спектры растворов в диметилформамиде:
- 43. Чистота Устанавливают допустимое содержание посторонних примесей (от
- 44. Количественное определение 1. Проводят методом УФ-спектрофотометрии в
- 45. Применение и формы выпуска Фармакологическое действие -
- 46. Формы выпуска. раствор спиртовой 1:1500
- 47. Нитрофурантоин (фурадонин) Активен в отношении грамположительной
- 48. Фуразидин (фурагин) Активен в отношении грамположительной
- 49. Фуразидин калия [фурагин растворимый] Смесь
- 50. Нифуроксазид Противомикробное средство широкого спектра действия,
- 51. Лекарственные средства, производные бензофурана Бензофуран существует в
- 52. Амиодарон Amiodaron Белый кристаллический порошок, очень
- 53. Получают путём синтеза С ядром бензофурана связывают
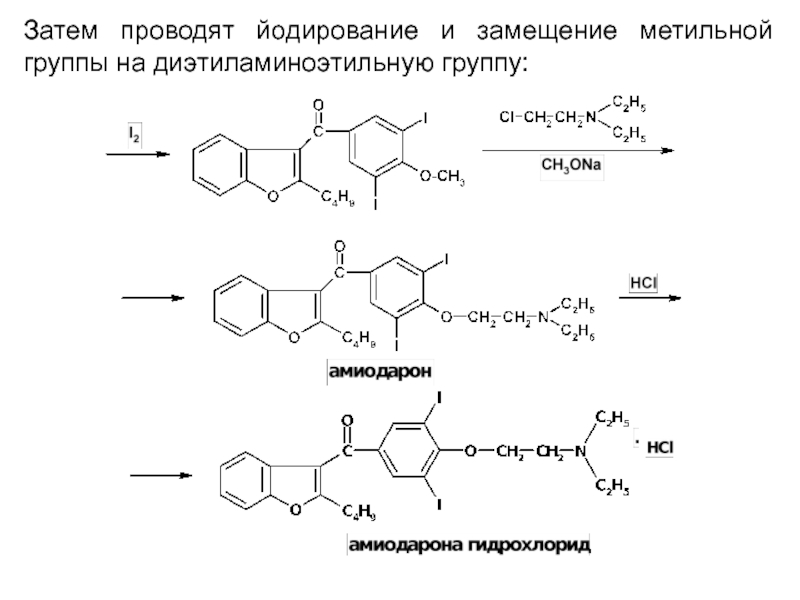
- 54. Затем проводят йодирование и замещение метильной группы
- 55. Связь между структурой и свойствами:
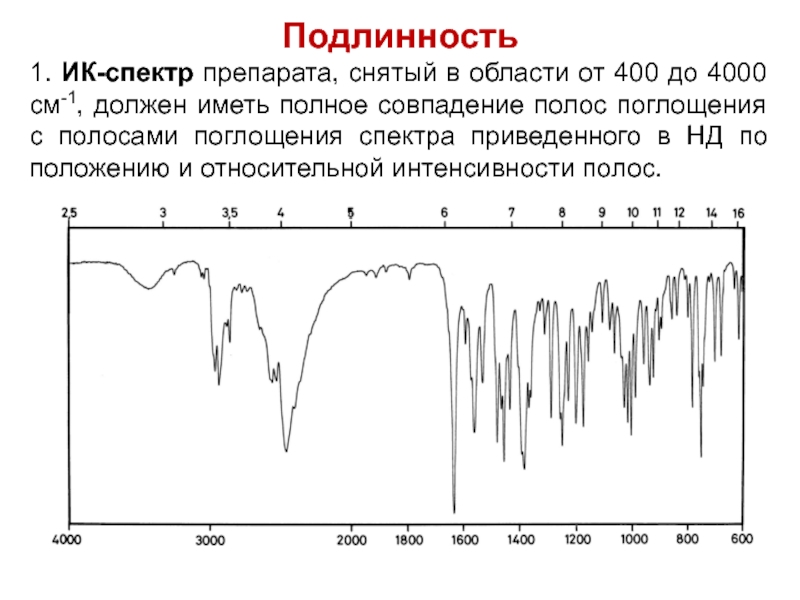
- 56. Подлинность 1. ИК-спектр препарата, снятый в области
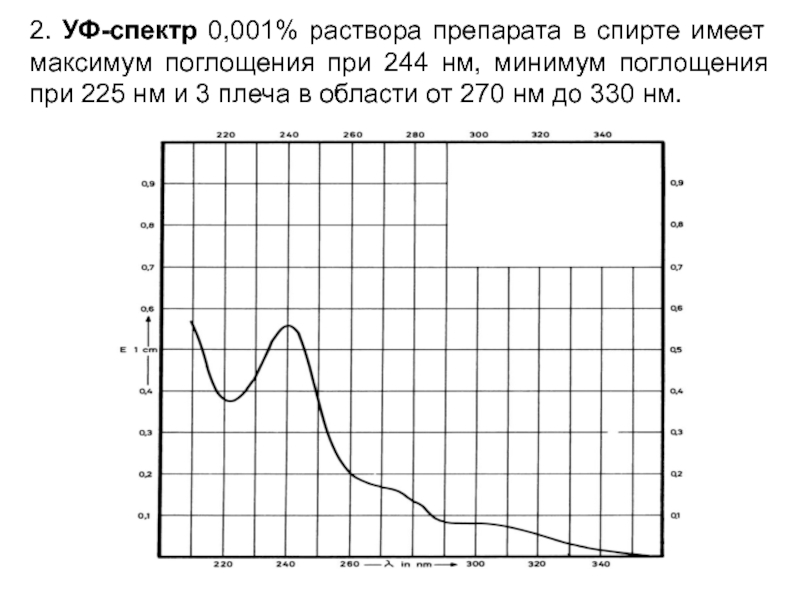
- 57. 2. УФ-спектр 0,001% раствора препарата в спирте
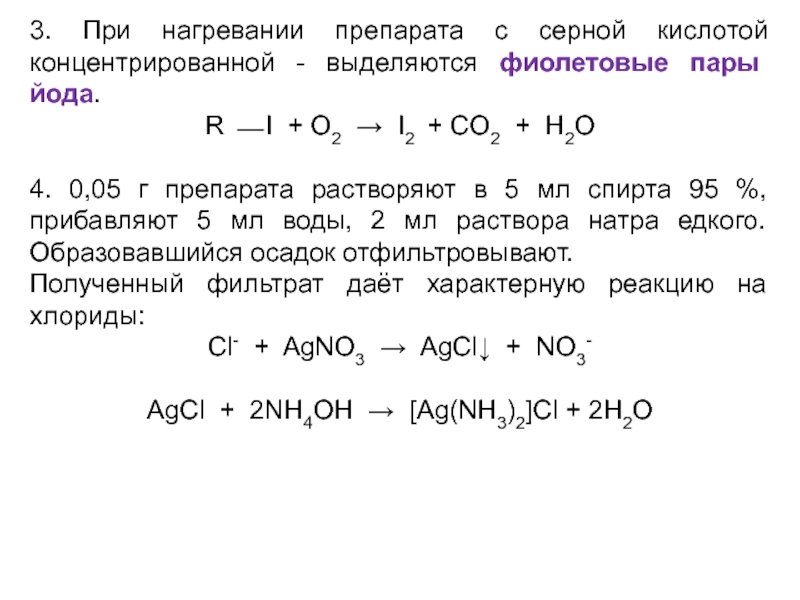
- 58. 3. При нагревании препарата с серной кислотой
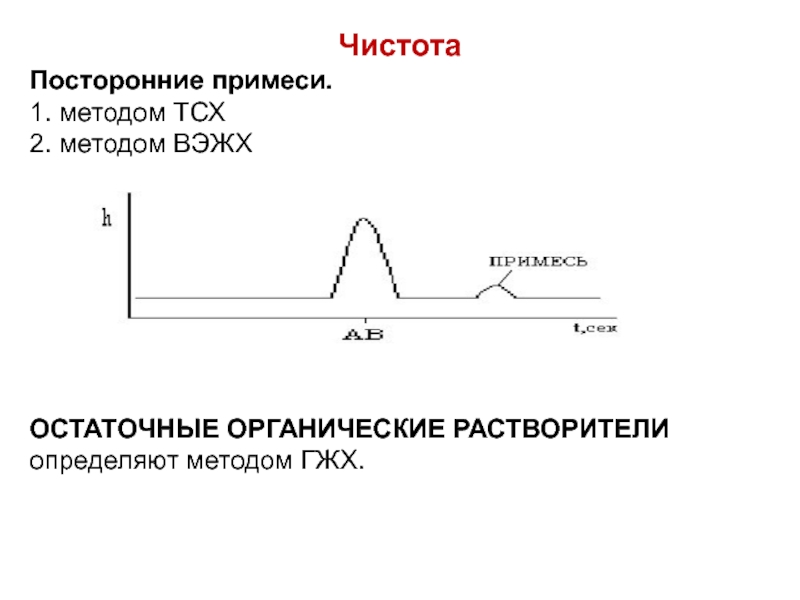
- 59. Чистота Посторонние примеси. 1. методом ТСХ
- 60. Количественное определение 1. Метод алкалиметрии.
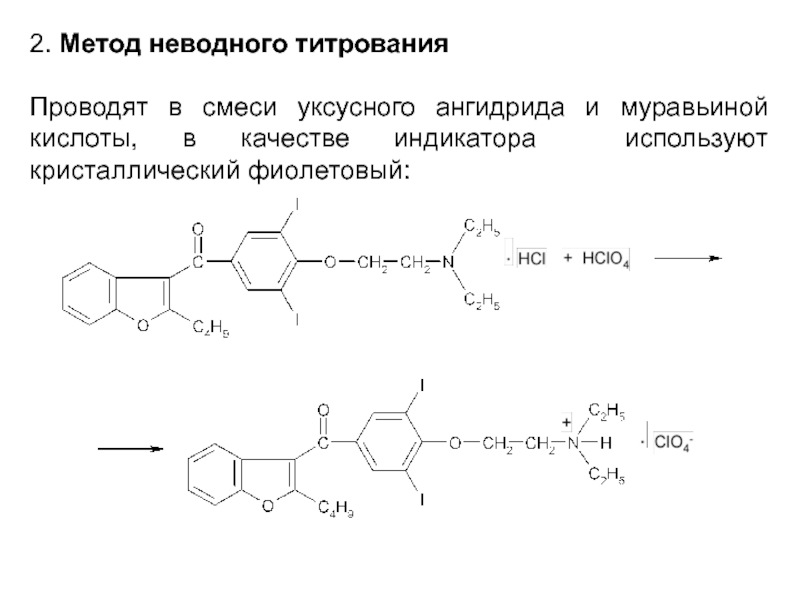
- 61. 2. Метод неводного титрования Проводят в
- 62. В среде уксусного ангидрида соли хлористоводородной кислоты
- 63. Хранят амиодарон в сухом, защищенном от света
- 64. Гризеофульвин Griseofulvin Белый с желтоватым оттенком
- 65. Присутствие в молекуле метокси-, кето-, эпокси-групп обусловливает
- 66. Количественное определение Проводят спектрофотометрическим методом при
Слайд 1Лекция № 1 - 2
Гетероциклические соединения природного и синтетического происхождения.
Производные фурана
Слайд 2Гетероциклическими соединениями
(от греч. heteros – другой)
называют
карбоциклические соединения,
содержащие в
цикле
один или несколько гетероатомов,
чаще всего азота, кислорода, серы
один или несколько гетероатомов,
чаще всего азота, кислорода, серы
Слайд 3
гетероциклы играют важную роль в химии лекарственных веществ, так как
наряду с функциональными группами сам гетероцикл может вступать в различные биохимические реакции в организме
гетероциклы широко распространены в природе, входят в состав нуклеиновых кислот, витаминов, алкалоидов, некоторых антибиотиков, гликозидов и др.
наиболее часто в химии лекарственных веществ встречаются пяти- и шестичленные гетероциклы с одним или более гетероатомов
гетероциклы широко распространены в природе, входят в состав нуклеиновых кислот, витаминов, алкалоидов, некоторых антибиотиков, гликозидов и др.
наиболее часто в химии лекарственных веществ встречаются пяти- и шестичленные гетероциклы с одним или более гетероатомов
Слайд 4Классификация гетероциклических соединений
классификацию гетероциклов проводят по общему числу атомов в
цикле, внутри каждой группы выделяют подгруппы в соответствии с природой гетероатома и по числу гетероатомов
наиболее часто в химии лекарственных веществ встречаются пяти- и шестичленные гетероциклы с одним или более гетероатомом
для наименования гетероциклических соединений допускается использование тривиальных названий
наиболее часто в химии лекарственных веществ встречаются пяти- и шестичленные гетероциклы с одним или более гетероатомом
для наименования гетероциклических соединений допускается использование тривиальных названий
Слайд 6Пятичленные гетероциклы
с несколькими гетероатомами
Азолы — пятичленные гетероциклы, имеющие в цикле не
менее двух гетероатомов, один из которых атом азота.
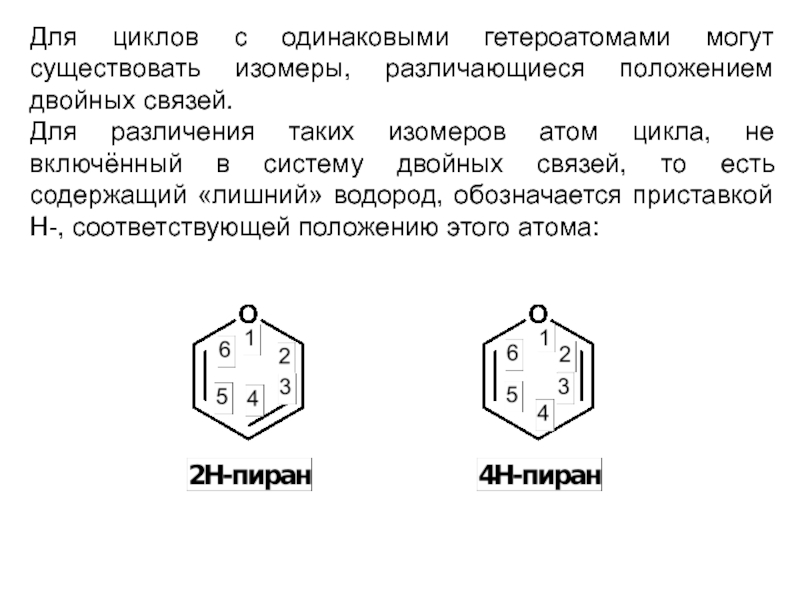
Слайд 9Для циклов с одинаковыми гетероатомами могут существовать изомеры, различающиеся положением двойных
связей.
Для различения таких изомеров атом цикла, не включённый в систему двойных связей, то есть содержащий «лишний» водород, обозначается приставкой H-, соответствующей положению этого атома:
Для различения таких изомеров атом цикла, не включённый в систему двойных связей, то есть содержащий «лишний» водород, обозначается приставкой H-, соответствующей положению этого атома:
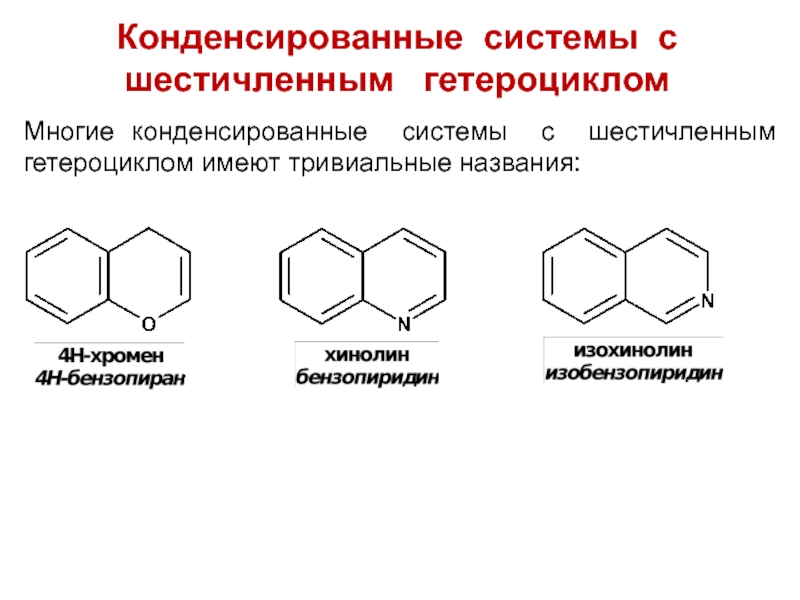
Слайд 10Конденсированные системы с шестичленным гетероциклом
Многие конденсированные системы с шестичленным
гетероциклом имеют тривиальные названия:
Слайд 14
По химическим свойствам гетероциклические соединения отличаются от карбоциклических:
Насыщенные азотсодержащие гетероциклы приближаются
по свойствам к алифатическим аминам
Ненасыщенные гетероциклические соединения по свойствам близки к ароматическим, однако являются более реакционноспособными
Разнообразие фармакологических свойств гетероциклических соединений гораздо шире по сравнению с алифатическими и карбоциклическими соединениями. Среди гетероциклических соединений находятся некоторые витамины, алкалоиды, антибиотики и др.
Ненасыщенные гетероциклические соединения по свойствам близки к ароматическим, однако являются более реакционноспособными
Разнообразие фармакологических свойств гетероциклических соединений гораздо шире по сравнению с алифатическими и карбоциклическими соединениями. Среди гетероциклических соединений находятся некоторые витамины, алкалоиды, антибиотики и др.
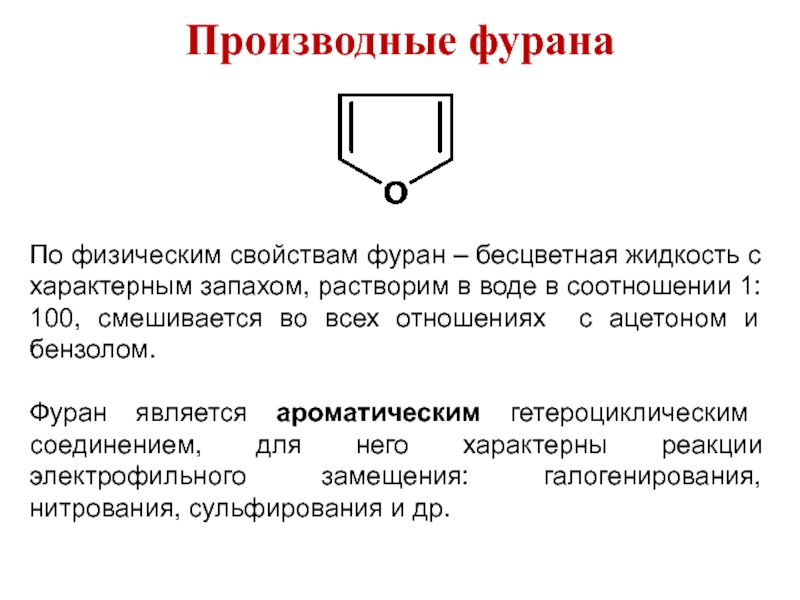
Слайд 15Производные фурана
По физическим свойствам фуран – бесцветная жидкость с характерным запахом,
растворим в воде в соотношении 1: 100, смешивается во всех отношениях с ацетоном и бензолом.
Фуран является ароматическим гетероциклическим соединением, для него характерны реакции электрофильного замещения: галогенирования, нитрования, сульфирования и др.
Фуран является ароматическим гетероциклическим соединением, для него характерны реакции электрофильного замещения: галогенирования, нитрования, сульфирования и др.
Слайд 16Лекарственные средства, производные фурана
Медицинское значение имеют производные фурана:
Производные 5-нитрофурана – противомикробные
средства
2. Производные бензофурана
Амиодарон - антиаретмическое средство
Гризеофульвин - противогрибковое средство
2. Производные бензофурана
Амиодарон - антиаретмическое средство
Гризеофульвин - противогрибковое средство
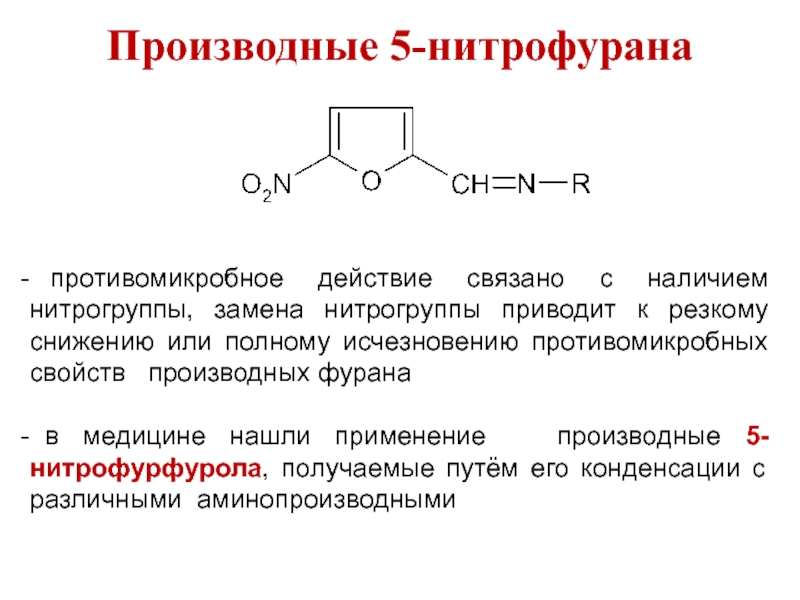
Слайд 17Производные 5-нитрофурана
противомикробное действие связано с наличием нитрогруппы, замена нитрогруппы приводит
к резкому снижению или полному исчезновению противомикробных свойств производных фурана
в медицине нашли применение производные 5-нитрофурфурола, получаемые путём его конденсации с различными аминопроизводными
в медицине нашли применение производные 5-нитрофурфурола, получаемые путём его конденсации с различными аминопроизводными
Слайд 22
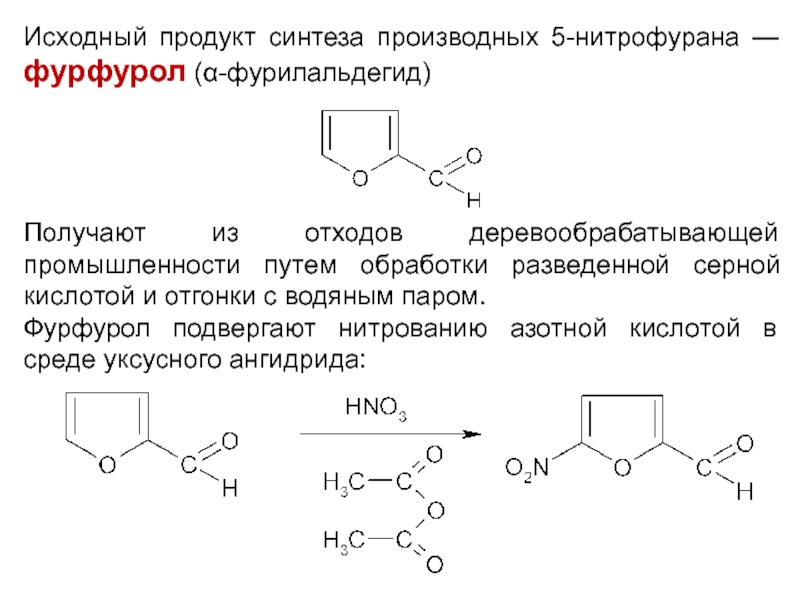
Исходный продукт синтеза производных 5-нитрофурана — фурфурол (α-фурилальдегид)
Получают из отходов деревообрабатывающей
промышленности путем обработки разведенной серной кислотой и отгонки с водяным паром.
Фурфурол подвергают нитрованию азотной кислотой в среде уксусного ангидрида:
Фурфурол подвергают нитрованию азотной кислотой в среде уксусного ангидрида:
Слайд 23
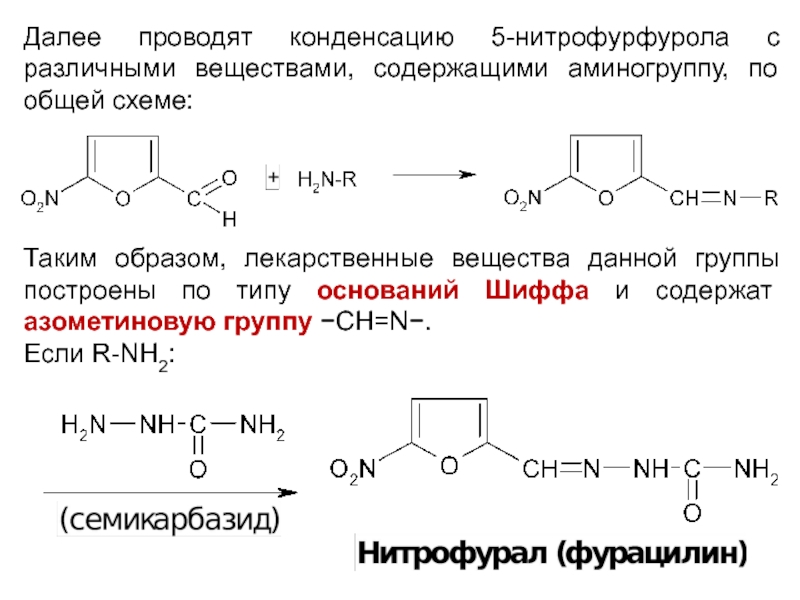
Далее проводят конденсацию 5-нитрофурфурола с различными веществами, содержащими аминогруппу, по общей
схеме:
Таким образом, лекарственные вещества данной группы построены по типу оснований Шиффа и содержат азометиновую группу −СН=N−.
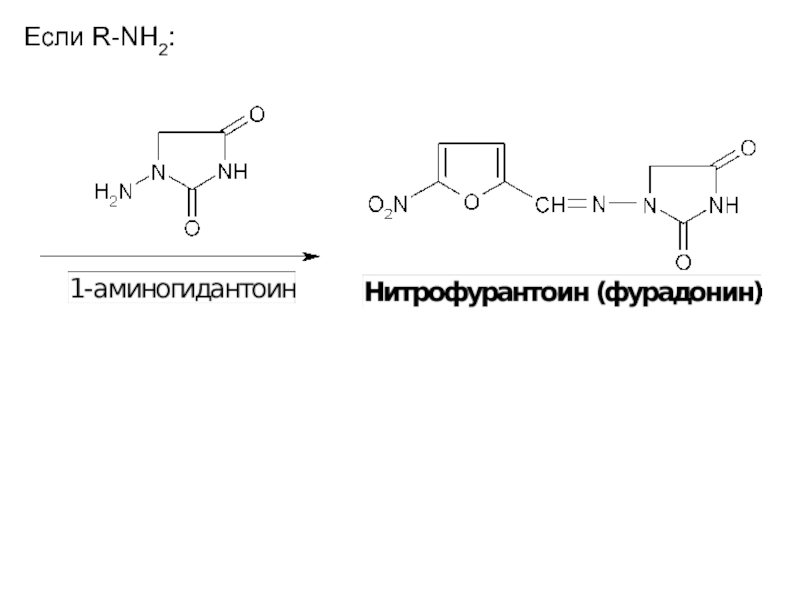
Если R-NH2:
Таким образом, лекарственные вещества данной группы построены по типу оснований Шиффа и содержат азометиновую группу −СН=N−.
Если R-NH2:
Слайд 25При синтезе фуразидина, у которого азометиновая группа отделена от нитрофуранового фрагмента
этиленовым радикалом, 5-нитрофурфурол вначале конденсируют с ацетальдегидом, а затем сочетают с 1-аминогидантоином:
Слайд 26Физические свойства
Желтые с зеленоватым оттенком кристаллические вещества, без запаха.
Очень мало
растворимы или практически нерастворимы в воде и в этаноле (нитрофурал очень мало и медленно растворим).
Мало или умеренно растворимы в диметилформамиде.
Мало или очень мало растворимы в ацетоне.
Мало или умеренно растворимы в диметилформамиде.
Мало или очень мало растворимы в ацетоне.
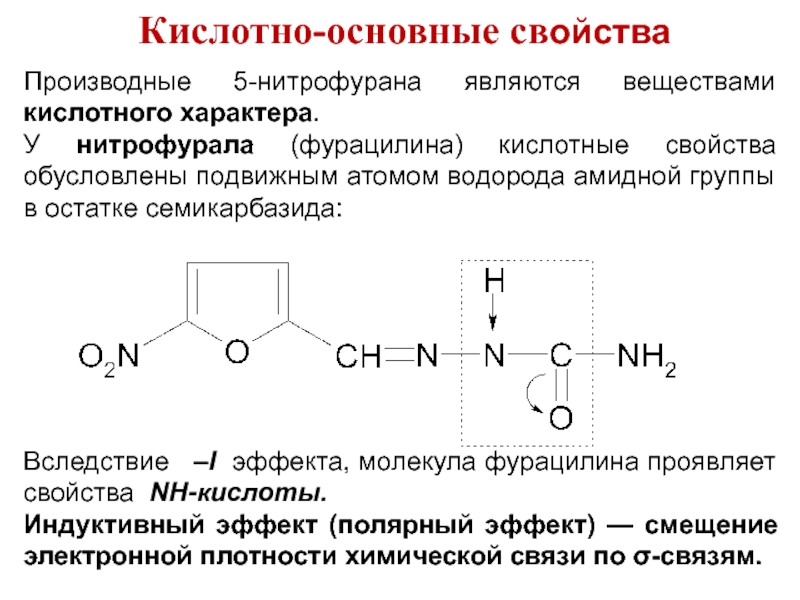
Слайд 27Кислотно-основные свойства
Производные 5-нитрофурана являются веществами кислотного характера.
У нитрофурала (фурацилина) кислотные свойства
обусловлены подвижным атомом водорода амидной группы в остатке семикарбазида:
Вследствие –I эффекта, молекула фурацилина проявляет свойства NH-кислоты.
Индуктивный эффект (полярный эффект) — смещение электронной плотности химической связи по σ-связям.
Вследствие –I эффекта, молекула фурацилина проявляет свойства NH-кислоты.
Индуктивный эффект (полярный эффект) — смещение электронной плотности химической связи по σ-связям.
Слайд 28
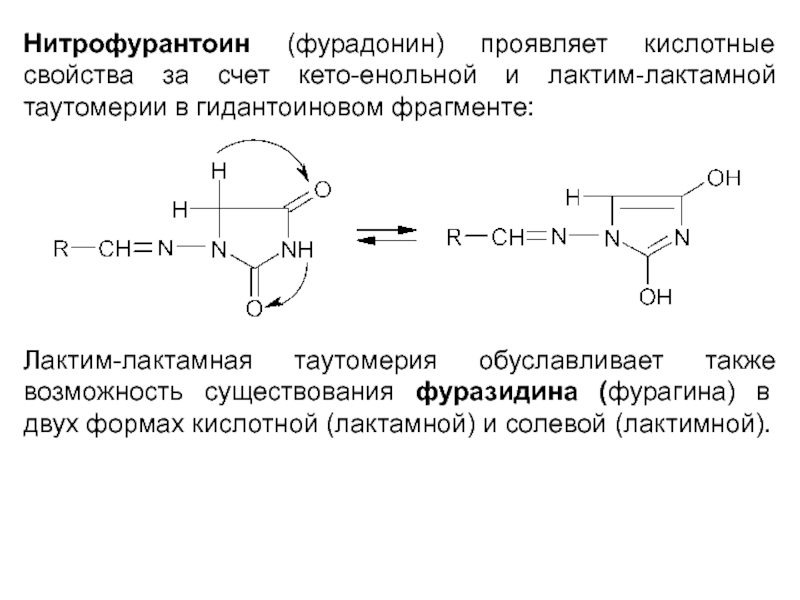
Нитрофурантоин (фурадонин) проявляет кислотные свойства за счет кето-енольной и лактим-лактамной таутомерии
в гидантоиновом фрагменте:
Лактим-лактамная таутомерия обуславливает также возможность существования фуразидина (фурагина) в двух формах кислотной (лактамной) и солевой (лактимной).
Лактим-лактамная таутомерия обуславливает также возможность существования фуразидина (фурагина) в двух формах кислотной (лактамной) и солевой (лактимной).
Слайд 29
Кислотные свойства лекарственных веществ группы 5-нитрофурана проявляются в следующих реакциях:
1. С
водными растворами щелочей.
2. С протофильными растворителями (диметилформамид, пиридин).
3. С ионами тяжелых металлов.
1. Все лекарственные вещества данной группы реагируют с раствором натрия гидроксида, что приводит к углублению их окраски. Поэтому реакция со щелочью является общегрупповой для данных веществ.
2. С протофильными растворителями (диметилформамид, пиридин).
3. С ионами тяжелых металлов.
1. Все лекарственные вещества данной группы реагируют с раствором натрия гидроксида, что приводит к углублению их окраски. Поэтому реакция со щелочью является общегрупповой для данных веществ.
Слайд 30
При растворении фурацилина в 10% растворе натрия гидроксида происходит депротонирование NH-кислотного
центра, что вызывает перераспределение электронной плотности, а это в свою очередь приводит к ионизации вещества и образованию новой сопряженной системы двойных связей - образуется оранжево-красное окрашивание:
Слайд 31
Образование темно-красного окрашивания при действии раствора натрия гидроксида на фурадонин обусловлено
таутомерными превращениями в ядре гидантоина, что также приводит к образованию дополнительных двойных связей и ионизации:
Слайд 32
2. За счет кислотных свойств производные 5-нитрофурана растворяются в протофильных растворителях
(пиридин, диметилформамид) с образованием окрашенных анионов, которые с катионами щелочных металлов образуют соли различного цвета. Это свойство позволяет дифференцировать данные вещества.
3. Кислотный характер производных 5-нитрофурана дает возможность проводить реакции комплексообразования с ионами тяжелых металлов (Cu2+, Co2+, Ag+).
3. Кислотный характер производных 5-нитрофурана дает возможность проводить реакции комплексообразования с ионами тяжелых металлов (Cu2+, Co2+, Ag+).
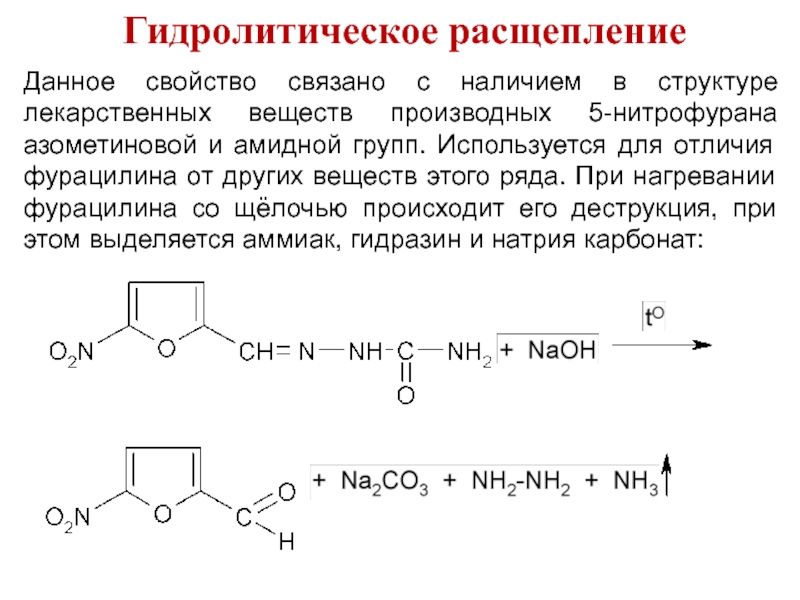
Слайд 33Гидролитическое расщепление
Данное свойство связано с наличием в структуре лекарственных веществ производных
5-нитрофурана азометиновой и амидной групп. Используется для отличия фурацилина от других веществ этого ряда. При нагревании фурацилина со щёлочью происходит его деструкция, при этом выделяется аммиак, гидразин и натрия карбонат:
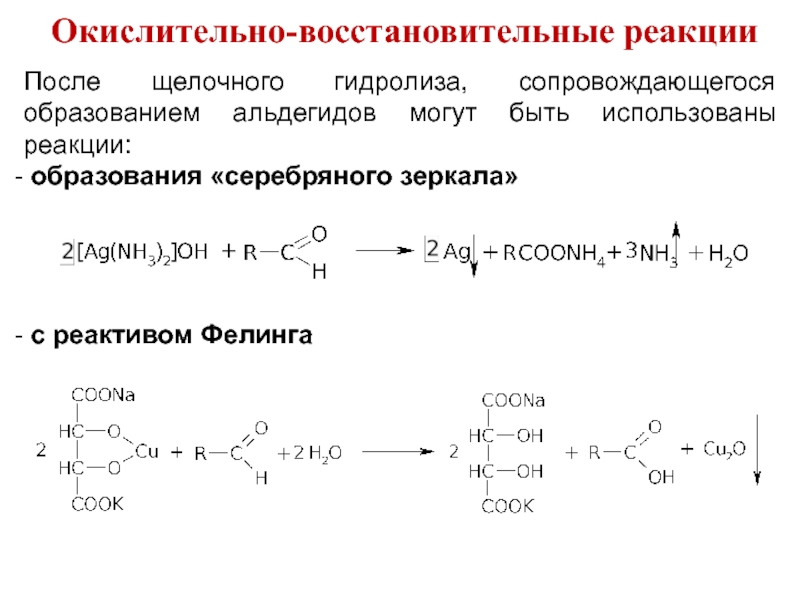
Слайд 35Окислительно-восстановительные реакции
После щелочного гидролиза, сопровождающегося образованием альдегидов могут быть использованы реакции:
образования «серебряного зеркала»
с реактивом Фелинга
с реактивом Фелинга
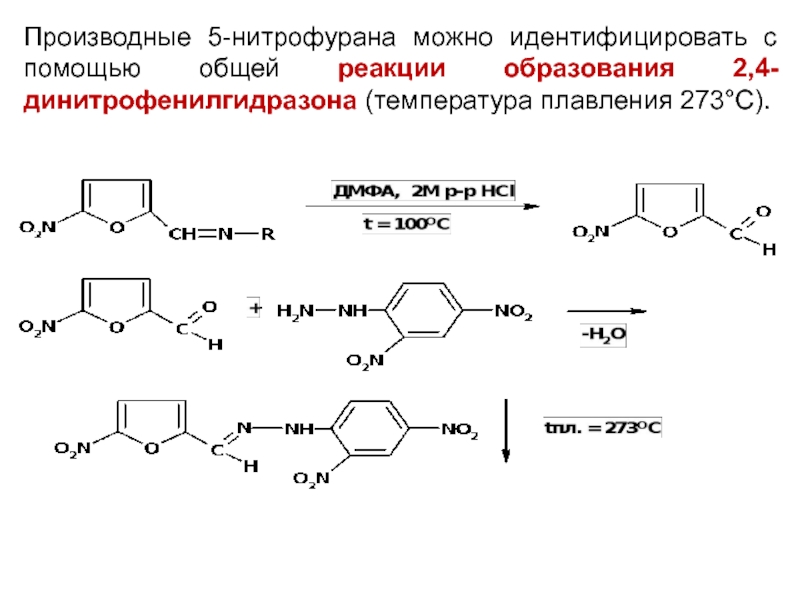
Слайд 36
Производные 5-нитрофурана можно идентифицировать с помощью общей реакции образования 2,4-динитрофенилгидразона (температура
плавления 273°C).
Слайд 37Методы количественного анализа
1. Кислотно-основное титрование в неводной среде.
Как вещества кислотного
характера, производные 5-нитрофурана можно титровать в среде протофильных растворителей (диметилформамид) стандартыми растворами натрия метилата.
Так, Международная фармакопея рекомендует этот метод для фурадонина, который титруется как одноосновная кислота.
среда – диметилформамид,
титрант – 0,1 М раствор натрия метилата
индикатор- тимоловый синий
Так, Международная фармакопея рекомендует этот метод для фурадонина, который титруется как одноосновная кислота.
среда – диметилформамид,
титрант – 0,1 М раствор натрия метилата
индикатор- тимоловый синий
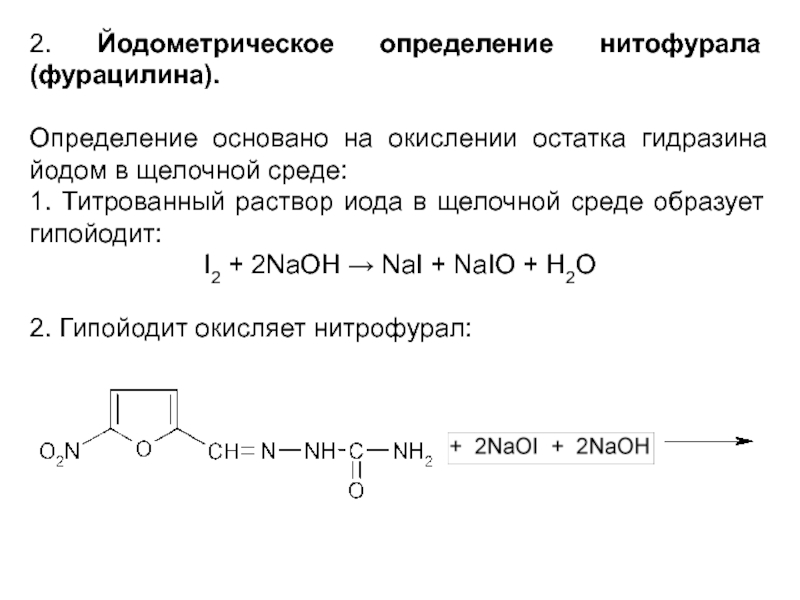
Слайд 392. Йодометрическое определение нитофурала (фурацилина).
Определение основано на окислении остатка гидразина йодом
в щелочной среде:
1. Титрованный раствор иода в щелочной среде образует гипойодит:
I2 + 2NaOH → NaI + NaIO + H2O
2. Гипойодит окисляет нитрофурал:
1. Титрованный раствор иода в щелочной среде образует гипойодит:
I2 + 2NaOH → NaI + NaIO + H2O
2. Гипойодит окисляет нитрофурал:
Слайд 40
3. После окончания процесса окисления нитрофурала раствор подкисляют:
NaI + NaIO +
H2SO4 → I2 + Na2SO4 + H2O
4. Выделившийся йод титруют раствором натрия тиосульфата (индикатор крахмал):
I2 + 2Na2S2O3 → 2NaI + Na2S4O6
4. Выделившийся йод титруют раствором натрия тиосульфата (индикатор крахмал):
I2 + 2Na2S2O3 → 2NaI + Na2S4O6
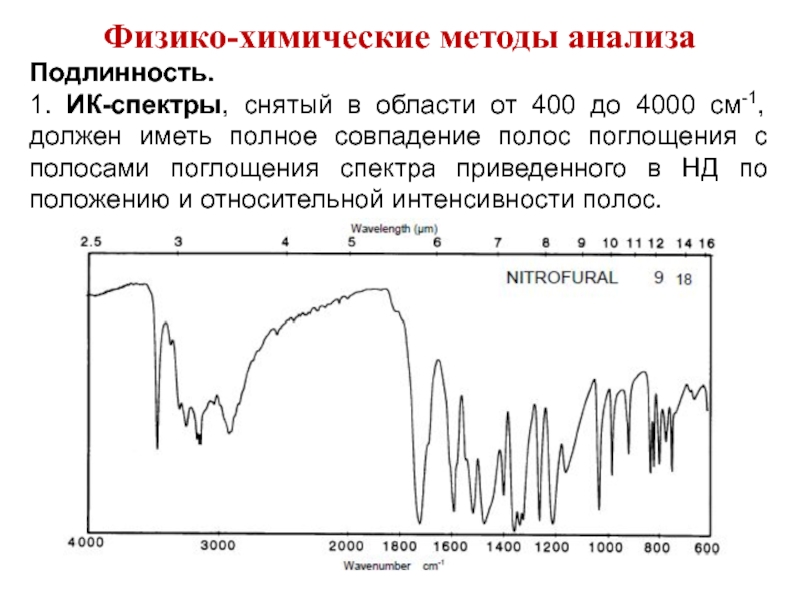
Слайд 41Физико-химические методы анализа
Подлинность.
1. ИК-спектры, снятый в области от 400 до
4000 см-1, должен иметь полное совпадение полос поглощения с полосами поглощения спектра приведенного в НД по положению и относительной интенсивности полос.
Слайд 422. УФ-спектры растворов в диметилформамиде:
Нитрофурал – имеет максимумы поглощения при
260 нм и 375 нм и минимум поглощения при 306 нм.
Нитрофурантоин - имеет максимумы поглощения при 266 и 367 нм.
Фуразидин — максимумы при 292 и 396 нм.
Максимумы второй полосы поглощения (365 - 400 нм) более специфичны для производных 5-нитрофурана, т.к. обусловлены наличием различных электронодонорных групп в положении 2 фуранового цикла.
Нитрофурантоин - имеет максимумы поглощения при 266 и 367 нм.
Фуразидин — максимумы при 292 и 396 нм.
Максимумы второй полосы поглощения (365 - 400 нм) более специфичны для производных 5-нитрофурана, т.к. обусловлены наличием различных электронодонорных групп в положении 2 фуранового цикла.
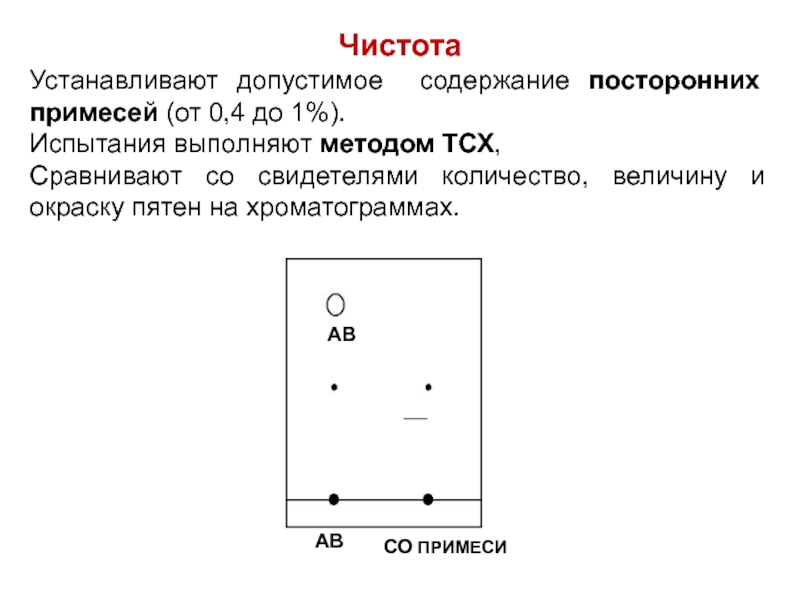
Слайд 43Чистота
Устанавливают допустимое содержание посторонних примесей (от 0,4 до 1%).
Испытания выполняют
методом ТСХ,
Сравнивают со свидетелями количество, величину и окраску пятен на хроматограммах.
Сравнивают со свидетелями количество, величину и окраску пятен на хроматограммах.
Слайд 44Количественное определение
1. Проводят методом УФ-спектрофотометрии в смеси воды с диметилформамидом:
Нитрофурал –
при длине волны 375 нм.
Нитрофурантоин - при длине волны 367нм.
Фуразидин - при длине волны 396 нм.
Расчет содержания проводят по формуле:
2. Можно проводить фотоколориметрическим методом, основанным на использовании цветных реакций со щелочью в различных растворителях.
Нитрофурантоин - при длине волны 367нм.
Фуразидин - при длине волны 396 нм.
Расчет содержания проводят по формуле:
2. Можно проводить фотоколориметрическим методом, основанным на использовании цветных реакций со щелочью в различных растворителях.
Слайд 45Применение и формы выпуска
Фармакологическое действие - Противомикробное
Нитрофурал (фурацилин)
Активен в отношении грамположительной
и грамотрицательной флоры, эффективен при устойчивости микроорганизмов к другим противомикробным средствам.
Применяется для лечения и предупреждения гнойно-воспалительных процессов местно:
гнойные раны, пролежни, ожоги II–III степени,
конъюнктивит,
фурункулы,
острый наружный и средний отит,
ангина,
стоматит, гингивит;
мелкие повреждения кожи (в т.ч. ссадины, царапины, трещины, порезы).
Применяется для лечения и предупреждения гнойно-воспалительных процессов местно:
гнойные раны, пролежни, ожоги II–III степени,
конъюнктивит,
фурункулы,
острый наружный и средний отит,
ангина,
стоматит, гингивит;
мелкие повреждения кожи (в т.ч. ссадины, царапины, трещины, порезы).
Слайд 46
Формы выпуска.
раствор спиртовой 1:1500
таблетки для приготовления раствора для местного
применения 0,1 г
таблетки для приготовления раствора для местного применения 0.02 г
фурацилиновая мазь 0,2%
Лифузоль аэрозоль д/наружн. прим.
таблетки для приготовления раствора для местного применения 0.02 г
фурацилиновая мазь 0,2%
Лифузоль аэрозоль д/наружн. прим.
Слайд 47Нитрофурантоин (фурадонин)
Активен в отношении грамположительной и грамотрицательной флоры.
Применяется прежде всего для
лечения инфекций мочевыводящих путей:
пиелонефрит,
цистит,
уретрит,
профилактика инфекций при урологических операциях.
Формы выпуска. Таблетки 50, 100 мг
пиелонефрит,
цистит,
уретрит,
профилактика инфекций при урологических операциях.
Формы выпуска. Таблетки 50, 100 мг
Слайд 48Фуразидин (фурагин)
Активен в отношении грамположительной и грамотрицательной флоры. В зависимости от
концентрации оказывает бактерицидное или бактериостатическое действие.
Применяется при инфекционно-воспалительные заболеваниях:
цистит,
уретрит,
пиелонефрит;
инфекции женских половых органов;
конъюнктивит,
профилактика инфекций при урологических операциях, цистоскопии, катетеризации
Формы выпуска. Таблетки 50 мг.
Применяется при инфекционно-воспалительные заболеваниях:
цистит,
уретрит,
пиелонефрит;
инфекции женских половых органов;
конъюнктивит,
профилактика инфекций при урологических операциях, цистоскопии, катетеризации
Формы выпуска. Таблетки 50 мг.
Слайд 49Фуразидин калия [фурагин растворимый]
Смесь фуразидина с калия карбонатом
Формы выпуска.
Фурасол -
порошок для приготовления раствора для местного и наружного применения 100 мг, (пакетики ламинированные).
Фурамаг - капсулы 25 мг
Фурамаг - капсулы 25 мг
Слайд 50Нифуроксазид
Противомикробное средство широкого спектра действия, производное нитрофурана.
Эффективное бактерицидное средство при острых
кишечных инфекциях.
Не нарушает равновесие кишечной микрофлоры. При острой бактериальной диарее восстанавливает эубиоз кишечника.
Применяется при диареи инфекционного генеза.
Формы выпуска.
Торговое наименование Энтерофурил:
- таблетки покрытые пленочной оболочкой 100 мг
суспензия для приема внутрь 220 мг
Не нарушает равновесие кишечной микрофлоры. При острой бактериальной диарее восстанавливает эубиоз кишечника.
Применяется при диареи инфекционного генеза.
Формы выпуска.
Торговое наименование Энтерофурил:
- таблетки покрытые пленочной оболочкой 100 мг
суспензия для приема внутрь 220 мг
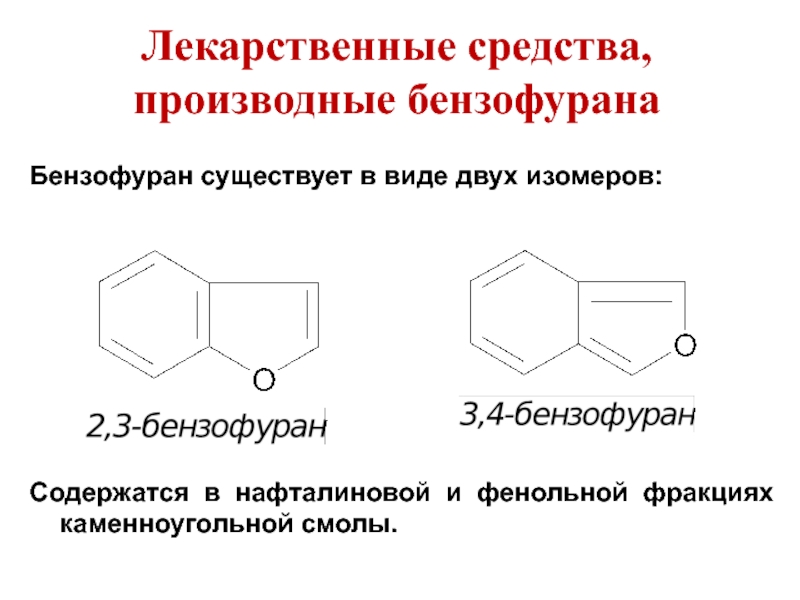
Слайд 51Лекарственные средства, производные бензофурана
Бензофуран существует в виде двух изомеров:
Содержатся в нафталиновой
и фенольной фракциях каменноугольной смолы.
Слайд 52Амиодарон
Amiodaron
Белый кристаллический порошок, очень мало растворимый в воде, умеренно
растворим в спирте.
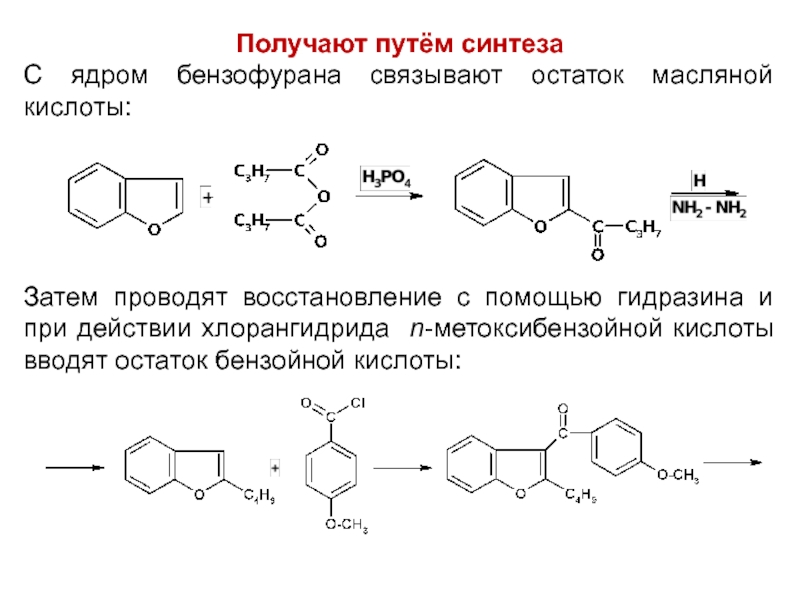
Слайд 53Получают путём синтеза
С ядром бензофурана связывают остаток масляной кислоты:
Затем проводят восстановление
с помощью гидразина и при действии хлорангидрида n-метоксибензойной кислоты вводят остаток бензойной кислоты:
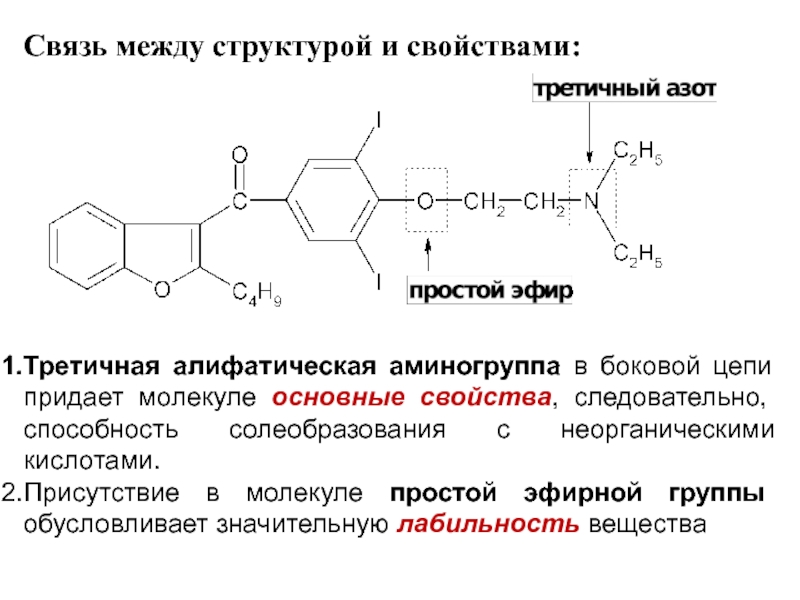
Слайд 55Связь между структурой и свойствами:
Третичная алифатическая аминогруппа в боковой цепи придает
молекуле основные свойства, следовательно, способность солеобразования с неорганическими кислотами.
Присутствие в молекуле простой эфирной группы обусловливает значительную лабильность вещества
Присутствие в молекуле простой эфирной группы обусловливает значительную лабильность вещества
Слайд 56Подлинность
1. ИК-спектр препарата, снятый в области от 400 до 4000 см-1,
должен иметь полное совпадение полос поглощения с полосами поглощения спектра приведенного в НД по положению и относительной интенсивности полос.
Слайд 572. УФ-спектр 0,001% раствора препарата в спирте имеет максимум поглощения при
244 нм, минимум поглощения при 225 нм и 3 плеча в области от 270 нм до 330 нм.
Слайд 583. При нагревании препарата с серной кислотой концентрированной - выделяются фиолетовые
пары йода.
R ⎯ I + O2 → I2 + CO2 + H2O
4. 0,05 г препарата растворяют в 5 мл спирта 95 %, прибавляют 5 мл воды, 2 мл раствора натра едкого. Образовавшийся осадок отфильтровывают.
Полученный фильтрат даёт характерную реакцию на хлориды:
Cl- + AgNO3 → AgCl↓ + NO3-
AgCl + 2NH4OH → [Ag(NH3)2]Cl + 2H2O
R ⎯ I + O2 → I2 + CO2 + H2O
4. 0,05 г препарата растворяют в 5 мл спирта 95 %, прибавляют 5 мл воды, 2 мл раствора натра едкого. Образовавшийся осадок отфильтровывают.
Полученный фильтрат даёт характерную реакцию на хлориды:
Cl- + AgNO3 → AgCl↓ + NO3-
AgCl + 2NH4OH → [Ag(NH3)2]Cl + 2H2O
Слайд 59Чистота
Посторонние примеси.
1. методом ТСХ
2. методом ВЭЖХ
ОСТАТОЧНЫЕ ОРГАНИЧЕСКИЕ РАСТВОРИТЕЛИ определяют методом
ГЖХ.
Слайд 60Количественное определение
1. Метод алкалиметрии.
Навеску растворяют в смеси этанола и 0,01
М раствора хлороводородной кислоты. Титруют с использованием потенциометра 0,1 М раствором натрия гидроксида. Объём титранта, пошедшего на титрование, устанавливают на потенциометрической кривой между двумя точками перегиба:
HCl + NaOH → NaCl + H2O
[R3N] · HCl + NaOH → R3N + NaCl + H2O
HCl + NaOH → NaCl + H2O
[R3N] · HCl + NaOH → R3N + NaCl + H2O
Слайд 612. Метод неводного титрования
Проводят в смеси уксусного ангидрида и муравьиной кислоты,
в качестве индикатора используют кристаллический фиолетовый:
Слайд 62В среде уксусного ангидрида соли хлористоводородной кислоты титруют без добавления ртути(II)
ацетата:
1. Приготовление титранта:
HClO4 + CH3COOH ⇄ CH3COOH2+ + ClO4¯
ацетоний-ион хлорат-ион
2. Взаимодействие соли с уксусным ангидридом:
[R3N]·HCl + (CH3CO)2O → [R3N−H]+ + CH3COCl + CH3COO-
3. Солеобразование протонированного основания с хлорат-ионом:
[R3N−H]+ + ClO4– → [R3N−H]+·ClO4–
4. Регенерация растворителя:
CH3COOH2+ + CH3COO– ⇄ 2CH3COOH
1. Приготовление титранта:
HClO4 + CH3COOH ⇄ CH3COOH2+ + ClO4¯
ацетоний-ион хлорат-ион
2. Взаимодействие соли с уксусным ангидридом:
[R3N]·HCl + (CH3CO)2O → [R3N−H]+ + CH3COCl + CH3COO-
3. Солеобразование протонированного основания с хлорат-ионом:
[R3N−H]+ + ClO4– → [R3N−H]+·ClO4–
4. Регенерация растворителя:
CH3COOH2+ + CH3COO– ⇄ 2CH3COOH
Слайд 63Хранят амиодарон в сухом, защищенном от света месте при температуре не
выше 25°C, в хорошо укупоренной таре.
Применение
Амиодарона был синтезирован как коронарорасширяющее средство. Однако в дальнейшем были выявлены его антиаритмические свойства. В настоящее время он применяется как высокоэффективный антиаритмический препарат.
Применяют в таблетках по 0,2 г или в виде 5% раствора для инъекций в ампулах по 3 мл (при угрожающих жизни аритмиях).
Торговые наименования
Амиокордин
Кордарон
Применение
Амиодарона был синтезирован как коронарорасширяющее средство. Однако в дальнейшем были выявлены его антиаритмические свойства. В настоящее время он применяется как высокоэффективный антиаритмический препарат.
Применяют в таблетках по 0,2 г или в виде 5% раствора для инъекций в ампулах по 3 мл (при угрожающих жизни аритмиях).
Торговые наименования
Амиокордин
Кордарон
Слайд 64Гризеофульвин
Griseofulvin
Белый с желтоватым оттенком порошок, практически нерастворим в воде,
мало растворим в спирте.
Получают путём ферментации штамма Penicilium patulum.
Получают путём ферментации штамма Penicilium patulum.
Слайд 65Присутствие в молекуле метокси-, кето-, эпокси-групп обусловливает лабильность лекарственного вещества (способность
к Ox/Red реакциям).
Подлинность
1. Устанавливают по реакции с дихроматом калия в серной кислоте концентрированной – образуется тёмно-красное окрашивание.
2. Уф-спектр гризеофульвина в этаноле имеет полосы поглощегия с максимумами при 236 и 291нм.
3. ИК-спектр должен совпадать со спектром стандартного образца гризеофульвина или со спектром, прилагаемым к НД.
Подлинность
1. Устанавливают по реакции с дихроматом калия в серной кислоте концентрированной – образуется тёмно-красное окрашивание.
2. Уф-спектр гризеофульвина в этаноле имеет полосы поглощегия с максимумами при 236 и 291нм.
3. ИК-спектр должен совпадать со спектром стандартного образца гризеофульвина или со спектром, прилагаемым к НД.
Слайд 66Количественное определение
Проводят спектрофотометрическим методом при длине волны 291нм. Расчёт содержания
ведут по стандартному образцу.
Применение
Гризеофульвин является эффективным противогрибковым средством.
Применяется внутрь по 0,125 г или наружно в виде линимента 2,5% с салициловой кислотой при дерматомикозе, вызванным патогенными грибами.
Применение
Гризеофульвин является эффективным противогрибковым средством.
Применяется внутрь по 0,125 г или наружно в виде линимента 2,5% с салициловой кислотой при дерматомикозе, вызванным патогенными грибами.























![Фуразидин калия [фурагин растворимый] Смесь фуразидина с калия карбонатомФормы выпуска.Фурасол - порошок для приготовления раствора](/img/tmb/3/234000/4eed0a8327f16a8785e1a0ae99c36eb8-800x.jpg)