- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Периодический закон и периодическая система элементов Д.И. Менделеева презентация
Содержание
- 1. Периодический закон и периодическая система элементов Д.И. Менделеева
- 2. В основу своей классификации химических элементов Д.И.
- 3. При этом он обнаружил, что свойства элементов
- 4. На основании своих наблюдений 1 марта 1869
- 5. Если написать ряды один под другим так,
- 6. Периодический закон Д.И. Менделеева Современная трактовка
- 9. Периоды Периоды - горизонтальные ряды химических элементов,
- 10. Каждый период (за исключением первого) начинается типичным
- 11. Группы вертикальные столбцы элементов с одинаковым числом
- 12. Различают главные (А) и побочные подгруппы (Б).
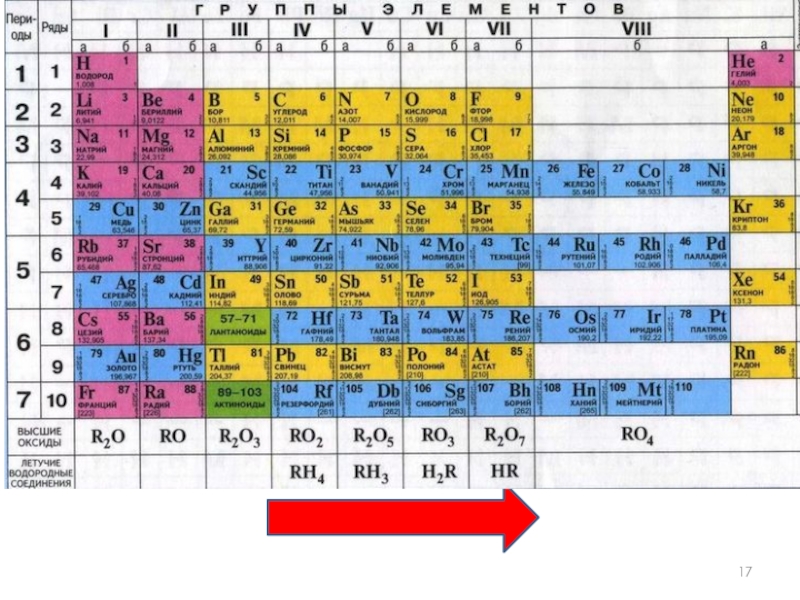
- 14. Периодическая таблица химических элементов
- 15. Валентность Номер группы показывает высшую валентность элемента по кислороду.
- 16. Валентность Элементы IV, V, VI и VII
- 18. Задание: Назовите в каком периоде и в
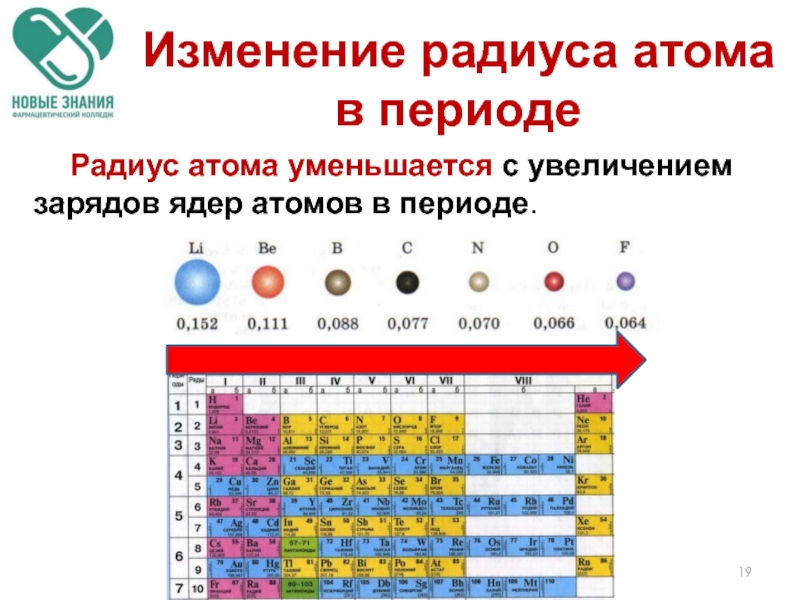
- 19. Радиус атома уменьшается с увеличением зарядов ядер
- 20. В одной группе с увеличением номера периода
- 21. Изменение радиусов атомов в таблице Д.И. Менделеева
- 22. Задание: Сравните радиусы следующих химических элементов: Литий,
- 23. Электроотрицательность - это способность атома притягивать электронную
- 24. Электроотрицательность в группе увеличивается с уменьшением числа
- 25. Li 0,98 Na 0,93 К
- 26. Задание: Сравните ЭО следующих химических элементов: Натрий
- 27. Восстановительные свойства атомов - способность терять электроны
- 28. В главных подгруппах снизу вверх, в периодах
- 29. Изменение свойств химических элементов электроотрицательность Окислительные и неметаллические свойства Окислительные и неметаллические свойства
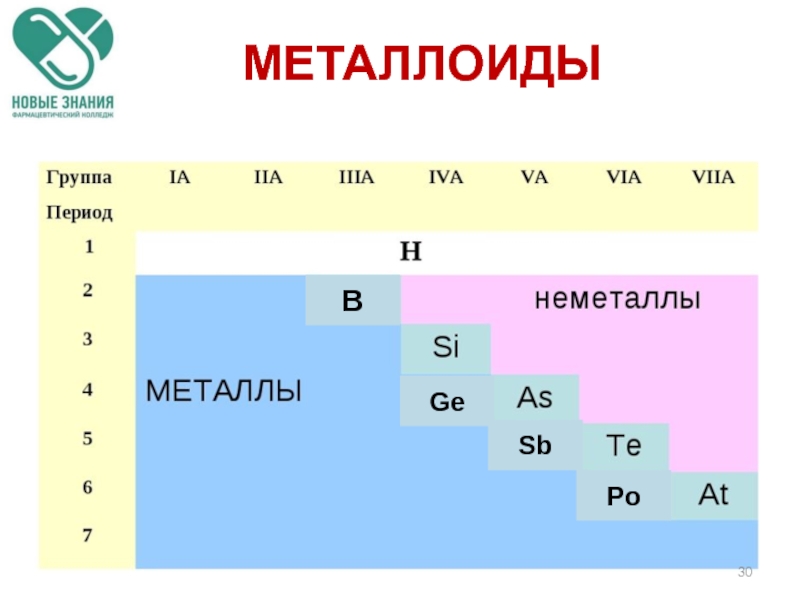
- 30. МЕТАЛЛОИДЫ Ge Sb Po B
- 31. МЕТАЛЛОИДЫ По своим химическим свойствам полуметаллы являются
- 33. Cпасибо за внимание!!
- 34. СТРОЕНИЕ АТОМА
- 35. СТРОЕНИЕ АТОМА 1911 г Английский ученый Эрнест Резерфорд предложил планетарную модель атома
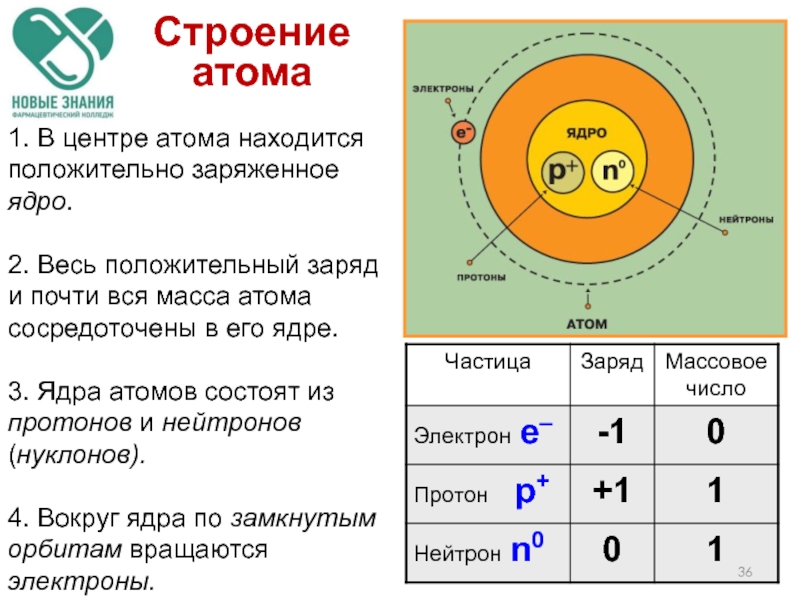
- 36. 1. В центре атома находится положительно заряженное
- 38. Строение атома электрон протон нейтрон
- 39. Mg 12 Z = +12 р+
- 40. Число нейтронов Во атомах одного химического элемента
- 41. Массовое число А Mg 24
- 42. Примерные задания Определите для предложенных ХЭ:
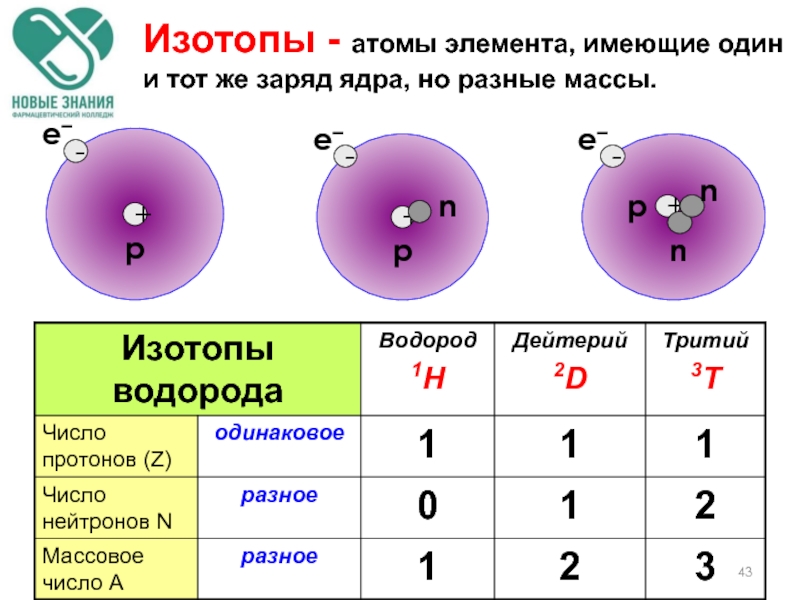
- 43. Изотопы - атомы элемента, имеющие один и тот же заряд ядра, но разные массы.
- 44. 17 Сl 35 17 Сl 37 75%
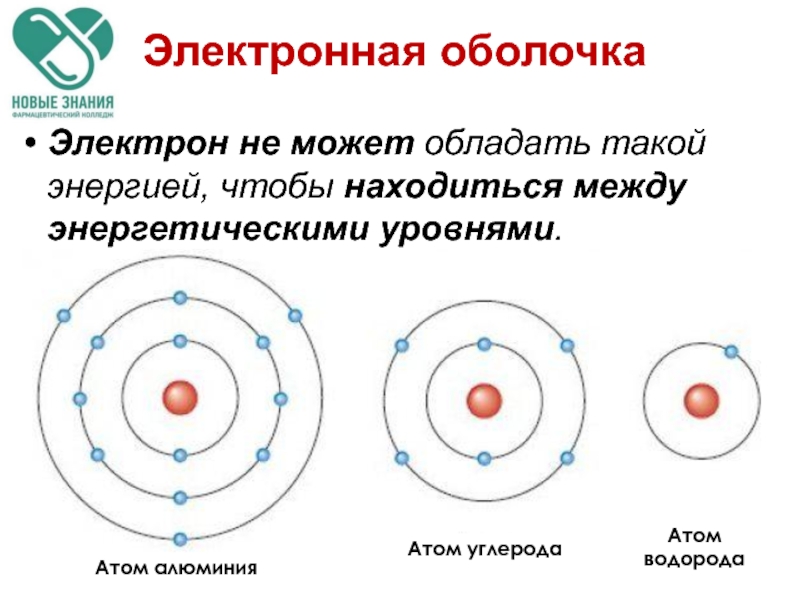
- 45. Электронная оболочка - совокупность всех электронов в атоме, окружающих ядро.
- 46. Электронная оболочка Электрон в атоме находится в
- 47. Электрон не может обладать такой энергией, чтобы
- 48. Стационарное и возбужденное состояние атома
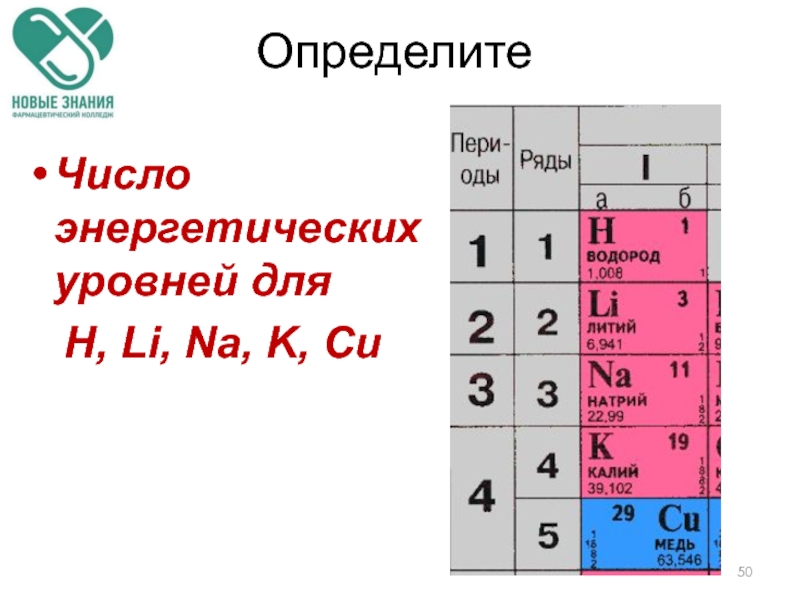
- 50. Определите Число энергетических уровней для Н, Li, Na, K, Сu
- 51. Распределение электронов по уровням N=2n2 формула для
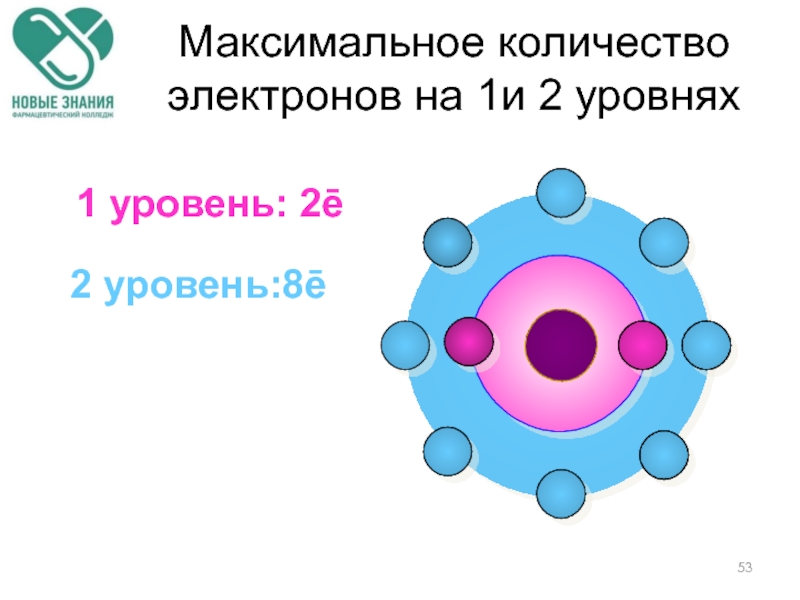
- 52. Максимальное количество электронов на 1 уровне 1 уровень: 2ē
- 53. 1 уровень: 2ē 2 уровень:8ē Максимальное количество электронов на 1и 2 уровнях
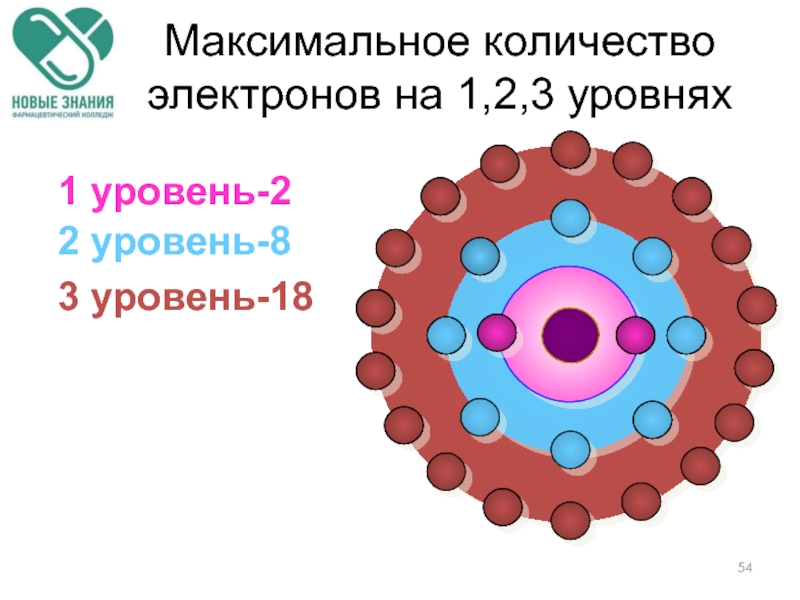
- 54. 1 уровень-2 2 уровень-8 3 уровень-18 Максимальное количество электронов на 1,2,3 уровнях
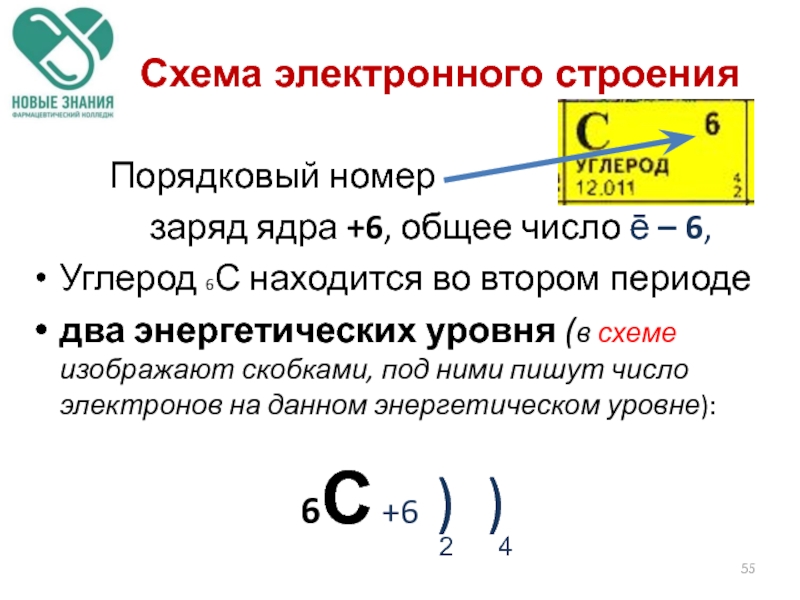
- 55. Схема электронного строения Порядковый номер
- 56. Составьте схему электронного строения для: Li, Na Bе, O, Р, F, Br
- 57. Энергетические уровни, содержащие максимальное число электронов, называются
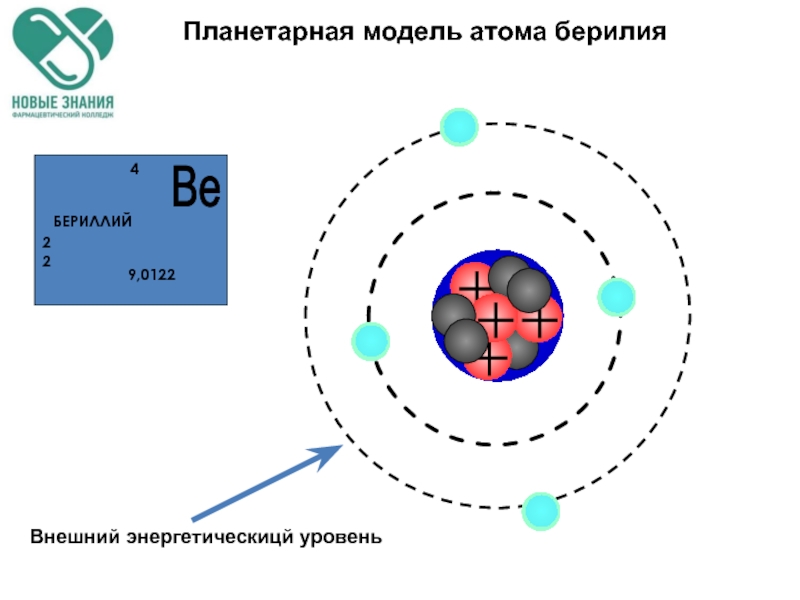
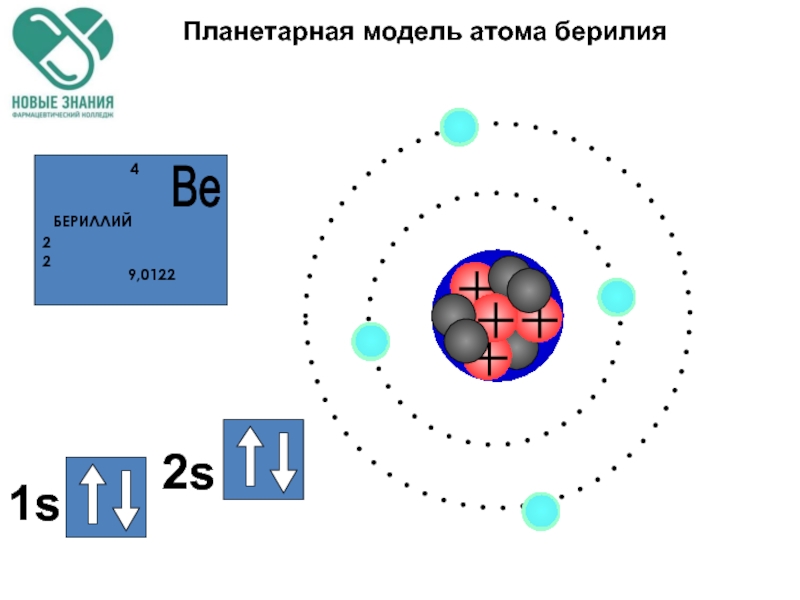
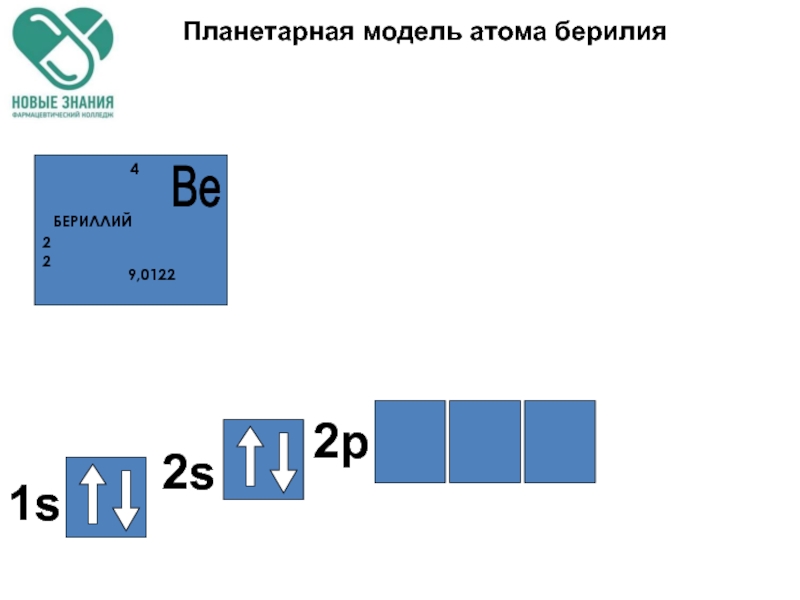
- 58. Планетарная модель атома берилия
- 59. Периодическая таблица химических элементов
- 61. Внешние электроны Число внешних электронов = № группы Электрон внешнего уровня
- 62. Каждый энергетический уровень состоит из подуровней: s,
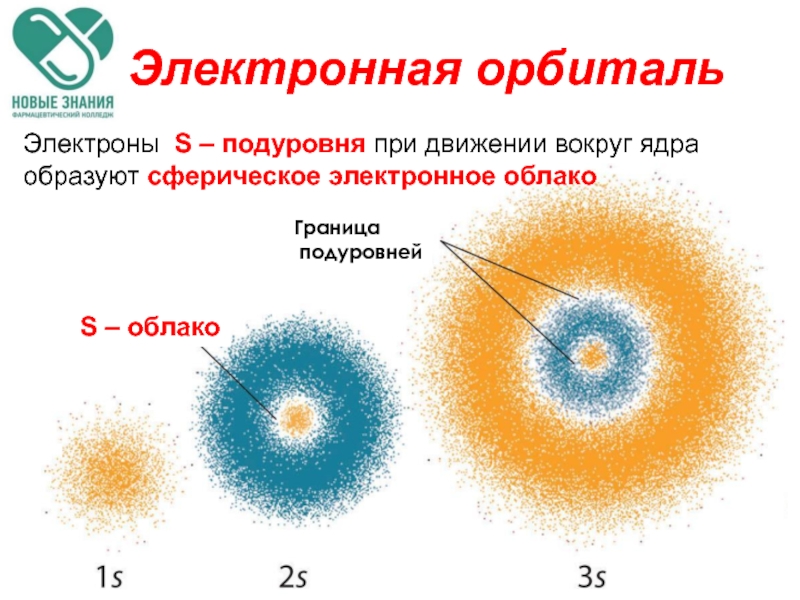
- 63. Электронная орбиталь Электроны S – подуровня при
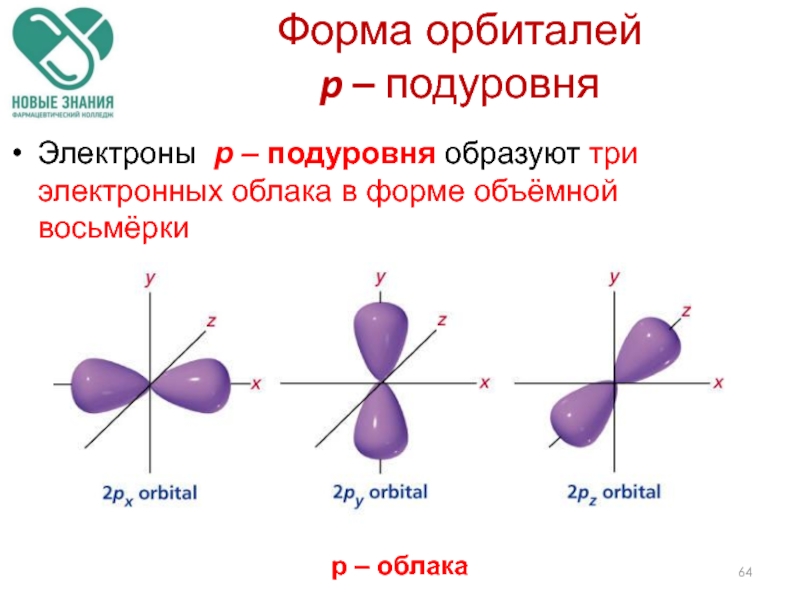
- 64. Форма орбиталей p – подуровня
- 65. Форма орбиталей p – подуровня
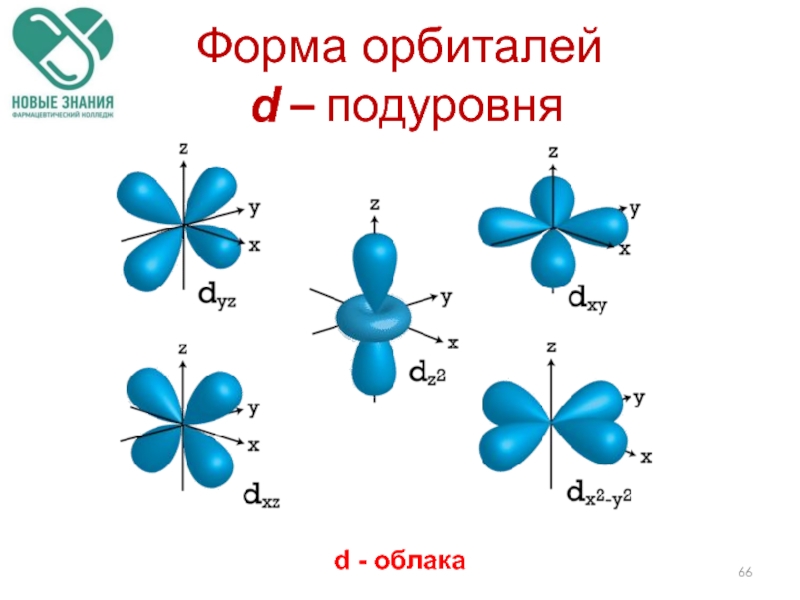
- 66. d - облака Форма орбиталей d – подуровня
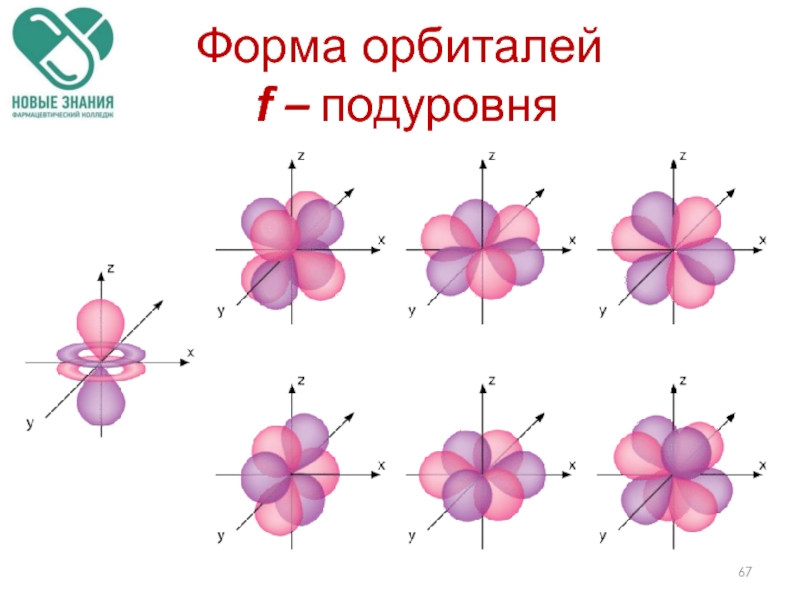
- 67. Форма орбиталей f – подуровня
- 68. Электронно-графические формулы электронная орбиталь, электроны,
- 69. Е n=1 n=2 n=3 n=4
- 70. Состояние каждого электрона в атоме обычно описывают
- 71. Квантовые числа - энергетические параметры, определяющие состояние
- 72. Квантовые числа 2. Орбитальное (побочное) квантовое
- 73. 3. Магнитное квантовое число m - определяет
- 74. Квантовые числа 4.Спиновое квантовое число s может
- 75. Спин характеризует собственный магнитный момент электрона.
- 76. Заполнение атомных орбиталей электронами Принцип Паули. Правило Хунда. Принцип устойчивости Клечковского.
- 77. Правила заполнения энергетических уровней 1) Запрет Паули
- 78. Планетарная модель атома берилия
- 79. Планетарная модель атома берилия 1s 2s 2p
- 80. Заполнение атомных орбиталей электронами 2) Принцип
- 81. Правила заполнения энергетических уровней Правило Хунда
- 82. Заполнение атомных орбиталей электронами 3) Принцип
- 83. В первую очередь заполняются те
- 84. С помощью электронных формул (конфигураций) можно показать
- 85. Пример: Углерод, №6, период II, группа
- 86. Алгоритм составления электронных формул. Записываем знак химического
- 87. Алгоритм составления электронных формул. Н + 1
- 88. 2 период Li + 3
- 89. 2 период F + 9
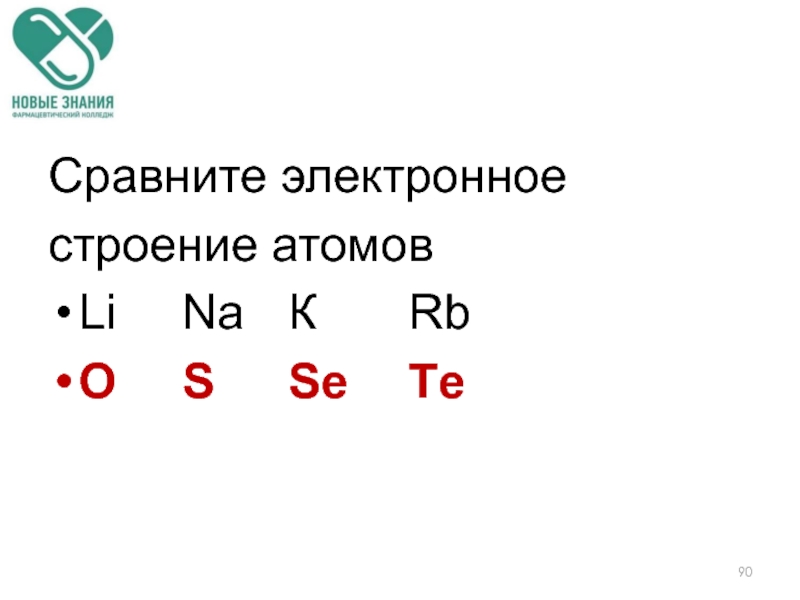
- 90. Сравните электронное строение атомов Li
- 92. Выводы Строение внешних энергетических уровней периодически повторяется, поэтому периодически повторяются и свойства химических элементов.
- 93. Атомы устойчивы лишь в некоторых стационарных состояниях,
- 94. Строение атома марганца: Mn +25
- 95. Значение переходных металлов для организма и жизнедеятельности.
- 96. Ионы Ион – положительно или отрицательно заряженная
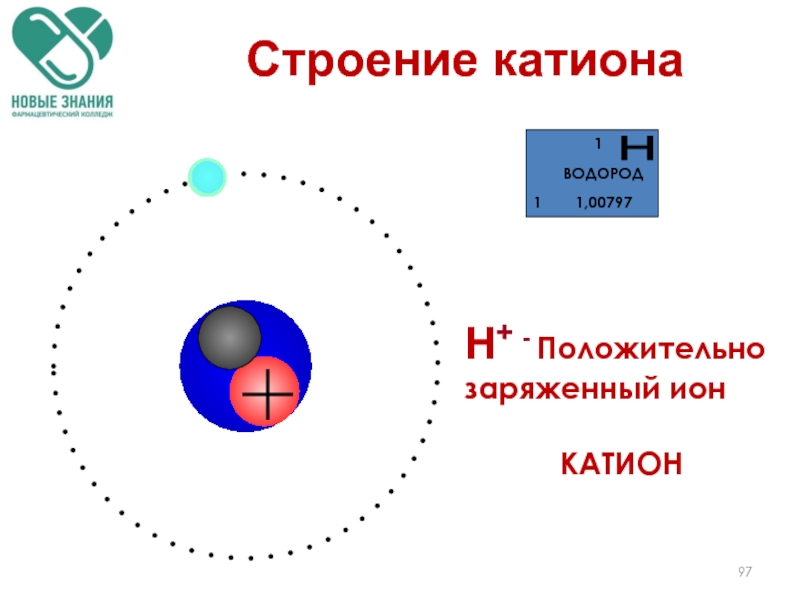
- 97. Строение катиона Н+ - Положительно заряженный ион КАТИОН
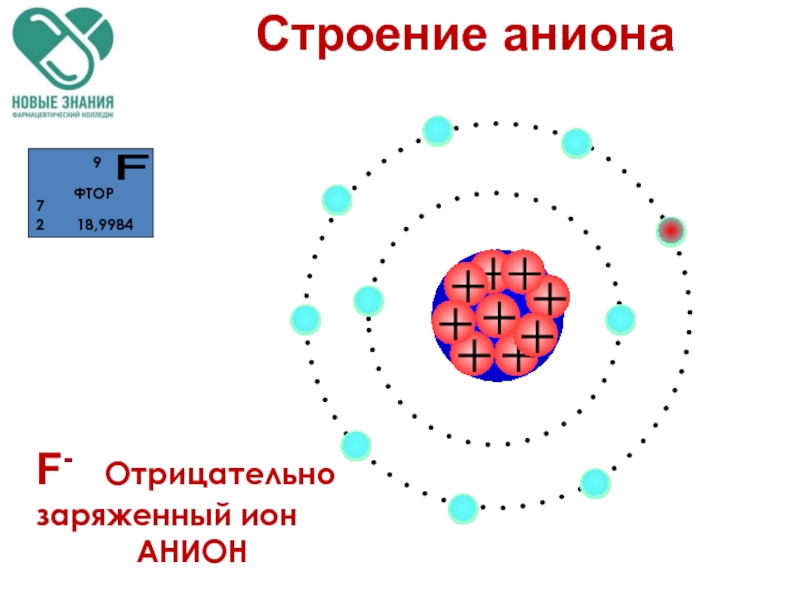
- 98. F- Отрицательно заряженный ион АНИОН
- 99. Строение атома https://www.youtube.com/watch?v=NP9x3Tiu3RE
- 100. Определите количество электронов для частиц: H+ Na+
- 101. ХАРАКТЕРИСТИКИ ЭЛЕМЕНТА Положение в ПСХЭ (порядковый номер,
- 102. Спасибо за внимание !
- 103. smoligra.ru newpictures.club/s-p-d-f-orbitals infourok.ru Использованные интернет – ресурсы: https://www.youtube.com/watch?v=3GbGjc-kSRw Интересные видео
- 104. Найдите соответствия элементов и их признаков:
- 105. Установите соответствия
Слайд 2 В основу своей классификации химических элементов Д.И. Менделеев положил два их
величину атомной массы
свойства образованных химическими элементами веществ.
Открытие Периодического закона
Слайд 3При этом он обнаружил, что свойства элементов в некоторых пределах изменяются
Открытие Периодического закона
Слайд 4На основании своих наблюдений 1 марта 1869 г. Д.И. Менделеев сформулировал
Первый вариант Периодической таблицы
Слайд 5Если написать ряды один под другим так, чтобы под литием находился
Li Be B C N O F Ne
Na Mg Al Si P S Cl Ar
При таком расположении в вертикальные столбики
попадают элементы, сходные по своим свойствам.
Периодический закон
Д.И. Менделеева
Слайд 6Периодический закон
Д.И. Менделеева
Современная трактовка Периодического закона:
Свойства химических элементов и образуемых ими
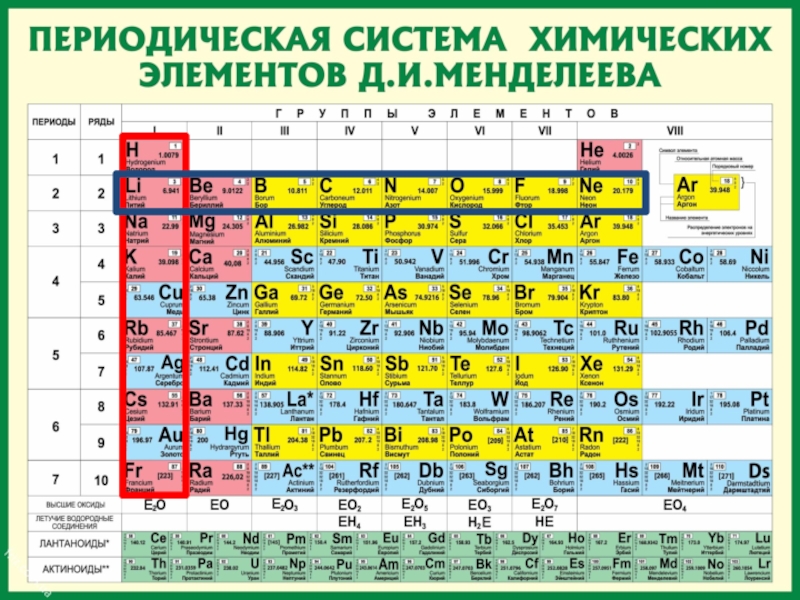
Слайд 9Периоды
Периоды - горизонтальные ряды химических элементов, всего 7 периодов. Периоды делятся
Слайд 10Каждый период (за исключением первого) начинается типичным металлом (Li, Nа, К,
Периоды
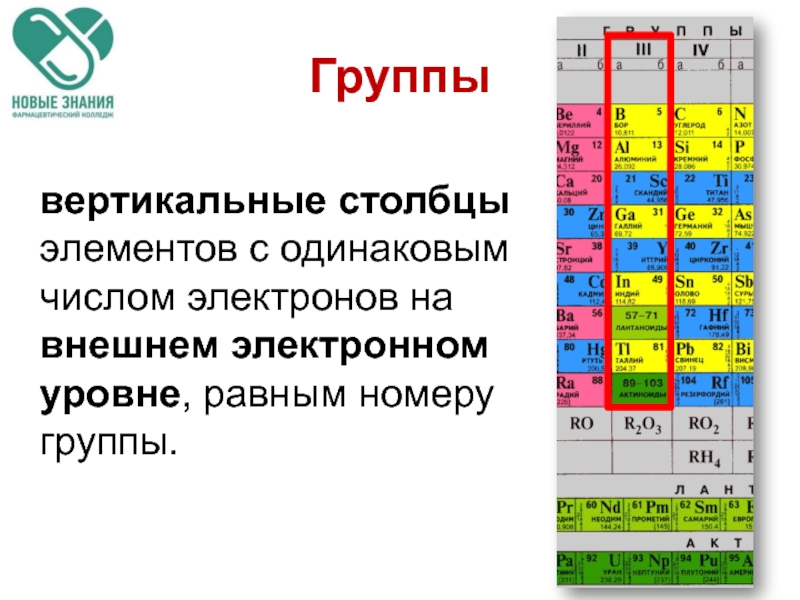
Слайд 11Группы
вертикальные столбцы элементов с одинаковым числом электронов на внешнем электронном уровне,
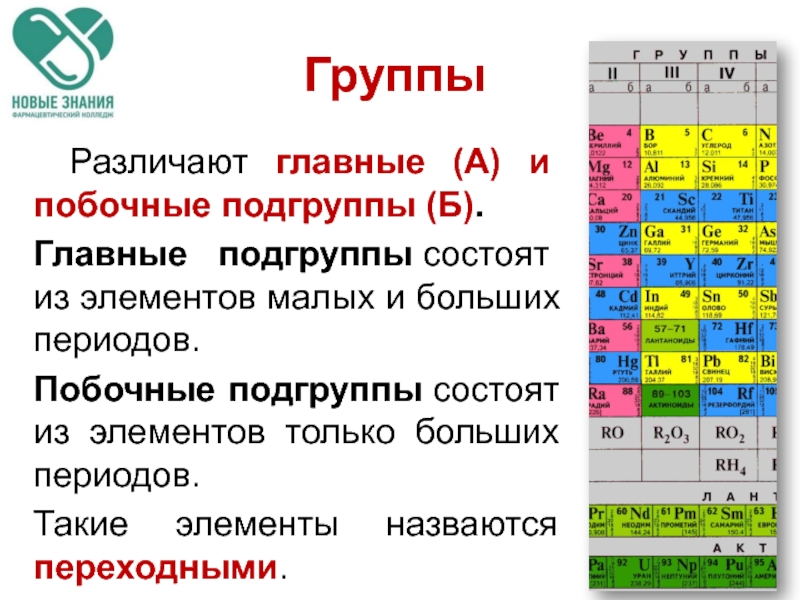
Слайд 12 Различают главные (А) и побочные подгруппы (Б).
Главные подгруппы состоят из элементов
Побочные подгруппы состоят из элементов только больших периодов.
Такие элементы назваются переходными.
Группы
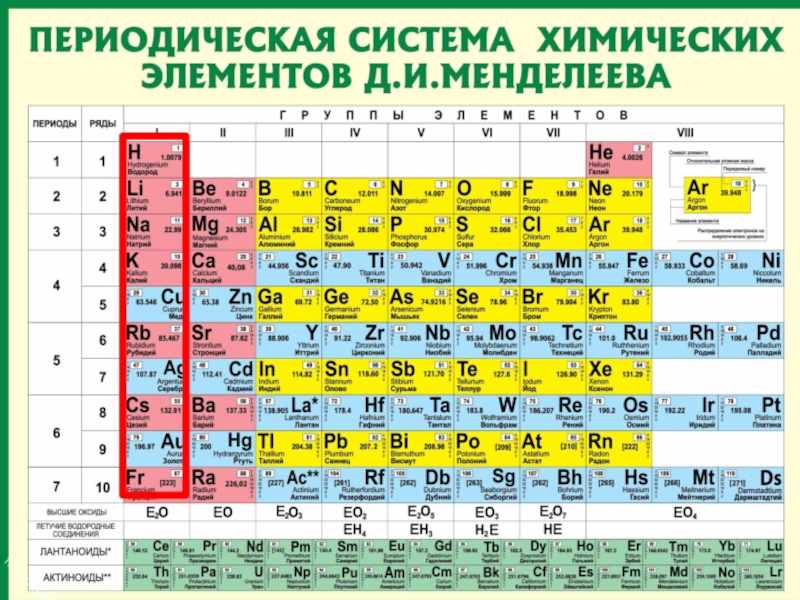
Слайд 14
Периодическая таблица
химических элементов
Запомнить!!!
Номер периода = число энергетических
Номер группы = число внешних электронов атома.
(Для элементов главных подгрупп)
Слайд 16Валентность
Элементы IV, V, VI и VII групп образуют летучие водородные соединения.
Номер
8-№группы
Слайд 18Задание:
Назовите в каком периоде и в какой группе, подгруппе находятся следующие
Натрий, Медь, Углерод, Сера, Хлор, Хром, Железо, Бром
Слайд 19 Радиус атома уменьшается с увеличением зарядов ядер атомов в периоде.
Изменение
Слайд 20 В одной группе с увеличением номера периода атомные радиусы возрастают.
Изменение
Слайд 22Задание:
Сравните радиусы следующих химических элементов:
Литий, натрий, калий
Бор, углерод, азот
Кислород, Сера, селен
Йод,
Хлор, сера, фосфор
Слайд 23Электроотрицательность - это способность атома притягивать электронную плотность.
Электроотрицательность в периоде
Электроотрицательность
Слайд 24Электроотрицательность в группе увеличивается с уменьшением числа электронных слоев атома (снизу
Самым электроотрицательным элементом является фтор (F), а наименее электроотрицательным – франций (Fr).
Слайд 25Li
0,98
Na
0,93
К
0,91
Rb
0,89
Be
1,5
Mg
1,2
Ca
1,04
Sr
0,99
В
2,0
Al
1,6
Ga
1,8
In
1,5
С
2,5
Si
1,9
Ge
2,0
Sn
1,7
N
3,07
P
2,2
As
2,1
Sb
1,8
О
3,5
S
2,6
Se
2,5
Те
2,1
F
4,0
Сl
3,0
Br
2,8
I
2,6
Н
2,1
ОТНОСИТЕЛЬНАЯ ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ
АТОМОВ
Слайд 26Задание:
Сравните ЭО следующих химических элементов:
Натрий и кислород
Углерод и водород
Кислород и фтор
Бор
Йод, фтор
Хлор, фосфор
Слайд 27Восстановительные свойства атомов - способность терять электроны при образовании химической связи.
Окислительные свойства атомов -способность принимать электроны при образовании химической связи.
Окислительно-восстановительные
свойства
Слайд 28В главных подгруппах снизу вверх, в периодах – слева направо окислительные
Окислительно-восстановительные
свойства
Слайд 29Изменение свойств химических элементов
электроотрицательность
Окислительные и неметаллические свойства
Окислительные и неметаллические свойства
Слайд 31МЕТАЛЛОИДЫ
По своим химическим свойствам полуметаллы являются неметаллами, но по типу проводимости
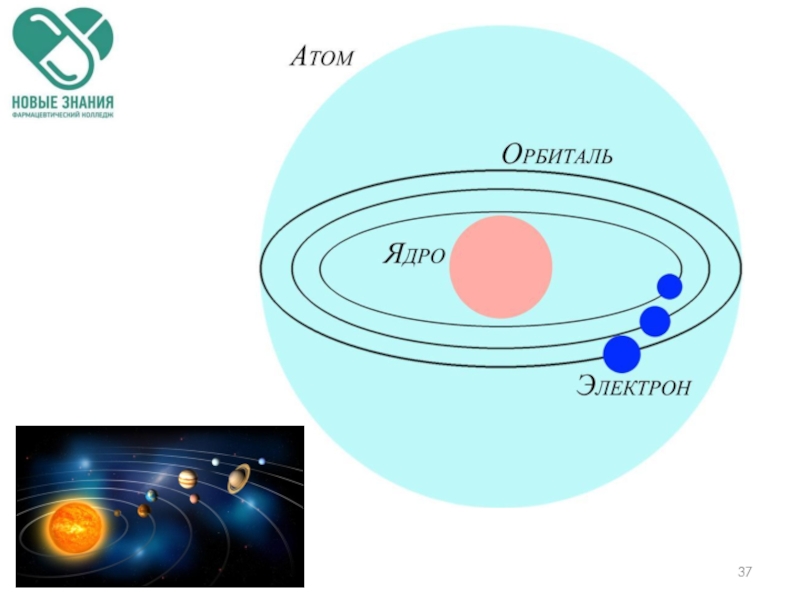
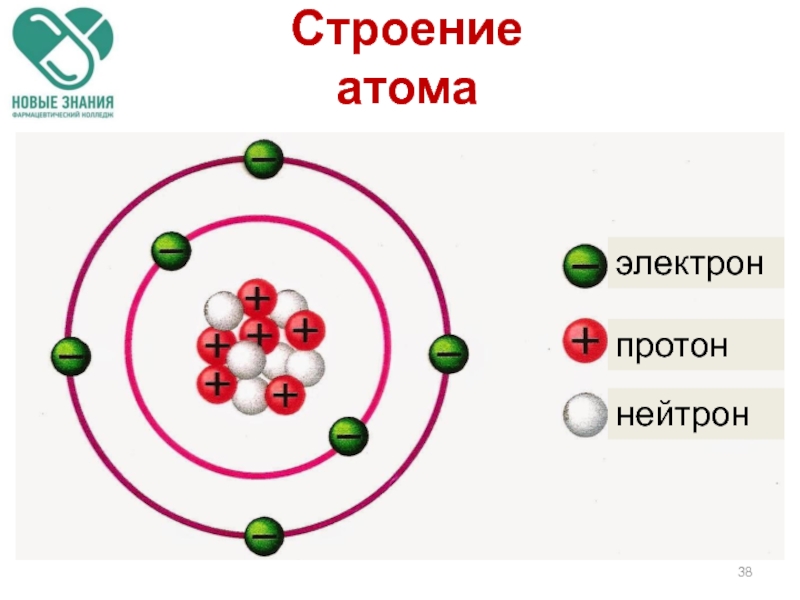
Слайд 361. В центре атома находится положительно заряженное ядро.
2. Весь положительный заряд
3. Ядра атомов состоят из протонов и нейтронов (нуклонов).
4. Вокруг ядра по замкнутым орбитам вращаются электроны.
Строение
атома
Слайд 39
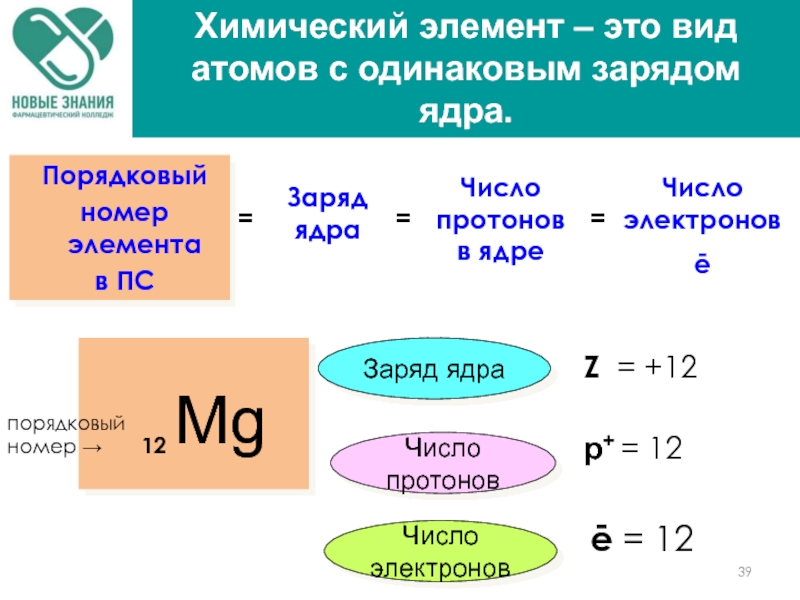
Mg
12
Z = +12
р+ = 12
порядковый номер →
ē = 12
Порядковый
номер элемента
в ПС
Число протонов
Число электронов
Заряд ядра
Химический элемент – это вид атомов с одинаковым зарядом ядра.
Слайд 40Число нейтронов
Во атомах одного химического элемента число
протонов р+ всегда одинаково
Слайд 41
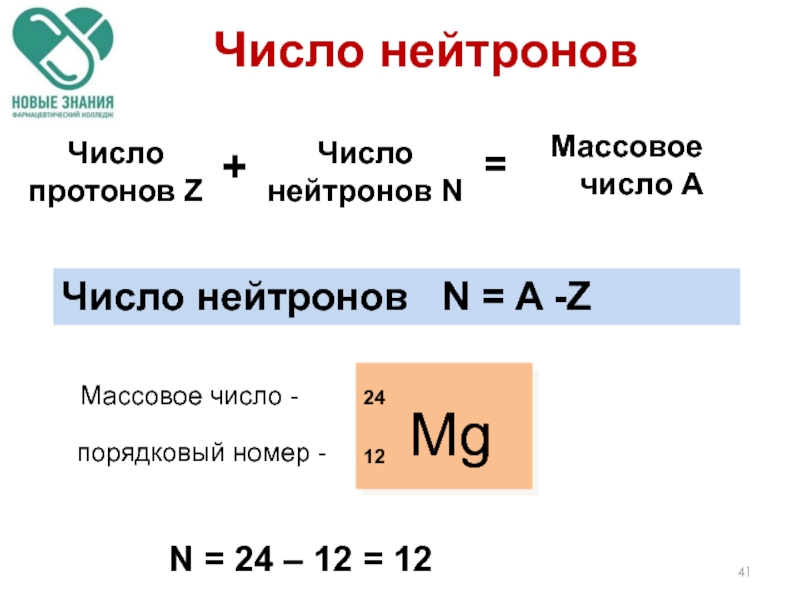
Массовое число А
Mg
24
12
Массовое число -
порядковый номер -
N = 24 –
Число нейтронов N = A -Z
Число протонов Z
Число нейтронов N
+
=
Число нейтронов
Слайд 42Примерные задания
Определите для предложенных ХЭ:
порядковый номер
массовое число
заряд ядра
кол-во
кол-во электронов
кол-во нейтронов
Слайд 46Электронная оболочка
Электрон в атоме находится в связанном состоянии с ядром и
Слайд 47Электрон не может обладать такой энергией, чтобы находиться между энергетическими уровнями.
Атом алюминия
Атом углерода
Атом
водорода
Электронная оболочка
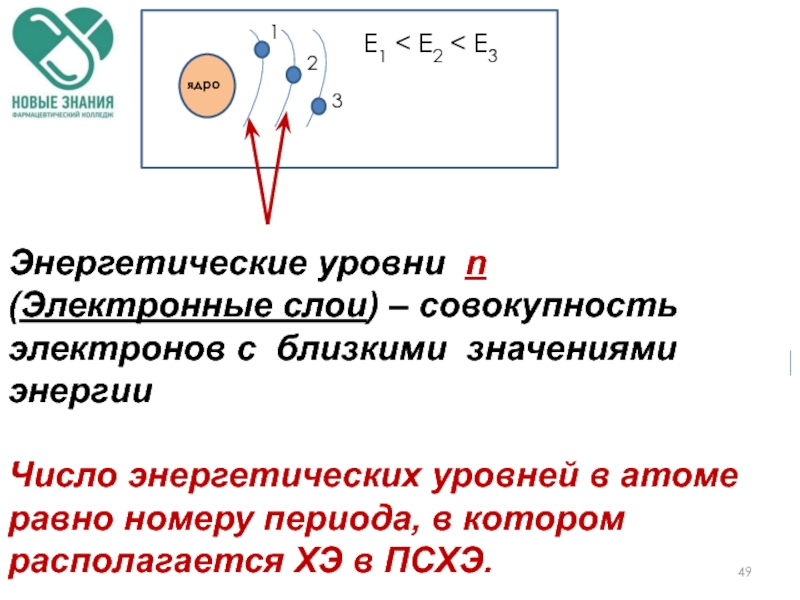
Слайд 49
1
2
3
Е1 < E2 < E3
Энергетические уровни n (Электронные слои) – совокупность
Число энергетических уровней в атоме равно номеру периода, в котором располагается ХЭ в ПСХЭ.
ядро
Слайд 51Распределение электронов по уровням
N=2n2 формула для вычисления максимального количества электронов на
1Й уровень - 2 электрона.
2Й уровень - 8 электронов.
3Й уровень - 18 электронов.
Слайд 55Схема электронного строения
Порядковый номер
заряд ядра +6, общее число ē
Углерод 6С находится во втором периоде
два энергетических уровня (в схеме изображают скобками, под ними пишут число электронов на данном энергетическом уровне):
6С +6 ) )
2 4
Слайд 57Энергетические уровни, содержащие максимальное число электронов, называются завершенными.
Они обладают
Энергетические уровни, содержащие меньшее число электронов, называются незавершенными
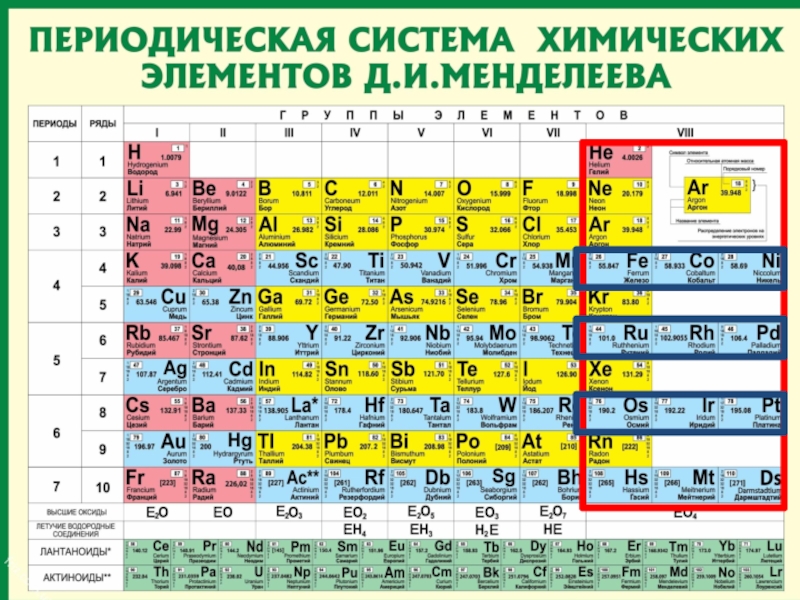
Слайд 59
Периодическая таблица
химических элементов
Число энергетических =
уровней атома.
Число внешних электронов = № группы
Слайд 62Каждый энергетический уровень состоит из подуровней: s, p, d, f.
Подуровень
Электронная орбиталь - область наиболее вероятного местонахождения электрона в пространстве
Строение энергетических уровней
Слайд 63Электронная орбиталь
Электроны S – подуровня при движении вокруг ядра образуют сферическое
S – облако
Граница
подуровней
Слайд 64Форма орбиталей
p – подуровня
Электроны p – подуровня образуют три
р – облака
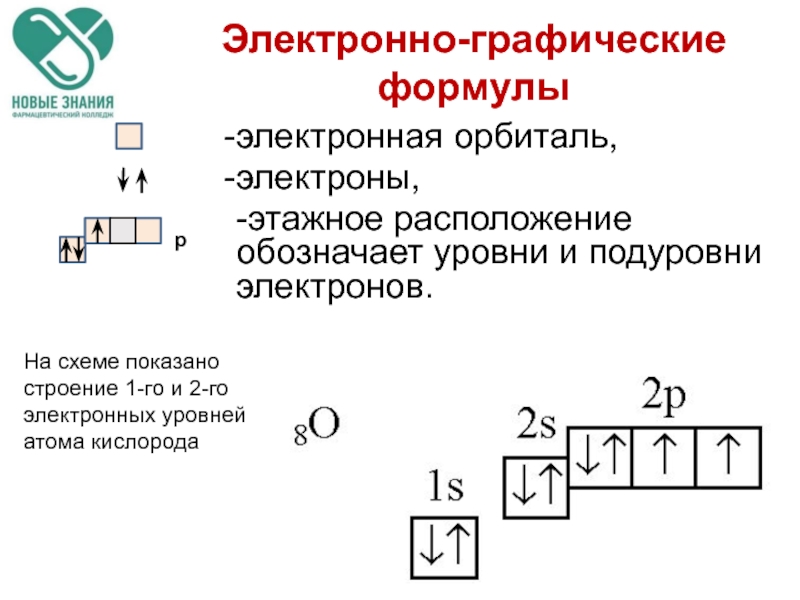
Слайд 68Электронно-графические формулы
электронная орбиталь,
электроны,
-этажное расположение обозначает уровни и подуровни электронов.
На схеме показано строение 1-го и 2-го электронных уровней атома кислорода
p
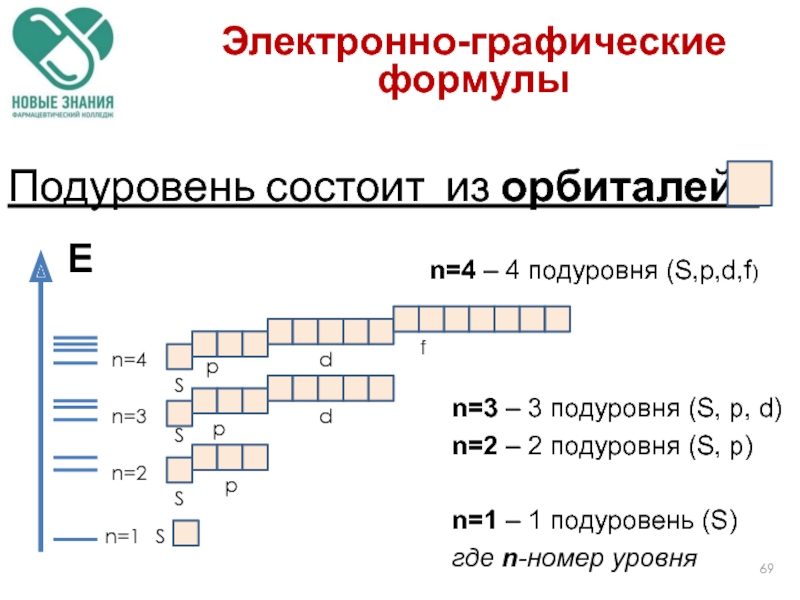
Слайд 69Е
n=1
n=2
n=3
n=4
S
p
d
f
S
S
S
p
p
d
Подуровень состоит из орбиталей -
n=3 – 3 подуровня (S, р, d)
n=2
n=1 – 1 подуровень (S)
где n-номер уровня
n=4 – 4 подуровня (S,р,d,f)
Электронно-графические формулы
Электронно-графические формулы
Слайд 70Состояние каждого электрона в атоме обычно описывают с помощью четырех квантовых
главного (n),
орбитального (l),
магнитного (m) и
спинового (s).
Первые три характеризуют движение электрона в пространстве, а четвертое - вокруг собственной оси.
Квантовые числа
Слайд 71Квантовые числа
- энергетические параметры, определяющие состояние электрона и тип атомной орбитали,
1. Главное квaнтовое число n определяет общую энергию электрона и степень его удаления от ядра (номер энергетического уровня);
n = 1, 2, 3, . . .
Слайд 72 Квантовые числа
2. Орбитальное (побочное) квантовое число l определяет форму атомной
Значения от 0 до n-1 (l = 0, 1, 2, 3,..., n-1).
Каждому значению l соответствует орбиталь особой формы.
l = 0 - s-орбиталь,
l = 1 - р-орбиталь, l = 2 - d-орбиталь,
l = 3 - f-орбиталь
Слайд 733. Магнитное квантовое число m
- определяет ориентацию орбитали в пространстве относительно
m = 2 l +1
Значения изменяются от +l до -l, включая 0.
Например, при l = 1 число m принимает
3 значения: +1, 0, -1, поэтому существуют
3 типа р-АО: рx, рy, рz.
Слайд 74Квантовые числа
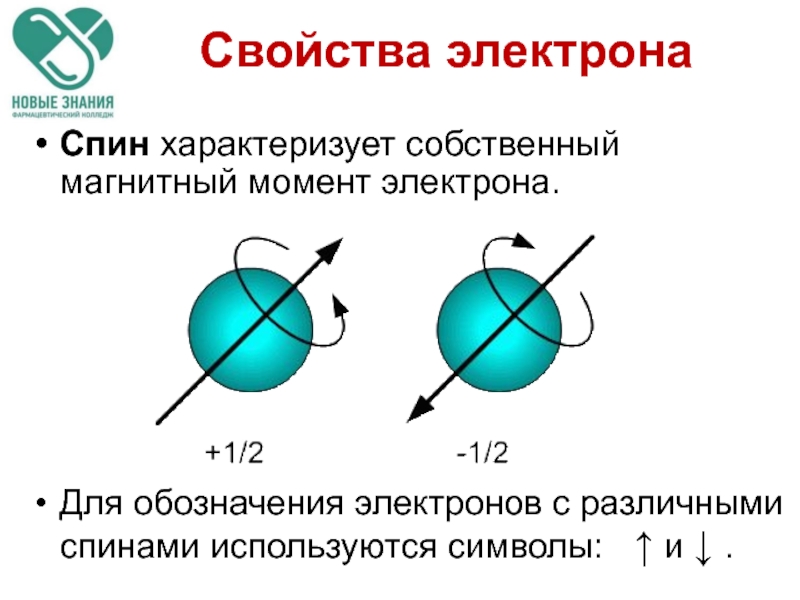
4.Спиновое квантовое число s может принимать лишь два возможных значения
Они соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона, называемого спином.
Для обозначения электронов с различными спинами используются символы: ↑ и ↓ .
Слайд 75Спин характеризует собственный магнитный момент электрона.
Для обозначения электронов с различными спинами
Свойства электрона
Слайд 76Заполнение атомных орбиталей электронами
Принцип Паули.
Правило Хунда.
Принцип устойчивости Клечковского.
Слайд 77Правила заполнения энергетических уровней
1) Запрет Паули
На одной АО могут находится не
Запрещено!
Разрешено
В атоме не может быть двух электронов с одинаковым набором всех четырех квантовых чисел.
Слайд 80Заполнение атомных орбиталей электронами
2) Принцип Хунда:
Устойчивому состоянию атома соответствует такое
Разрешено
Запрещено!
Слайд 81Правила заполнения энергетических уровней
Правило Хунда
Если, например, в трех
p-ячейках атома азота
p-орбиталях:
в этом случае суммарный спин равен +3/2 , поскольку его проекция равна
ms = +1/2+1/2+1/2=+3/2 .
Эти же три электрона не могут быть расположены
таким образом,
потому что тогда проекция суммарного спина
ms = +1/2-1/2+1/2=+1/2 .
Запрещено!
Разрешено
Слайд 82Заполнение атомных орбиталей электронами
3) Принцип устойчивости Клечковского.
АО заполняются
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d
Слайд 83 В первую очередь заполняются те орбитали, у которых min
При равных суммах (n+l) заполняются те, у которых n меньше
1s < 2s < 2p < 3s < 3p < 4s < 3d ...
4s (4+0=4)
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d
Принцип устойчивости Клечковского.
Слайд 84С помощью электронных формул (конфигураций) можно показать распределение электронов по энергетическим
1s2 2s22p6 3s23p6
ЭЛЕКТРОНАЯ ФОРМУЛА
АТОМА
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d
3d0
4s2
Слайд 85
Пример: Углерод, №6, период II, группа IVA.
С+6 ) )
Электронная формула: 1s2 2s22p2
ЭЛЕКТРОННАЯ ФОРМУЛА
Схема электронного
строение атома
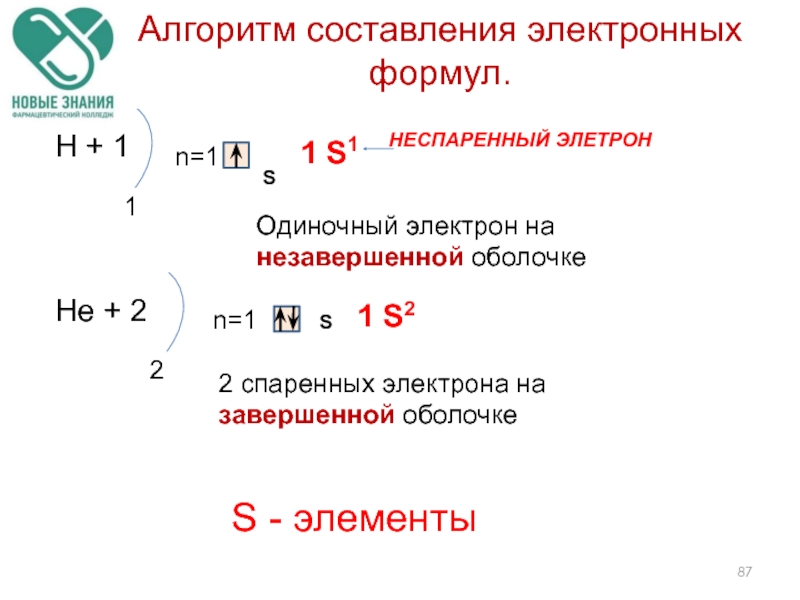
Слайд 86Алгоритм составления электронных формул.
Записываем знак химического элемента и заряд ядра его
Определяем количество энергетических уровней (№ периода) и количество электронов на каждом уровне.
Составляем электронную формулу, учитывая номер уровня, вид орбитали и количество электронов на ней (принцип Клечковского).
Слайд 87Алгоритм составления электронных формул.
Н + 1
1
n=1
S
1 S1
Нe + 2
2
n=1
S
1 S2
Одиночный электрон
2 спаренных электрона на завершенной оболочке
S - элементы
НЕСПАРЕННЫЙ ЭЛЕТРОН
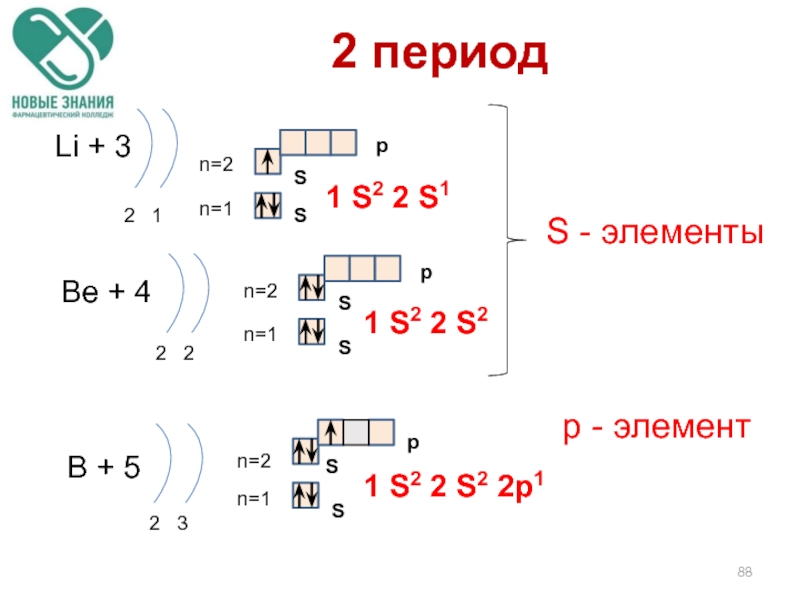
Слайд 882 период
Li + 3
2 1
n=1
n=2
1 S2 2 S1
Be + 4
2
n=1
n=2
1 S2 2 S2
B + 5
2 3
n=1
n=2
1 S2 2 S2 2p1
S - элементы
р - элемент
S
S
S
S
S
S
p
p
p
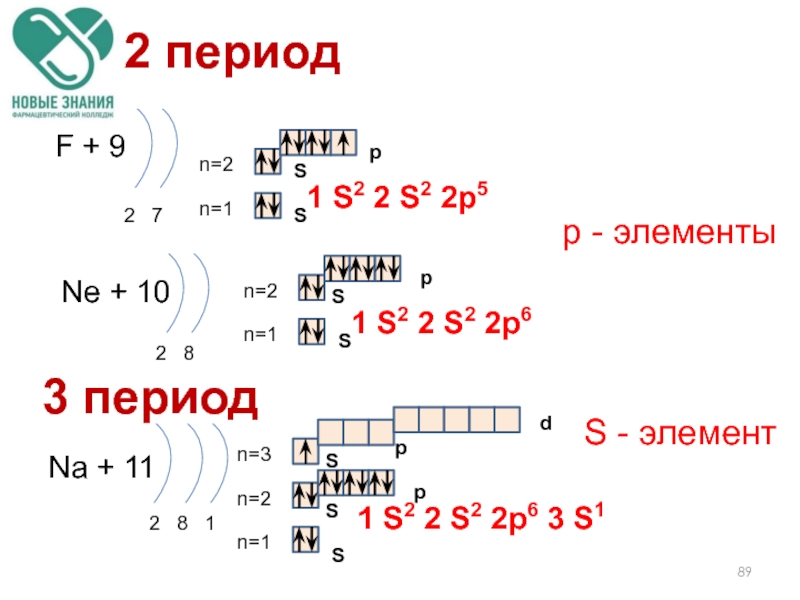
Слайд 89
2 период
F + 9
2 7
n=1
n=2
Ne + 10
2 8
n=1
n=2
Na +
2 8 1
n=1
n=2
1 S2 2 S2 2p6 3 S1
р - элементы
1 S2 2 S2 2p5
1 S2 2 S2 2p6
3 период
S - элемент
S
S
S
S
S
S
S
p
p
p
p
d
n=3
Слайд 92Выводы
Строение внешних энергетических уровней периодически повторяется, поэтому периодически повторяются и
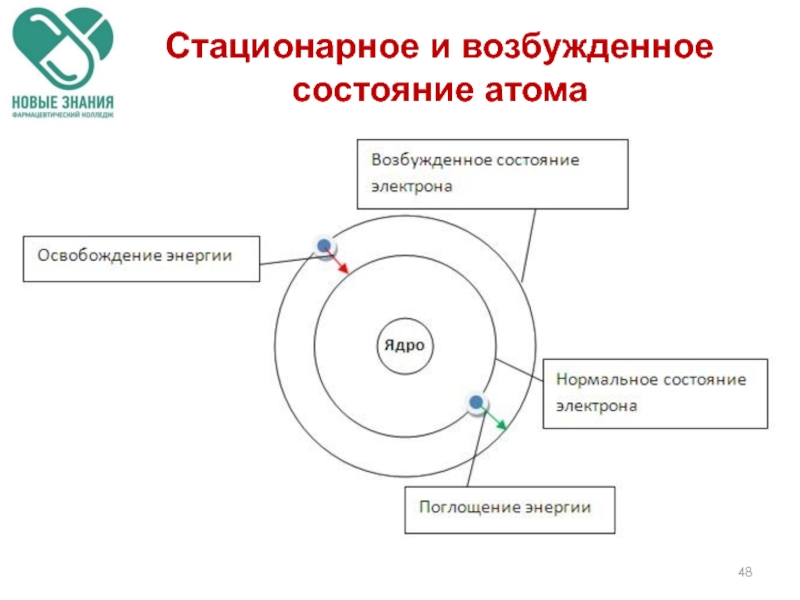
Слайд 93Атомы устойчивы лишь в некоторых стационарных состояниях, которым отвечают определенные значения
Наинизшее из разрешённых энергетических состояний атома называется основным, а все остальные — возбуждёнными.
Возбужденные состояния атомов образуются из основного состояния при переходе одного или нескольких электронов с занятых орбиталей на свободные (или занятые лишь
1 электроном)
Состояния атомов
Слайд 94Строение атома марганца:
Mn +25 ) ) ) )
2 8 13 2
1s22s22p63s23p64s23d54p0
1s
2s
2p
3p
3s
3d
4s
3d
4s
4p
возбужденное состояние атома
основное состояние атома
d - элемент
Слайд 95Значение переходных металлов для организма и жизнедеятельности.
Без переходных металлов наш организм
Железо – это действующее начало гемоглобина.
Цинк участвует в выработке инсулина. Кобальт – центр витамина В-12.
Медь, марганец и молибден, а также некоторые другие металлы входят в состав ферментов.
Слайд 96Ионы
Ион – положительно или отрицательно заряженная частица, образованная при отдаче или
Катион – (+) заряженная частица, Kat
Анион – (-) заряженная частица, An
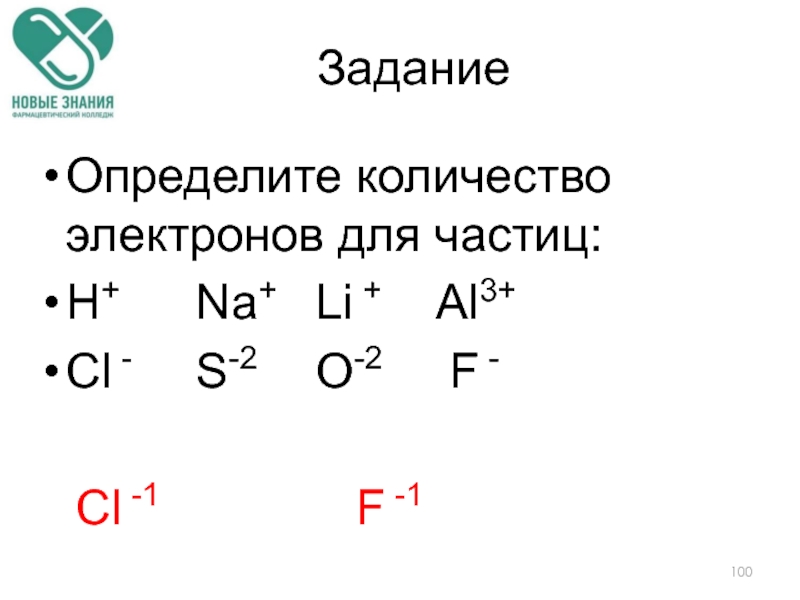
Слайд 100Определите количество электронов для частиц:
H+ Na+ Li + Аl3+
Сl - S-2 O-2 F
Сl -1 F -1
Задание
Слайд 101ХАРАКТЕРИСТИКИ ЭЛЕМЕНТА
Положение в ПСХЭ (порядковый номер, относительная атомная масса, период (какой),
Состав ядра атома, общее число электронов в электронной оболочке, схема строения электронной оболочки.
Металл, неметалл, переходный металл.
Сравнение металлических (неметаллических) свойств с соседними по периоду и подгруппе элементами.
Электроотрицательность, то есть сила притяжения электронов к ядру.