- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Оксид серы (VI). Серная кислота презентация
Содержание
- 1. Оксид серы (VI). Серная кислота
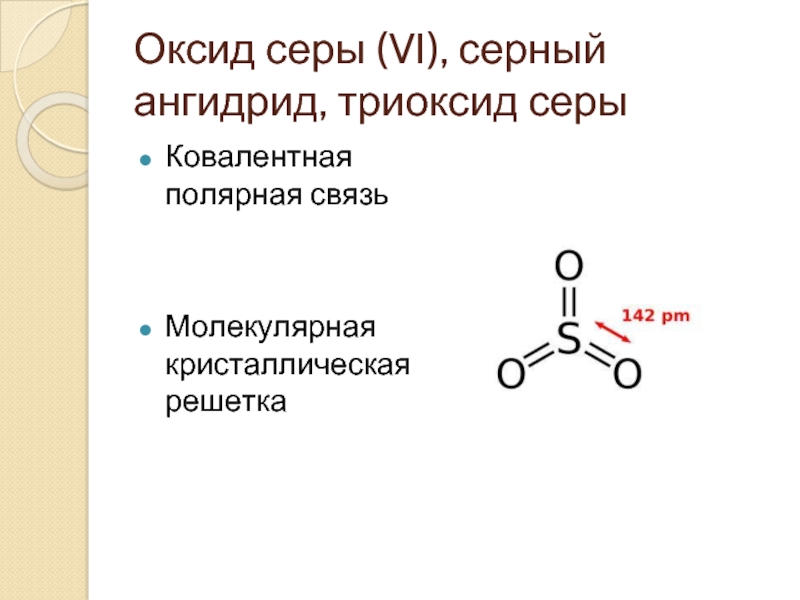
- 2. Оксид серы (VI), серный ангидрид, триоксид серы
- 3. Физические свойства серного ангидрида Бесцветная,
- 4. Химические свойства I. SO3 - представитель кислотных оксидов 1) 2) 3)
- 5. Получение оксида серы (VI) 1. Окисление оксида серы (IV)
- 6. H2SO4 серная кислота Дать классификацию серной кислоте.
- 7. Разбавление серной кислоты Относительно смешивания серной кислоты
- 8. Химические свойства серной кислоты разбавленная серная кислота
- 9. Качественная реакция на ион –SO42- Реактивом на
- 10. Концентрированная серная кислота
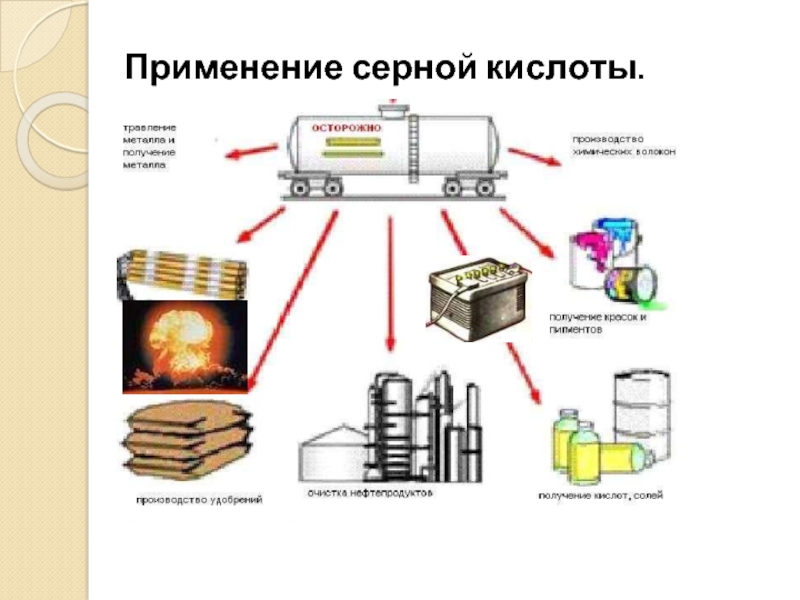
- 11. Применение серной кислоты.
- 12. Вулкан Малый Семячик Вулканический хребет длиной около
Слайд 2Оксид серы (VI), серный ангидрид, триоксид серы
Ковалентная полярная связь
Молекулярная кристаллическая решетка
Слайд 3Физические свойства серного ангидрида
Бесцветная, летучая, маслянистая жидкость, t° пл. =
17°C; t° кип. = 45°С; на воздухе "дымит", сильно поглощает влагу (хранят в запаянных сосудах
Слайд 7Разбавление серной кислоты
Относительно смешивания серной кислоты с водой с давних пор
существует строгое правило: «Сначала вода, потом кислота, иначе произойдет ужасное».
Если же сделать наоборот, то первые же порции воды, оставшись наверху (вода легче кислоты) и взаимодействуя с кислотой, разогреваются так сильно, что вскипают и разбрызгиваются вместе с кислотой; могут попасть в глаза, на лицо и одежду.
Если же сделать наоборот, то первые же порции воды, оставшись наверху (вода легче кислоты) и взаимодействуя с кислотой, разогреваются так сильно, что вскипают и разбрызгиваются вместе с кислотой; могут попасть в глаза, на лицо и одежду.
Слайд 8Химические свойства серной кислоты
разбавленная серная кислота проявляет все характерные свойства кислот:
С
оксидами металлов.(реакция обмена)
Н2SO4+MeO→MeSO4+H2O
2. С основаниями.(реакция обмена, реакция нейтрализации)
Н2SO4+Me(OН)n→MeSO4+H2O
3. С металлами.
Н2SO4+Me(до Н)→MeSO4(р)+H2↑(реакция замещения)
4.С солями( реакция обмена)
Н2SO4+MeR(Р)→MeSO4 (Р)+HR
(протекает в том случае, если образуется осадок или газ)
Н2SO4+MeO→MeSO4+H2O
2. С основаниями.(реакция обмена, реакция нейтрализации)
Н2SO4+Me(OН)n→MeSO4+H2O
3. С металлами.
Н2SO4+Me(до Н)→MeSO4(р)+H2↑(реакция замещения)
4.С солями( реакция обмена)
Н2SO4+MeR(Р)→MeSO4 (Р)+HR
(протекает в том случае, если образуется осадок или газ)
Слайд 9Качественная реакция на ион –SO42-
Реактивом на серную кислоту и ее соли
является катион бария , т.к. с ионами бария сульфат ион образует белый нерастворимый сульфат бария, выпадающий в осадок.
Ва2++SO42- = BaSO4↓
Ва2++SO42- = BaSO4↓
Слайд 10Концентрированная серная кислота
Ме+Н2SO4(кoнц)→МеSO4+H2O+(Н2S,S,SO2)
Серная
кислота(конц) восстанавливается до
(Н2S,S,SO2) в зависимости от активности металла и условий протекания реакции.
Железо и алюминий пассивируются кислотой, т.е покрываются защитной пленкой, поэтому кислоту(конц) можно перевозить в стальных и алюминиевых цистернах.
Сu+2H2SO4(конц)→CuSO4+2H2O+SO2
4Zn+5H2SO4(конц)→4ZnSO4+4H2O+H2S
Концентрированная серная кислота способна отнимать воду из молекул органических веществ, обугливая их.
Взаимодействие кислоты с сахарозой(C12H22O11)
C12H22O11 + 2H2SO4(конц) = 11C + 13H2O↑ +2SO2↑ +CO2↑
(Н2S,S,SO2) в зависимости от активности металла и условий протекания реакции.
Железо и алюминий пассивируются кислотой, т.е покрываются защитной пленкой, поэтому кислоту(конц) можно перевозить в стальных и алюминиевых цистернах.
Сu+2H2SO4(конц)→CuSO4+2H2O+SO2
4Zn+5H2SO4(конц)→4ZnSO4+4H2O+H2S
Концентрированная серная кислота способна отнимать воду из молекул органических веществ, обугливая их.
Взаимодействие кислоты с сахарозой(C12H22O11)
C12H22O11 + 2H2SO4(конц) = 11C + 13H2O↑ +2SO2↑ +CO2↑
Слайд 12Вулкан Малый Семячик
Вулканический хребет длиной около 3 км., на гребне которого
имеются три кратера.
В южном (кратер Троицкого) на глубине 170м. находится необычное кислое озеро.
Температура этого непрозрачного озера колеблется от +270С до +420С, а уровень минерализации соответствует раствору серной и соляной кислот средней концентрации.
Поражают размеры озера: ширина около полукилометра, а глубина - до 140м.
Существуют предположения, что кислотное озеро возникло сравнительно недавно в результате извержения вулкана, произошедшего незаметно для людей.
Кислотные озера