- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Гидролиз неорганических соединений презентация
Содержание
- 1. Гидролиз неорганических соединений
- 2. Что такое гидролиз? Гидролиз – реакция обменного
- 3. Исследование растворов солей индикаторами показало, что
- 5. Рассматривая соли, как продукт взаимодействия кислоты с
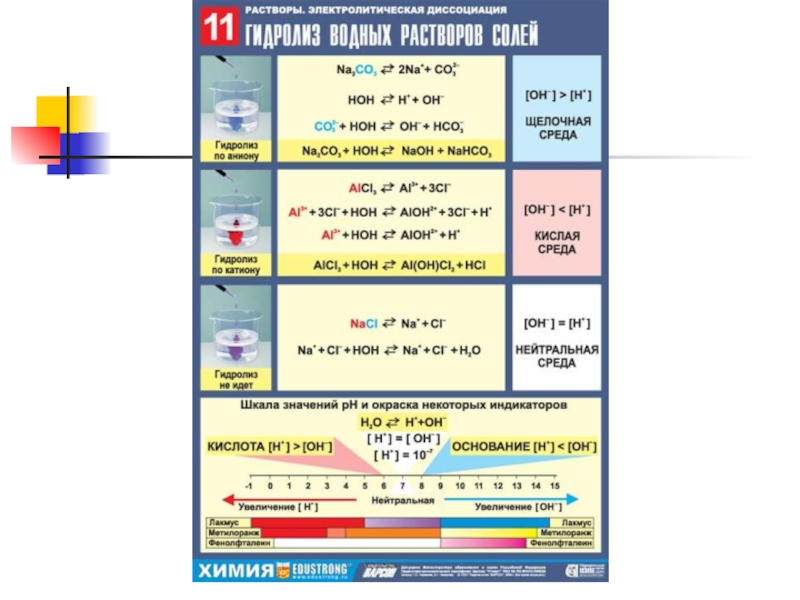
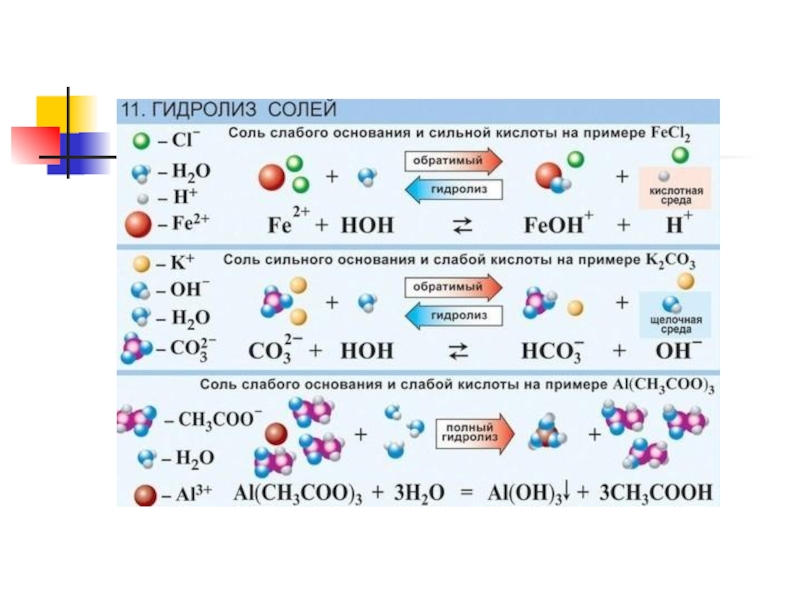
- 6. 1. гидролиз соли, образованной сильным основанием и
- 7. 2. гидролиз соли, образованной слабым основанием и
- 8. 3. гидролиз соли, образованной сильным основанием и
- 9. 4. гидролиз соли, образованной слабым основанием и
- 13. Выводы: Процесс гидролиза обратимый; В реакции гидролиза
Слайд 1Гидролиз неорганических соединений
Общая характеристика;
Гидролиз разных солей;
Связь с pH, применение.
Слайд 2Что такое гидролиз?
Гидролиз – реакция обменного разложения веществ водой.
Гидролиз – это
процесс взаимодействия ионов соли с водой, приводящий к образованию слабого электролита.
Слайд 3
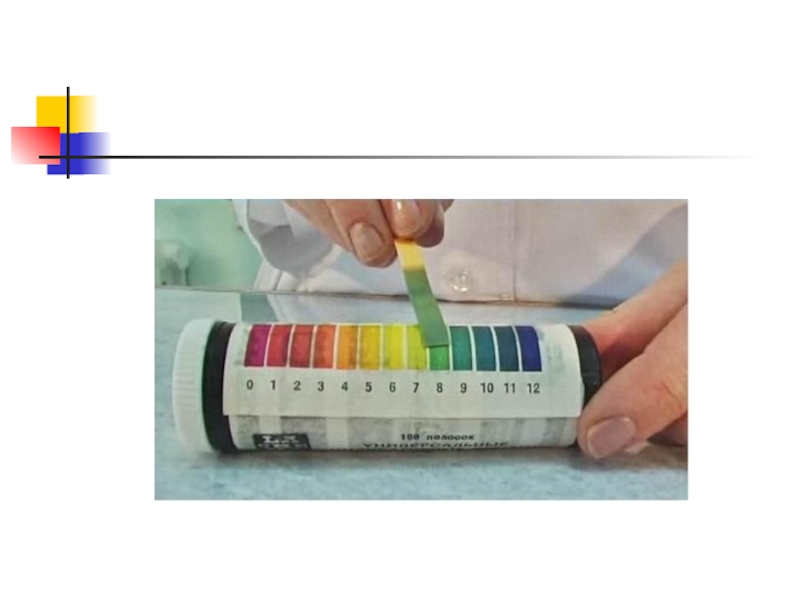
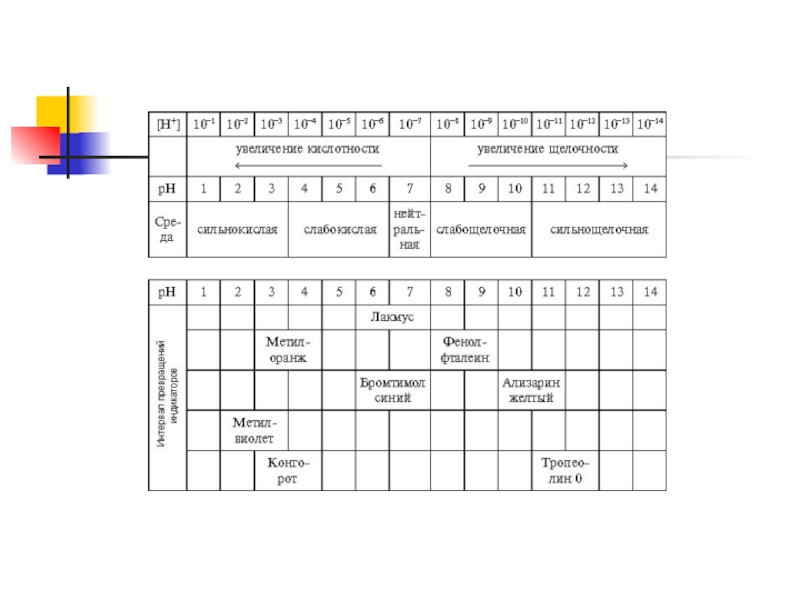
Исследование растворов солей индикаторами показало, что они могут характеризоваться нейтральной, кислой
и щелочной реакцией среды. При растворении многих солей в воде происходит взаимодействие ионов соли с катионами водорода и гидроксид-анионами. В растворе происходит накопление либо катионов водорода, либо гидроксид-анионов и раствор, соответственно, приобретает кислую или щелочную реакцию.
Слайд 5Рассматривая соли, как продукт взаимодействия кислоты с основанием, выделяют четыре типа
гидролиза в зависимости от силы исходных кислоты и основания.
Слайд 61. гидролиз соли, образованной сильным основанием и слабой кислотой
щелочная среда
протекает в
направлении накопления ионов гидроксо-группы (щелочная среда). Фенолфталеин малиновый.
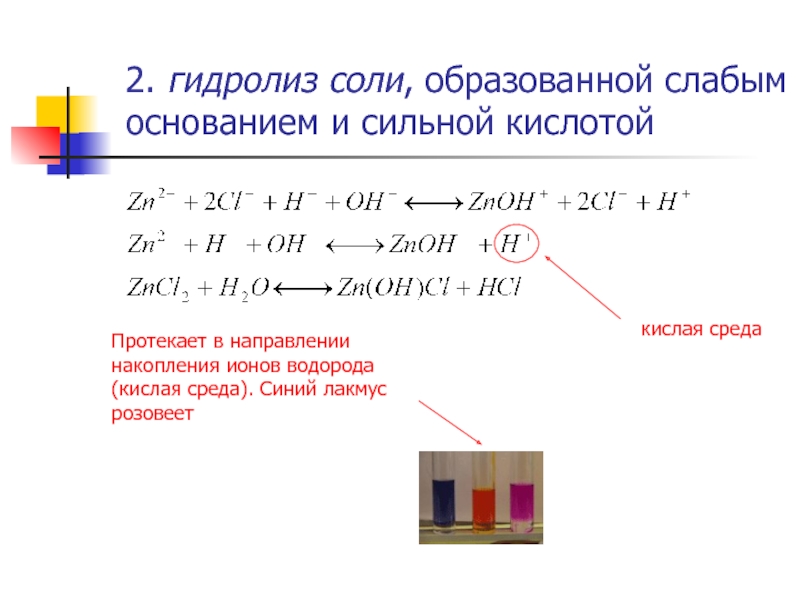
Слайд 72. гидролиз соли, образованной слабым основанием и сильной кислотой
кислая среда
Протекает в
направлении накопления ионов водорода (кислая среда). Синий лакмус розовеет
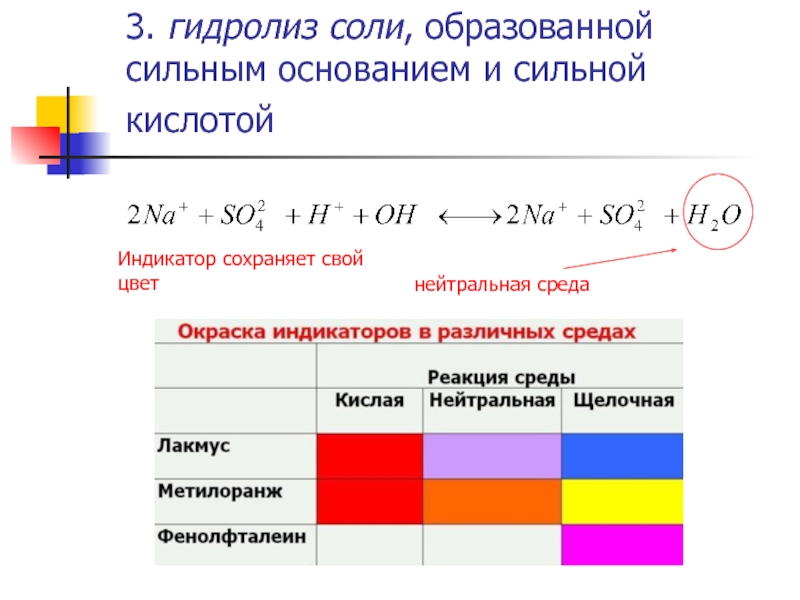
Слайд 83. гидролиз соли, образованной сильным основанием и сильной кислотой
нейтральная среда
Индикатор
сохраняет свой цвет
Слайд 94. гидролиз соли, образованной слабым основанием и слабой кислотой
гидролиз такой соли
не имеет смысла. Гидролиз идет и по катиону и по аниону. Реакция идет до конца с образованием соответствующих кислоты и основания. Реакция среды растворов таких солей зависит от относительной силы образующихся слабых кислот и оснований и может быть либо нейтральной, либо слабощелочной, либо слабокислой
Слайд 13Выводы:
Процесс гидролиза обратимый;
В реакции гидролиза участвуют одна молекула воды с одной
молекулой соли;
AgNO3 гидролизу не подвергается.
AgNO3 гидролизу не подвергается.