- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Номенклатура оснований. Классификация и примеры. Получение оснований. Химические свойства презентация
Содержание
- 1. Номенклатура оснований. Классификация и примеры. Получение оснований. Химические свойства
- 2. Номенклатура оснований Классификация и примеры Получение оснований Химические свойства
- 3. Названия оснований состоят из двух слов:
- 4. Класификация Основания
- 5. Гидроксид натрия
- 6. Гранулы гидроксидов калия и натрия расплываются, поглощая влагу из воздуха. Они очень гигроскопичны.
- 7. Водный раствор гидроксида калия
- 8. Пример нерастворимого основания – Сu(OH)2
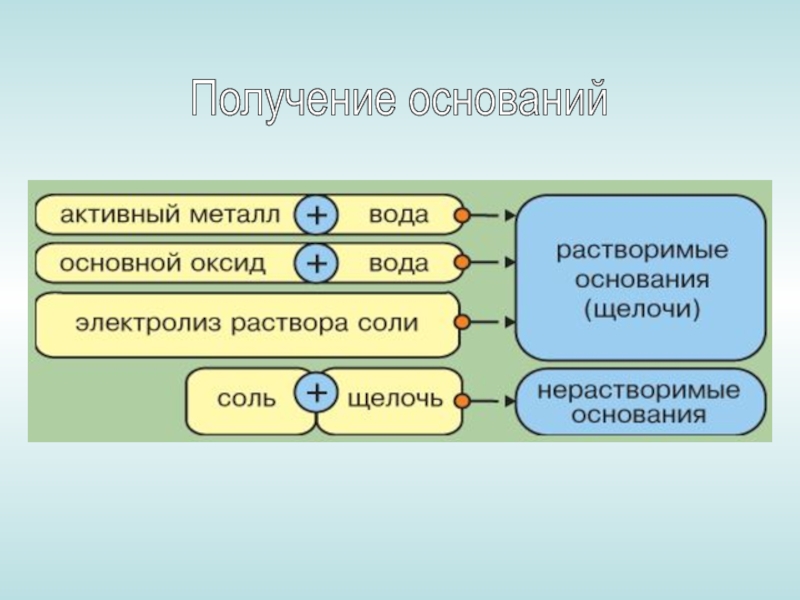
- 9. Получение оснований
- 10. 2Na + 2H2O = 2NaOH + H2
- 11. При растворении в воде оксида кальция образуется гидроксид кальция (малорастворимый)
- 12. Получение нерастворимых оснований: Соль + щёлочь
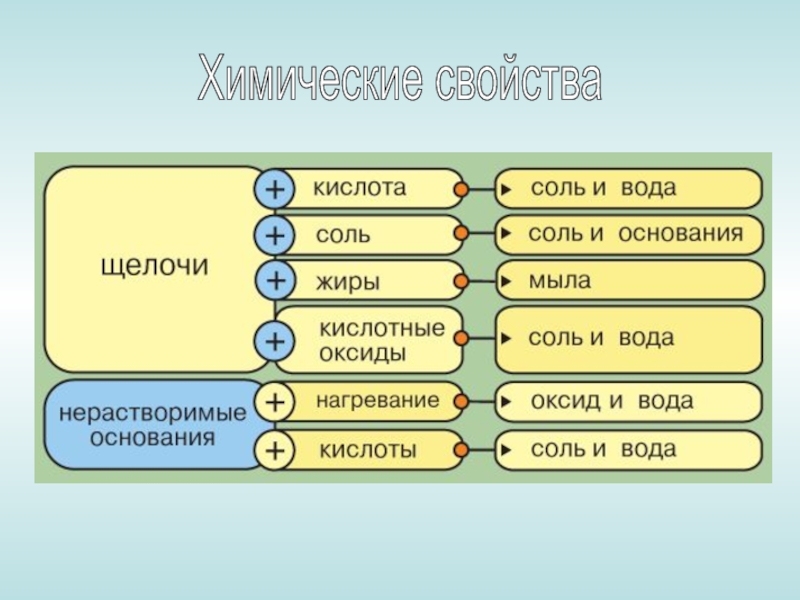
- 13. Химические свойства
- 14. Щёлочи изменяют окраску индикатора фенолфталеина (бесцветный – малиновый)
- 15. Реакция между основанием и кислотой называется реакцией
- 16. Взаимодействие щелочей с кислотными оксидами (на примере
- 17. Все щёлочи называют едкими, т. к. они разрушают бумагу, ткани, древесину.
- 18. Гидроксид калия повреждает ткань
- 19. Запомните: Основание – это сложное
Слайд 3Названия оснований состоят из двух слов:
гидроксид + металл
Если металл образует
соединения с разными степенями окисления, то степень окисления указывается после названия металла в скобках римской цифрой, например, гидроксид меди(II).
Гидроксид натрия NaOH
Гидроксид калия KOH
Гидроксид кальция Ca(OH)2
Гидроксид магния Mg(OH)2
Гидроксид алюминия Al(OH)3
Гидроксид железа (III) Fe(OH)3
Гидроксид меди (II) Cu(OH)2
Гидроксид никеля (II) Ni(OH)2
Число гидроксогрупп в молекуле гидроксида зависит от степени окисления металла.
Гидроксид натрия NaOH
Гидроксид калия KOH
Гидроксид кальция Ca(OH)2
Гидроксид магния Mg(OH)2
Гидроксид алюминия Al(OH)3
Гидроксид железа (III) Fe(OH)3
Гидроксид меди (II) Cu(OH)2
Гидроксид никеля (II) Ni(OH)2
Число гидроксогрупп в молекуле гидроксида зависит от степени окисления металла.
Основания – это сложные вещества, состоящие из атомов металлов и одной или нескольких гидроксогрупп (OH).
Слайд 6Гранулы гидроксидов калия и натрия расплываются, поглощая влагу из воздуха. Они
очень гигроскопичны.
Слайд 102Na + 2H2O = 2NaOH + H2
Натрий реагирует с водой с
образованием гидроксида натрия и водорода:
Натрий + вода = гидроксид натрия + водород
Натрий + вода = гидроксид натрия + водород
Слайд 12
Получение нерастворимых оснований:
Соль + щёлочь = новая соль + нерастворимое основание
CuSO4 NaOH Cu(OH)2
Слайд 15Реакция между основанием и кислотой называется реакцией нейтрализации. Реакции между кислотой
и щелочью следует проводить в присутствии индикатора.
2NaOH + H2SO4 = Na2SO4 + 2H2O
Mg(OH)2 + H2SO4 = MgSO4 + 2H2O
Как и щелочи, нерастворимые в воде основания взаимодействуют с кислотой с образованием соли и воды.
Mn(OH)2 + 2HCl = MnCl2 + 2H2O
Fe(OH)2 + H2SO4 = FeSO4 +2H2O
2NaOH + H2SO4 = Na2SO4 + 2H2O
Mg(OH)2 + H2SO4 = MgSO4 + 2H2O
Как и щелочи, нерастворимые в воде основания взаимодействуют с кислотой с образованием соли и воды.
Mn(OH)2 + 2HCl = MnCl2 + 2H2O
Fe(OH)2 + H2SO4 = FeSO4 +2H2O
Слайд 16Взаимодействие щелочей с кислотными оксидами
(на примере реакции углекислого газа с известковой
водой)
СО2 + Са(ОН)2 = СаСО3 + Н2О
СО2 + Са(ОН)2 = СаСО3 + Н2О
Слайд 19
Запомните:
Основание – это сложное вещество, состоящее из атомов металла и одной
или нескольких гидроксогрупп.
Гидроксогруппа всегда одновалентна.
Большинство оксидов металлов I и II А групп периодической системы реагируют с водой с образованием оснований.
Растворимые в воде основания называются щелочами.
При контакте с щелочами фенолфталеин окрашивается в малиновый цвет, метилоранж – в желтый, а универсальный индикатор и лакмусовая бумага – в синий.
Гидроксиды калия и натрия – едкие вещества. Они очень гигроскопичны. Растворение этих веществ в воде является экзотермическим процессом.
Гидроксогруппа всегда одновалентна.
Большинство оксидов металлов I и II А групп периодической системы реагируют с водой с образованием оснований.
Растворимые в воде основания называются щелочами.
При контакте с щелочами фенолфталеин окрашивается в малиновый цвет, метилоранж – в желтый, а универсальный индикатор и лакмусовая бумага – в синий.
Гидроксиды калия и натрия – едкие вещества. Они очень гигроскопичны. Растворение этих веществ в воде является экзотермическим процессом.