- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Растворы. Определения и понятия презентация
Содержание
- 1. Растворы. Определения и понятия
- 2. Определения и понятия Растворы – это гомогенные
- 3. Определения и понятия Растворимость – это способность
- 4. Растворимость Количественно растворимость (Р) выражают отношением массы
- 5. Физическая теория образования растворов. Основоположниками данной теории
- 6. Химическая теория образования растворов Основные тезисы химической
- 7. Гидраты (сольваты) возникают не за счет основных
- 8. При растворении веществ с молекулярной структурой сольваты
- 9. Современная теория образования растворов Современная теория растворения
- 10. Современная теория образования растворов Стадия гидратации экзотермическая,
- 11. Растворимость твердых веществ
- 12. Как правило с повышением температуры растворимость большинства
- 13. Растворимость газов На растворимость газов в жидкостях
- 14. Способы выражения концентрации 1. Массовая доля W
- 15. Способы выражения концентрации 3. Молярная концентрация (См)
- 16. Способы выражения концентрации 6. Титр (Т) показывает
- 17. Формулы перехода для бинарных растворов Формулы
- 18. Формулы пересчета массовой доли в молярную концентрацию
- 19. Зависимость между титром и молярной концентрацией эквивалента Формулы перехода для бинарных растворов
- 20. Классификация растворов По агрегатному состоянию: Газообразные
- 21. Классификация растворов 3. Растворы делят на насыщение,
- 22. Дисперсные системы Дисперсные системы это гетерогенные системы,
- 23. Идеальные растворы Раствор состоит из растворенного вещества
- 24. Закон Рауля. Коллигативные свойства растворов. Ф. Рауль
- 25. Закон Рауля. Коллигативные свойства растворов. Вторая
- 26. Коллигативные свойства растворов. Эбулиоскопия. Коллигативные свойства характерны
- 27. Криоскопия Уменьшение давления насыщенного пара над раствором
- 28. Осмос. Осмотическое давление. Процесс диффузии вещества
- 29. Закон Вант-Гоффа – Пфефера Осмотическое давление
- 30. Закон Вант-Гоффа – Пфефера В растворах
- 31. Изотоничность Кровь, лимфа и другие тканевые жидкости
- 32. Применение коллигативных свойств в медицине Коллигативные свойства
Слайд 2Определения и понятия
Растворы – это гомогенные термодинамически устойчивые системы, состоящие из
Раствор – это однородная система состоящая из двух и более компонентов: растворителя, растворенных веществ и продуктов их взаимодействия.
Слайд 3Определения и понятия
Растворимость – это способность вещества растворяться в том или
Растворитель – это то вещество, которого по массе или по объему больше.
Слайд 4Растворимость
Количественно растворимость (Р) выражают отношением массы вещества (г) к объему или
Р=m(вещества)/V(растворителя)
По растворимости вещества делят на:
1. Растворимые;
2. Малорастворимые;
3. Нерастворимые.
Слайд 5Физическая теория образования растворов.
Основоположниками данной теории являются Аррениус, Оствальд и Вант-Гофф.
Слайд 6Химическая теория образования растворов
Основные тезисы химической теории были представлены в 1887
Химическая теория рассматривает растворы, как системы, образованные частицами растворителя, растворенного вещества и неустойчивых химических соединений, которые образуются между ними.
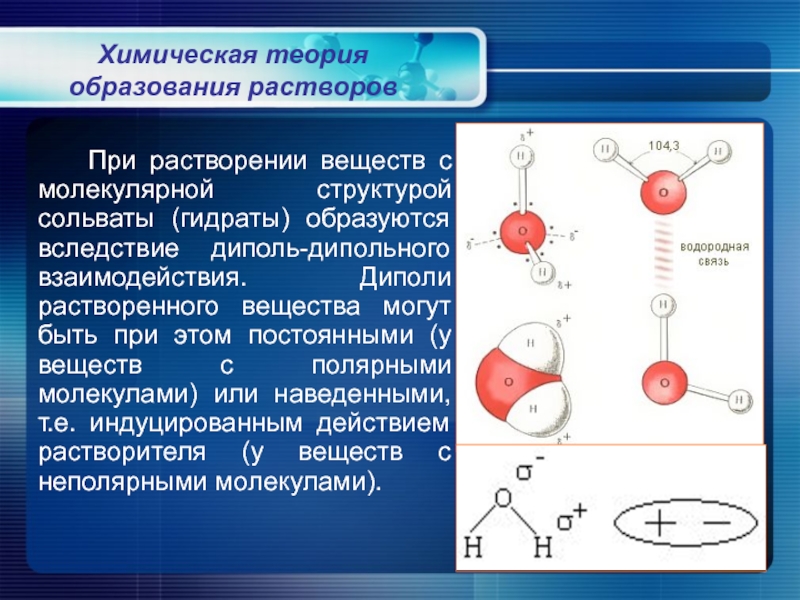
Слайд 7 Гидраты (сольваты) возникают не за счет основных химических связей, а за
Химическая теория образования растворов
Слайд 8 При растворении веществ с молекулярной структурой сольваты (гидраты) образуются вследствие диполь-дипольного
Химическая теория образования растворов
Слайд 9Современная теория образования растворов
Современная теория растворения объединяет физическую и химическую теории
1.Стадия гидратации (сольватации) на которой молекулы воды окружают молекулы вещества, образуя сольваты или гидраты.
2. На второй стадии происходит диффузия гидратов (сольватов) в различные части системы. Этот процесс приводит к однородности системы.
Слайд 10Современная теория образования растворов
Стадия гидратации экзотермическая, а стадия растворения эндотермическая. Общий
ΔНобщ=ΔНст. гидрат.+ΔНст. р-рения
Если ΔНст. гидрат.>ΔНст. р-рения, то при растворении таких веществ в воде выделяется тепло.
Например: растворение сульфатной кислоты в воде.
Если ΔНст. гидрат.<ΔНст. р-рения, то для растворения таких веществ в воде необходимо затратить энергию.
Например: растворение натрий тиосульфата в воде, растворение сахарозы в воде…
Если ΔНст. гидрат.≈ΔНст. р-рения, то на растворение таких веществ температурный фактор почти не влияет.
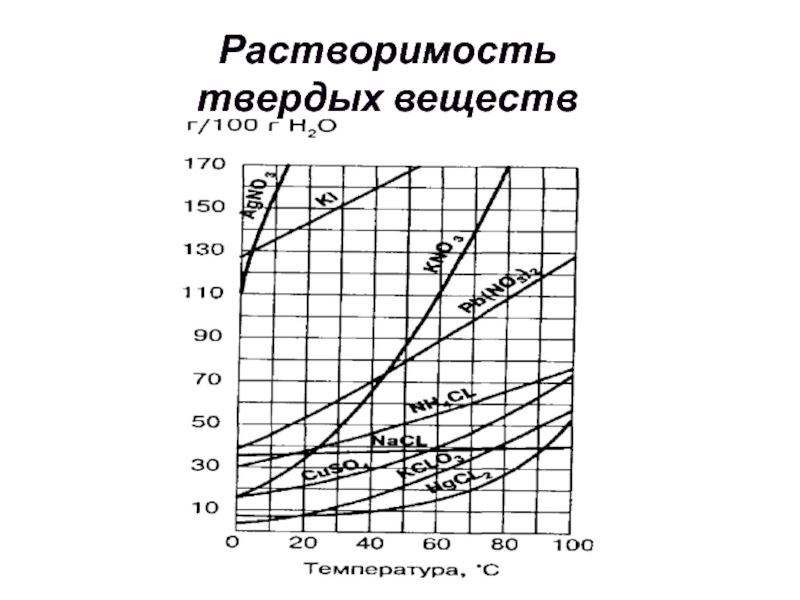
Слайд 12 Как правило с повышением температуры растворимость большинства твердых веществ повышается. При
Растворимость
твердых веществ
Слайд 13Растворимость газов
На растворимость газов в жидкостях оказывает влияние температура и давление.
Зависимость растворимости газов от давления выражают законом Генри:
Масса газа, который растворяется при постоянной температуре в данном объеме вещества, прямо пропорциональна порциальному давлению газа
W=kp,
Где W-массовая концентрация, р-давление, k-коэффициент пропорциональности (постоянная Генри)
Слайд 14Способы выражения концентрации
1. Массовая доля W – это отношение массы растворенного
Молярная доля Wm – это отношение количества растворенного вещества (n) к общему количеству всех веществ в растворе (Σn).
Слайд 15Способы выражения концентрации
3. Молярная концентрация (См) показывают какое количество вещетва (n)
4. Молярная концентрация эквивалента (Сн) показывает какое количество моль эквивалентов (nэк) растворенного вещества содержится в 1 литре раствора
Слайд 16Способы выражения концентрации
6. Титр (Т) показывает сколько граммов вещества (m в-ва)
5. Моляльность (Сm) показывает какое количество вещества (n) приходится на 1 кг растворителя (m р-ля)
Слайд 17Формулы перехода
для бинарных растворов
Формулы пересчета молярной концентрации в молярную концентрацию
1. Если Мэк = М
(например, для HCl, KOH, KCl), то пересчет делать не нужно,
Сн = СМ
2. Если Мэк ≠ М ,
См = Сн * fэк
Слайд 18Формулы пересчета массовой доли в молярную концентрацию и в молярную концентрацию
Формулы перехода
для бинарных растворов
Слайд 19Зависимость между титром и молярной концентрацией эквивалента
Формулы перехода
для бинарных растворов
Слайд 20Классификация растворов
По агрегатному состоянию:
Газообразные (воздух – N2+O2+He+CO2)
Жидкие (NaOH+H2O; NaCl + H2O)
Твердые
2. По способности проводить электрический ток:
Растворы электролитов - проводят электрический ток (водные растворы OH-,H+,солей)
Растворы не электролитов – не проводящие электрический ток (растворы большинства органических веществ и оксидов )
Слайд 21Классификация растворов
3. Растворы делят на насыщение, не насыщенные и пересыщенные
Насыщенные
4. По размеру частиц растворенного вещества
Истинные (размер частиц растворенного вещества приблизительно равен размеру молекул);
Коллоидные или дисперсные (частицы растворенного вещества имеют размеры, намного большие, чем у молекул
Слайд 22Дисперсные системы
Дисперсные системы это гетерогенные системы, которые характеризуются дисперсностью.
Дисперсность – это
К дисперсным системам относят суспензии и эмульсии.
Суспензиями называют микрогетерогенные системы с жидкой дисперсионной средой и твердой дисперсной фазой.
Эмульсиями называют дисперсные системы, в которых дисперсионная среда и дисперсионная фаза жидкие.
Слайд 23Идеальные растворы
Раствор состоит из растворенного вещества (А) и растворителя(В)
Между одноименными молекулами,
Идеальные растворы – это растворы у которых силы взаимодействия между одноименными и разноименными частицами равны и ими можно пренебречь.
Слайд 24Закон Рауля. Коллигативные свойства растворов.
Ф. Рауль установил, что:
Для идеальных (разбавленных) растворов
Р1=Р10Х1,
где Р10 - давление насыщенного пара чистого растворителя
Слайд 25Закон Рауля. Коллигативные свойства растворов.
Вторая формулировка данного закона: Относительное понижение давления
Относительное понижение давления насыщенного пара растворителя над раствором не зависит от природы растворенного вещества, а определяется только числом частиц в растворе. Такие свойства растворов называют коллигативными.
Слайд 26Коллигативные свойства растворов. Эбулиоскопия.
Коллигативные свойства характерны для растворов не электролитов. К
Температура кипения раствора нелетучего вещества всегда выше, чем температура кипения растворителя.
ΔТкип=Еm, где m-моляльность, Е-эбулиоскопическая постоянная
Эбулиоскопическая постоянная численно равна температуре кипения одномоляльного раствора.
Слайд 27Криоскопия
Уменьшение давления насыщенного пара над раствором приводит к понижению температуры его
ΔТзам=Кm, где m - моляльность, К - криоскопическая постоянная
Криоскопическая постоянная численно равна температуре замерзания одномоляльного раствора.
Слайд 28Осмос.
Осмотическое давление.
Процесс диффузии вещества через полунепроницаемую мембрану называют осмосом.
А то
Я, Вант-Гофф обнаружил, что осмотическое давление разбавленных растворов подчиняется законам идеального газа и сформулировал следующий закон, который носит название
закона Вант-Гоффа – Пфефера:
Слайд 29Закон
Вант-Гоффа – Пфефера
Осмотическое давление раствора равно такому давлению, которое имело
Расчет осмотического давления проводят по формуле:
Р=сRT, где с - молярная концентрация раствора (г/моль)
Слайд 30Закон
Вант-Гоффа – Пфефера
В растворах электролитов количество частиц в единице объема
Расчет осмотического давления растворов электролитов проводят по формуле:
Р=ісRT, где і - изотонический коэффициент, зависит от степени диссоциации электролита á и числа ионов n.
І=1+á(n-1)
Слайд 31Изотоничность
Кровь, лимфа и другие тканевые жидкости организма человека имеют осмотическое давление
Растворы с одинаковым осмотическим давлением называют изотоническими, с большим осмотическим давлением, чем какой-то стандарт – гипертоническими и с меньшим – гипотоническими.