- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Молекулярная адсорбция. (Лекция 2) презентация
Содержание
- 1. Молекулярная адсорбция. (Лекция 2)
- 2. Сорбция - гетерогенный процесс самопроизвольного поглощения твердым
- 3. Явление сорбции было открыто во второй половине
- 4. Классификация сорбционных процессов: I. В зависимости от
- 5. В качестве адсорбентов используют пористые твердые вещества:
- 6. Капиллярная конденсация - сжижение пара в порах
- 7. Количественные характеристики адсорбционных процессов Абсолютная адсорбция (А)
- 8. Важнейшей характеристикой адсорбционного процесса является зависимость А
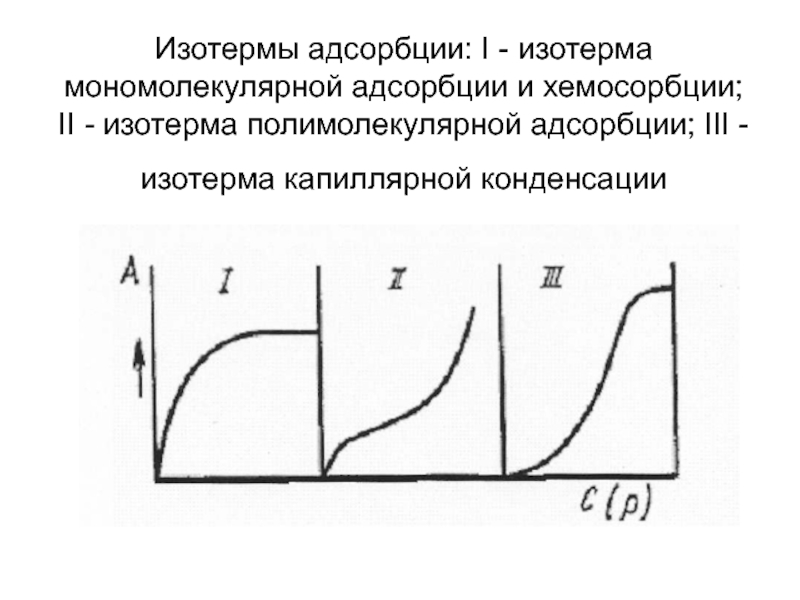
- 9. Изотермы адсорбции: I - изотерма мономолекулярной адсорбции
- 10. Зависимость Г от концентрации и поверхностного натяжения
- 11. Из уравнения Гиббса ясно, что величина избыточной
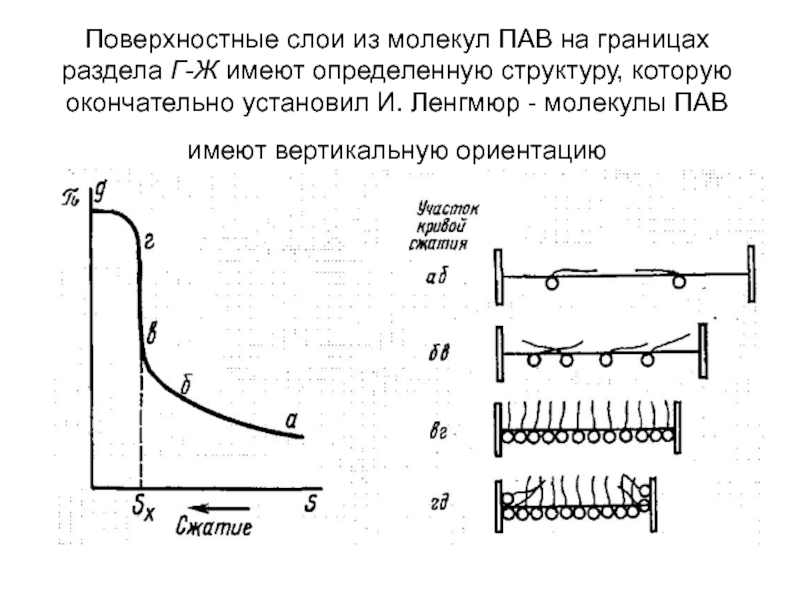
- 12. Поверхностные слои из молекул ПАВ на границах
- 13. Для описания адсорбции на границе Т-Ж необходимо
- 14. Экспериментальное изучение адсорбции из растворов твердыми веществами:
- 15. Величина удельной адсорбции для твердых сорбентов рассчитывается
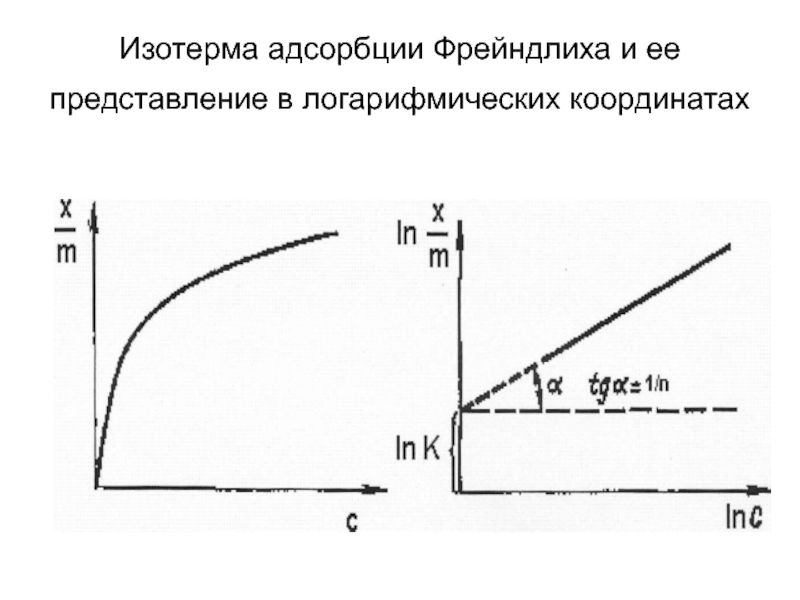
- 16. Изотерма адсорбции Фрейндлиха и ее представление в логарифмических координатах
- 17. Ход такой кривой для средних давлений или концентраций можно выразить эмпирическим уравнением Г. Фрейндлиха:
- 18. При логарифмировании уравнение Фрейндлиха переходит в линейную форму и изотерма имеет вид прямой
- 19. Линейная изотерма Фрейндлиха позволяет определить
- 20. В 1915 г Ленгмюр предложил теорию мономолекулярной
- 21. Основные положения теории Ленгмюра: Адсорбционные силы
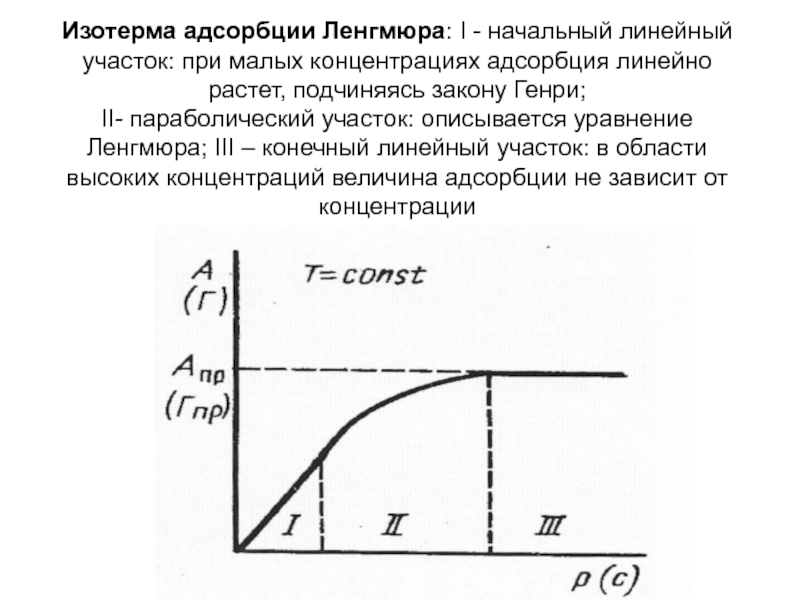
- 22. Изотерма адсорбции Ленгмюра: I - начальный линейный
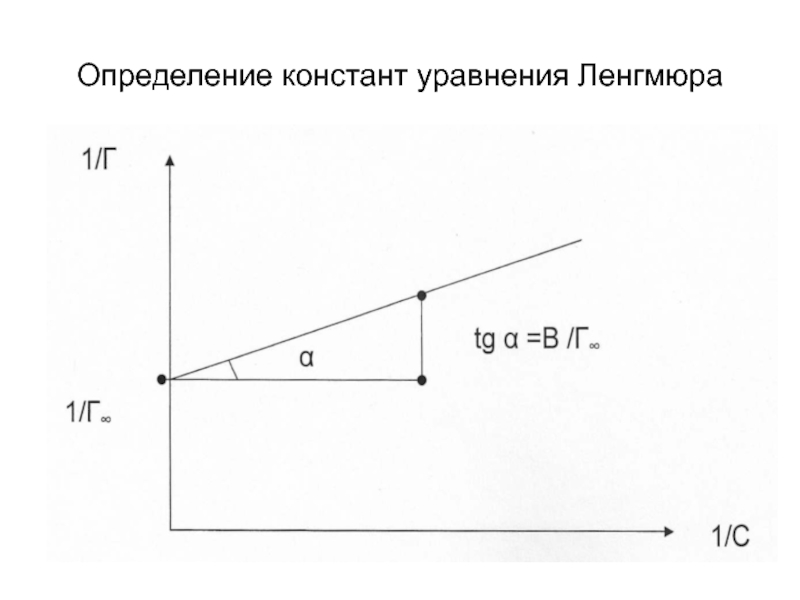
- 23. Уравнение Ленгмюра: Для определения констант
- 24. Определение констант уравнения Ленгмюра
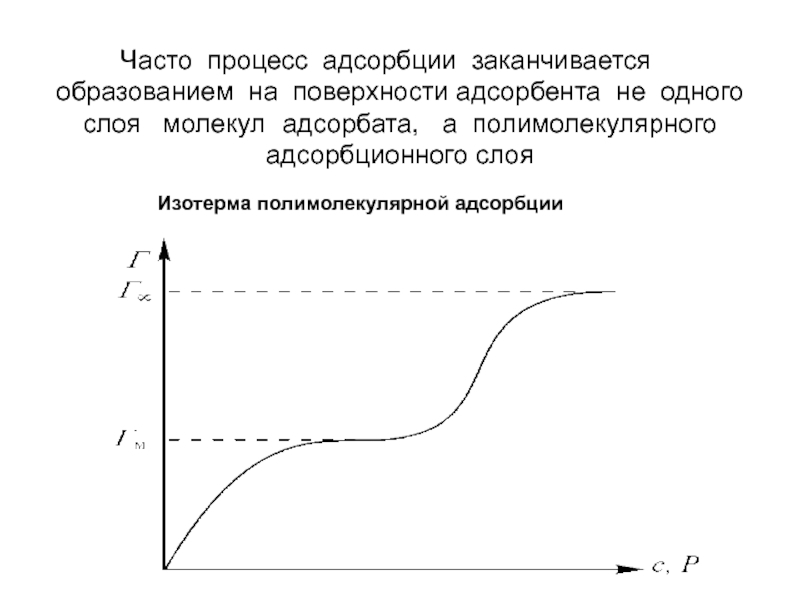
- 25. Часто процесс адсорбции заканчивается образованием на поверхности адсорбента не одного слоя молекул адсорбата, а полимолекулярного адсорбционного слоя Изотерма полимолекулярной адсорбции
- 26. Теория полимолекулярной адсорбции Поляни (1915 г.). Адсорбция
- 27. Теория Поляни не дала математического выражения изотермы
- 28. Основные положения теории БЭТ: 1. На поверхности
- 29. Авторы теории на основе уравнения изотермы адсорбции
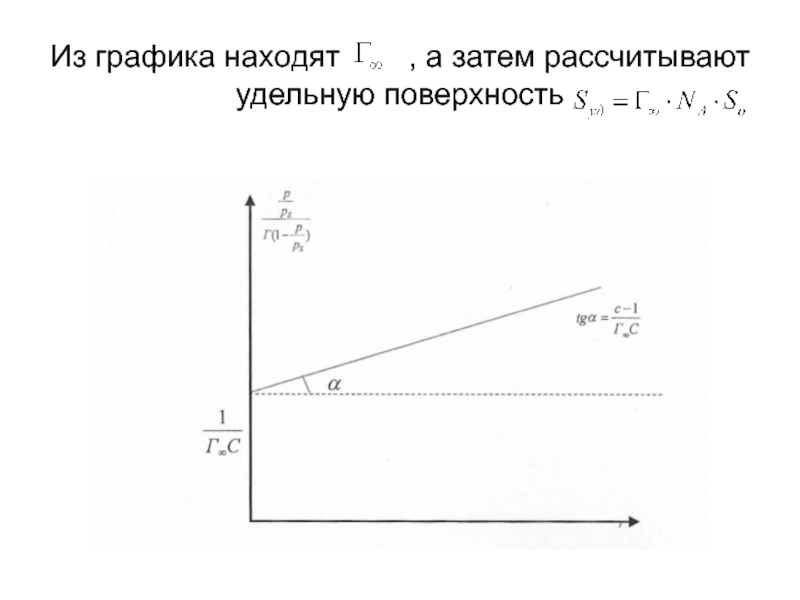
- 30. На теории БЭТ основан стандартный метод измерения
- 31. Из графика находят , а затем рассчитывают удельную поверхность
Слайд 1ОМСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ
КАФЕДРА ХИМИИ
Лекция 2. Молекулярная адсорбция
Сорбция: общая
Адсорбция на границах раздела Ж-Г. Уравнение изотермы адсорбции Гиббса. Строение адсорбционного слоя на границе Ж-Г.
Мономолекулярная адсорбция. Эмпирическое уравнение Фрейндлиха. Теория мономолекулярной адсорбции Ленгмюра.
Полимолекулярная адсорбция. Теория полимолекулярной адсорбции Поляни. Теория БЭТ.
Слайд 2Сорбция - гетерогенный процесс самопроизвольного поглощения твердым телом или жидкостью веществ
Вещества поглотители называются сорбентами, а поглощаемое вещество — сорбатом.
Сорбционные процессы в фарм. технологии применяются для выделения и очистки биологически активных веществ, для разделения смесей (хроматография). На их основе создана гемосорбция, адсорбционная терапия и т.д.
Слайд 3Явление сорбции было открыто во второй половине XVIII в. Адсорбцию газов
Слайд 4Классификация сорбционных процессов: I. В зависимости от степени связывания поглощаемого вещества сорбентом
Слайд 5В качестве адсорбентов используют пористые твердые вещества: активированный уголь, силикагель, цеолиты,
Слайд 6Капиллярная конденсация - сжижение пара в порах твердого сорбента, вследствие понижения
Слайд 7Количественные характеристики адсорбционных процессов Абсолютная адсорбция (А) - это количество вещества сорбата
Слайд 8Важнейшей характеристикой адсорбционного процесса является зависимость А (а,Г) от равновесной концентрации
Слайд 9Изотермы адсорбции: I - изотерма мономолекулярной адсорбции и хемосорбции; II -
Слайд 10Зависимость Г от концентрации и поверхностного натяжения была установлена Гиббсом (1876
Слайд 11Из уравнения Гиббса ясно, что величина избыточной адсорбции зависит от поверхностной активности
если dσ/ dc > 0 (ПНВ), то Г < 0, иначе говоря, концентрация растворенного вещества в поверхностном слое меньше, чем в объеме раствора (отрицательная адсорбция);
если dσ/dc < 0 (ПАВ), то Г > 0 и концентрация вещества в поверхностном слое больше, чем во всем объеме (положительная адсорбция);
если dσ/dc = 0, то Г = 0, а следовательно адсорбции не наблюдается.
Слайд 12Поверхностные слои из молекул ПАВ на границах раздела Г-Ж имеют определенную
Слайд 13Для описания адсорбции на границе Т-Ж необходимо учитывать:
Взаимодействие между молекулами растворенного
Сложное строение поверхности твердого сорбента.
Слайд 14Экспериментальное изучение адсорбции из растворов твердыми веществами:
Определенные навески твердого адсорбента вносят
Величину удельной адсорбции находят, определив концентрацию раствора до и после адсорбции.
Слайд 15Величина удельной адсорбции для твердых сорбентов рассчитывается по формуле: а = х
Слайд 17Ход такой кривой для средних давлений или концентраций можно выразить эмпирическим
Слайд 18При логарифмировании уравнение Фрейндлиха переходит в линейную форму и изотерма имеет
Слайд 19 Линейная изотерма Фрейндлиха позволяет определить графически константы уравнения К
Слайд 20В 1915 г Ленгмюр предложил теорию мономолекулярной адсорбции, которая справедлива для
Слайд 21Основные положения теории Ленгмюра:
Адсорбционные силы подобны «валентным силам» действуют на малых
Адсорбционной активностью обладает не вся поверхность адсорбента, а лишь определенные активные центры, расположенные на выпуклых участках поверхности.
Молекулы фиксируются на адсорбционных участках и не взаимодействуют друг с другом.
Слайд 22Изотерма адсорбции Ленгмюра: I - начальный линейный участок: при малых концентрациях
Слайд 23Уравнение Ленгмюра: Для определения констант необходимо привести уравнение к линейному виду где В
Слайд 25Часто процесс адсорбции заканчивается образованием на поверхности адсорбента не одного слоя молекул адсорбата, а полимолекулярного адсорбционного
Изотерма полимолекулярной адсорбции
Слайд 26Теория полимолекулярной адсорбции Поляни (1915 г.).
Адсорбция обуславливается чисто физическими силами.
На поверхности
Адсорбционные силы действуют на сравнительно большие расстояния, а следовательно можно говорить о существовании у поверхности адсорбционного объема, который заполняется при адсорбции молекулами адсорбата.