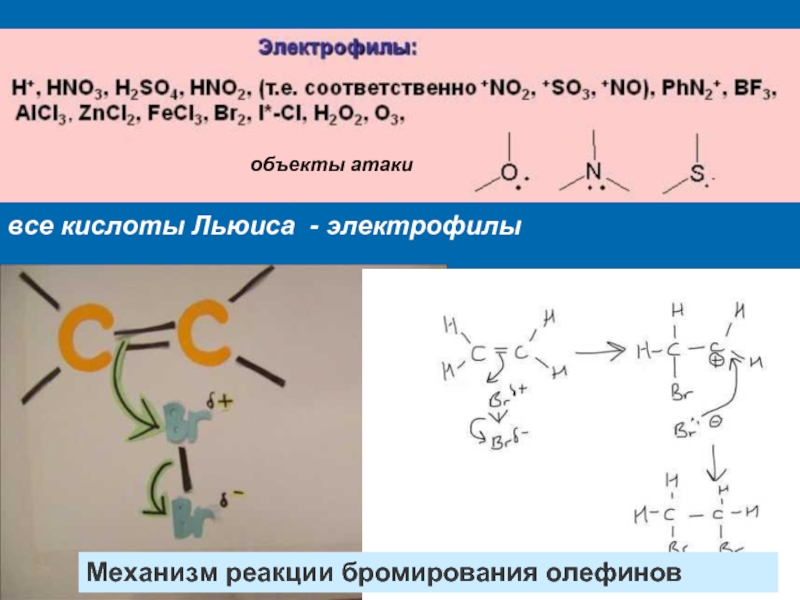
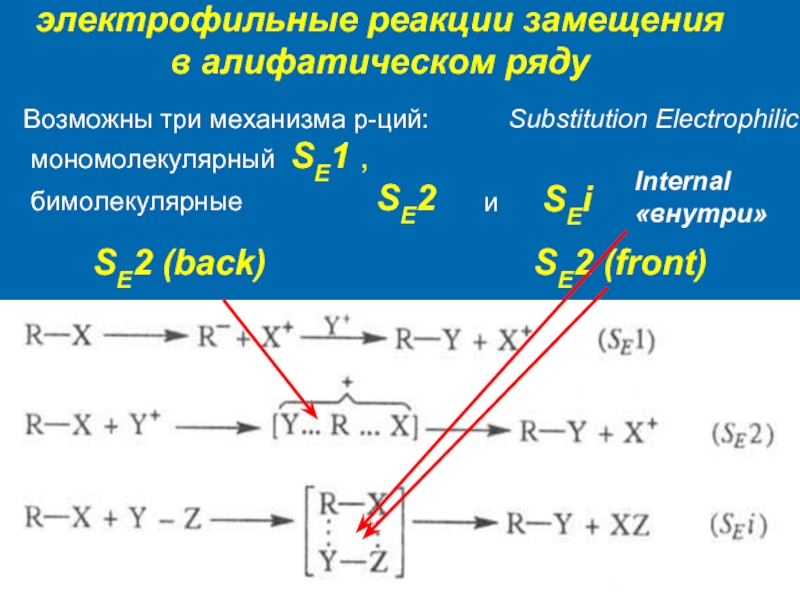
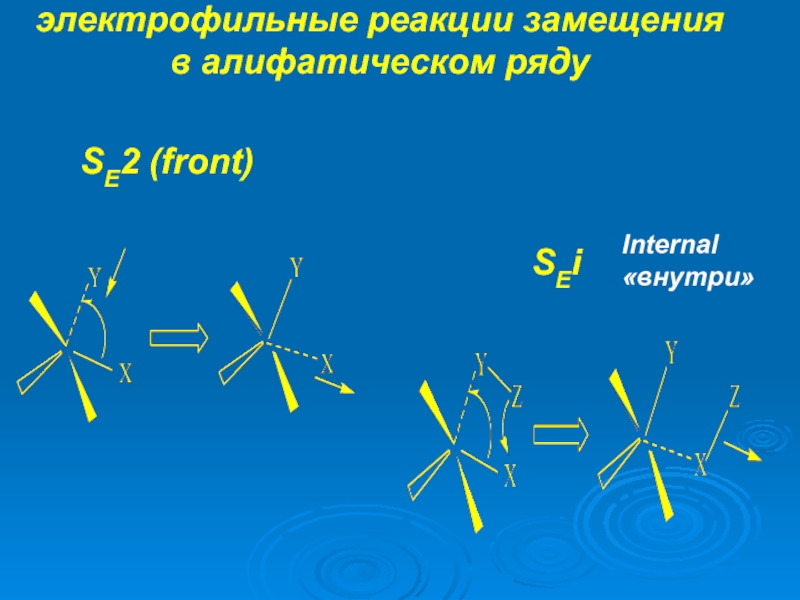
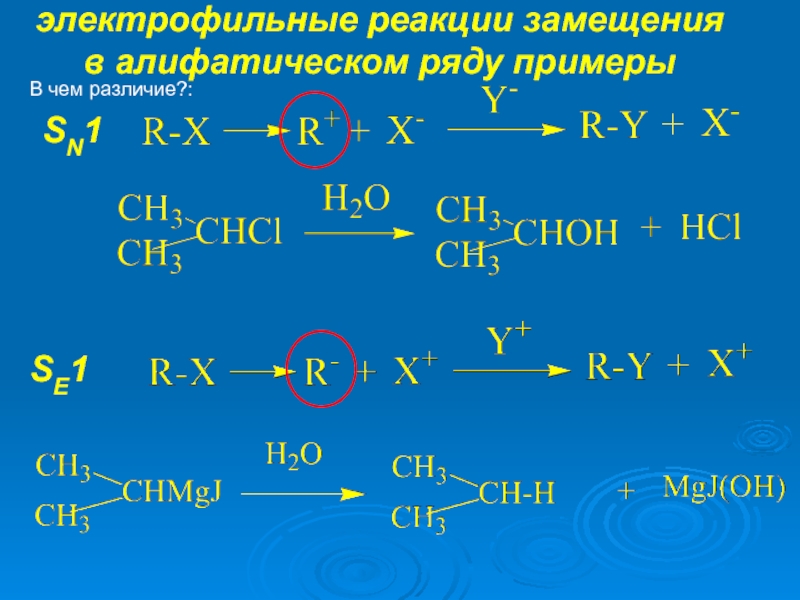
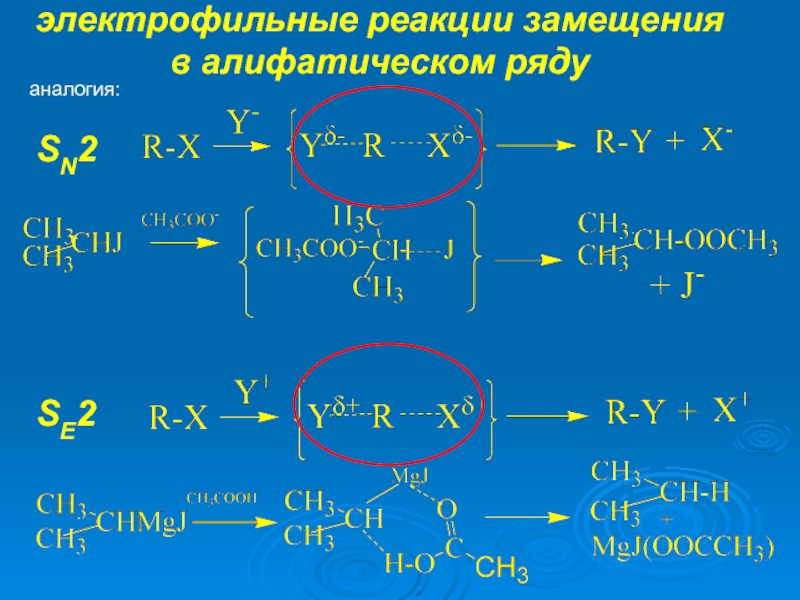
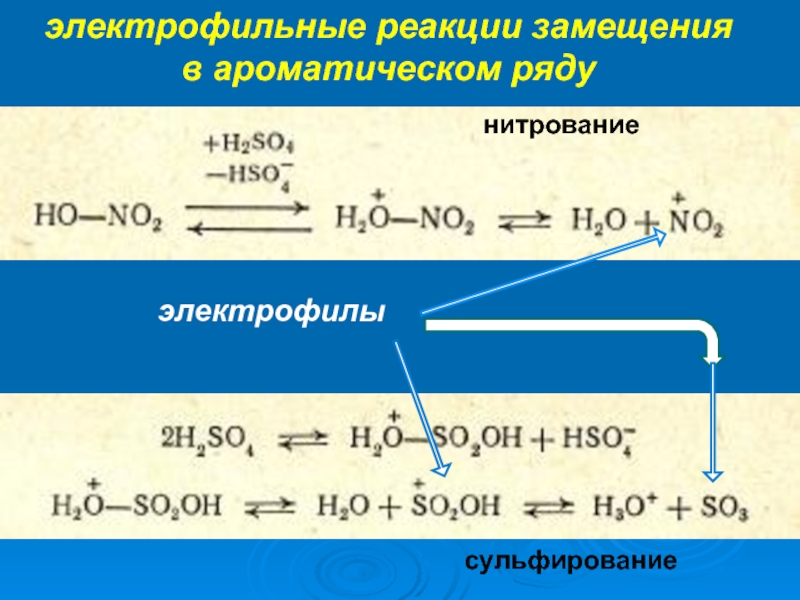
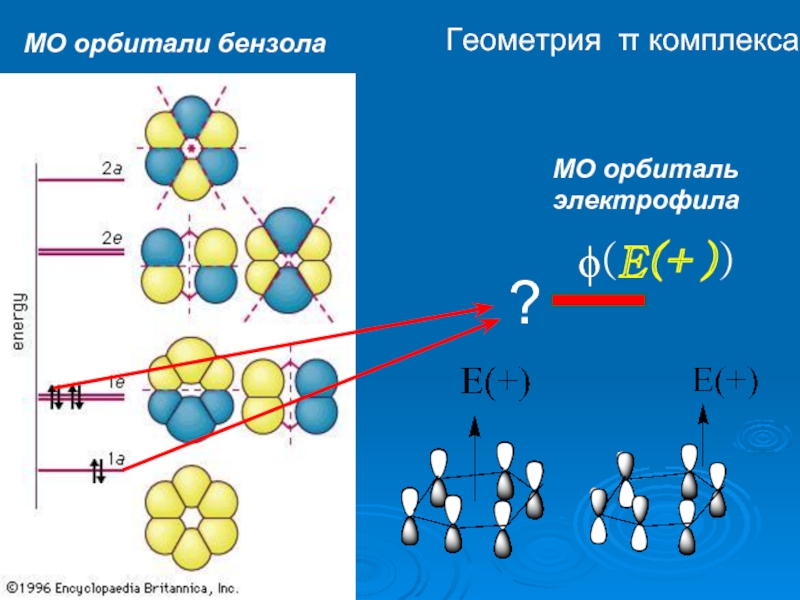
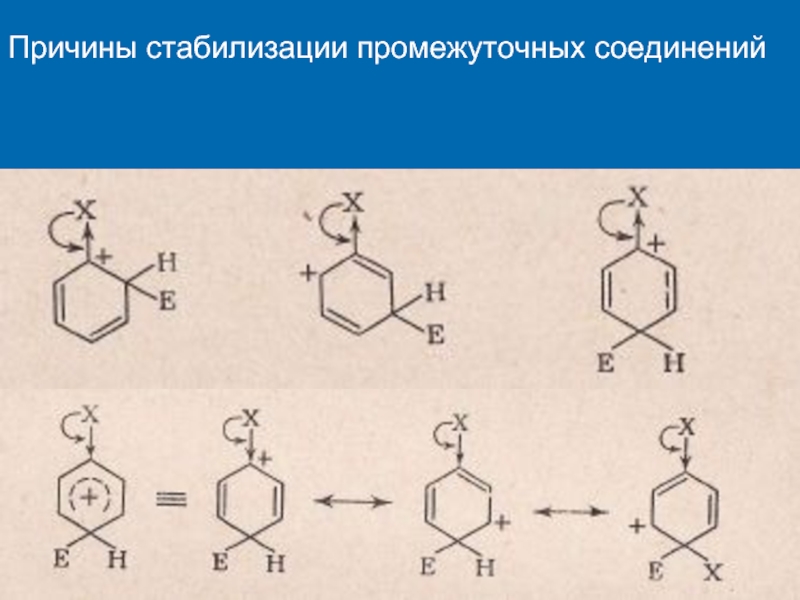
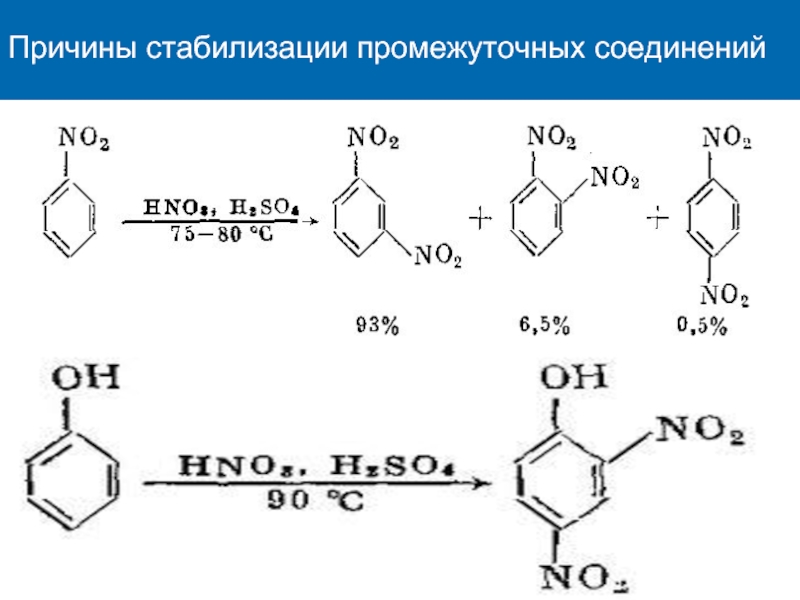
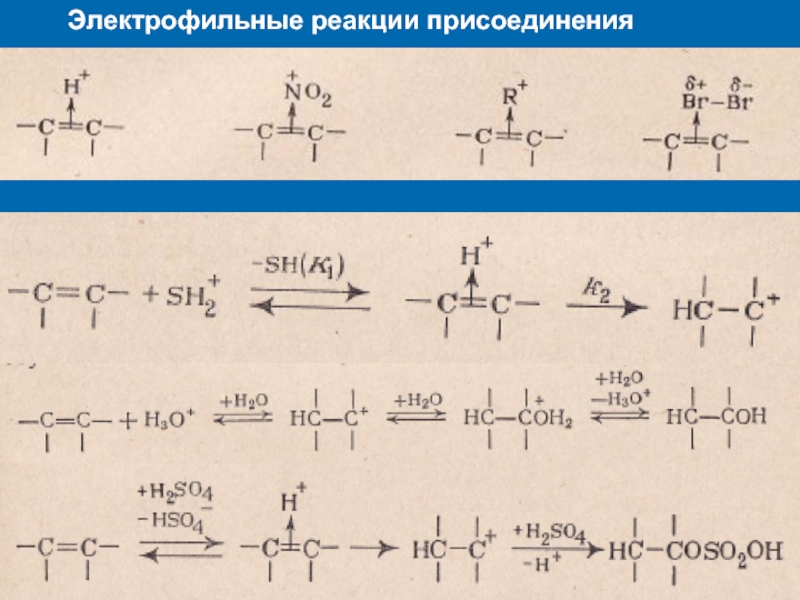
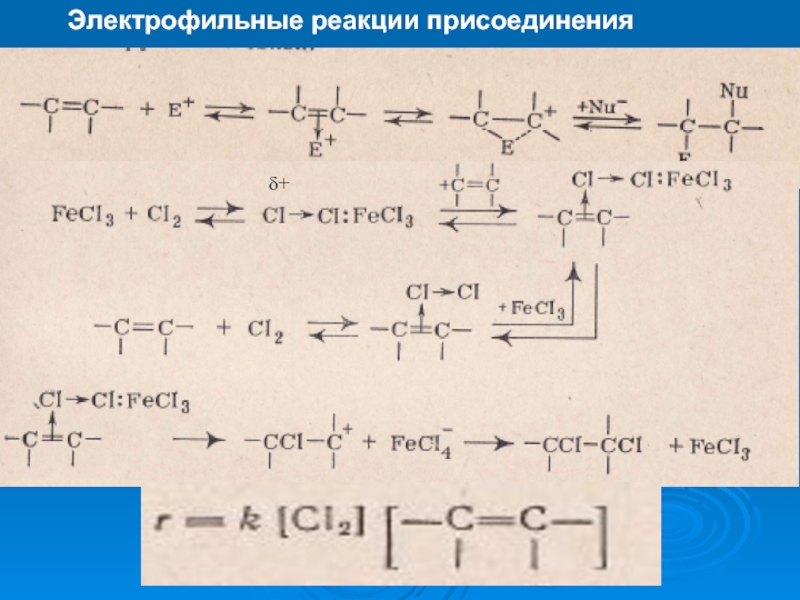
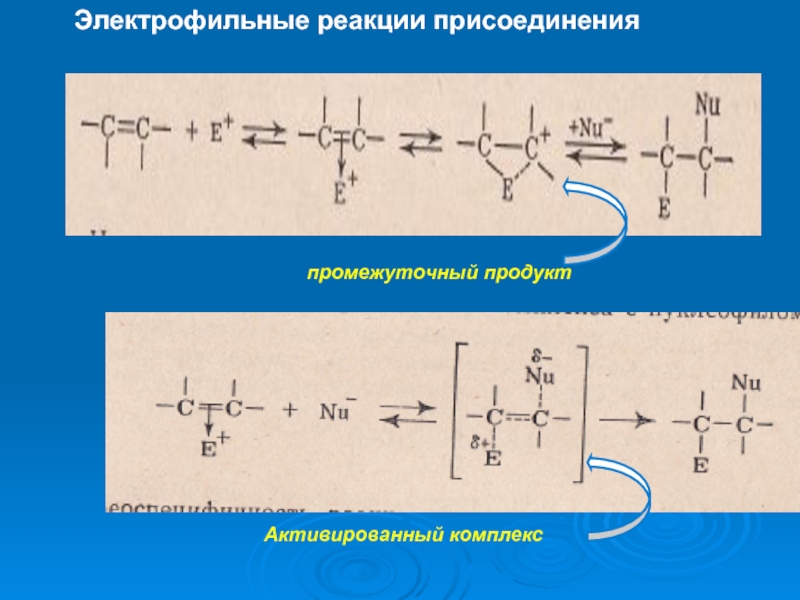
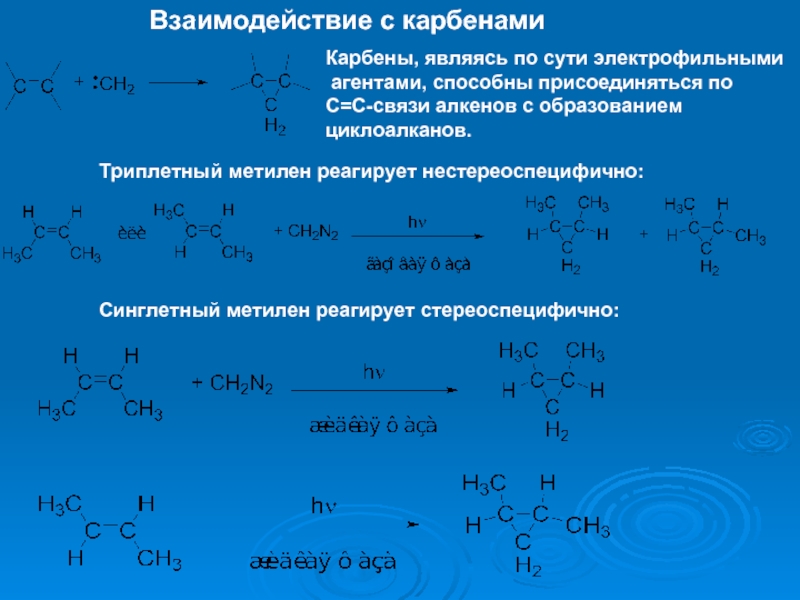
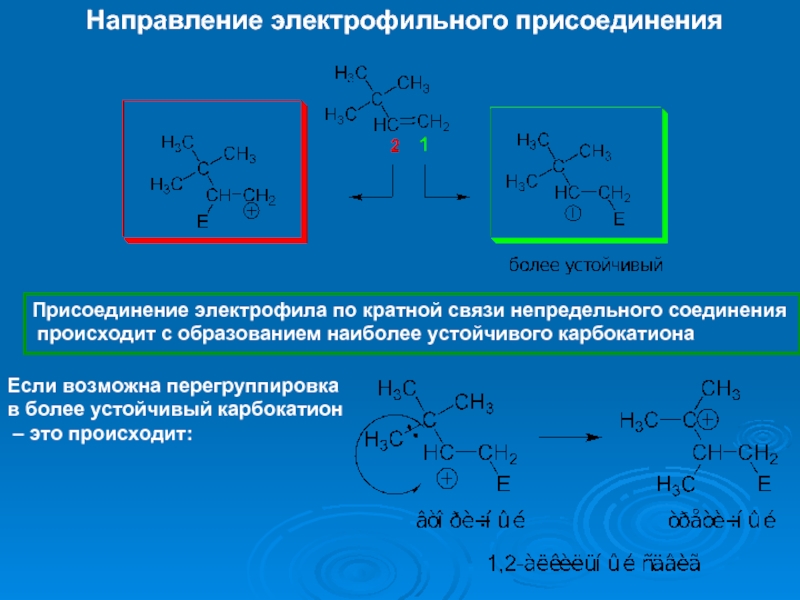
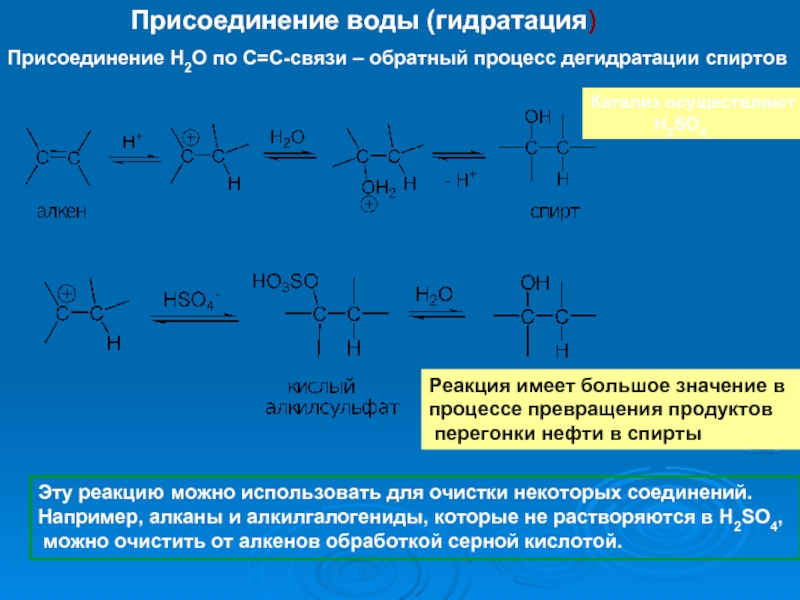
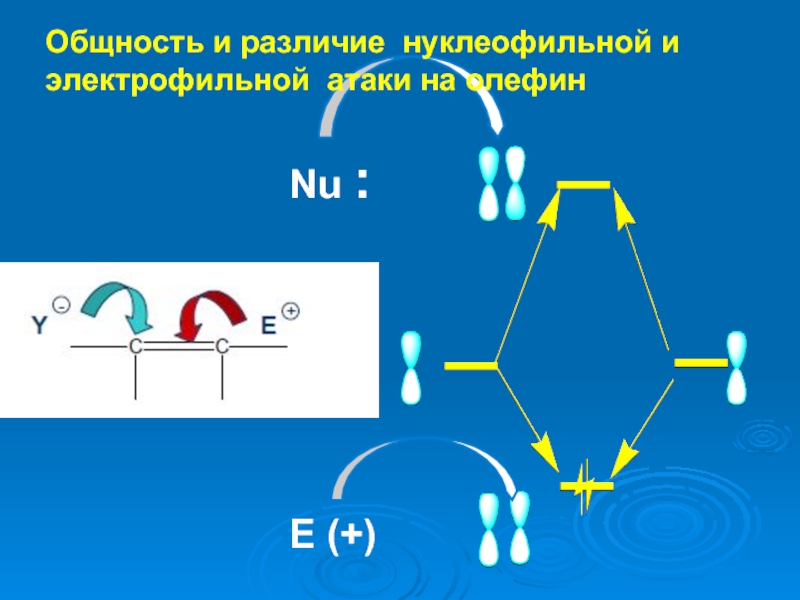
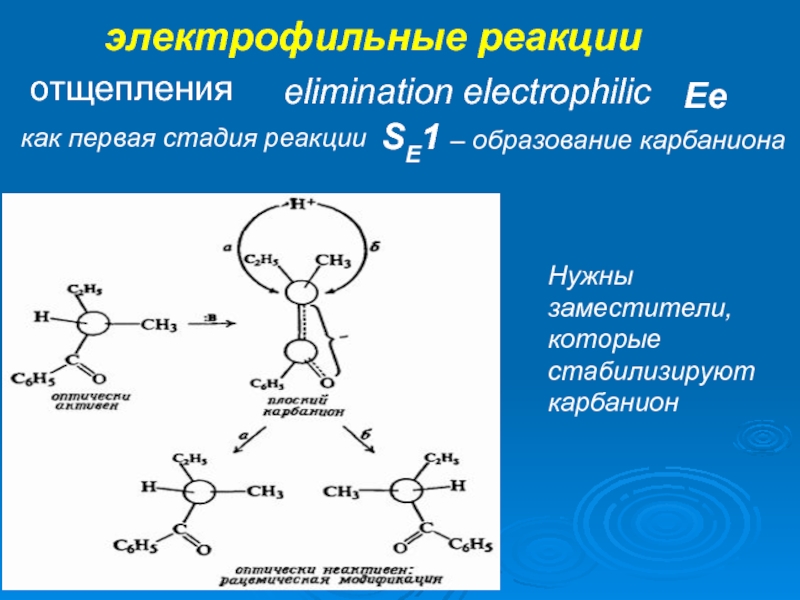
К электрофилам относят ионы или молекулы, имеющие низкую по энергии вакантную орбиталь - Н+, D+, Li+, Alk+, AlAlk3, Hal+, BF3, SO3H+, NO+, NO+2 и др.- для принятия электронной пары другой молекулы (иона).
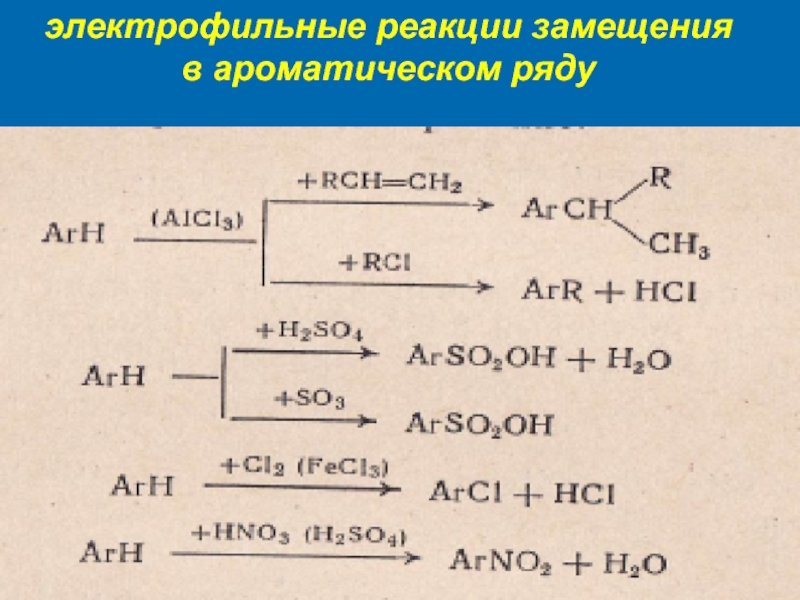
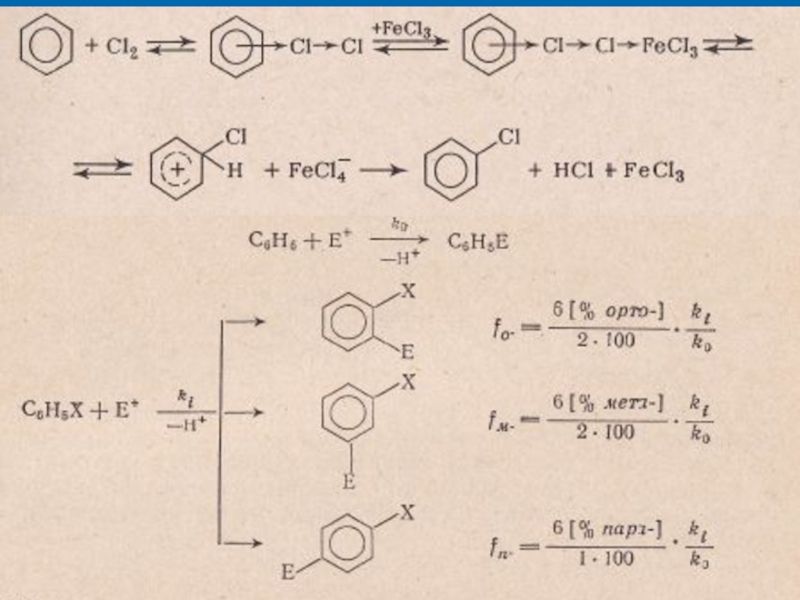
Пример реакции электрофильного замещения в ароматическом ядре