- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Многоатомные спирты презентация
Содержание
- 1. Многоатомные спирты
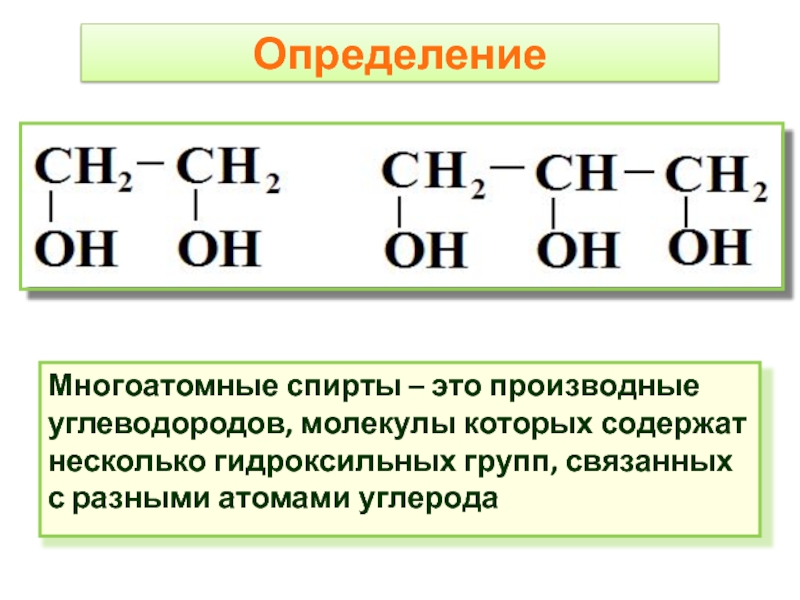
- 2. Определение Многоатомные спирты – это производные углеводородов,
- 3. Номенклатура По систематической номенклатуре название многоатомных спиртов дается следующим образом:
- 4. Физические свойства.
- 5. Многоатомный спирт -этиленгликоль Этиленгликоль — представитель предельных
- 6. Применение этиленгликоля Важным свойством этиленгликоля является способность
- 7. Этиленгликоль – яд ! Дозы
- 8. Химические свойства
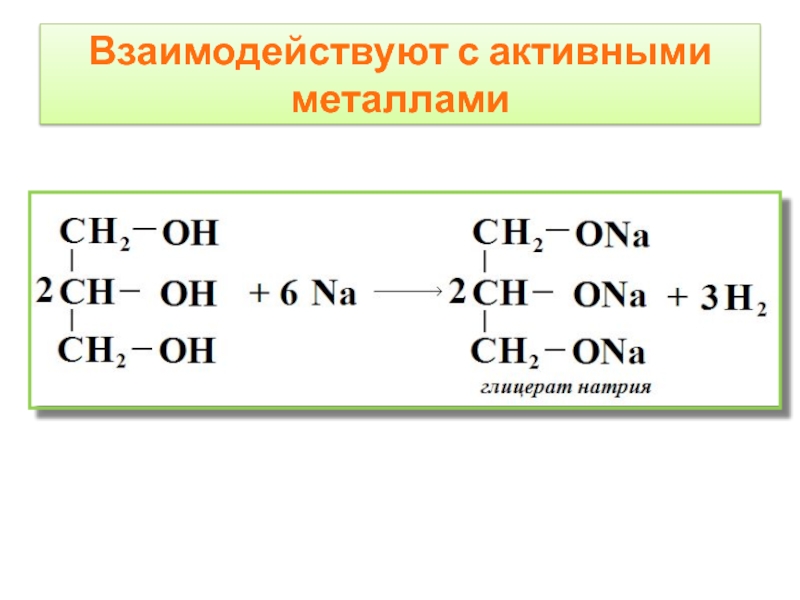
- 9. Взаимодействуют с активными металлами
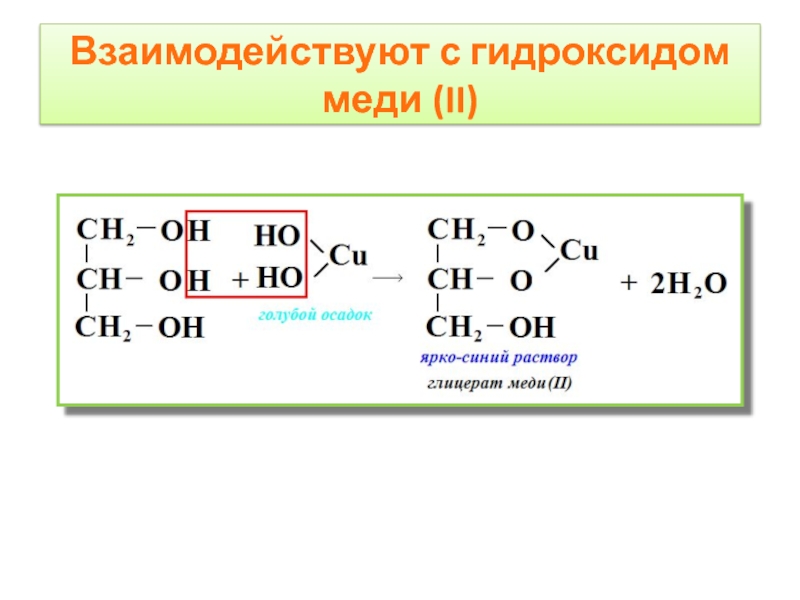
- 10. Взаимодействуют с гидроксидом меди (II)
- 11. Взаимодействуют с галогенводородами
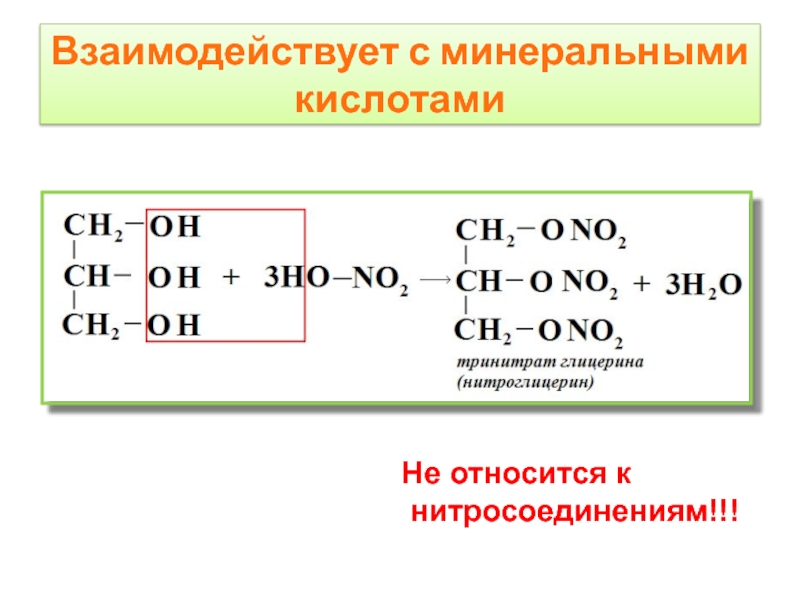
- 12. Взаимодействует с минеральными кислотами Не относится к нитросоединениям!!!
- 13. О нитроглицерине Его производство разработал русский ученый
- 14. О нитроглицерине Оказывает антиангинальное и спазмолитическое действие,
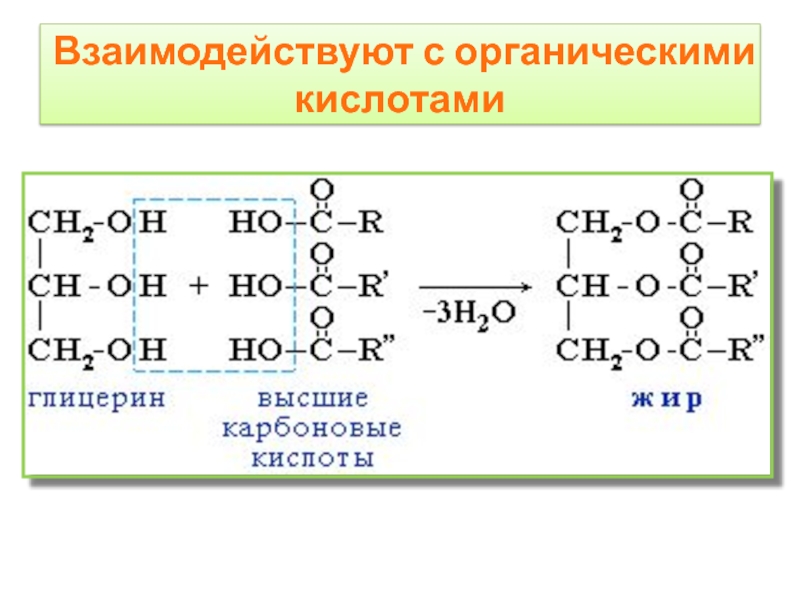
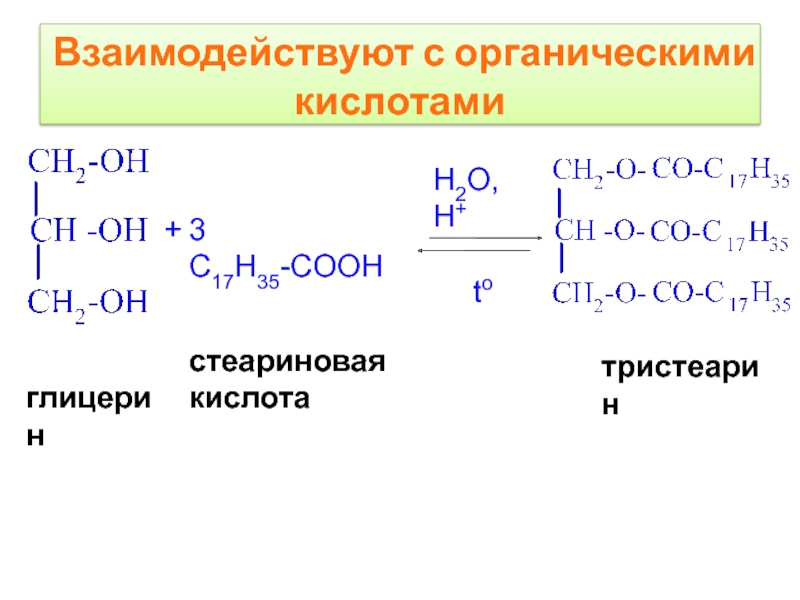
- 15. Взаимодействуют с органическими кислотами
- 16. тристеарин H2O, H+
- 17. Получение
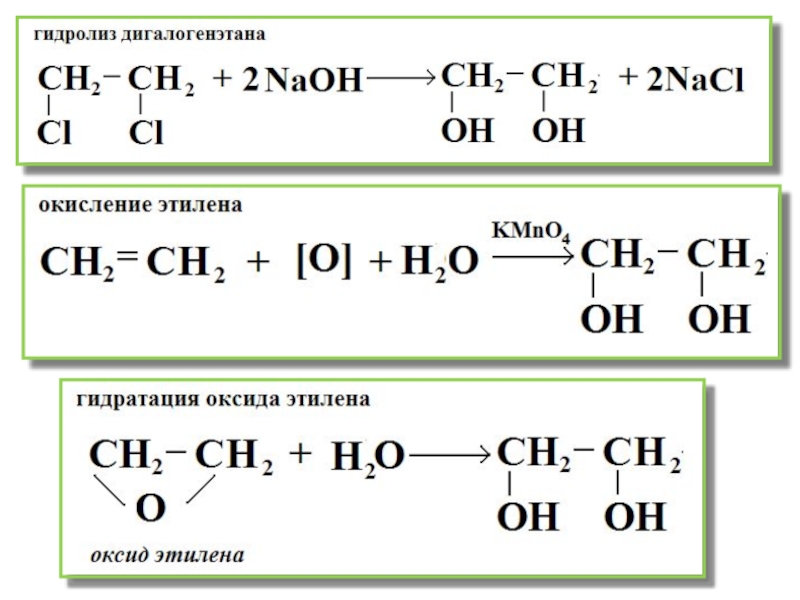
- 18. Получение этиленгликоля Гидролиз дигалогенэтана Окисление этилена Гидратация оксида этилена
- 20. Гидролиз жиров В зависимости от условий бывает:
- 21. тристеарин H2O, H+
- 22. Применение глицерина В производстве взрывчатых веществ, в
- 23. Глицерин. Видео по теме https://www.youtube.com/watch?v=ir_S46_qyaE
- 24. Вулкан Шееле: глицерин и перманганаткалия Реакцию можно
Слайд 2Определение
Многоатомные спирты – это производные углеводородов, молекулы которых содержат несколько гидроксильных
групп, связанных с разными атомами углерода
Слайд 3Номенклатура
По систематической номенклатуре название многоатомных спиртов дается следующим образом:
Слайд 5Многоатомный спирт -этиленгликоль
Этиленгликоль — представитель предельных двухатомных спиртов — гликолей.
Название
гликоли получили вследствие сладкого вкуса многих представителей ряда (греч. «гликос» — сладкий).
Этиленгликоль - сиропообразная жидкость сладкого вкуса, без запаха, ядовит. Хорошо смешивается с водой и спиртом, гигроскопичен.
Этиленгликоль - сиропообразная жидкость сладкого вкуса, без запаха, ядовит. Хорошо смешивается с водой и спиртом, гигроскопичен.
Слайд 6Применение этиленгликоля
Важным свойством этиленгликоля является способность понижать температуру замерзания воды, от
чего вещество нашло широкое применения как компонент автомобильных антифризов и незамерзающих жидкостей.
Он применяется для получения лавсана (ценного синтетического волокна).
Он применяется для получения лавсана (ценного синтетического волокна).
Слайд 7Этиленгликоль – яд !
Дозы вызывающие смертельное отравление этиленгликолем варьируются в
широких пределах - от 100 до 600 мл. Смертельной дозой для человека является 50-150 мл. Смертность при поражении этиленгликолем очень высока и составляет более 60% всех случаев отравления.
Механизм токсического действия этиленгликоля до настоящего времени изучен недостаточно. Этиленгликоль быстро всасывается (в том числе через поры кожи) и в течение нескольких часов циркулирует в крови в неизмененном виде, достигая максимальной концентрации через 2-5 часов. Затем его содержание в крови постепенно снижается, и он фиксируется в тканях.
Механизм токсического действия этиленгликоля до настоящего времени изучен недостаточно. Этиленгликоль быстро всасывается (в том числе через поры кожи) и в течение нескольких часов циркулирует в крови в неизмененном виде, достигая максимальной концентрации через 2-5 часов. Затем его содержание в крови постепенно снижается, и он фиксируется в тканях.
Слайд 13О нитроглицерине
Его производство разработал русский ученый Н.Н.Зинин в 1853г., но предложения
о строительстве промышленных предприятий по изготовлению снарядов и мин не заинтересовали царское правительство. Только в 1863-1867 гг. нитроглицерин начали успешно применять для подземных и подводных взрывов. Ученик Н.Н.Зинина Альфред Нобель продолжил работы своего учителя и запатентовал способ производства динамита в 1867г.
Слайд 14О нитроглицерине
Оказывает антиангинальное и спазмолитическое действие, расслабляет гладкую мускулатуру сосудистых стенок, бронхов, желудочно-кишечного тракта, желчевыводящих путей, мочеточников.
При внутривенном введении вызывает уменьшает приток крови к правому предсердию, способствует снижению давления в «малом» круге кровообращения
5.30
https://www.youtube.com/watch?v=5V2zbeGUtwo#t=169.627987012987
5.30
https://www.youtube.com/watch?v=5V2zbeGUtwo#t=169.627987012987
Слайд 16тристеарин
H2O, H+
to
глицерин
+
3 C17H35-COOH
стеариновая кислота
Взаимодействуют с органическими кислотами
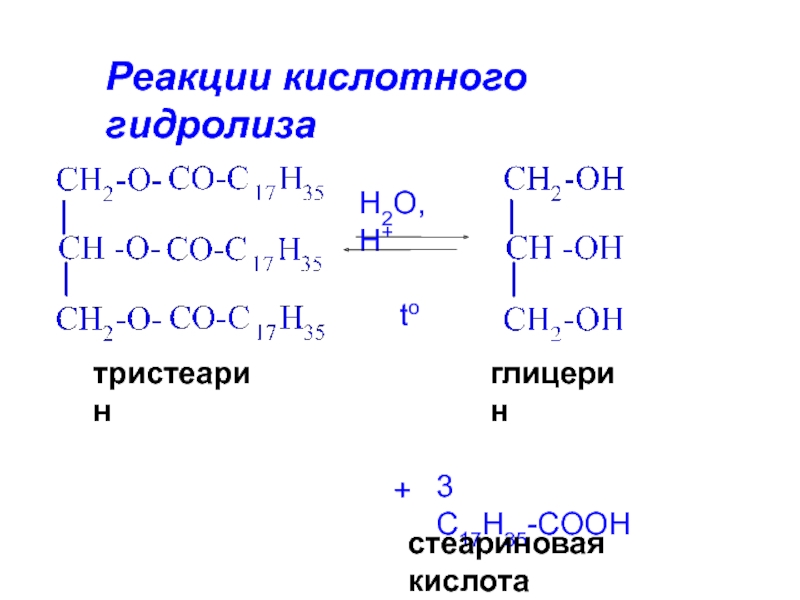
Слайд 20Гидролиз жиров
В зависимости от условий бывает:
А) водный (без катализатора, при
высоких температуре и давлении)
Б) кислотный (в присутствии кислоты в качестве катализатора)
В) ферментативный (происходит в живых клетках)
Г) щелочной (под действием щелочей).
Б) кислотный (в присутствии кислоты в качестве катализатора)
В) ферментативный (происходит в живых клетках)
Г) щелочной (под действием щелочей).
Получение глицерина
Слайд 22Применение глицерина
В производстве взрывчатых веществ, в частности тринитрата глицерина.
При обработке кожи,
для предотвращения от высыхания.
В текстильной промышленности для придания тканям мягкости и шелковистости.
Как компонент некоторых клеeв.
При производстве пластмасс в качестве пластификатора – компонента, придающего материалу гибкость и эластичность.
В производстве кондитерских изделий и напитков (как пищевая добавка E422).
Широко используется в парфюмерной промышленности: входит в состав кремов, помад, зубных паст, предотвращая их от высыхания и способствуя увлажнению и смягчению кожи.
Несмотря на взрывоопасность этого вещества, в очень малых дозах его применяют в медицине в качестве сосудорасширяющего средства при сердечно-сосудистых заболеваниях.
В текстильной промышленности для придания тканям мягкости и шелковистости.
Как компонент некоторых клеeв.
При производстве пластмасс в качестве пластификатора – компонента, придающего материалу гибкость и эластичность.
В производстве кондитерских изделий и напитков (как пищевая добавка E422).
Широко используется в парфюмерной промышленности: входит в состав кремов, помад, зубных паст, предотвращая их от высыхания и способствуя увлажнению и смягчению кожи.
Несмотря на взрывоопасность этого вещества, в очень малых дозах его применяют в медицине в качестве сосудорасширяющего средства при сердечно-сосудистых заболеваниях.
Слайд 24Вулкан Шееле:
глицерин и перманганаткалия
Реакцию можно выразить уравнением:
14КМnО4 + 3С3Н5(ОН)3 = 7K2CO3 + 14MnO2 + 12H2O
+ 2CO2
Взаимодействие сопровождается выделением большого количества теплоты и газов (углекислый газ СО2 и пары воды Н2О), которые увлекают за собой горячие твердые частицы диоксида марганца МnО2 и карбоната калия К2CO3.
https://www.youtube.com/watch?v=lTrFoLSUDgs
Взаимодействие сопровождается выделением большого количества теплоты и газов (углекислый газ СО2 и пары воды Н2О), которые увлекают за собой горячие твердые частицы диоксида марганца МnО2 и карбоната калия К2CO3.
https://www.youtube.com/watch?v=lTrFoLSUDgs