- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Металлы презентация
Содержание
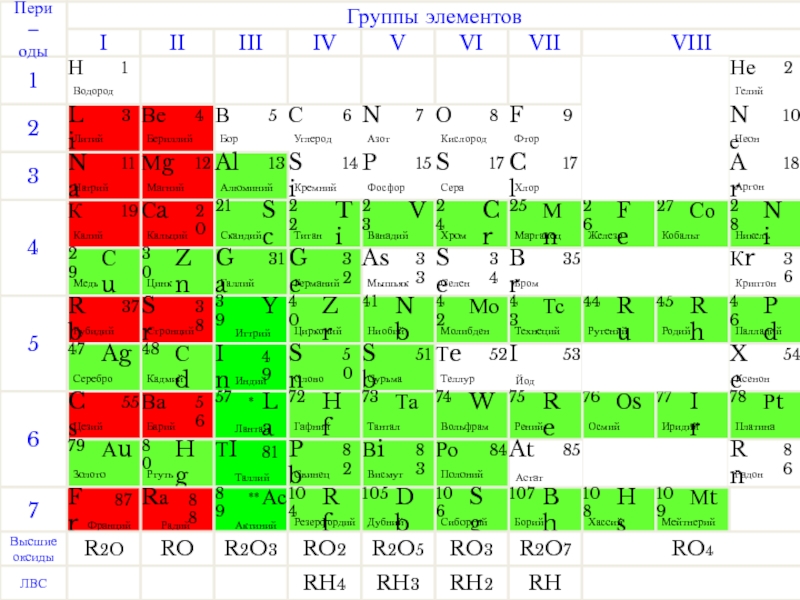
- 1. Металлы
- 3. В At Условная граница между элементами-неметаллами и
- 4. В атомах металлов на внешнем электронном
- 5. электропроводность теплопроводность Металлы проводят электрический ток и тепло Физические свойства металлов
- 6. Физические свойства металлов
- 7. Металлы обладают металлическим блеском Физические свойства металлов
- 8. Физические свойства металлов
- 9. Металлы ковки и пластичны Физические свойства металлов
- 10. Физические свойства металлов
- 11. Физические свойства металлов
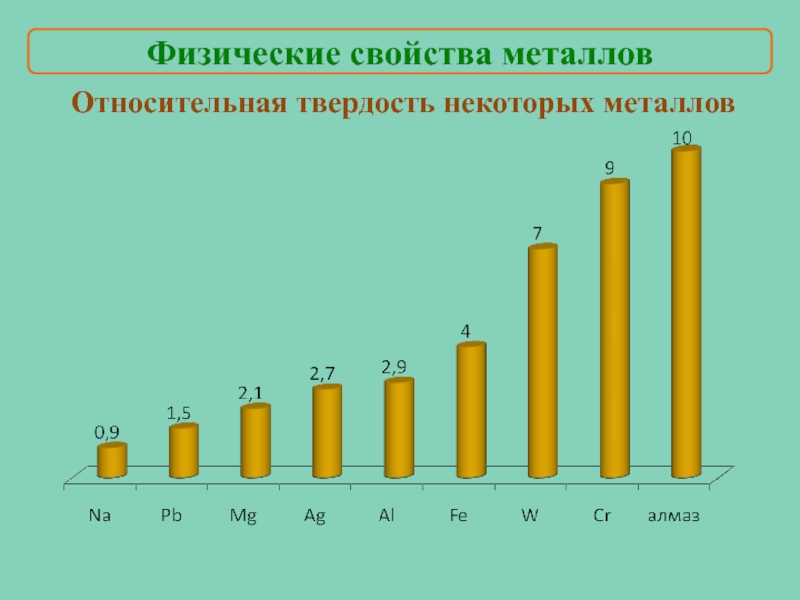
- 12. Относительная твердость некоторых металлов Физические свойства металлов
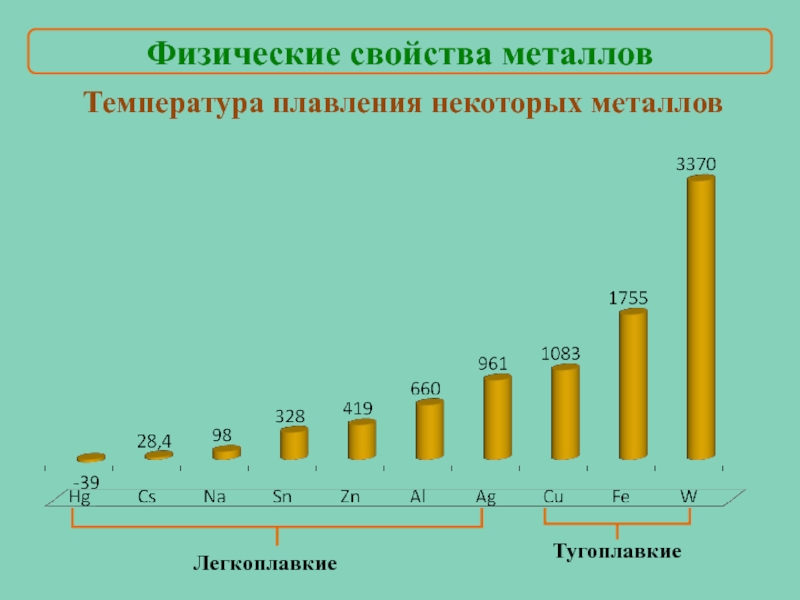
- 13. Температура плавления некоторых металлов Легкоплавкие Тугоплавкие Физические свойства металлов
- 14. Физические свойства металлов
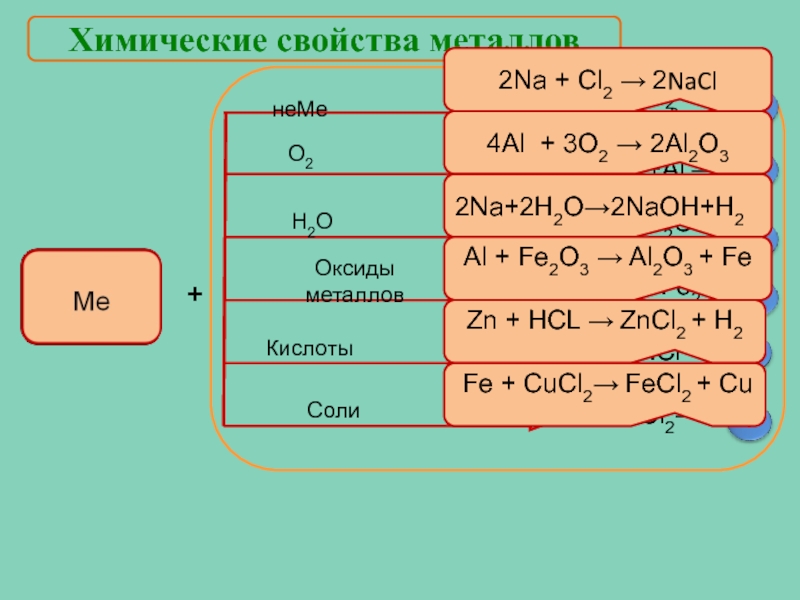
- 15. Химические свойства металлов + 2Na +
- 16. Особенности химических реакций металлов:
- 17. Взаимодействие металлов с кислотами M + HmAc → MxAcy + H2↑
- 18. Взаимодействие металлов с растворами солей M + M/xAcy → MxAcy + М/
- 19. Общие способы получения металлов Пирометаллургия –
- 20. Общие способы получения металлов Пирометаллургия Восстановление
- 21. Общие способы получения металлов Гидрометаллургия 1 стадия:
- 22. Общие способы получения металлов Электрометаллургия Электролиз расплавов:
- 23. Химическая Электрохимическая
- 24. Защита более активным металлом; Отделение металла
Слайд 1Металлы
Металлы – это элементы, атомы которых легко отдают электроны внешнего
(а некоторые и предвнешнего) электронного слоя, превращаясь в положительные ионы.
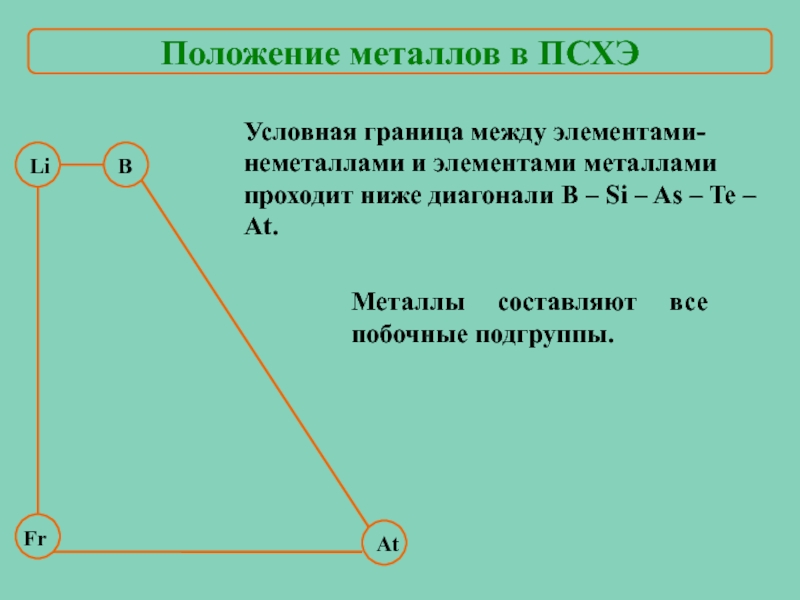
Слайд 3В
At
Условная граница между элементами-неметаллами и элементами металлами проходит ниже диагонали B
Li
Fr
Металлы составляют все побочные подгруппы.
Положение металлов в ПСХЭ
Слайд 4 В атомах металлов на внешнем электронном слое небольшое число электронов
Атомы металлов отдают валентные электроны, превращаясь в катионы
Атомы металлов соединяются друг с другом металлической связью
Атомы металлов, соединенные друг с другом металлической связью, образуют простые вещества с металлической кристаллической решеткой
М0 ─ nе ↔ Мn+
атом катион
Мы знаем, что…
Слайд 5электропроводность
теплопроводность
Металлы проводят электрический ток и тепло
Физические свойства металлов
Слайд 13Температура плавления некоторых металлов
Легкоплавкие
Тугоплавкие
Физические свойства металлов
Слайд 15Химические свойства металлов
+
2Na + Cl2 → 2NaCl
4Al + 3O2 → 2Al2O3
2Na+2Н2О→2NaOH+H2
Al
Соли
О2
Zn+HCl →
Fe+CuCl2→
Zn + HCL → ZnCl2 + H2
Fe + CuCl2→ FeCl2 + Cu
Слайд 19Общие способы получения металлов
Пирометаллургия – получение металлов и сплавов под
Гидрометаллургия – получение металлов из водных растворов.
Электрометаллургия – получение металлов под действием электрического тока.
Слайд 20Общие способы получения металлов
Пирометаллургия
Восстановление углем (угарным газом):
2PbO + C
Восстановление алюминием (кальцием):
2Al + Fe2O3 = Al2O3 + 2Fe
Восстановление водородом:
СuO + H2 = Cu + H2O
Слайд 21Общие способы получения металлов
Гидрометаллургия
1 стадия: растворение в кислоте нерастворимых минералов, содержащих
CuS + 2HCl = CuCl2 + H2S
2 стадия: вытеснение металлов из растворов их солей более активными металлами:
CuCl2 + Fe = FeCl2 + Cu
Слайд 22Общие способы получения металлов
Электрометаллургия
Электролиз расплавов:
KCl → K+ + Cl─
катод (─) K+
анод (+) 2Cl─ ─ 2e → Cl20
эл.ток
2KCl → 2K + Cl2↑
Этим способом в промышленности получают металлы, стоящие в ряду напряжений металлов до Al.
Слайд 23
Химическая
Электрохимическая
4Fe + 6H2O + 3O2 = 4Fe(OH)3
Коррозия железа и
Коррозия железа в контакте с медью и в растворе соляной кислоты:
Катод 2Н+ + 2е = Н2
Анод Fe2+ - 2e = Fe0
Коррозия металлов
Самопроизвольное разрушение металлических материалов, происходящее под воздействием окружающей среды, называется коррозией.
Слайд 24
Защита более активным металлом;
Отделение металла от агрессивной среды;
Использование замедлителей коррозии;
Электрозащита;
Пассивация металлов;
Изготовление
Способы защиты металлов от коррозии