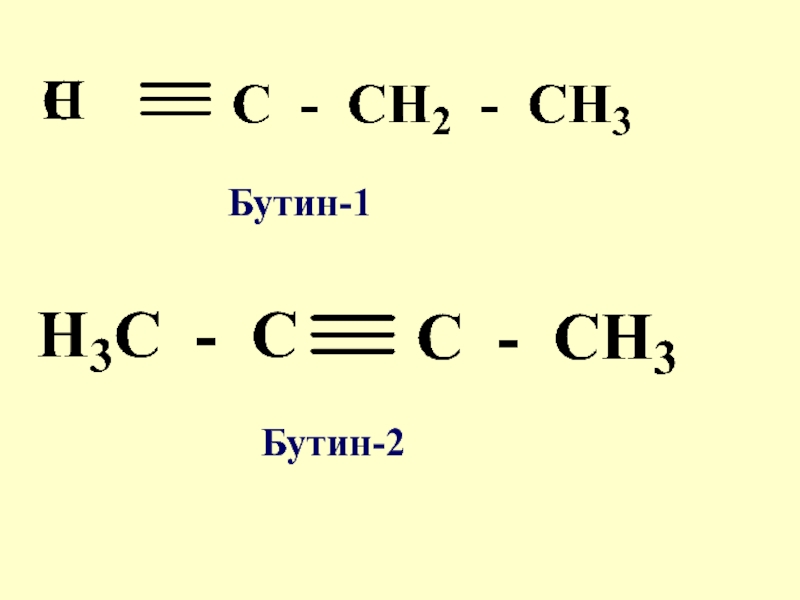- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция 2. Пространственное строение органических соединений презентация
Содержание
- 1. Лекция 2. Пространственное строение органических соединений
- 2. План 2.1 Теория строения органических соединений А.М.
- 3. Первая научно-обоснованная теория строения органических соединений появилась
- 4. Основные положения теории А.М. Бутлерова 1.Атомы в
- 5. 2. Свойства веществ зависят не только
- 6. 3. Атомы или группы атомов, образовавшие молекулу,
- 7. Химическое строение молекулы определяется природой и последовательностью связей между составляющими ее атомами
- 8. 2.2 Изомерия. Типы изомерии Под
- 9. Химические и физические свойства изомерных веществ различны
- 10. . Различают структурную и пространственную изомерию
- 11. Виды структурной изомерии 1. Изомерия углеродного скелета Н-БУТАН ИЗОБУТАН
- 12. Виды структурной изомерии 2. Изомерия положения, обусловлена
- 13. Бутин-1 Бутин-2
- 14. Виды структурной изомерии 3. Межклассовая изомерия
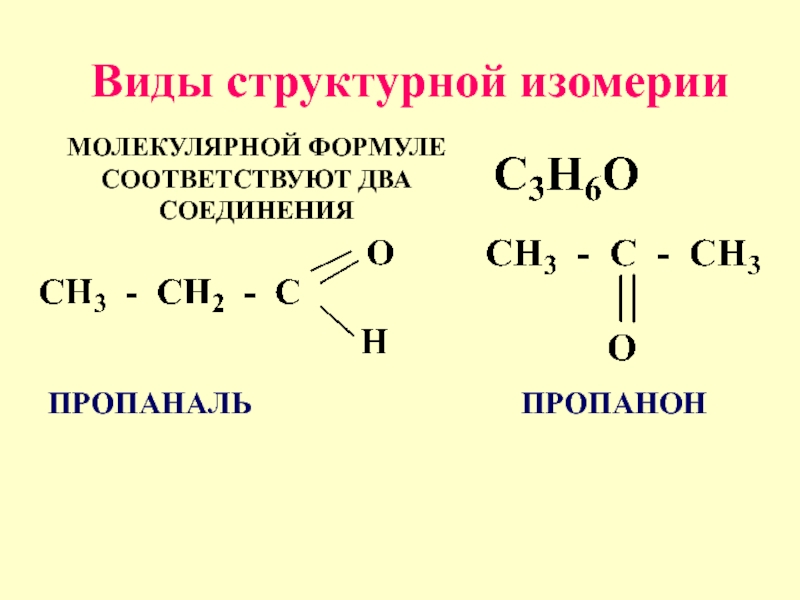
- 15. Виды структурной изомерии МОЛЕКУЛЯРНОЙ ФОРМУЛЕ СООТВЕТСТВУЮТ ДВА СОЕДИНЕНИЯ ПРОПАНАЛЬ ПРОПАНОН
- 16. Виды структурной изомерии 4. ТАУТОМЕРИЯ- изомеры
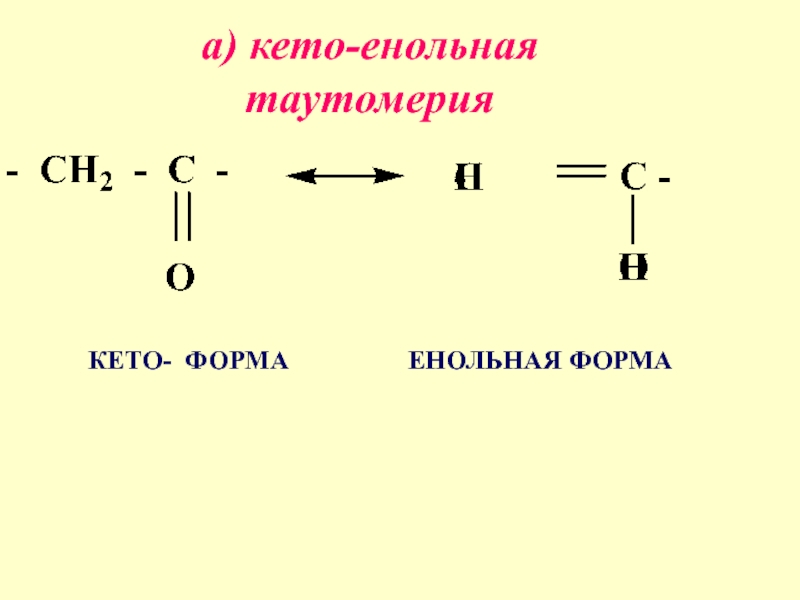
- 17. а) кето-енольная таутомерия КЕТО- ФОРМА ЕНОЛЬНАЯ ФОРМА
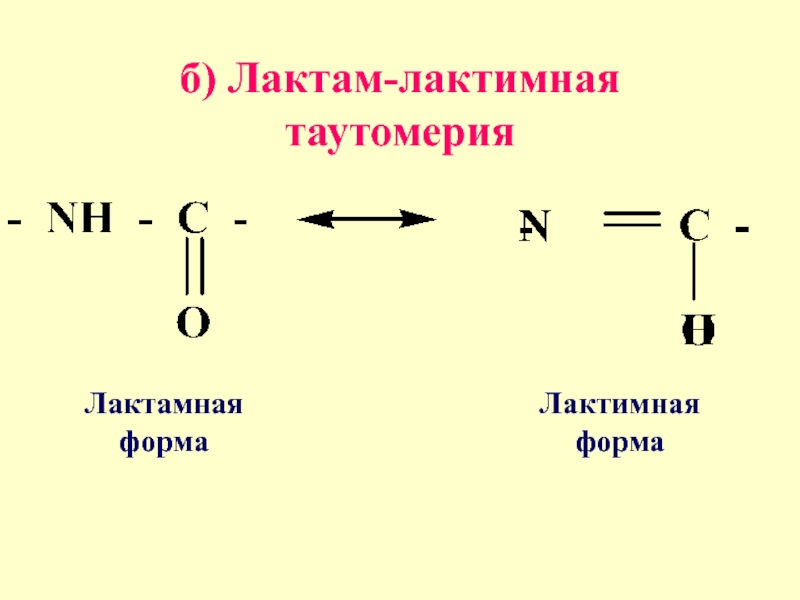
- 18. б) Лактам-лактимная таутомерия Лактамная форма Лактимная форма
- 19. Пространственная изомерия стереоизомерия Пространственная изомерия обусловлена
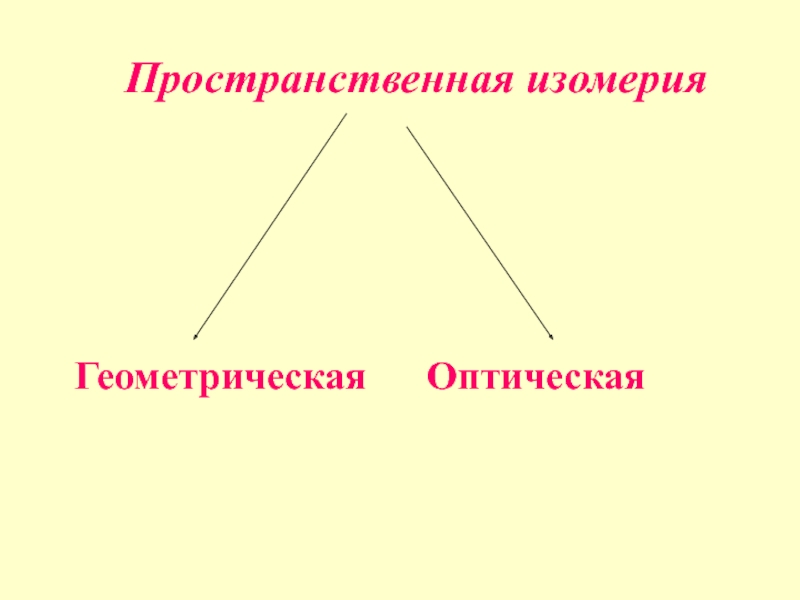
- 20. Пространственная изомерия Геометрическая Оптическая
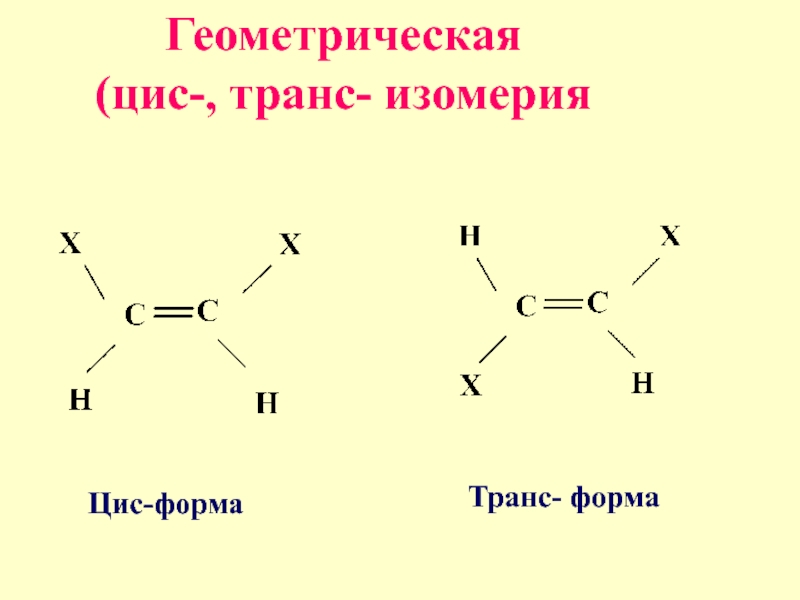
- 21. Геометрическая (цис-, транс- изомерия Цис-форма Транс- форма
- 22. Цис- и транс- изомеры возможны для
- 23. Наиболее устойчивы транс-изомеры, поэтому в природе они наиболее распространены
- 24. 2.3. Конфигурация и конформации соединений с открытой
- 25. Конфигурация – определенное пространственное расположение атомов
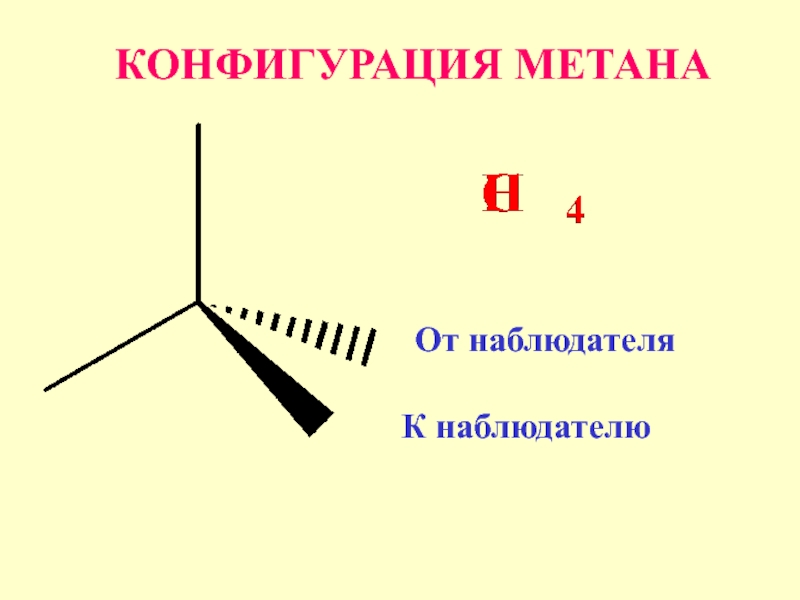
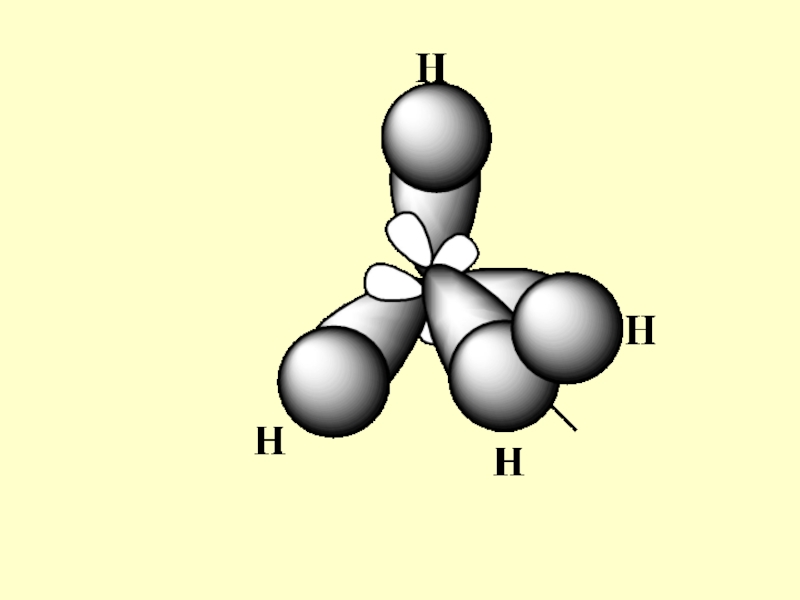
- 26. От наблюдателя К наблюдателю КОНФИГУРАЦИЯ МЕТАНА
- 28. Конформации – динамические изомеры (конформеры), отличающиеся
- 29. Взаимные переходы конформеров могут осуществляться только
- 30. Термин конформация был предложен
- 31. Конформации молекулы представляют собой различные
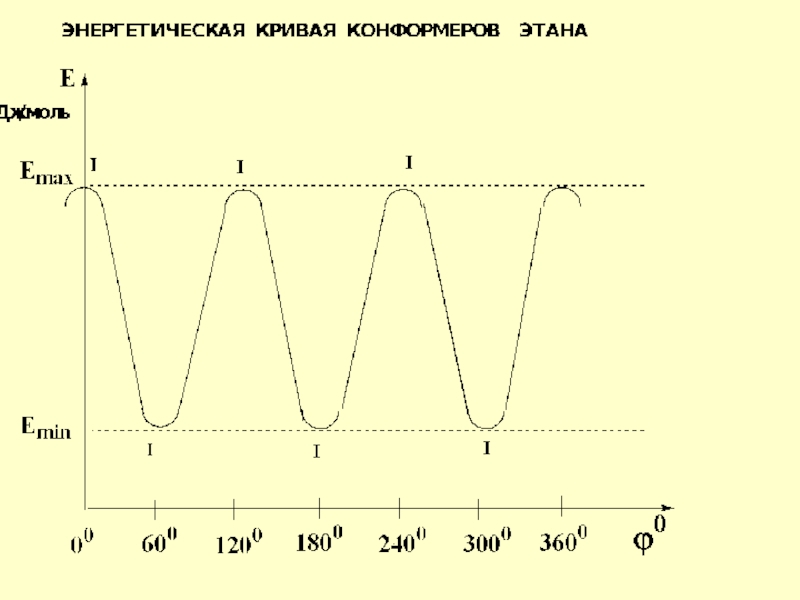
- 32. Образующиеся конфор-мации различаются по энергетическому уровню
- 33. Для изображения конформаций используют проекционные формулы Ньюмена
- 34. Для построения формул Ньюмена выбирается некоторая связь, относительно которой производится свободное вращение
- 35. Относительно большей внутренней энергией обладают конформации,
- 36. Наименьшей энергией обладают конформеры, в которых заместители рас-положены наиболее далеко друг от друга
- 37. Атомы, образующие
- 38. Второй атом С как бы прикрыт кружком,
- 39. Разность между этими энергиями составляет энергетический барьер вращения или торсионное напряжение
- 40. Конформации соединений с открытой цепью
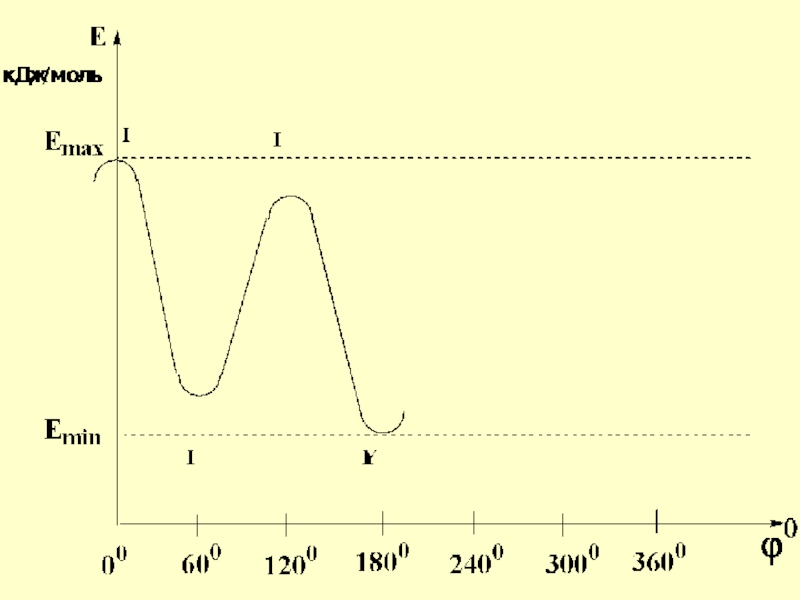
- 41. При полном обороте вокруг центральной связи возникает 6 конформаций
- 42. Угол поворота вокруг
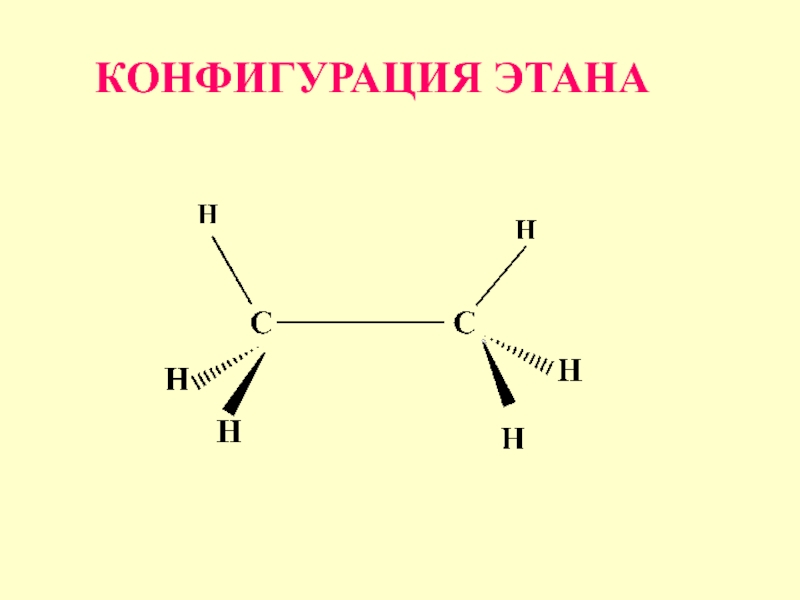
- 43. Строение, конфигурация и возможные конформации для этана Н3С - СН3
- 44. КОНФИГУРАЦИЯ ЭТАНА
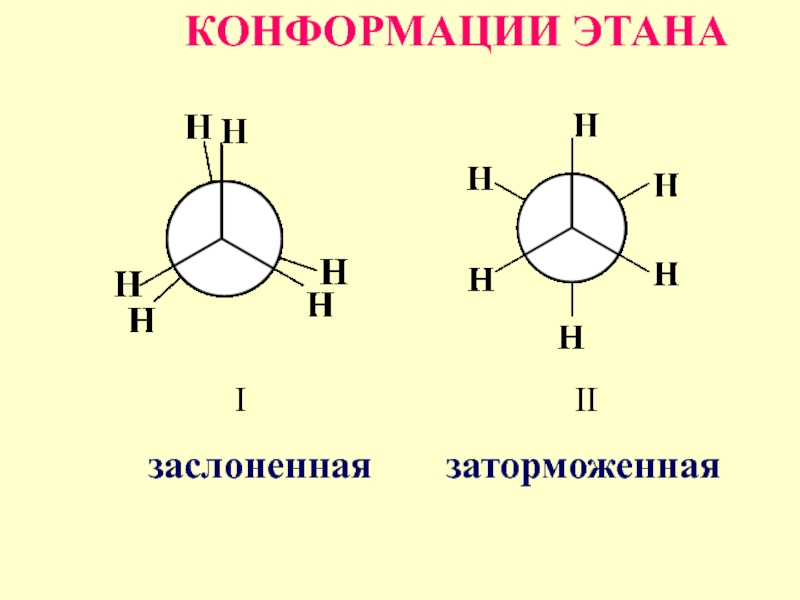
- 46. I- заслоненные конформации, заместители одного атома
- 47. II – заторможенные конформации, заместители одного атома
- 49. У более сложных соединений наряду с торсионным
- 50. Ван-дер-ваальсово напряжение обусловлено силами отталкивания между валентно не связанными большими по объему заместителями
- 51. Возникающие при этом конформации называют скошенными или
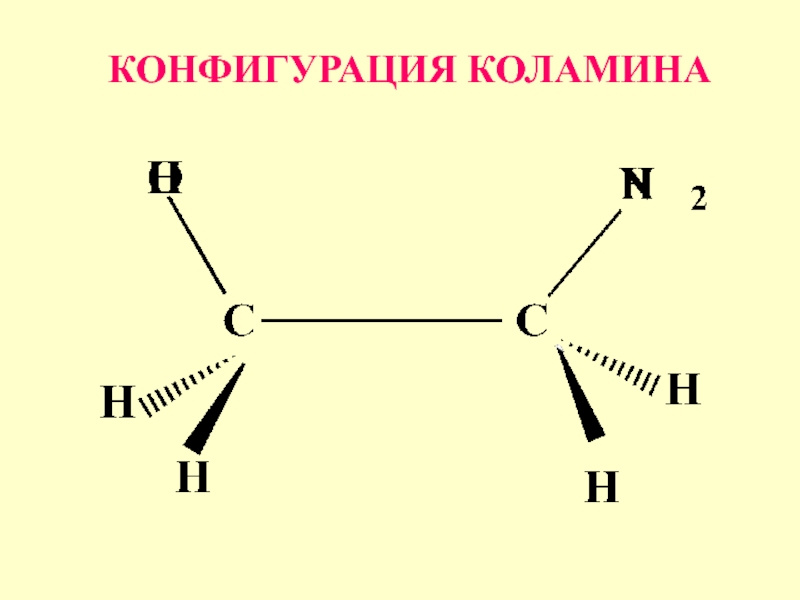
- 52. Строение, конфигурация и возможные конформации для коламина
- 53. КОНФИГУРАЦИЯ КОЛАМИНА
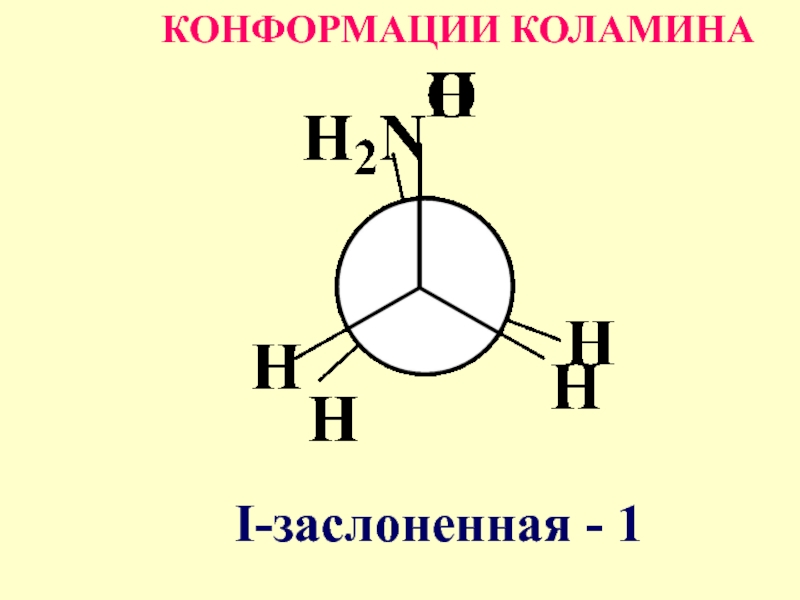
- 54. КОНФОРМАЦИИ КОЛАМИНА I-заслоненная - 1
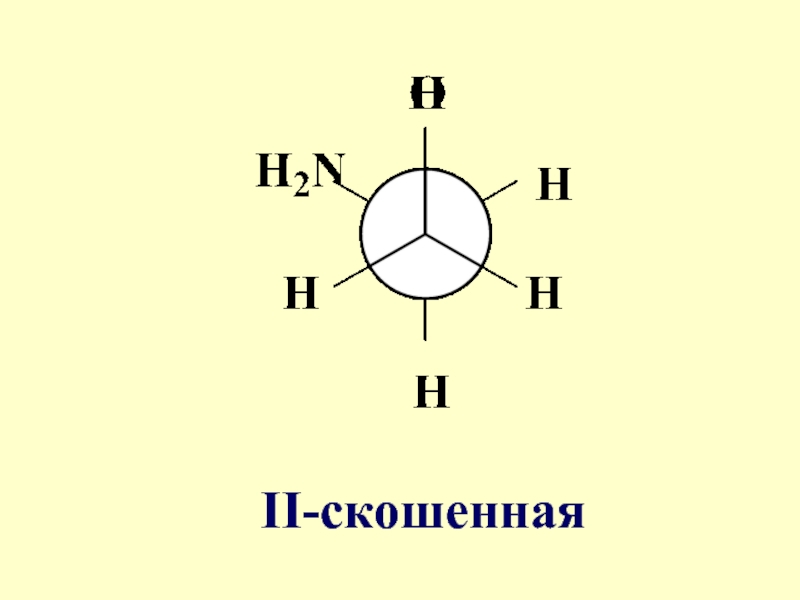
- 55. II-скошенная
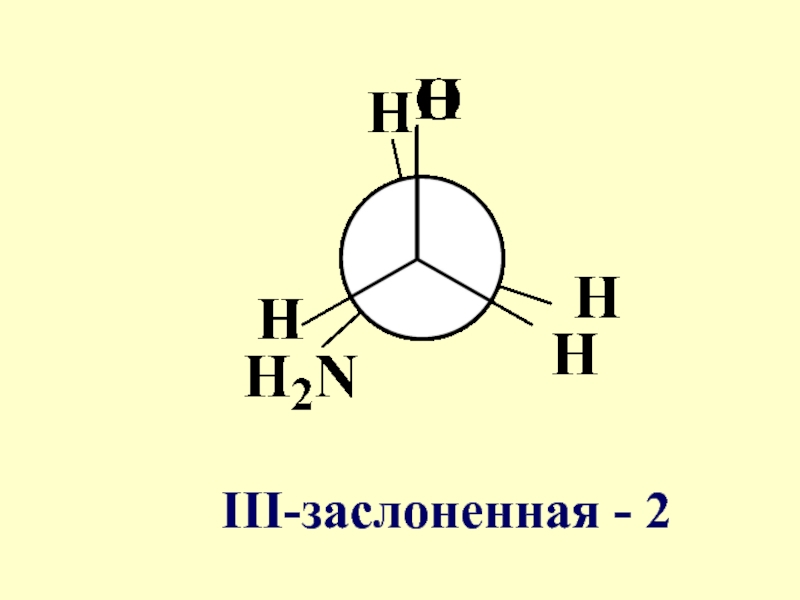
- 56. III-заслоненная - 2
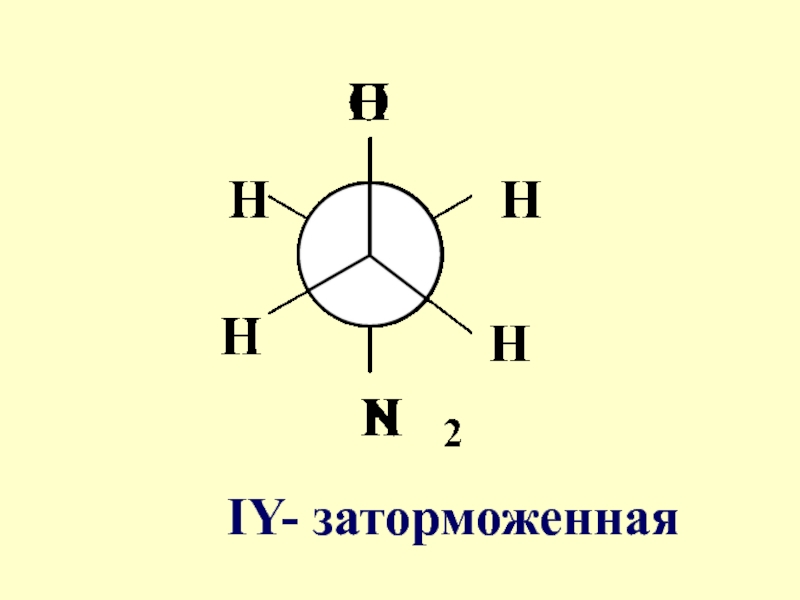
- 57. IY- заторможенная
- 58. Конформации I-IY характеризуются различной потенциальной энергией
- 60. В длинных углеродных цепях вращение может происходить
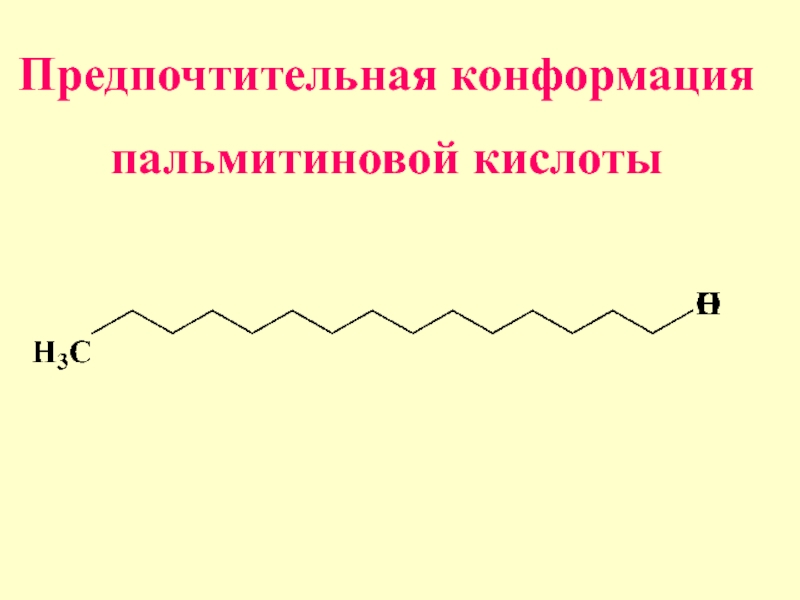
- 61. По данным рентгеноструктурного анализа установлено, что длинные цепи насыщенных углеводородов имеют зигзагообразную конформацию
- 62. Это наиболее выгодная конформация , т.к. атомы углерода находятся в заторможенной конформации
- 63. Предпочтительная конформация пальмитиновой кислоты
- 64. Для молекул, у которых две или более
- 65. 2.4. Конформации циклических соединений По
- 66. Согласно теории Байера циклические системы имеют
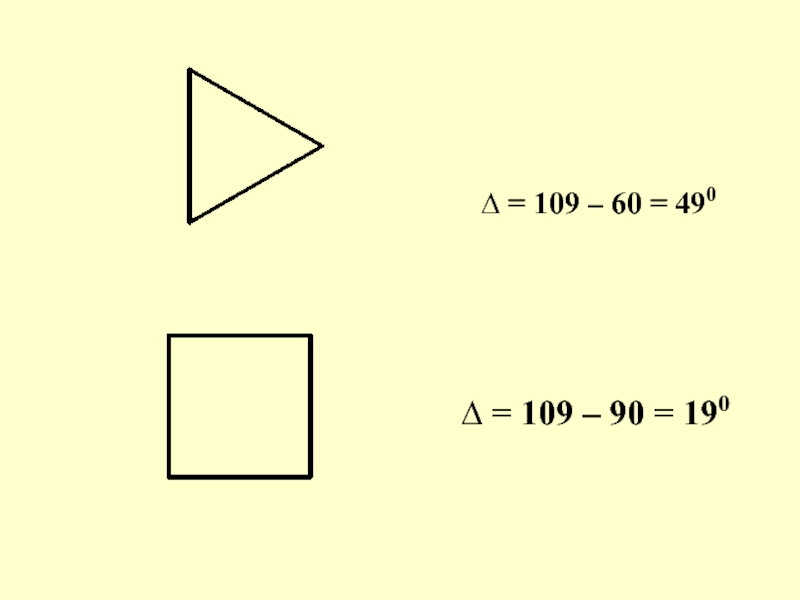
- 67. ∆ = 109 – 60 = 490 ∆ = 109 – 90 = 190
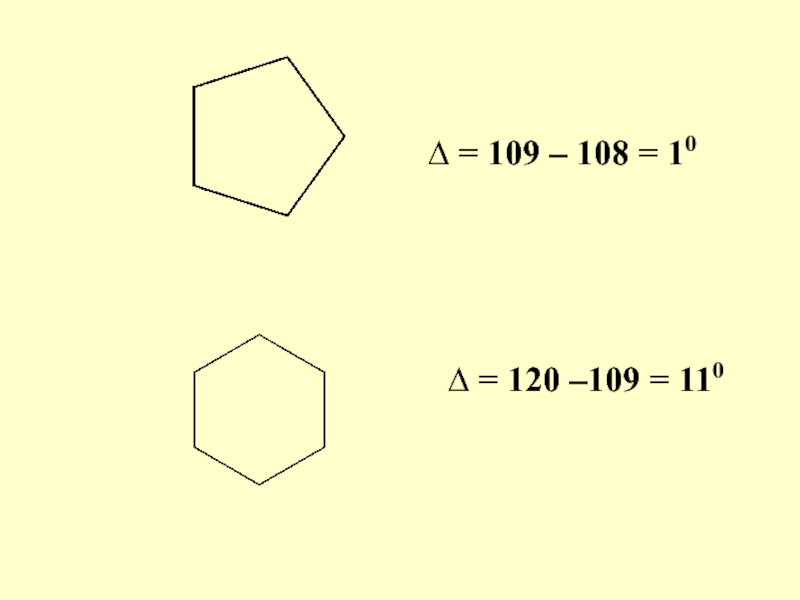
- 68. ∆ = 109 – 108 = 10 ∆ = 120 –109 = 110
- 69. Теория Байера верна только малых циклов и лишена основы для остальных циклических систем
- 70. Согласно теории Закса и Мора циклы с
- 71. В связи с этим оказалось возможным построить
- 72. Конформация кресло
- 73. В конформации кресло для циклогексана возможны два
- 74. II – 6 связей параллельны оси симметрии
- 75. Для циклогексана возможны две энергетически одинаковые вырожденные
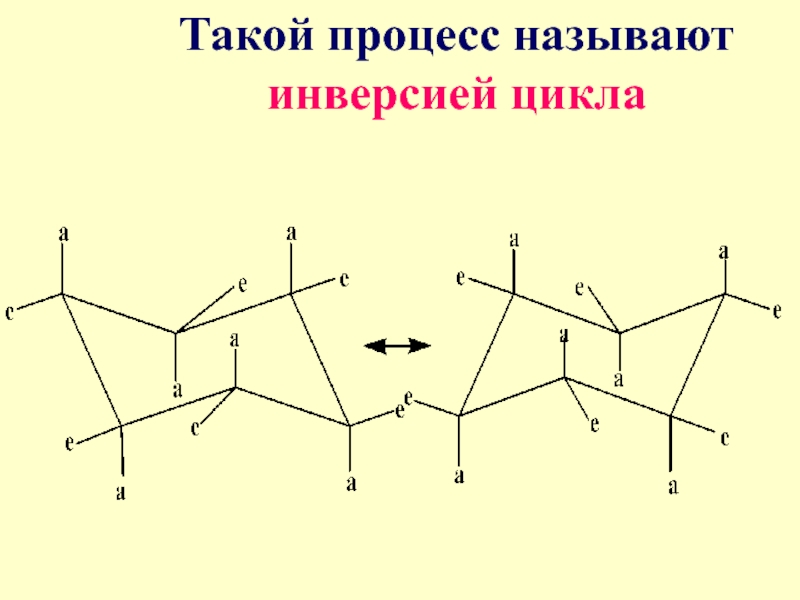
- 76. Такой процесс называют инверсией цикла
- 77. Если имеется монозамещенное производное циклогексана, то возможны
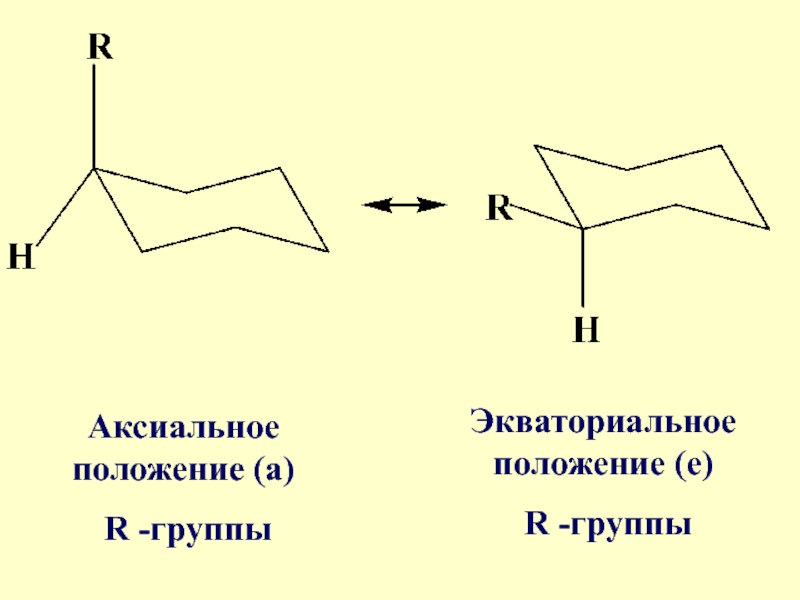
- 78. Энергетически наиболее выгодна конформация с экваториальным расположением заместителя
- 79. Аксиальное положение (а) R
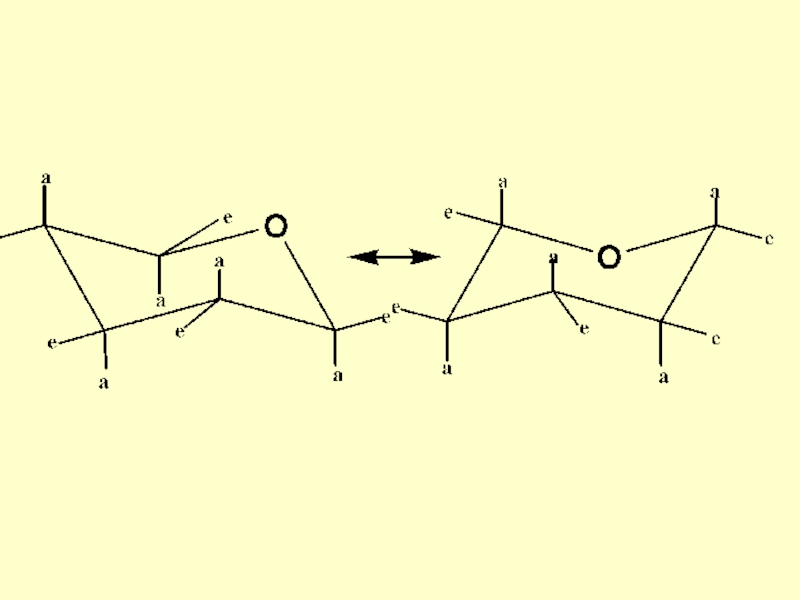
- 80. Конформации гетероциклов Природные биологически-активные соединения
- 81. Гетероатомы имеют одинаковую с атомами углерода гибридизацию и существенно не меняют конформацию соответствующего карбоцикла
- 82. В природные соединения в качестве гетероатома часто входит кислород и азот
- 83. Широкое распространение имеет насыщенный шестичленный гетероцикл с
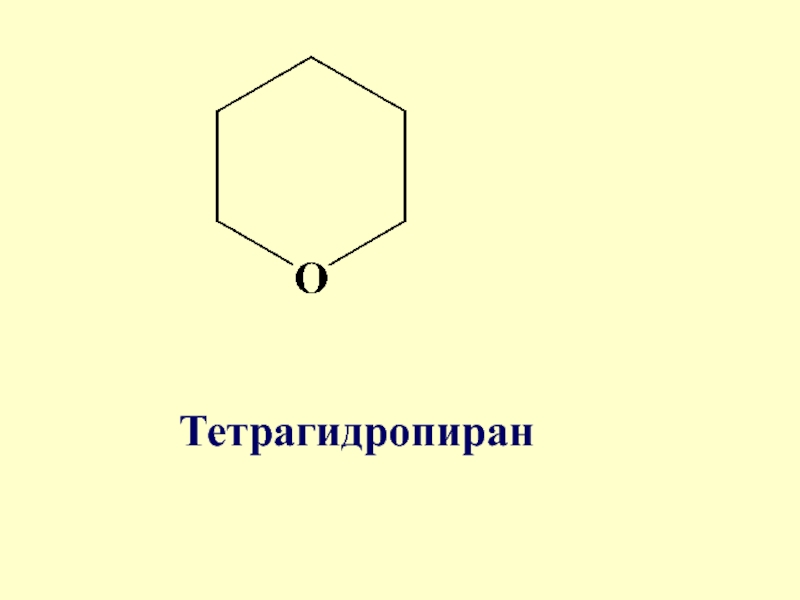
- 84. Тетрагидропиран
- 86. Спасибо за внимание !
Слайд 2План
2.1 Теория строения органических соединений А.М. Бутлерова
2.2 Изомерия. Типы изомерии
2.3 Конфигурация
и конформации соединений с открытой цепью
2.4 Конформации циклических соединений
2.4 Конформации циклических соединений
Слайд 3Первая научно-обоснованная теория строения органических соединений появилась в 60-ых годах 19
века. Основы этой теории были изложены в труде «Введение к полному изучению органической химии»
(1828-1886)
2.1 Теория строения органических соединений А.М. Бутлерова
Слайд 4Основные положения теории А.М. Бутлерова
1.Атомы в молекулах соедине-ны друг с другом
в определен-ной последовательности в соо-тветствии с их валентностью. Порядок связи атомов называется химическим строением
Слайд 5 2. Свойства веществ зависят не только от того, какие атомы
и в каком количестве входят в состав его молекулы, но и от того в каком порядке они соединены между собой, т.е. от химического строения молекулы
Слайд 63. Атомы или группы атомов, образовавшие молекулу, взаимно влияют друг на
друга, от чего зависит реакционная способность молекулы
Слайд 7Химическое строение молекулы определяется природой и последовательностью связей между составляющими ее
атомами
Слайд 82.2 Изомерия. Типы изомерии
Под изомерией понимают существование молекул с одинаковыми суммарными
формулами, но различным строением или расположением атомов в пространстве
Слайд 10.
Различают структурную и пространственную изомерию (стереоизомерия)
Структурная изомерия обусловлена различным расположением атомов
в молекуле
Слайд 12Виды структурной изомерии 2. Изомерия положения, обусловлена различным расположением функциональных групп или
кратных связей
1- хлорпропан
2-хлорпропан
Слайд 14Виды структурной изомерии
3. Межклассовая изомерия
ПРОПАНОЛ-1
МЕТИЛЭТИЛОВЫЙ
ЭФИР
МОЛЕКУЛЯРНОЙ ФОРМУЛЕ СООТВЕТСТВУЮТ ДВА СОЕДИНЕНИЯ
Слайд 16Виды структурной изомерии
4. ТАУТОМЕРИЯ-
изомеры отличаются функциональными группами легко переходящими друг
в друга
Слайд 19Пространственная изомерия
стереоизомерия
Пространственная изомерия обусловлена различным прос-транственным расположением атомов при одинаковом
порядке их связывания
Слайд 22Цис- и транс- изомеры
возможны для алкенов,
у которых при атомах
углерода с двойной связью
имеются разные
заместители
Слайд 242.3. Конфигурация и конформации соединений с открытой цепью
Для описания пространственных различий
используют два важнейших понятия: конфигурация и конформация молекул
Слайд 25Конфигурация –
определенное пространственное
расположение атомов в молекуле,
без учета различий,
возникающих
вследствие вращения
вокруг одинарных связей
вокруг одинарных связей
Слайд 28Конформации – динамические изомеры
(конформеры), отличающиеся
друг от друга пространственным
расположением
атомов в одной
и той же конфигурации
и той же конфигурации
Слайд 29Взаимные переходы конформеров
могут осуществляться только в
итоге вращения связей, но
не их разрыва
Слайд 30
Термин конформация был предложен
в 1929 году Хеуорсом.
В широком смысле
его используют
в тех случаях, когда необходимо
обозначить одно из бесчисленного
множества моментальных рас-положений атомов в пространстве, которые возникают в результате вращения вокруг одинарных связей
в тех случаях, когда необходимо
обозначить одно из бесчисленного
множества моментальных рас-положений атомов в пространстве, которые возникают в результате вращения вокруг одинарных связей
Слайд 31Конформации молекулы
представляют собой различные геометрические формы, возникающие в результате
вращения вокруг одинарных связей
Слайд 34
Для построения формул Ньюмена выбирается некоторая связь, относительно которой производится свободное
вращение
Слайд 35Относительно большей внутренней
энергией обладают конформации,
в которых заместители находятся в
наиболее близком положении
друг к другу, что связано
с действием сил отталкивания ,
возникающих между электронами
σ-связей С-Н при их сближении
Слайд 36Наименьшей энергией обладают конформеры, в которых заместители рас-положены наиболее далеко друг
от друга
Слайд 37Атомы, образующие С -С
связь строго проецируются друг на друга так, что мы видим ближайший к нам атом С и от него располагаем все связи к заместителям
Слайд 38Второй атом С как бы прикрыт кружком, идущие от этого атома
связи, изображаются выступающими за кружок
Слайд 39Разность между этими энергиями составляет энергетический барьер вращения или торсионное напряжение
Слайд 40Конформации соединений с открытой цепью
Оперировать бесчисленным множеством конформаций практически невозможно, поэтому
принимают во внимание молекулярные структуры, в которых последовательно осуществлен поворот вокруг простой связи на 600
Слайд 42Угол поворота вокруг σ-связи называют
торсионным углом – минимальный торсионный угол равен 600 и из бесчисленного множества конформаций рассматривают только 6
Слайд 46
I- заслоненные конформации, заместители одного атома углерода налагаются на заместители другого
атома углерода т.е. находятся друг относительно друга в наиболее близком положении, обладают самой высокой энергией
Слайд 47II – заторможенные конформации, заместители одного атома на проекции размещены между
заместителями другого, деля ва-лентные углы, т.е. заместители расположены наиболее далеко друг от друга в пространстве, такие конформеры обладают наименьшей энергией
Слайд 49У более сложных соединений наряду с торсионным напряжением, действует еще один
фактор, затрудняющий свободное вращение - ван-дер-ваальсово напряжение
Слайд 50Ван-дер-ваальсово напряжение обусловлено силами отталкивания между валентно не связанными большими по
объему заместителями
Слайд 51Возникающие при этом конформации называют скошенными или гош-формами.
В этане такого
отталкивания не возникает из-за небольшого радиуса атома водорода
Слайд 60В длинных углеродных цепях вращение может происходить вокруг нескольких С –С
связей, поэтому углеродная цепь приобретает различные конформации
Слайд 61По данным рентгеноструктурного анализа установлено, что длинные цепи насыщенных углеводородов имеют
зигзагообразную конформацию
Слайд 62Это наиболее выгодная конформация , т.к. атомы углерода находятся в
заторможенной конформации
Слайд 64Для молекул, у которых две или более функциональные группы, однозначно сказать
о предпочтительной конформации сложно, т.к. могут возникать водородные связи
Слайд 652.4. Конформации циклических соединений
По числу атомов углерода в цикле различают
малые циклы (3-4), обычные циклы (5,6,7), средние (8-11) и большие циклы > 11
Слайд 66 Согласно теории Байера циклические системы имеют плоскую структуру. Напряженность зависит
от углового напряжения, которое определяют как разницу между тетраэдрическим углом и углом правильного многоугольника, образующего ту или иную циклическую систему
Слайд 70Согласно теории Закса и Мора циклы с числом атомов в цикле
> 5 отклоняются от копланарности и сохраняют естественный угол валентности 1090
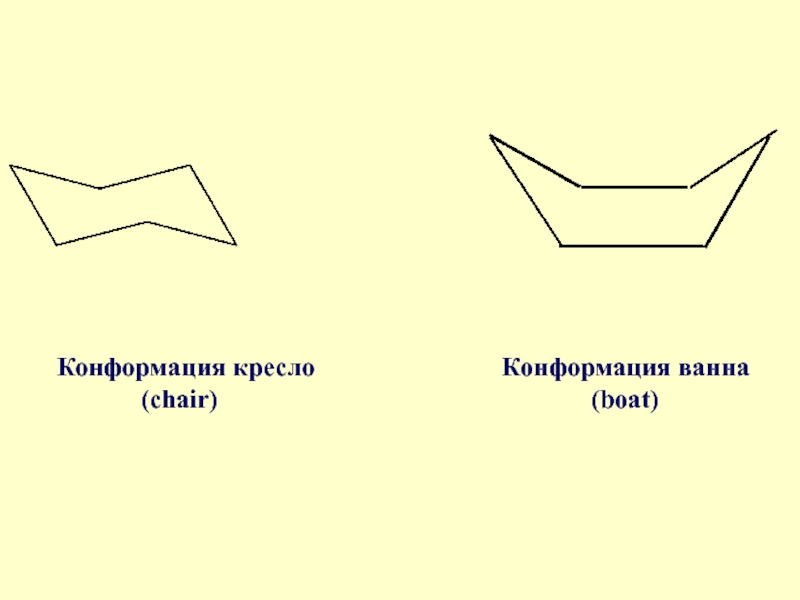
Слайд 71В связи с этим оказалось возможным построить две ненапряженные модели для
циклогексана - кресла и ванны
Слайд 73В конформации кресло для циклогексана возможны два типа СН связей: I
–6 связей направлены в стороны от кольца под углом 109,50, лежат примерно в в его плоскости и их называют экваториальными (е)
Слайд 74II – 6 связей параллельны оси симметрии и направлены попеременно вверх
– вниз, перпендикулярны плоскости кольца получили название – аксиальные (а)
Слайд 75Для циклогексана возможны две энергетически одинаковые вырожденные конформации кресла. При переходе
их друг в друга аксиальные превращаются в экваториальные и наоборот
Слайд 77Если имеется монозамещенное производное циклогексана, то возможны две конформации с экваториальным
и аксиальным расположением заместителя
Слайд 80Конформации гетероциклов
Природные биологически-активные соединения – пяти- и шестичленные циклы, содержащие
1 или более гетероатомов
Слайд 81Гетероатомы имеют одинаковую с атомами углерода гибридизацию и существенно не меняют
конформацию соответствующего карбоцикла
Слайд 83Широкое распространение имеет насыщенный шестичленный гетероцикл с атомом кислорода – тетрагидропиран
(входит в состав углеводов). Этот цикл называют пиранозным