- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Основы коррозии и защиты металлов презентация
Содержание
- 1. Основы коррозии и защиты металлов
- 2. Коррозия металлов приносит в любом развитом
- 3. Коррозия - самопроизвольное разрушение материалов при
- 4. 1.Семенова, И. В. Коррозия и защита
- 5. ХИМИЧЕСКАЯ КОРРОЗИЯ МЕТАЛЛОВ Типы коррозии
- 6. Химической коррозией называется самопроизвольный процесс разрушения
- 7. Химическая коррозия Сухой воздух Топочные газы Нефть
- 8. Согласно термодинамическим оценкам все металлы, за исключением
- 9. Скорость химической газовой коррозии зависит от свойств получающихся продуктов коррозии Скорость газовой коррозии
- 10. Свойства образующихся при коррозии оксидов и солевых
- 11. Разные по природе металлы могут
- 12. При
- 13. Сплошная защитная плёнка не может получиться
- 14. Рис. 1.1 Линейный закон роста оксидной плёнки
- 15. Vkop V
- 16. Для большинства технических металлов (Fe, Cu,
- 17. При сплошном оксиде скорость химической коррозии зависит
- 18. логарифмический t оС < 250
- 19. Рис. 1.3 Зависимость толщины плёнки
- 20. Рис. 1.4 Изменение скорости коррозии во времени
- 21. Вывод: Химическая коррозия становится опасной, когда
- 22. Температура окалинообразования - температура при которой наблюдается
- 23. Поведение металла при высоких температурах описывается
- 24. Влияние температуры на скорость газовой коррозии
- 25. Химическая коррозия печи
- 26. Vкор To Рис.1.5 Поведение железа
- 27. Таким образом железо, углеродистые и низколегированные стали
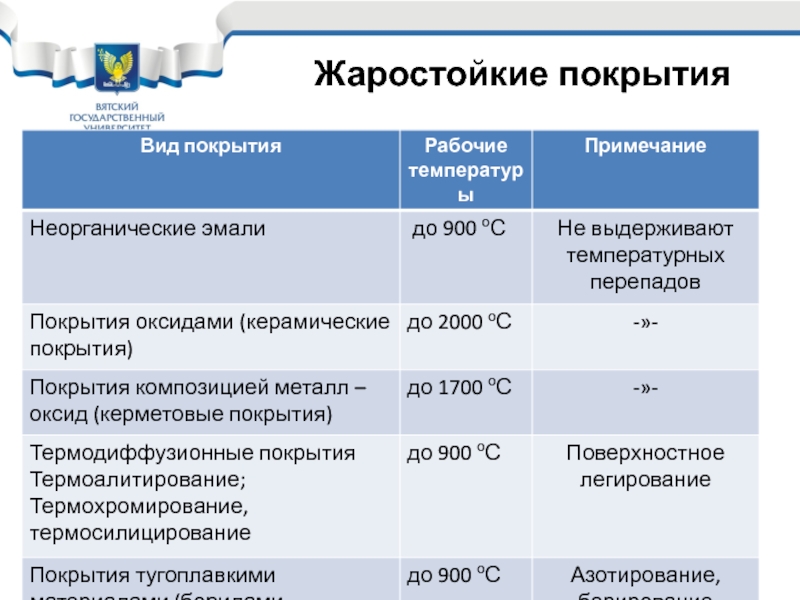
- 28. Большинство технических металлов не жаростойки. Но
- 29. Al: tпл = 658оС упорядоченная плёнка,
- 30. Три направления борьбы с химической коррозией:
- 31. Основные элементы жаростойкого легирования Cr, Al,
- 32. 15Х5М, 12Х5МА – 550-600 С; 15Х6СМ
- 34. Применяются широко при сварке. Сварка идет
Слайд 2
Коррозия металлов приносит в любом развитом государстве гигантские экономические потери, которые
Причем эти потери постоянно растут за счет 2 причин:
1. Увеличения массы эксплуатируемых конструкционных материалов;
2. Ужесточения условий коррозии.
Необходимость изучения курса
«Защита строительных конструкций от коррозии»
Слайд 3
Коррозия - самопроизвольное разрушение материалов при их физико-химическом взаимодействии с окружающей
Для строителей это:
Коррозия металлов (стали, чугун, сплавы алюминия);
Коррозия бетона и железобетона;
Коррозия (старение) пластмасс;
Коррозия (разрушение) дерева.
Термин коррозия
Слайд 4
1.Семенова, И. В. Коррозия и защита от коррозии [Текст] : учеб.
2. ГОСТы ЕСЗКС, СНиПы
Литература
Слайд 6 Химической коррозией называется самопроизвольный процесс разрушения металлов под действием сухих
Определение
Слайд 7Химическая коррозия
Сухой воздух
Топочные газы
Нефть и
продукты её перегонки
Органические
жидкости
Газовая коррозия
Коррозия в
Виды химической коррозии
В строительной практике наиболее распространенные виды химической коррозии: в сухом воздухе и в топочных газах.
Слайд 8Согласно термодинамическим оценкам все металлы, за исключением золота, должны корродировать под
Термодинамика химической коррозии
Слайд 9Скорость химической газовой коррозии зависит от свойств получающихся продуктов коррозии
Скорость газовой
Слайд 10Свойства образующихся при коррозии оксидов и солевых плёнок определяются тремя основными
природой корродирующего металла
температурой коррозии
составом коррозионной среды
Скорость газовой коррозии
Слайд 11
Разные по природе металлы могут образовывать при химической коррозии сплошной и
Сплошность оксида зависит от соотношения двух объемов:
Vok – объём оксида (продуктов коррозии),
VMe – объём корродирующего металла
Влияние природы металла на химическую коррозию
Слайд 12
При Vok/VMe< 1, оксид не
Щелочные и щелочеземельные металлы Na, K, Ca
Химическая коррозия при не сплошном оксиде
Слайд 13 Сплошная защитная плёнка не может получиться также, если
Vok/VMe>2,5÷3,5
Оксид из-за больших
Металлы: W, Mo, V при температурах более 600 С
Химическая коррозия при не сплошном оксиде
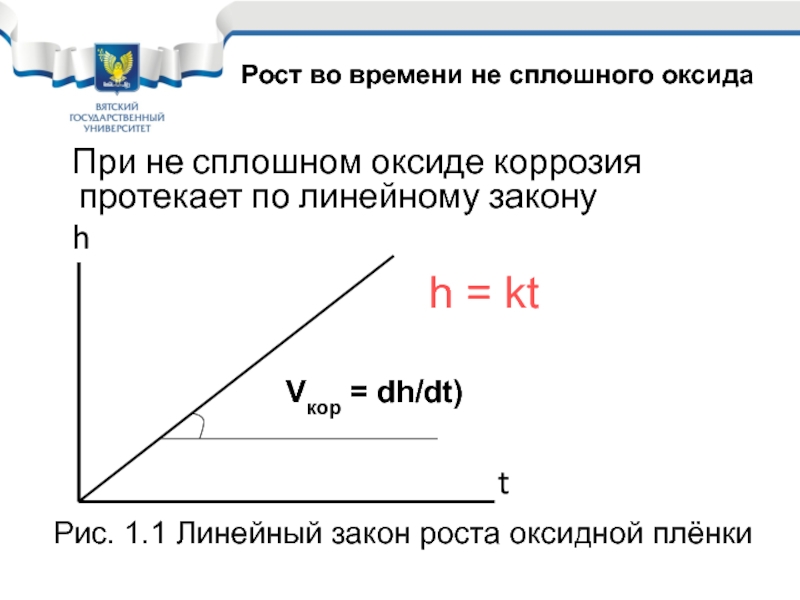
Слайд 14Рис. 1.1 Линейный закон роста оксидной плёнки
При не сплошном оксиде коррозия
h
t
h = kt
Vкор = dh/dt)
Рост во времени не сплошного оксида
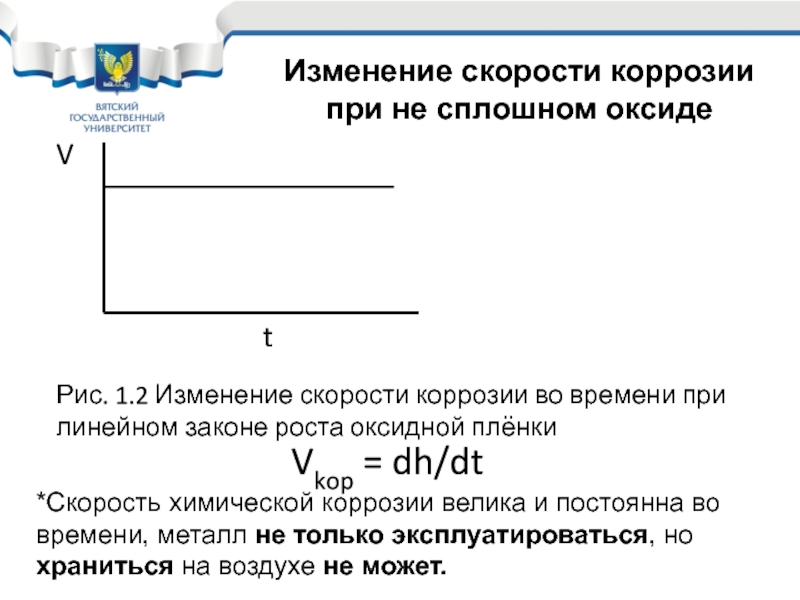
Слайд 15Vkop V
Vkop = dh/dt
*Скорость химической коррозии велика и постоянна во времени, металл не только эксплуатироваться, но храниться на воздухе не может.
Изменение скорости коррозии при не сплошном оксиде
Слайд 16
Для большинства технических металлов (Fe, Cu, Al, Ni, Ti и т.д.)
1
Химическая коррозия при сплошном оксиде
Слайд 17При сплошном оксиде скорость химической коррозии зависит от упорядоченности, плотности оксида,
Скорость коррозии при сплошном оксиде
Слайд 18
логарифмический t оС < 250 - 300
Степенной
параболический t оС > 250 - 300
паралинейный t оС > 800 - 900
Законы роста оксидной плёнки
Самый главный фактор, влияющий на упорядоченность, плотность оксида, а значит и на скорость химической газовой коррозии – это температура. В зависимости от температуры оксид растет по разным законам
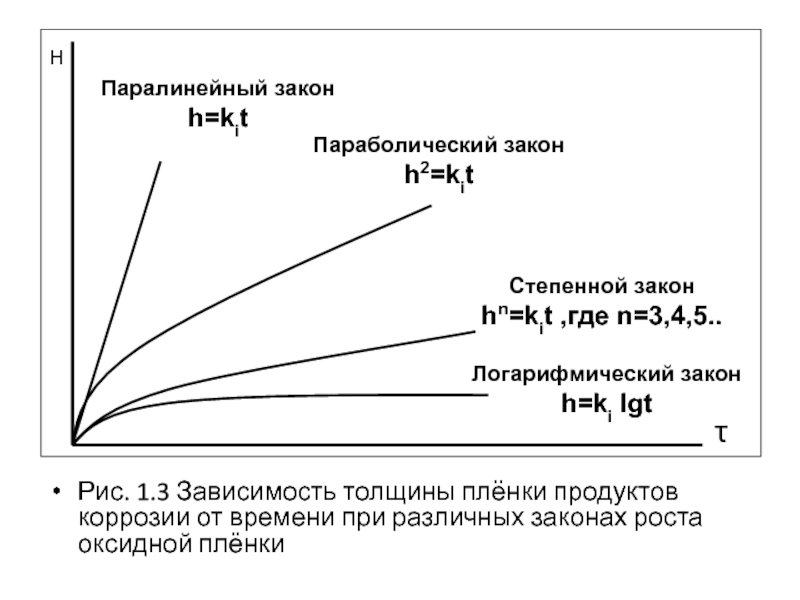
Слайд 19
Рис. 1.3 Зависимость толщины плёнки продуктов коррозии от времени при
Паралинейный закон
h=kit
H
Параболический закон
h2=kit
Степенной закон
hn=kit ,где n=3,4,5..
Логарифмический закон
h=ki lgt
τ
Слайд 20Рис. 1.4 Изменение скорости коррозии во времени при различных законах роста
Vkop
Паралинейный
Параболический
Степенной
Логарифмический
τ
Изменение скорости коррозии во времени при различных температурах
Слайд 21
Вывод: Химическая коррозия становится опасной, когда оксид растет по параболическому закону
Защитное действие окалины не велико и скорость коррозии даже через большое время при достаточно большом по толщине оксиде остается высокой.
Металл нужно защищать.
Влияние температуры на скорость химической коррозии
Слайд 22Температура окалинообразования - температура при которой наблюдается переход к параболическому закону
Слайд 23
Поведение металла при высоких температурах описывается двумя характеристиками:
Жаростойкость – способность металла
Жаропрочность – способность металла сохранять свои механические характеристики при высоких температурах.
Понятие о жаростойкости и жаропрочности
Слайд 24
Влияние температуры на скорость газовой коррозии
1.Чем выше температура, тем выше скорость
2. С газовой коррозией под действием сухого воздуха сталкиваются области промышленности, имеющие дело с горячим металлом.
3. Строители химическую газовую коррозию должны учитывать и по возможности уменьшать:
при сварке;
при термообработке;
при использовании печей.
Выводы
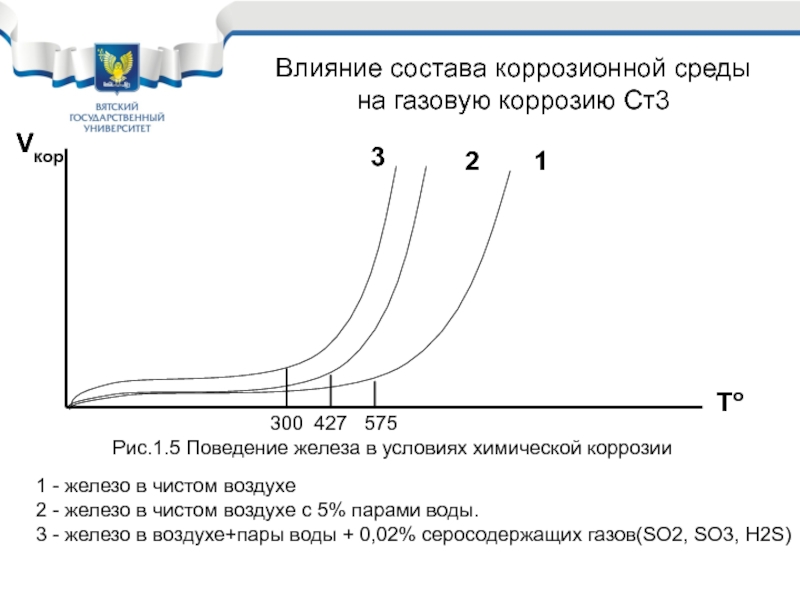
Слайд 26
Vкор
To
Рис.1.5 Поведение железа в условиях химической коррозии
1 - железо в
2 - железо в чистом воздухе с 5% парами воды.
3 - железо в воздухе+пары воды + 0,02% серосодержащих газов(SO2, SO3, H2S)
300
427
575
1
2
3
Влияние состава коррозионной среды на газовую коррозию Ст3
Слайд 27Таким образом железо, углеродистые и низколегированные стали в условиях химической коррозии
300оС – реальная температура окалинообразования железа.
Поведение железа и углеродистых сталей при химической коррозии
Слайд 28Большинство технических металлов не жаростойки.
Но некоторые металлы обладают жаростойкостью.
Жаростойкий металл
Понятие о жаростойком металле
Слайд 29
Al: tпл = 658оС упорядоченная плёнка, упорядоченный оксид до температуры плавления
Сr: tпл = 1857оС
tокалинообразования = 1300оС
Жаростойкие металлы
Слайд 30Три направления борьбы с химической коррозией:
1. изменение природы металла (жаростойкое легирование);
2.
3. защитные атмосферы.
Защита от химической коррозии
Слайд 31
Основные элементы жаростойкого легирования Cr, Al, Si.
Самый главный элемент Cr, вводится
Al и Si – дополнительные компоненты,
Al вводится в количестве 0 – 5%;
Si – в количестве 0-4%
Жаростойкое легирование
Слайд 32
15Х5М, 12Х5МА – 550-600 С;
15Х6СМ -
10Х9С2Ю, 12Х13 - 800 – 850 С;
12 Х17, 08Х17Т - 850-900 С;
12Х25Т, 15Х28, 15Х28Н – 1100-1200 С;
Никелевые сплавы
Нихром, нимоник, хастеллой, хромель, алюмель – 1100-1200 С
Примеры жаростойких сталей
Слайд 34
Применяются широко при сварке. Сварка идет при температуре выше температуры плавления
Нержавеющие стали, алюминий, титан не могут вариться даже под слоем флюса, а только в атмосфере инертного газа: аргона.
3. Применяются при термообработке (прежде всего при отжиге). Отжиг проводят в герметичных печах, куда специально закачивается инертная атмосфера или она формируется в печи за счет сжигания угля.
Защитные атмосферы



![1.Семенова, И. В. Коррозия и защита от коррозии [Текст] : учеб. пособие / И. В.](/img/tmb/5/475379/76dc9b93e0b0b17d19bb68617b87577e-800x.jpg)