- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Конфигурация макромолекулы презентация
Содержание
- 1. Конфигурация макромолекулы
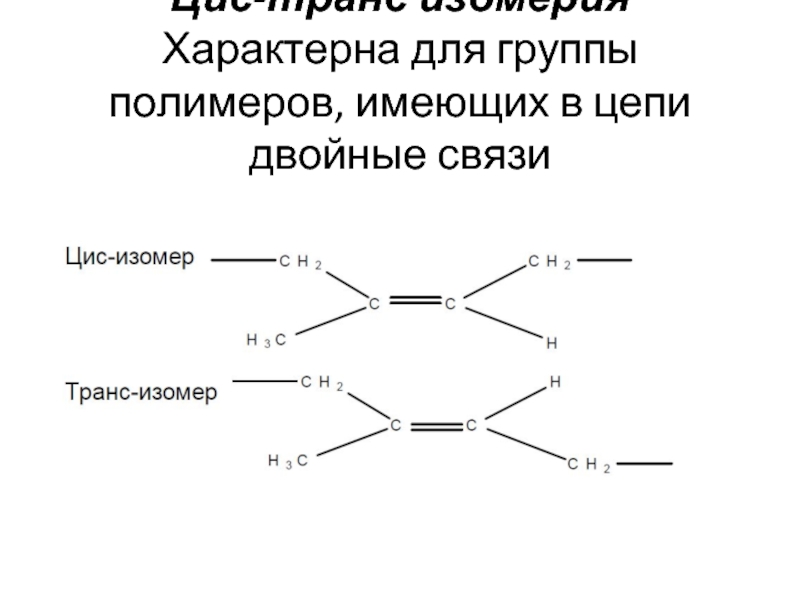
- 2. Цис-транс изомерия Характерна для группы полимеров, имеющих в цепи двойные связи
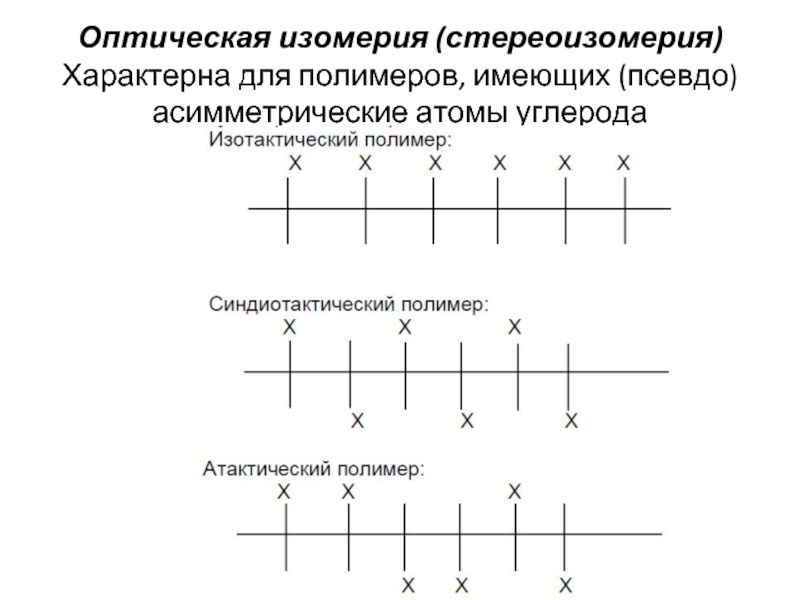
- 3. Оптическая изомерия (стереоизомерия) Характерна для полимеров, имеющих (псевдо)асимметрические атомы углерода
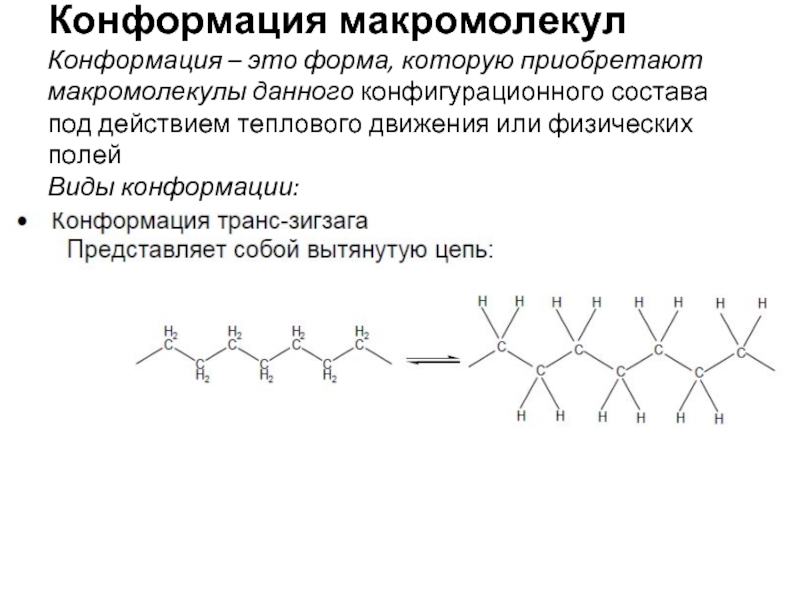
- 4. Конформация макромолекул Конформация – это форма,
- 6. Реакции синтеза макромолекул Полимеризация с раскрытием кратных
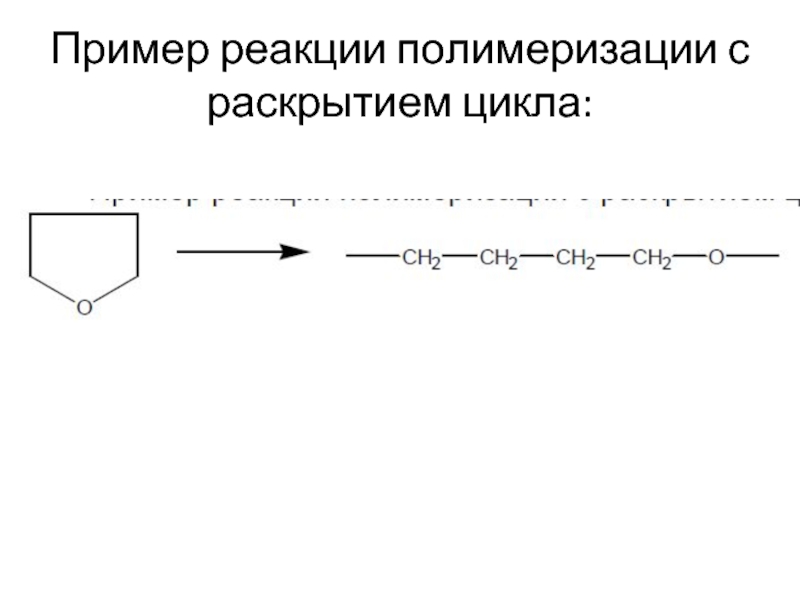
- 7. Полимеризация с раскрытием цикла В реакции этого
- 8. Поликонденсация и полиприсоединение Поликонденсация – ступенчатый процесс
- 9. гетерополиконденсациия участвуют разнородные молекулы – получение полиэтиленгликольтерефталата (лавсана)
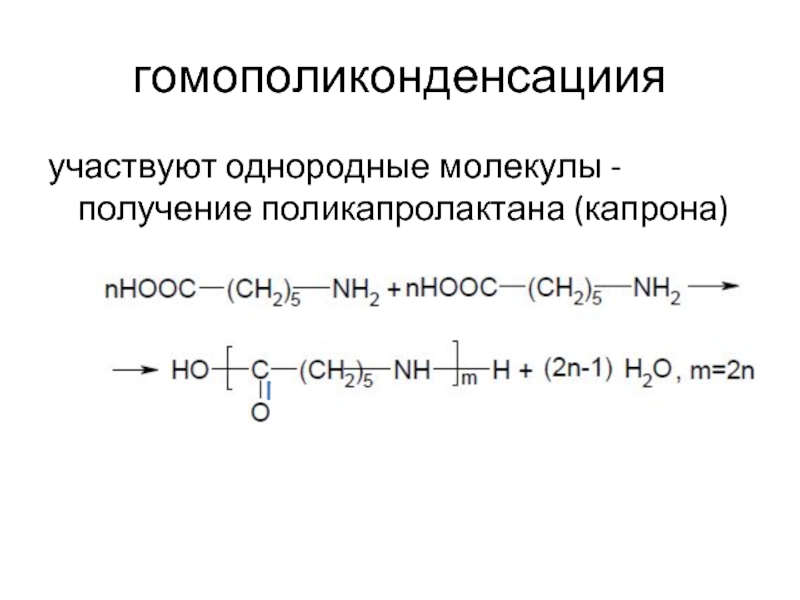
- 10. гомополиконденсациия участвуют однородные молекулы - получение поликапролактана (капрона)
- 11. Радикальная полимеризация Радикальной полимеризацией называется цепная реакция, протекающая через образование свободных радикалов.
- 12. Как всякая цепная реакция, полимеризация состоит в
- 13. Общая характеристика элементарных актов цепной полимеризации (ПМ)
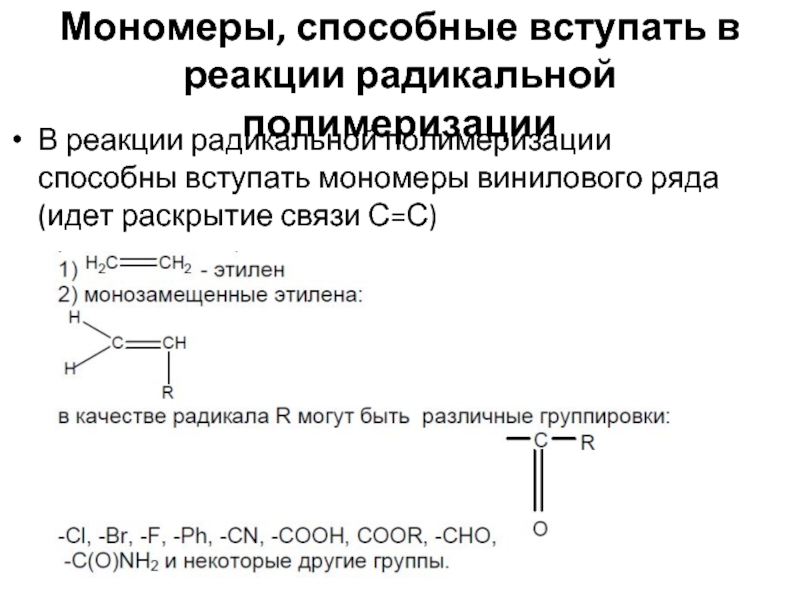
- 14. Мономеры, способные вступать в реакции радикальной полимеризации
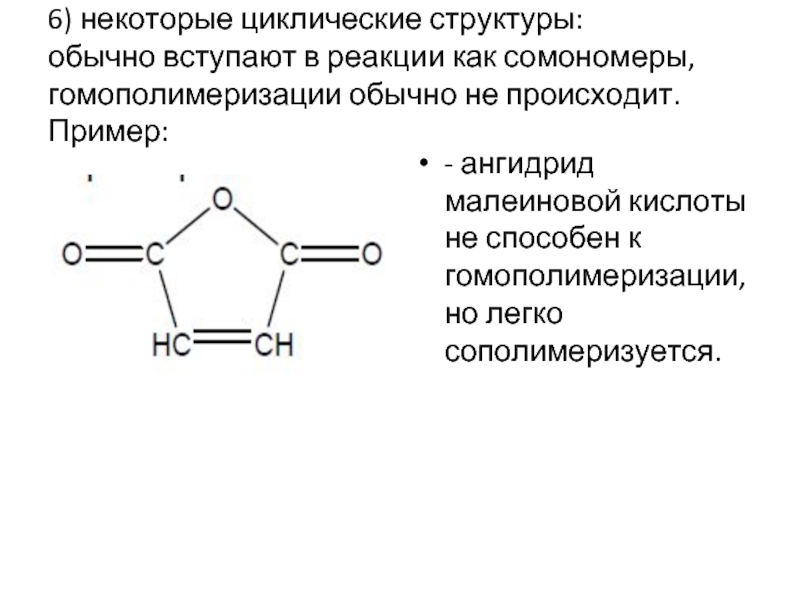
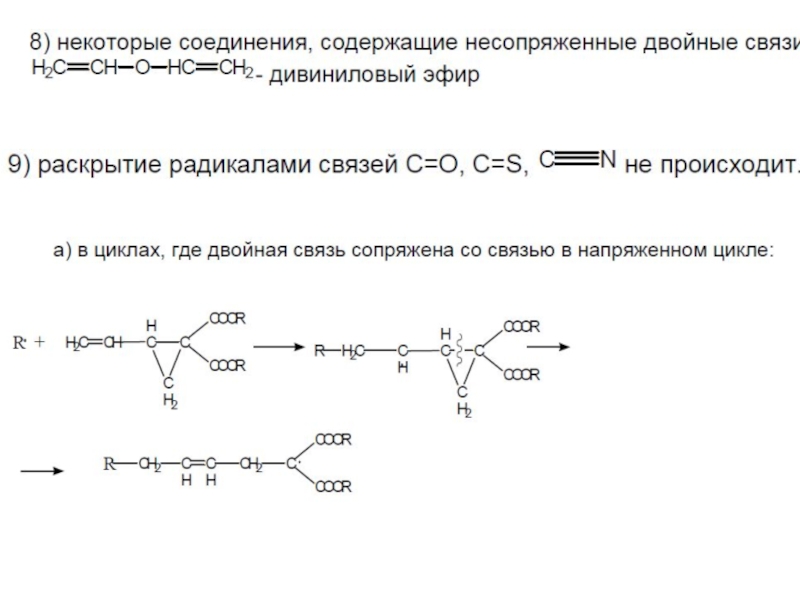
- 16. 6) некоторые циклические структуры: обычно вступают в
- 18. Пример реакции полимеризации с раскрытием цикла:
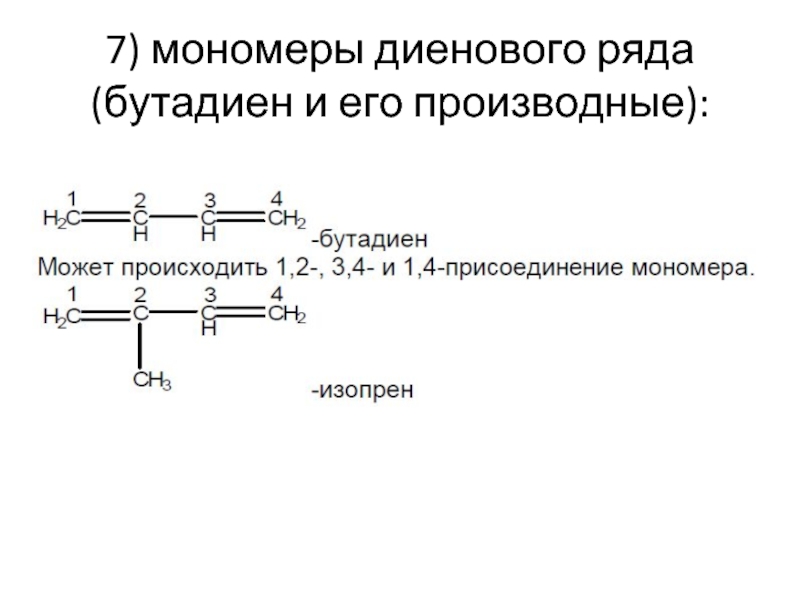
- 19. 7) мономеры диенового ряда (бутадиен и его производные):
- 20. СH2=CH–CH=CH2 полимеризуется; СH2=C(Ph)–CH=CH2 полимеризуется в
- 21. Относительная активность производных дивинила в полимеризации
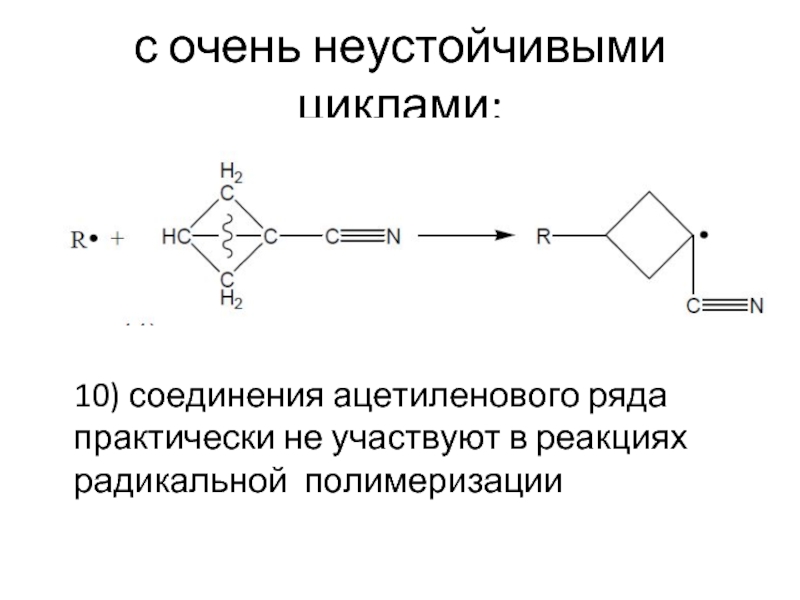
- 23. с очень неустойчивыми циклами: 10) соединения ацетиленового ряда практически не участвуют в реакциях радикальной полимеризации
- 24. Полимеризация Полимеризацией называется реакция соединения мономерных
- 25. Процесс полимеризации является цепной реакцией, состоящей из
- 26. Радикальная полимеризация Активными центрами являются свободные радикалы.
- 27. Реакции могут осуществляться различными способами, но
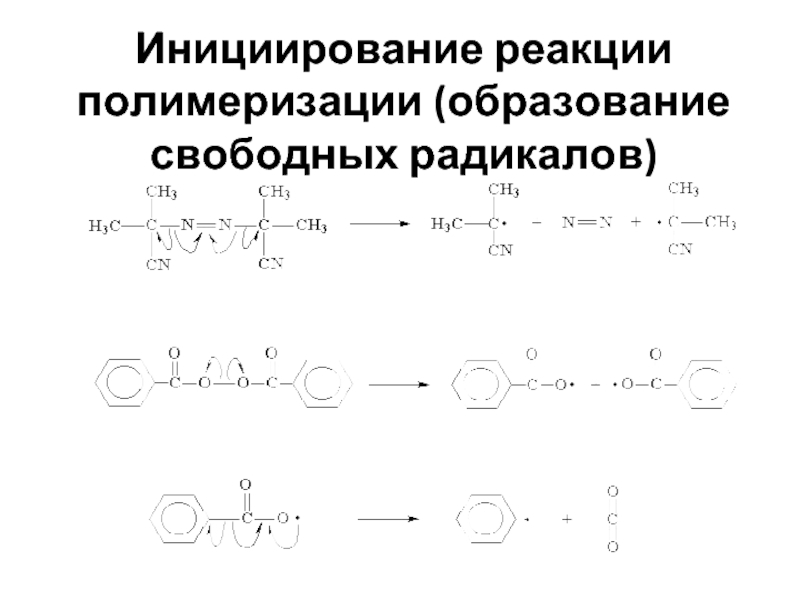
- 28. Инициирование реакции полимеризации (образование свободных радикалов)
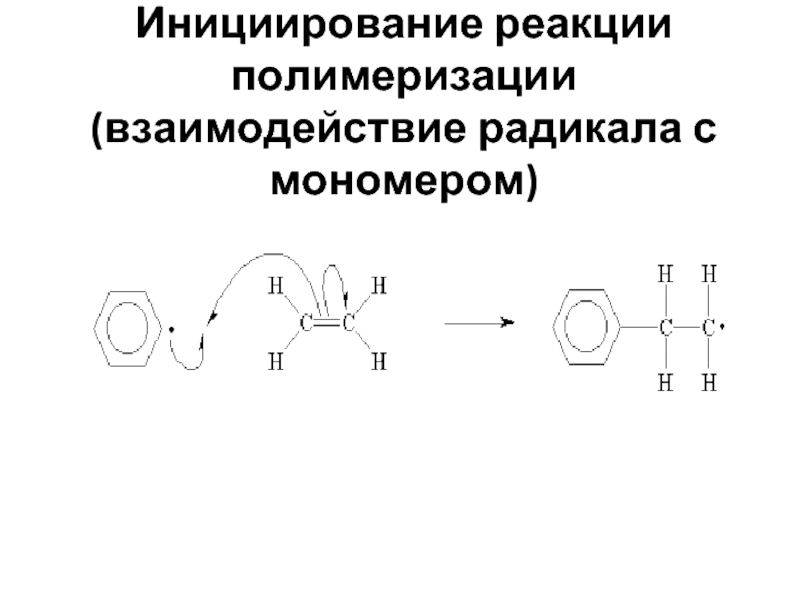
- 29. Инициирование реакции полимеризации (взаимодействие радикала с мономером)
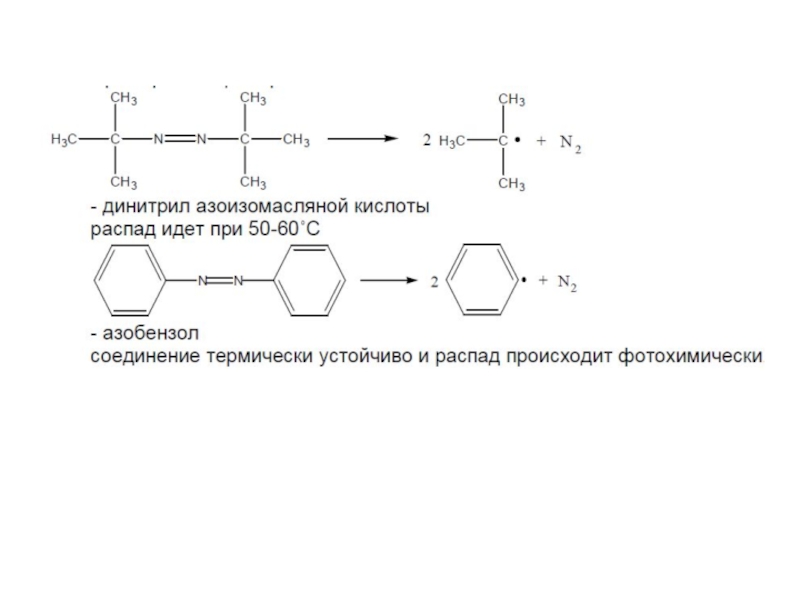
- 34. Соединения, имеющие в своем составе азогруппу
- 36. 1. Способность инициатора распадаться без образования радикалов.
- 37. Эффективность инициаторов Побочные реакции с участием радикалов
- 38. Эффективность инициирования f= отношение числа радикалов, инициирующих полимеризацию к общему числу радикалов
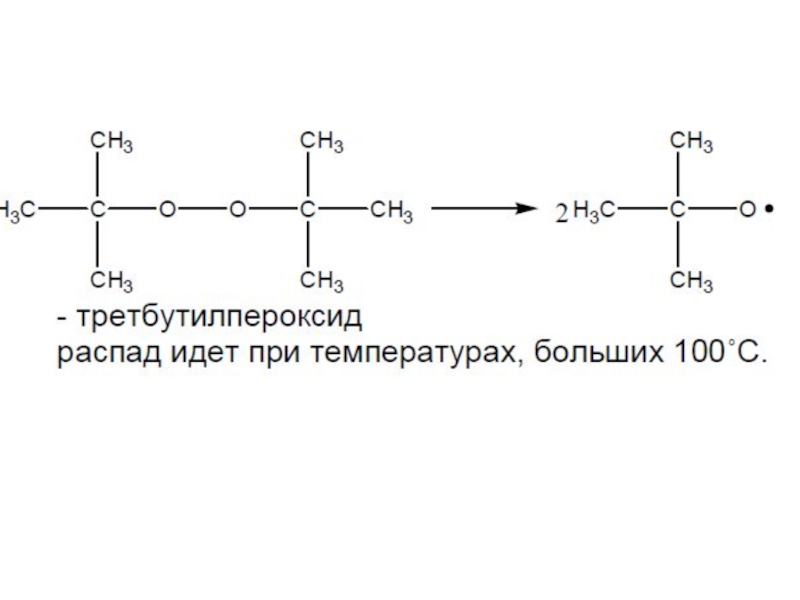
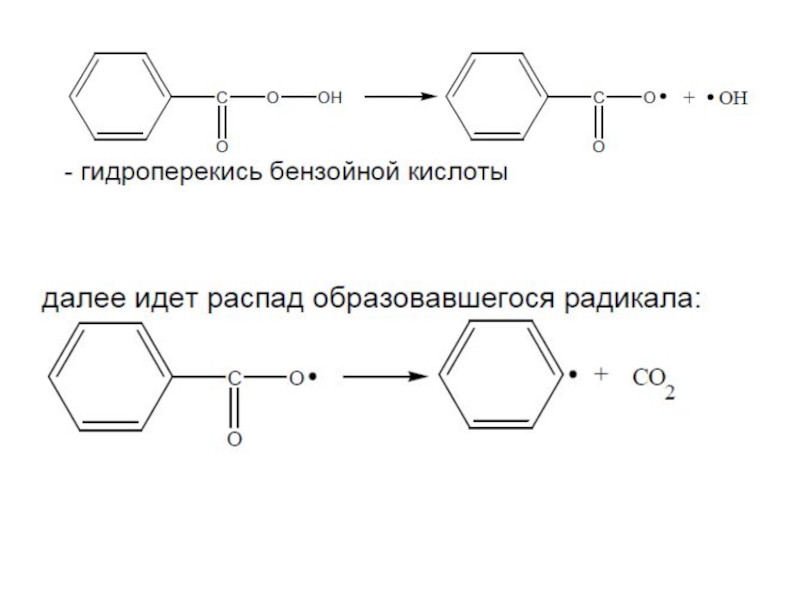
- 39. Характеристика некоторых инициаторов
- 40. Скорость инициирования представляет собой скорость распада с
- 41. Влияние температуры на ход процесса Константа скорости распада зависит от температуры по уравнению Аррениуса
- 42. Обратным процессу распада является процесс рекомбинации
- 43. Окислительно-восстановительные системы Реактив
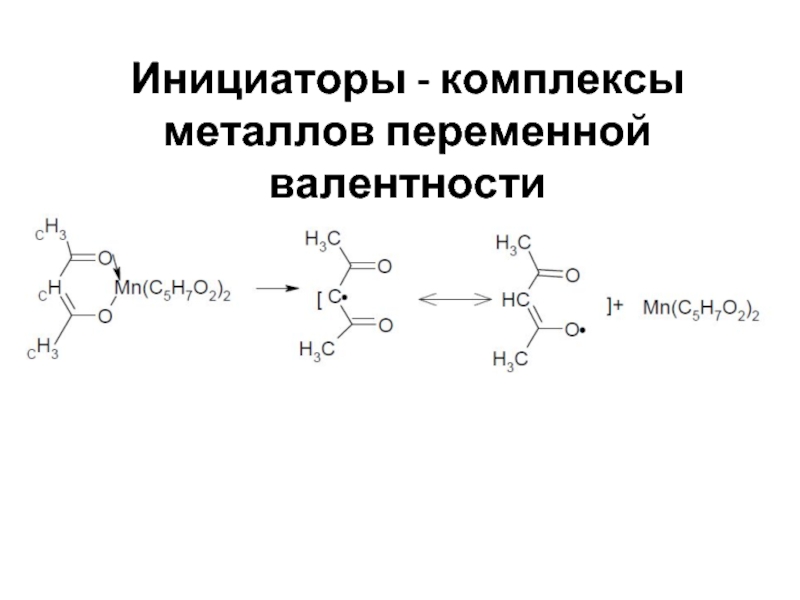
- 44. Инициаторы - комплексы металлов переменной валентности
- 45. Инициирование под действием различных излучений Радиационная химия
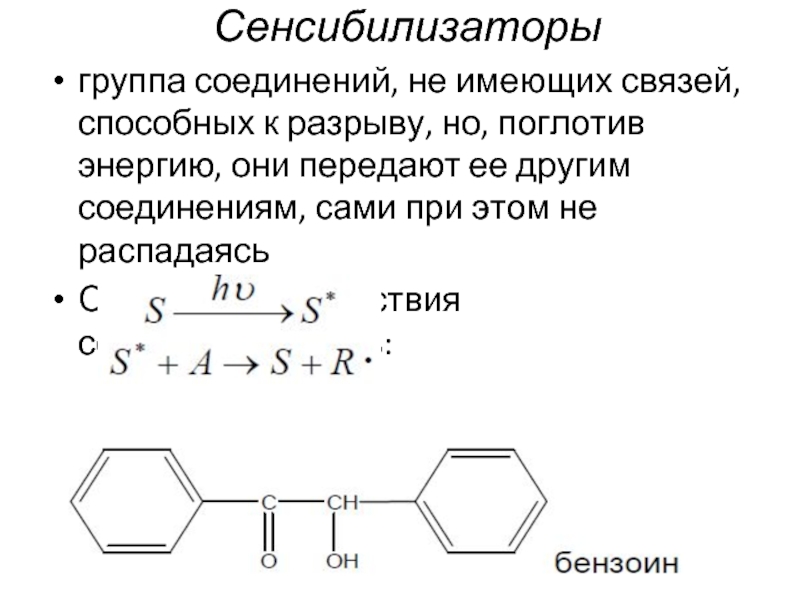
- 46. Сенсибилизаторы группа соединений, не имеющих связей, способных
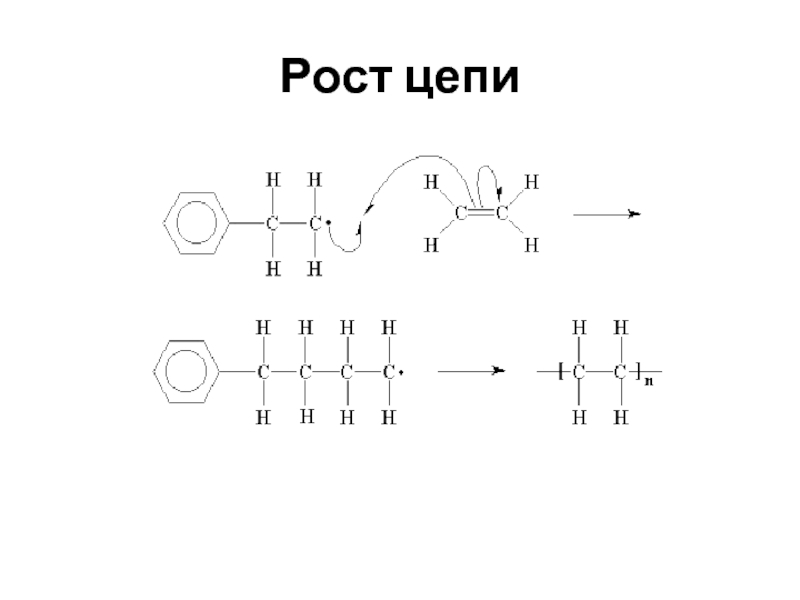
- 47. РОСТ ЦЕПИ Полимерная цепь растет в
- 48. Рост цепи
- 49. Обрыв цепи Обрыв цепи при радикальной полимеризации
- 50. Обрыв цепи при радикальной полимеризации может происходить
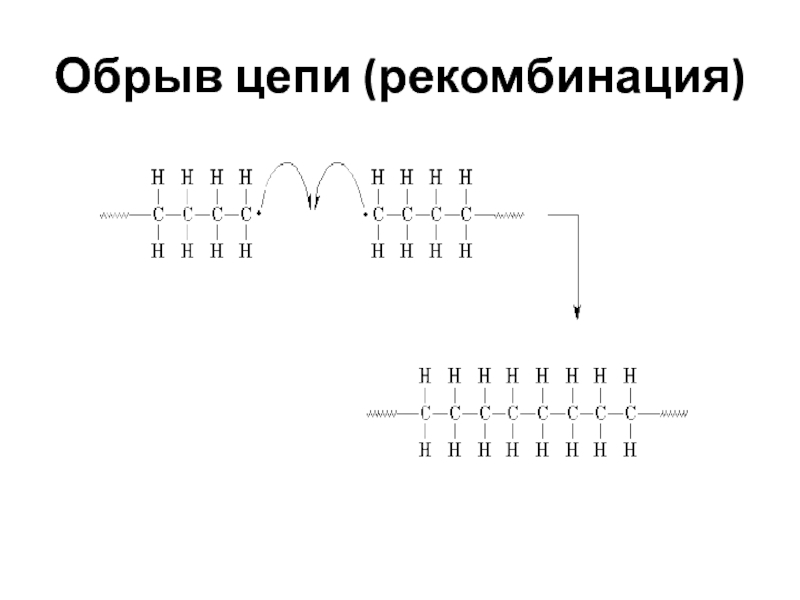
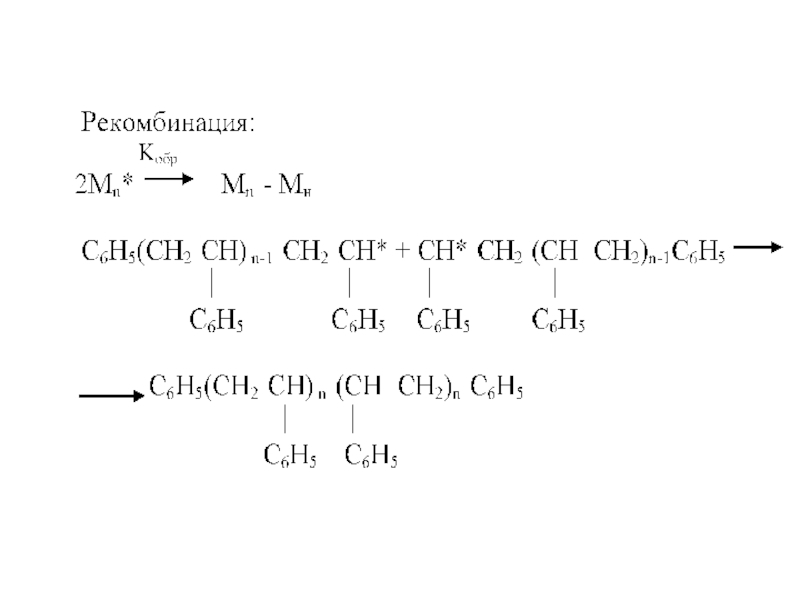
- 51. Обрыв цепи (рекомбинация)
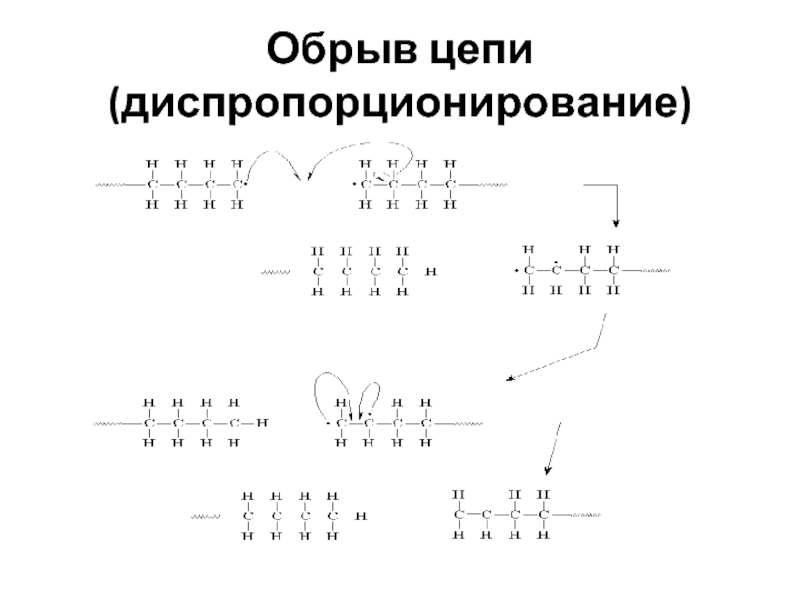
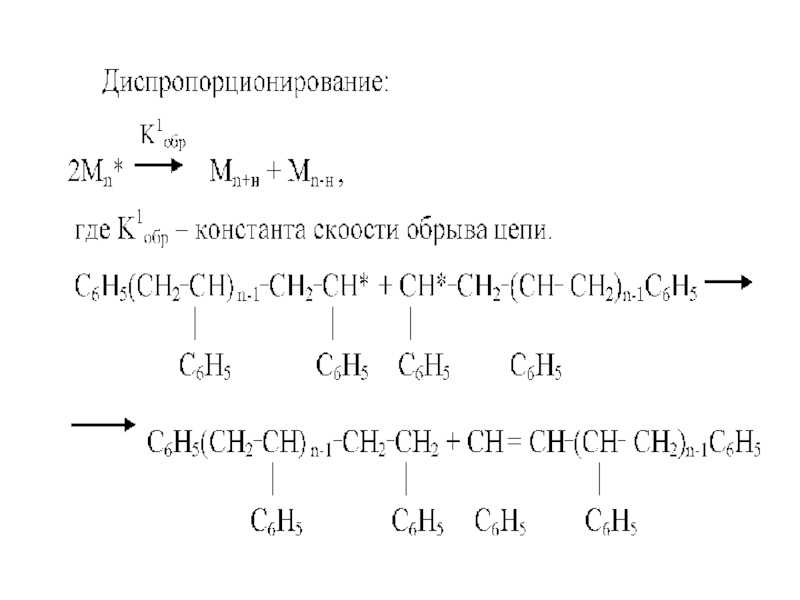
- 52. Обрыв цепи (диспропорционирование)
- 53. Скорость реакции обрыва зависит от концентрации радикалов в системе
- 54. Скорость процесса определяется диффузией Макрорадикалам нужно сблизиться
- 55. Гель-эффект
- 56. Гель-эффект При полимеризации винильных мономеров вязкость системы
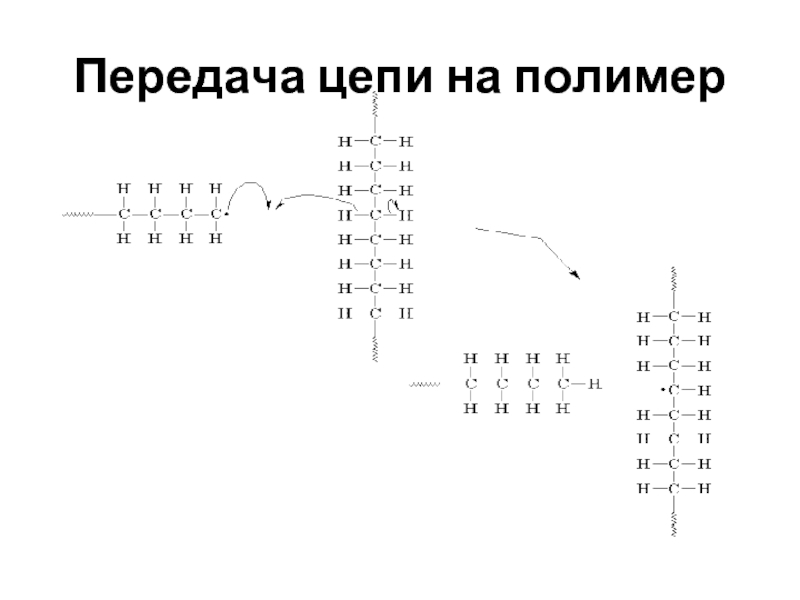
- 57. Передача цепи на полимер
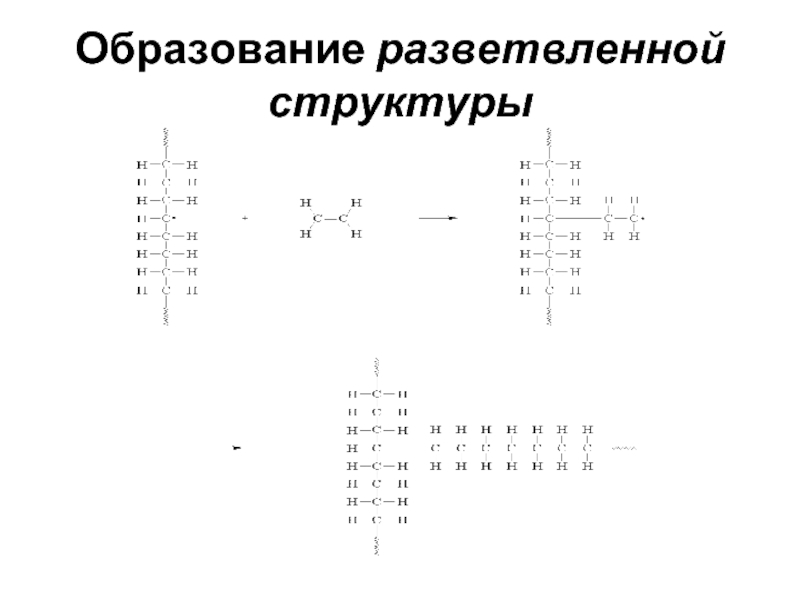
- 58. Образование разветвленной структуры
- 59. Передача цепи через молекулу мономера:
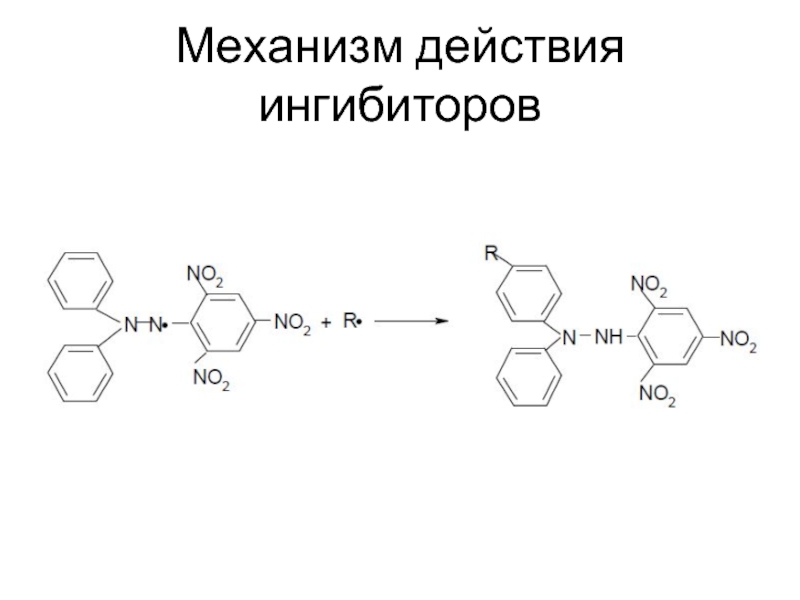
- 60. Ингибиторы – вещества, добавление которых к мономеру,
- 61. Механизм действия ингибиторов
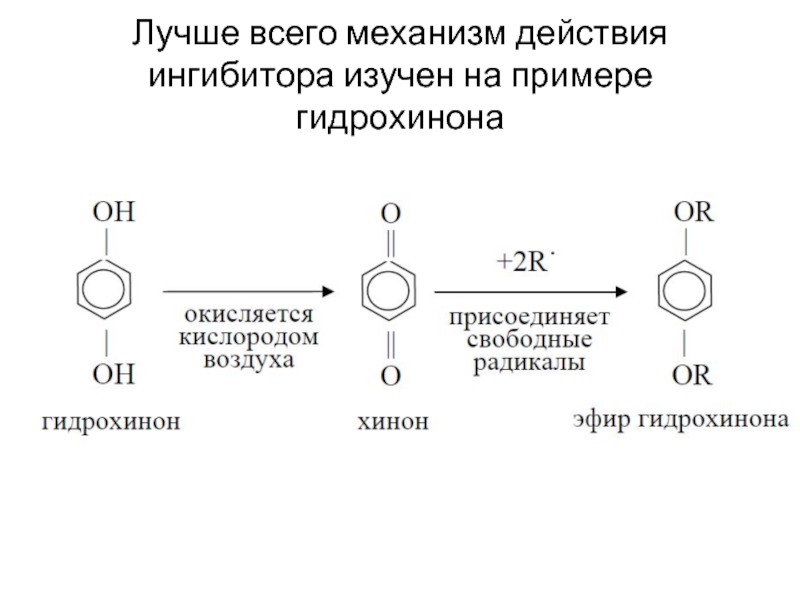
- 62. Лучше всего механизм действия ингибитора изучен на примере гидрохинона
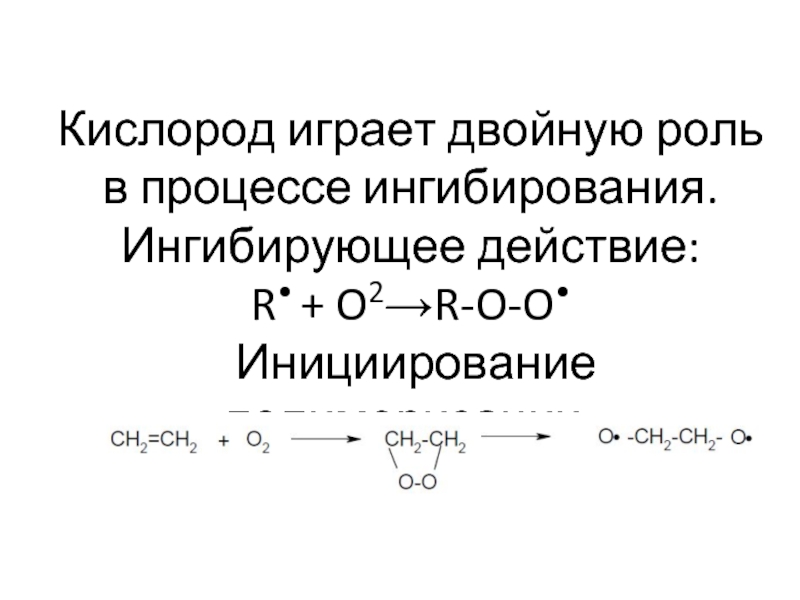
- 63. Кислород играет двойную роль в процессе ингибирования.
- 65. Доля радикалов инициатора, фактически участвующих в инициировании
- 66. Скорость инициирования
- 68. Скорость превращения мономера есть, практически, скорость роста.
- 69. При обрыве цепи в системе активные радикалы
- 72. Скорость обрыва цепи: Vобр= Кобр [ M* ]2 .
- 73. КИНЕТИКА РАДИКАЛЬНОЙ ПОЛИМЕРИЗАЦИИ Допущения: 1. Реакционная
- 74. Принцип стационарного состояния Боденштейна Скорость реакции в стационарном состоянии равна скорости роста цепи:
- 75. Длина кинетической цепи – среднее
- 76. Длина кинетической цепи обратно пропорциональна концентрации радикалов
- 77. Общая скорость полимеризации равна скорости расходования мономера
- 78. Vин = Vобр , т.е. 2Kин
- 79. Средняя степень полимеризации определяется соотношением скорости роста
- 80. Влияние основных факторов на полимеризацию винильных соединений
- 81. Чем больше концентрация инициатора, тем выше скорость
- 82. Способы проведения радикальной полимеризации в массе (или
Слайд 1Конфигурация макромолекулы
Локальная изомерия (изомерия положения) –
Возникает из-за возможности присоединения мономеров
Для оценки характера соединения составных звеньев в цепь иногда условно выделяют головную часть («голова») и хвостовую («хвост») часть.
Составное звено – CH2 – CHX -, то возможны варианты
– CH2 – CHX – CH2 – CHX – («голова» к «хвосту»);
– CH2 – CHX – CHX – CH2– («хвост» к «хвосту»);
– CHX – CH2 – CH2 – CHX – («голова» к «голове»);
– CHX – CH2 – CHX – CH2 – («хвост» к «голове»).
Слайд 3Оптическая изомерия (стереоизомерия)
Характерна для полимеров, имеющих (псевдо)асимметрические атомы углерода
Слайд 4 Конформация макромолекул Конформация – это форма, которую приобретают макромолекулы данного конфигурационного состава
Слайд 5
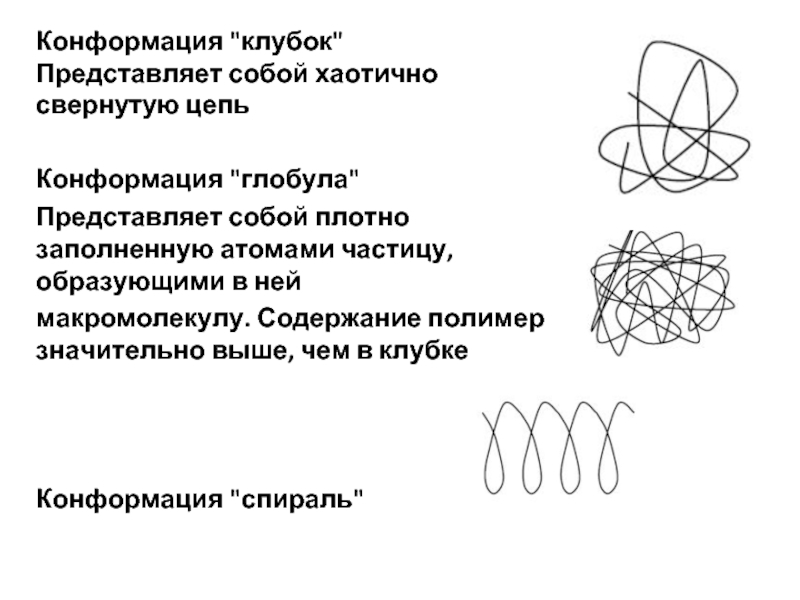
Конформация "клубок"
Представляет собой хаотично свернутую цепь
Конформация "глобула"
Представляет собой плотно заполненную атомами
макромолекулу. Содержание полимера значительно выше, чем в клубке
Конформация "спираль"
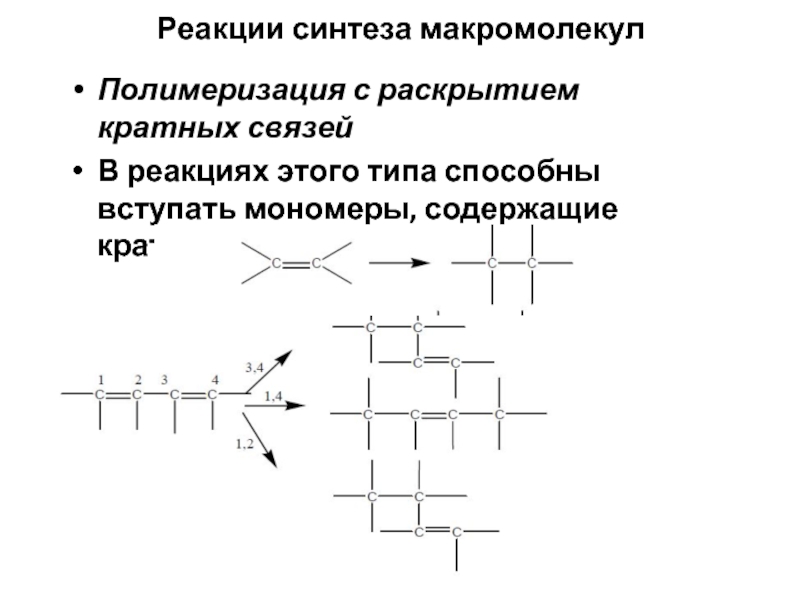
Слайд 6Реакции синтеза макромолекул
Полимеризация с раскрытием кратных связей
В реакциях этого типа способны
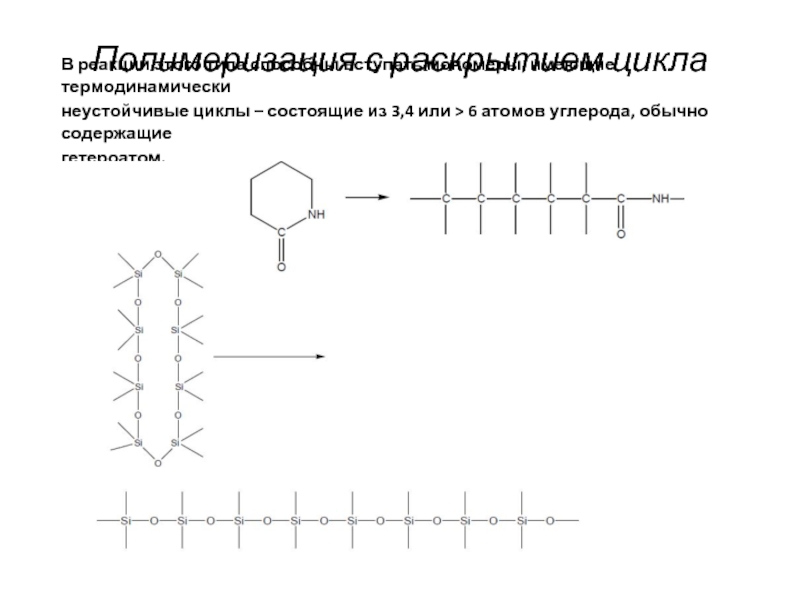
Слайд 7Полимеризация с раскрытием цикла
В реакции этого типа способны вступать мономеры, имеющие
неустойчивые циклы – состоящие из 3,4 или > 6 атомов углерода, обычно содержащие
гетероатом.
Слайд 8Поликонденсация и полиприсоединение
Поликонденсация – ступенчатый процесс взаимодействия молекул, содержащих функциональные группы,
Поликонденсация - это процесс синтеза высокомолекулярных соединений, в котором рост макромолекул происходит путем химического взаимодействия исходных молекул друг с другом, с реакционноспособными группами n-меров, накапливающихся в ходе реакции, а также молекул n-меров между собой.
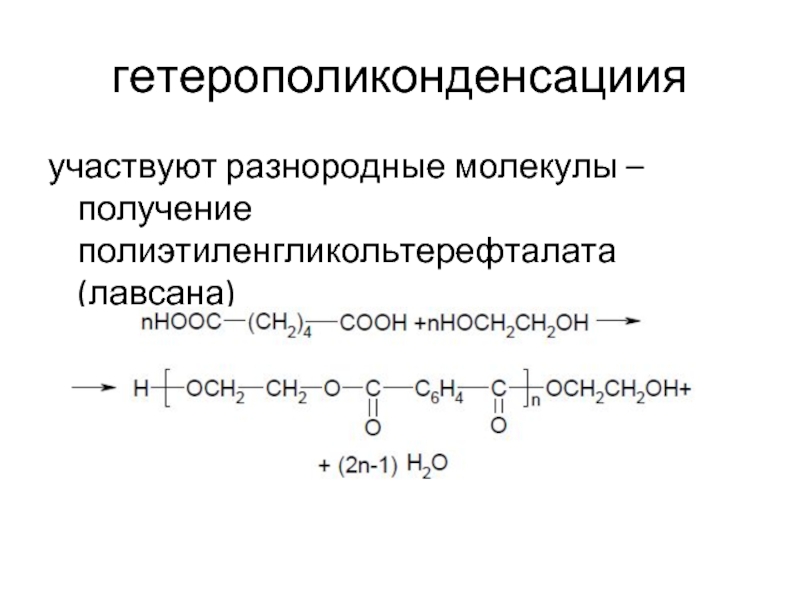
Слайд 9гетерополиконденсациия
участвуют разнородные молекулы – получение полиэтиленгликольтерефталата (лавсана)
Слайд 11Радикальная полимеризация
Радикальной полимеризацией называется цепная реакция, протекающая через образование свободных радикалов.
Слайд 12Как всякая цепная реакция, полимеризация состоит в основном из трех элементарных
1) образование активного центра;
2)рост цепи;
3) обрыв цепи.
Слайд 13Общая характеристика элементарных актов цепной полимеризации (ПМ) не отличается от тех
1. Реакция образования активных центров всегда требует затраты большого количества энергии и протекает медленно.
2. Рост цепи отличается малой энергией активации, и скорость этой реакции очень велика, тепловой эффект всегда положительный.
3. Реакция обрыва цепи также характеризуется небольшой энергией активации и протекает с достаточно высокой скоростью.
Слайд 14Мономеры, способные вступать в реакции радикальной полимеризации
В реакции радикальной полимеризации способны
Слайд 166) некоторые циклические структуры: обычно вступают в реакции как сомономеры, гомополимеризации обычно
- ангидрид малеиновой кислоты не способен к гомополимеризации, но легко сополимеризуется.
Слайд 20
СH2=CH–CH=CH2 полимеризуется;
СH2=C(Ph)–CH=CH2 полимеризуется в 10 раз быстрее дивинила;
(Ph)CH=CH–CH=CH2 полимеризуется
(Ph)CH=CH–CH=CH(Ph) не полимеризуется
Слайд 23с очень неустойчивыми циклами:
10) соединения ацетиленового ряда практически не участвуют в
Слайд 24Полимеризация
Полимеризацией называется реакция соединения мономерных молекул с раскрытием двойной (или
Слайд 25Процесс полимеризации является цепной реакцией, состоящей из трех элементарных актов:
Образования активного
Роста цепи
Обрыва цепи
В зависимости от характера активных центров, инициирующих цепной процесс, различают:
Радикальную полимеризацию
Ионную полимеризацию
Слайд 26Радикальная полимеризация
Активными центрами являются свободные радикалы.
В зависимости от способа образования свободных
Термическим (нагрев)
Фотохимическим (квант света)
Радиационным (под воздействием ускоренных электронов
Химическим (инициаторы) – в качестве инициаторов применяют пероксиды, гидропероксиды.
Слайд 27
Реакции могут осуществляться различными способами, но соблюдается следующая принципиальная схема процесса.
A1→A1*
А1*+А1→А2*
А2*+А1→А3* Рост цепи
Аn-1*+А1→Аn*
Аn*→А2 – Обрыв цепи,
где A1 – молекула мономера; А1* - активный центр; А2*, А3* … Аn-1*, Аn* - растущая цепь; Аn – молекула полимера
Слайд 361. Способность инициатора распадаться без образования радикалов.
2. Возможность протекания реакции передачи
3. Возможность протекания побочных реакций, в которых участвует радикал с образованием малоактивных радикалов или вообще неактивных веществ.
Эффективность инициаторов
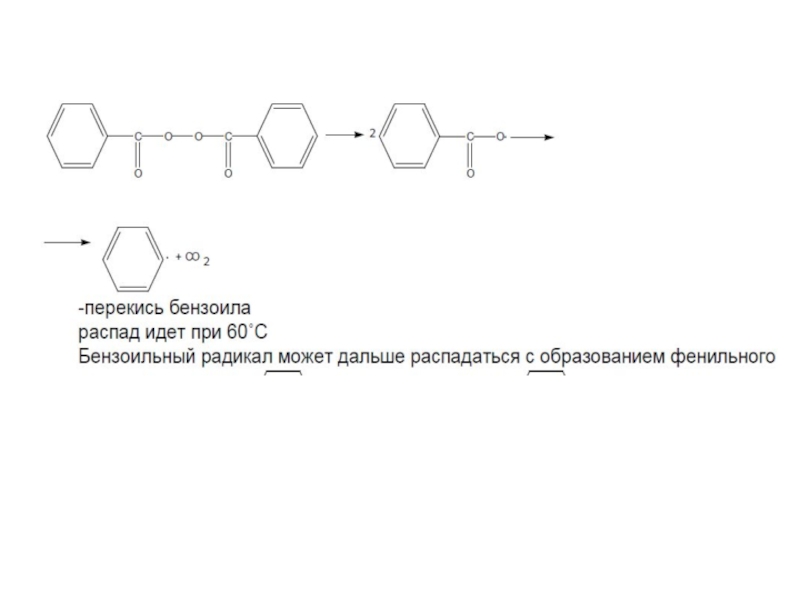
Слайд 37Эффективность инициаторов
Побочные реакции с участием радикалов перекиси бензоила
(а) [2С6Н5СО•] → [С6Н5СООС6Н5
(б) С6Н5• + 2С6Н5СОО• → С6Н5СООС6Н5;
(в) С6Н5• + С6Н5• → (С6Н5)2.
Слайд 38Эффективность инициирования
f= отношение числа радикалов, инициирующих полимеризацию к общему
Слайд 40Скорость инициирования представляет собой скорость распада с учетом эффективности инициирования:
где f
Скорость распада, в свою очередь, зависит от концентрации инициатора:
поэтому выражение для скорости инициирования принимает вид:
Слайд 41Влияние температуры на ход процесса
Константа скорости распада зависит от температуры по
Слайд 42
Обратным процессу распада является процесс рекомбинации образовавшихся в системе радикалов.
Рекомбинация может
Слайд 45Инициирование под действием различных излучений
Радиационная химия - может идти инициирование под
Фотохимия:
Инициирование осуществляется при облучении видимым или ультрафиолетовым светом:
Скорость инициирования в этом случае зависит от интенсивности падающего света:
Слайд 46Сенсибилизаторы
группа соединений, не имеющих связей, способных к разрыву, но, поглотив энергию,
Общая схема действия сенсибилизаторов:
Слайд 47РОСТ ЦЕПИ
Полимерная цепь растет в результате взаимодействия мономера с первоначально образовавшимся
А1*+А1→А2*
А2*+А1→А3* Рост цепи
Аn-1*+А1→Аn*
где A1 – молекула мономера; А1* - активный центр; А2*, А3* … Аn-1*, Аn* - растущая цепь
Слайд 49Обрыв цепи
Обрыв цепи при радикальной полимеризации может происходить различными путями: реакции
Слайд 50Обрыв цепи при радикальной полимеризации может происходить различными путями: реакции рекомбинации
Слайд 54Скорость процесса определяется диффузией
Макрорадикалам нужно сблизиться и развернуться в нужном направлении
Лимитирующей стадией является не поступательная диффузия клубка, а диффузия конца цепи. Таким образом, константа обрыва в разбавленных растворах полимера не зависит от длины цепи.
Слайд 56Гель-эффект
При полимеризации винильных мономеров вязкость системы изменяется на много порядков. Когда
Слайд 59 Передача цепи через молекулу мономера: через молекулу растворителя: через молекулу
Слайд 60Ингибиторы – вещества, добавление которых к мономеру, вызывает полное прекращение полимеризации.
Слайд 63Кислород играет двойную роль в процессе ингибирования. Ингибирующее действие: R• + O2→R-O-O•
Слайд 65Доля радикалов инициатора, фактически участвующих в инициировании и определяемых скоростью V/,
Так как Kин<< K/, то скорость инициирования определяется скоростью распада инициатора, и, следовательно,
Vин =2 Kин f [ I ].
Слайд 68Скорость превращения мономера есть, практически, скорость роста.
Vр= Кр [ M* ]
где [ M* ] – концентрация макрорадикалов;
[ M ] – концентрация мономера;
Кр – константа скорости роста цепи.
Слайд 69При обрыве цепи в системе активные радикалы исчезают или заменяются малоактивными
Слайд 73КИНЕТИКА РАДИКАЛЬНОЙ ПОЛИМЕРИЗАЦИИ
Допущения:
1. Реакционная способность радикалов, образующихся в процессе ПМ, не
2. Радикальная цепь участвует только в реакции с мономером, доля всех побочных процессов ничтожно мала;
3. Для вывода кинетических уравнений воспользуемся принципом стационарного состояния введенным Боденштейном.
Слайд 74Принцип стационарного состояния Боденштейна
Скорость реакции в стационарном состоянии равна скорости роста
Слайд 75Длина кинетической цепи –
среднее число молекул мономера, приходящихся на один
Слайд 76Длина кинетической цепи обратно пропорциональна концентрации радикалов или скорости полимеризации. Она
Слайд 77Общая скорость полимеризации равна скорости расходования мономера на стадии роста и
Vобщ= Vр Кр [ M* ] [ M ]. (1)
Слайд 78Vин = Vобр ,
т.е. 2Kин f [ I ] =
где [ M* ] = Vин.1/2 / Kоб.1/2 .
Подставив [ M* ] в уравнение (1):
Vр = ( Кр / Kобр1/2 ) Vин1/2 [M] =
= ( Кр / Kобр1/2 ) ( 2Kин f ) 1/2 [ I ] 1/2 [M],
обозначив ( Кр / Kобр1/2 ) ( 2Kин f ) 1/2 = K, запишем
Vр = K [ I ] 1/2 [M] __
общее кинетическое уравнение радикальной полимеризации
Слайд 79Средняя степень полимеризации определяется соотношением скорости роста и суммарной скорости обрыва
[ M*] = Vин1/2 / Kобр1/2 , получим:
Кр Kобр1/2 [ M ]
P = Кр Kобр1/2 [ M ] / Vин1/2 = ___________________
( 2Kин f ) 1/2 [ I ] 1/2
Объединив все константы величиной К1 , находим:
P = К1[ M ] / [ I ] 1/2
Слайд 80Влияние основных факторов на полимеризацию винильных соединений
С повышением температуры скорость полимеризации
Wp=Kp[M][R∙]
Wp=Kобр[R∙]2
Давление, как правило, увеличивает скорость и степень полимеризации.
Слайд 81Чем больше концентрация инициатора, тем выше скорость полимеризации, но ниже молекулярная
Слайд 82Способы проведения радикальной полимеризации
в массе (или блоке),
в растворе,
в суспензии,
в эмульсии















![Эффективность инициаторовПобочные реакции с участием радикалов перекиси бензоила(а) [2С6Н5СО•] → [С6Н5СООС6Н5 + СО2];(б) С6Н5• +](/img/tmb/1/80966/f9ca736f360091ca124e68162497f18d-800x.jpg)




















![Скорость превращения мономера есть, практически, скорость роста.Vр= Кр [ M* ] [ M ],где [](/img/tmb/1/80966/9ee5cfb8bcf52245c3c425e94e7c289c-800x.jpg)

![Скорость обрыва цепи: Vобр= Кобр [ M* ]2 .](/img/tmb/1/80966/2dbdf0b3dc8790e44afb16bbbe1ff084-800x.jpg)





![Vин = Vобр , т.е. 2Kин f [ I ] = Kобр [ M*]2, где](/img/tmb/1/80966/3e19bc841a13cf292d0cb76e8693f9fc-800x.jpg)









