- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Элементарные процессы роста кристаллов (лекция 2) презентация
Содержание
- 1. Элементарные процессы роста кристаллов (лекция 2)
- 2. Энергетические условия кристаллизации ΔТ = Т0 –
- 3. Энергетические условия кристаллизации ΔG = ΔH - TΔS ΔG= - ΔH·ΔT/T0
- 4. Энергетические условия кристаллизации Gж=Gкр → Tпл
- 5. Энергетические условия кристаллизации ΔT=T-T0 - переохлаждение ΔP=P-P0 – пересыщение Δс=с-с0 - пересыщение
- 6. Энергетические условия кристаллизации Фазовая диаграмма кристалл-пар(кристалл-раствор) P – T(C-T) диаграмма
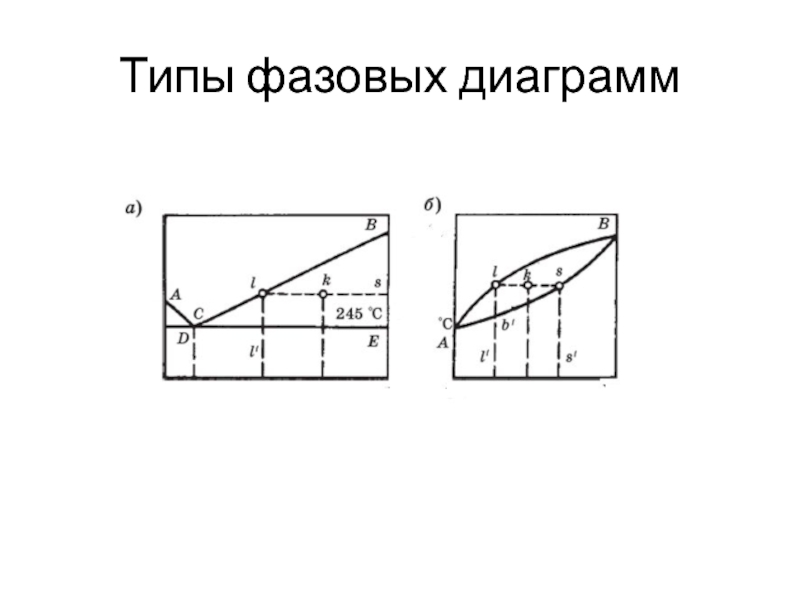
- 7. Энергетические условия кристаллизации Фаза – однородная часть,
- 8. Эвтектика греч. éutektos — легкоплавящийся)
- 9. Типы фазовых диаграмм
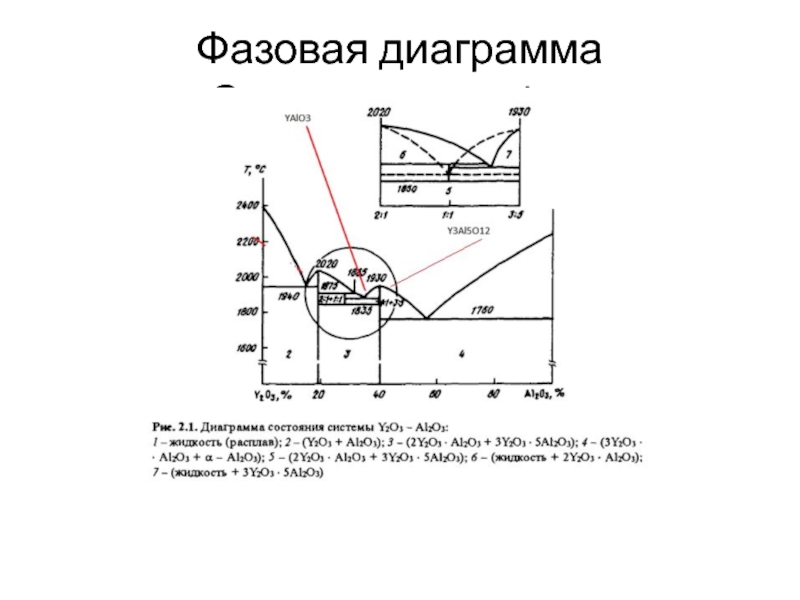
- 10. Фазовая диаграмма Системы Y2O3-Al2O3
- 11. Кинетика кристаллизации Гиббс – теория зарождения центров
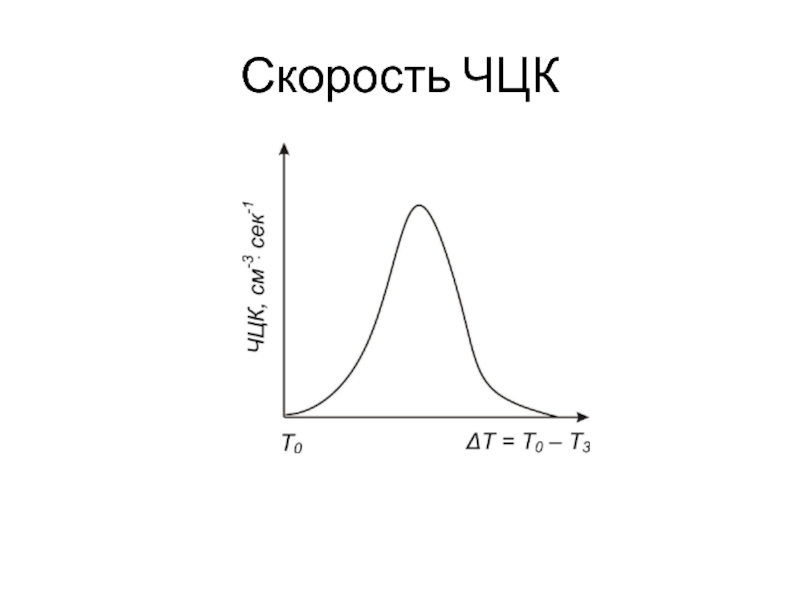
- 12. Скорость ЧЦК
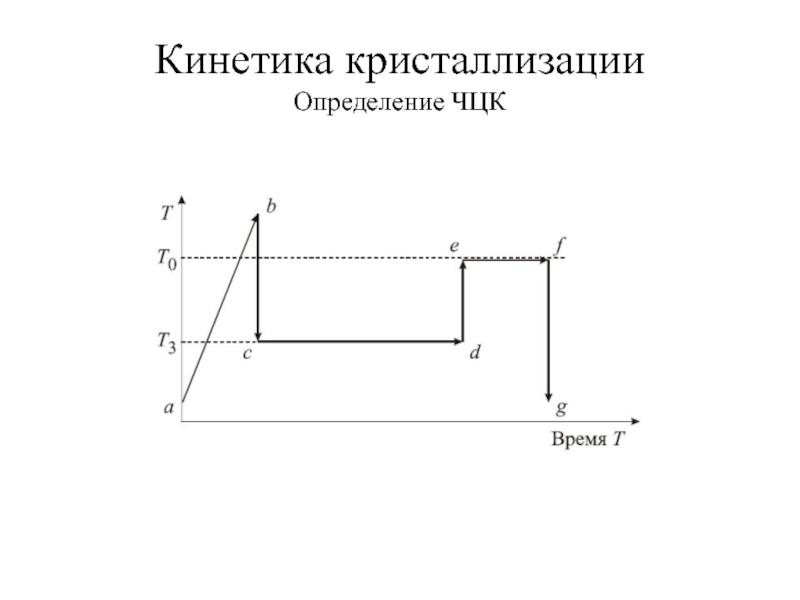
- 13. Кинетика кристаллизации Определение ЧЦК
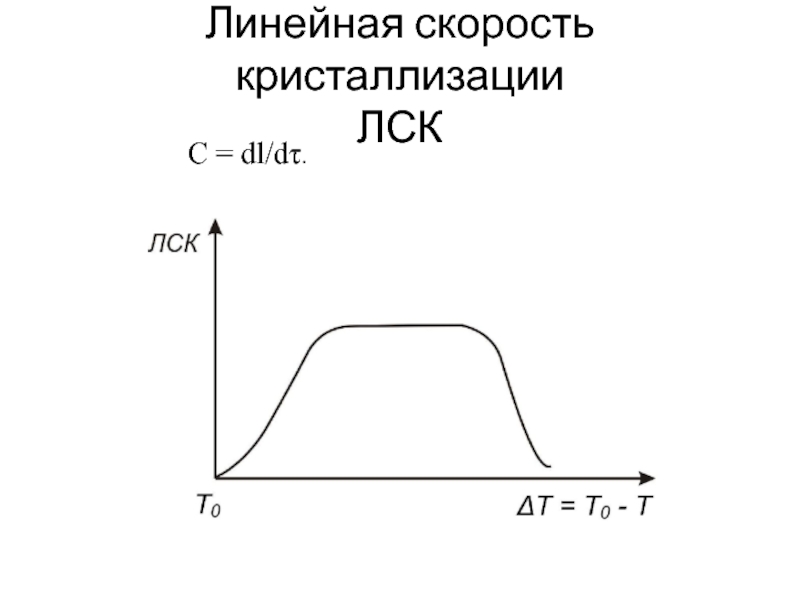
- 14. Линейная скорость кристаллизации ЛСК С = dl/dτ.
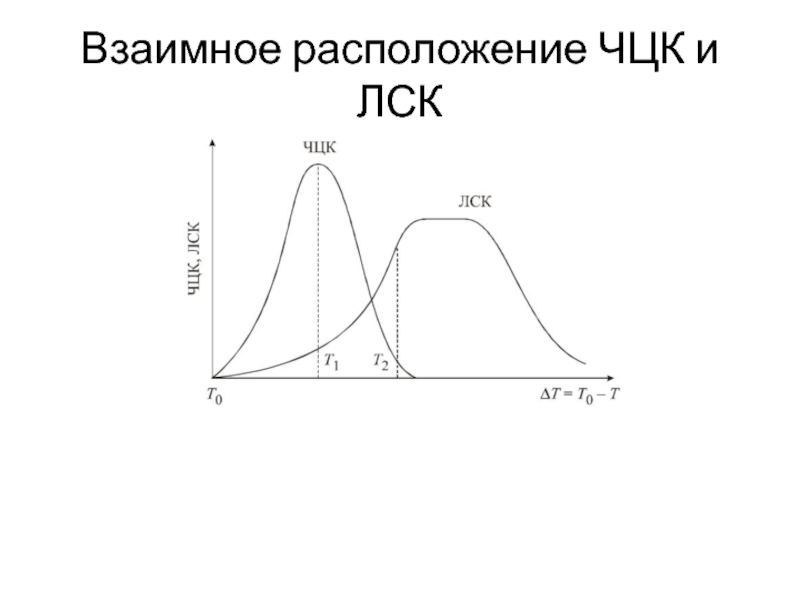
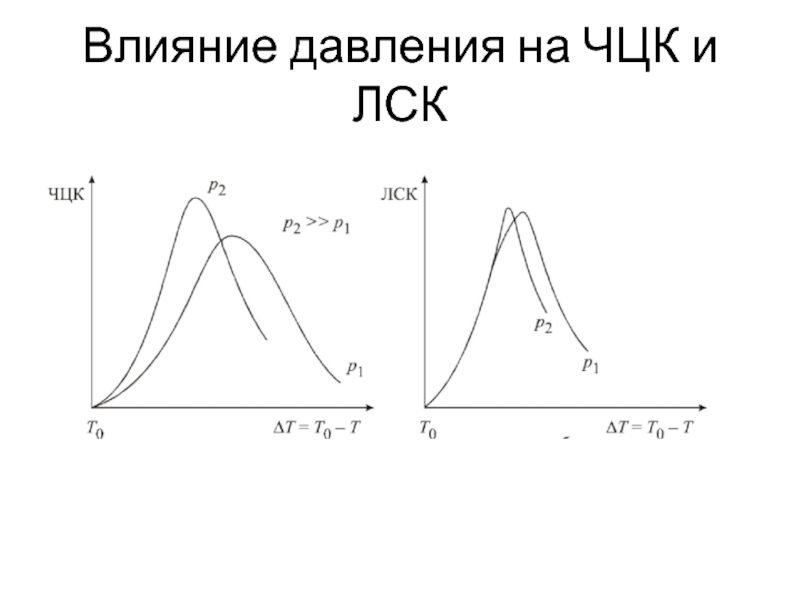
- 15. Взаимное расположение ЧЦК и ЛСК
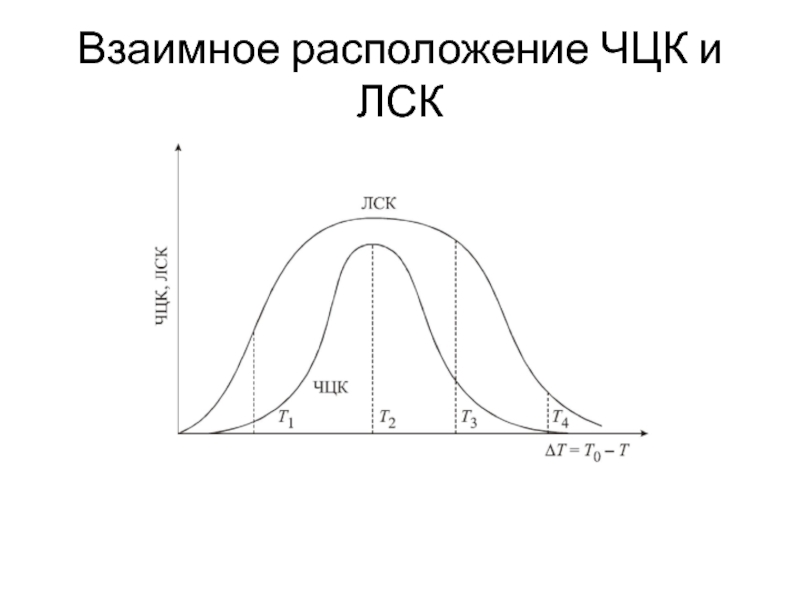
- 16. Взаимное расположение ЧЦК и ЛСК
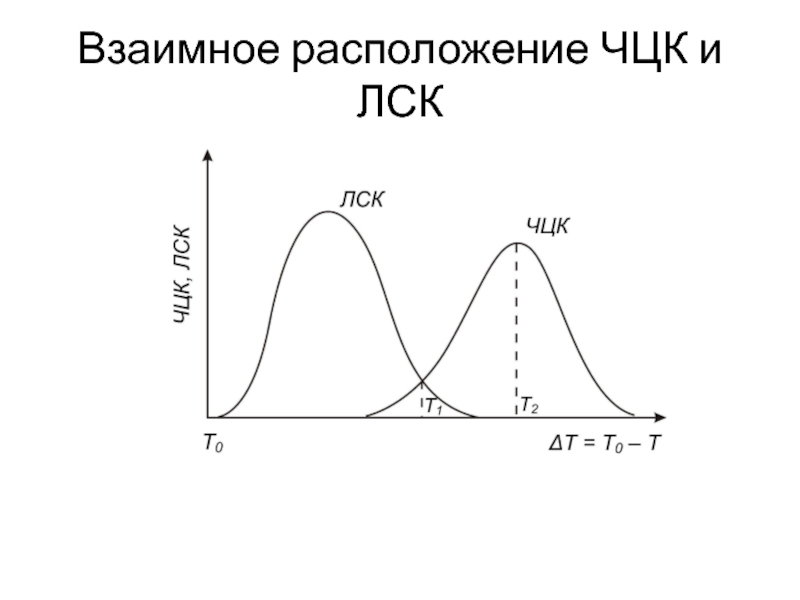
- 17. Взаимное расположение ЧЦК и ЛСК
- 18. Влияние давления на ЧЦК и ЛСК
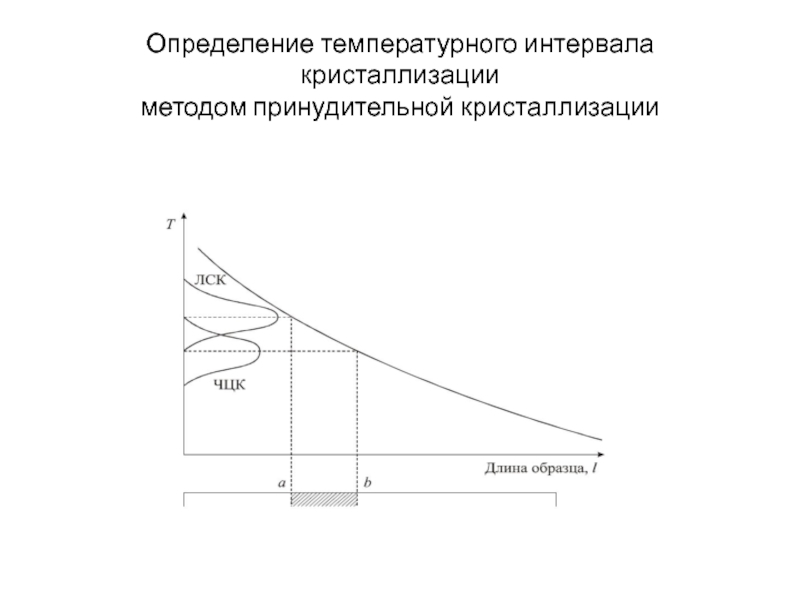
- 19. Определение температурного интервала кристаллизации методом принудительной кристаллизации
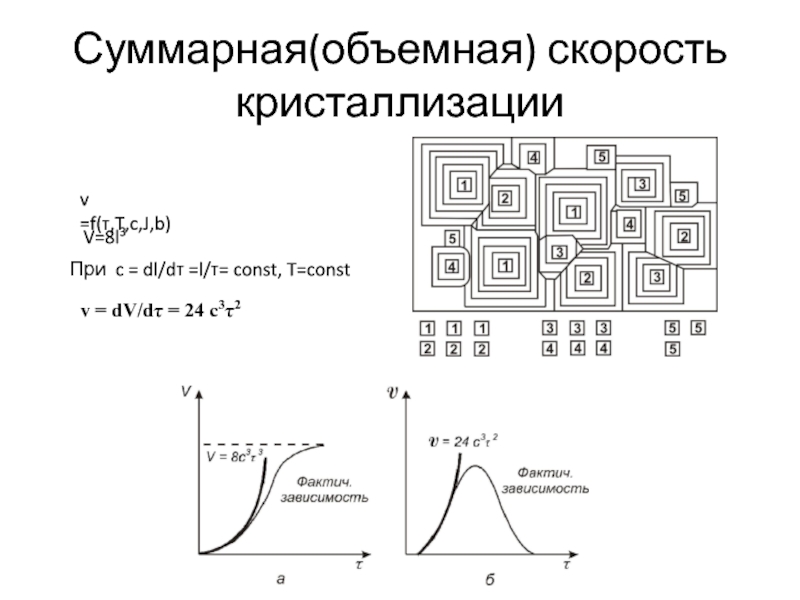
- 20. Суммарная(объемная) скорость кристаллизации v =f(τ,T,c,J,b) V=8l3
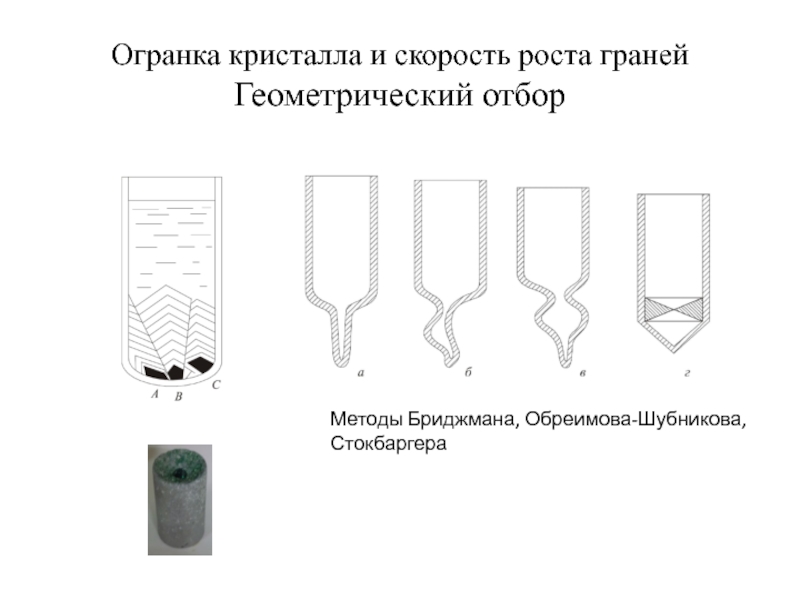
- 21. Огранка кристалла и скорость роста граней
- 22. Огранка кристалла и скорость роста граней Геометрический отбор Методы Бриджмана, Обреимова-Шубникова, Стокбаргера
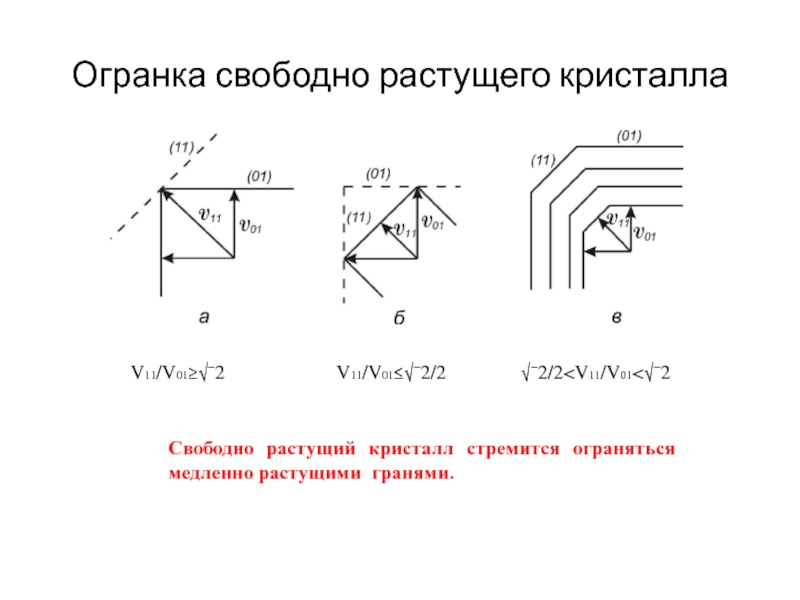
- 23. Огранка свободно растущего кристалла V11/V01≥√¯2 V11/V01≤√¯2/2 √¯2/2
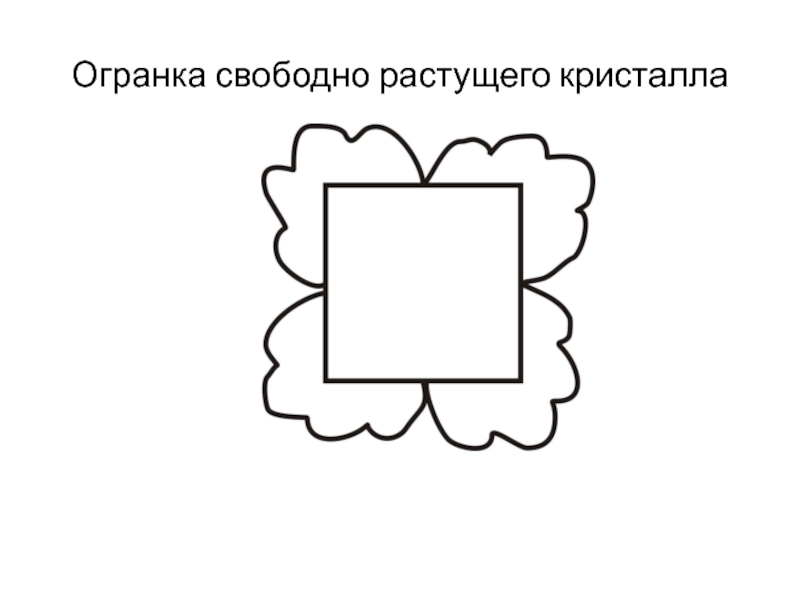
- 24. Огранка свободно растущего кристалла
- 25. Огранка свободно растущего кристалла
- 26. Огранка кристаллов Реальный кристалл сложен пирамидами роста.
- 27. Огранка кристаллов Грани реальные физически возможные
- 28. Огранка кристаллов Объемноцентрированая решетка. Максимальная ретикулярная плотность для грани [110]
- 29. Огранка кристаллов Гранецентрированная решетка . Максимальная ретикулярная плотность для грани [110]
- 30. Огранка кристаллов Форм роста много Равновесная
- 31. Огранка кристаллов Принцип Гиббса-Вульфа- Кюри Принцип Гиббса-Вульфа-Кюри.
- 32. Теорема Вульфа σi/hi = const В равновесном
- 33. Метод Шубникова определения равновесной формы кристалла С
- 34. Элементарные процессы роста кристаллов Грань не являющаяся
- 35. Рост шероховатых граней
- 36. Элементарные процессы роста кристаллов F- гладкие грани
- 37. Рост атомарно гладких граней Концепция образовании двумерных
- 38. Дислокационный механизм роста гладких граней Винтовые дислокации
- 39. Дислокационный механизм роста гладких граней
- 40. Установка «Гранат-2», компоненты теплового узла и
- 41. Монокристалл алюмо-иттриевого граната, легированного ванадием
- 42. Срезы були алюмоиттриевого граната с ванадием
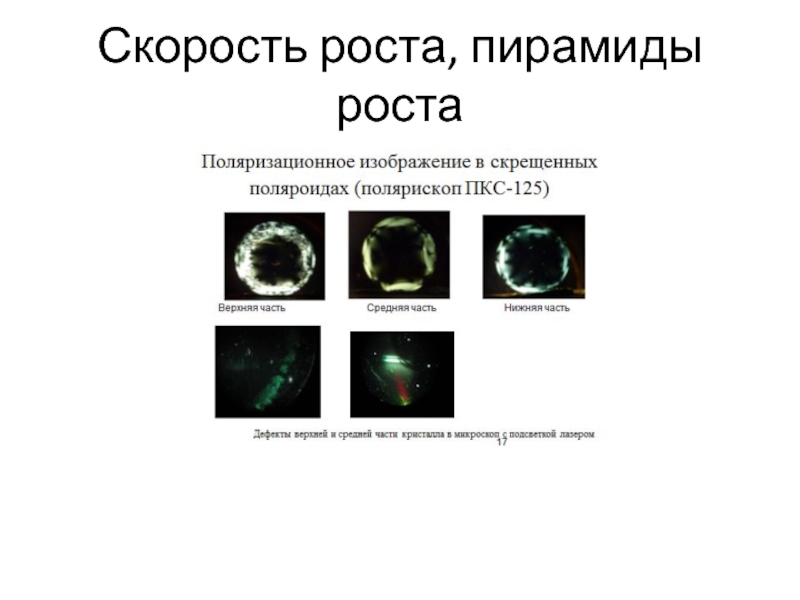
- 43. Скорость роста, пирамиды роста
- 44. Свойства кристаллов соединений Al2O3-Y2O3
- 45. Энергетические условия кристаллизации
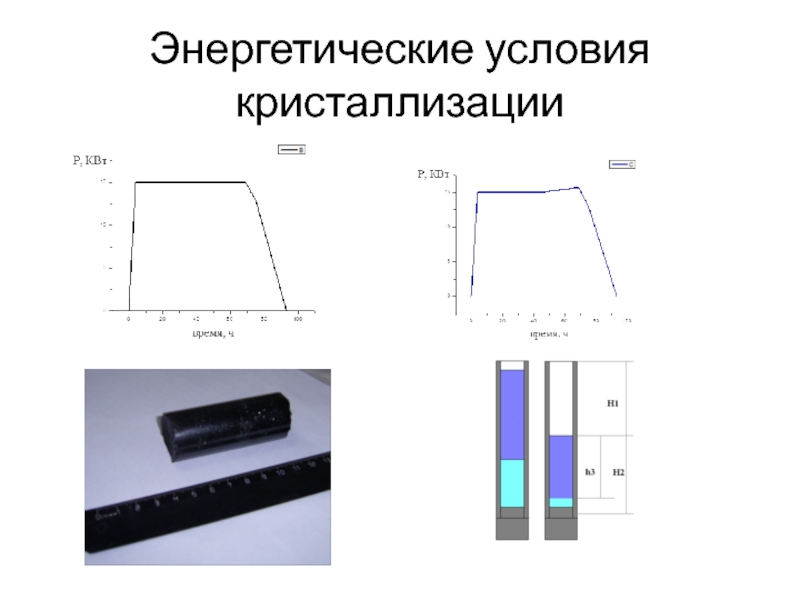
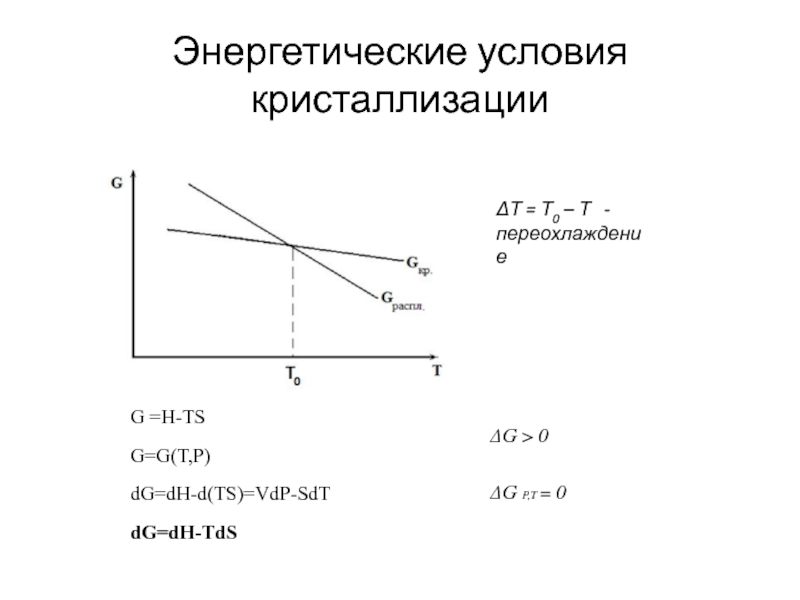
Слайд 2Энергетические условия кристаллизации
ΔТ = Т0 – Т - переохлаждение
G
G=G(T,P)
dG=dH-d(TS)=VdP-SdT
dG=dH-TdS
ΔG > 0
ΔG P,T = 0
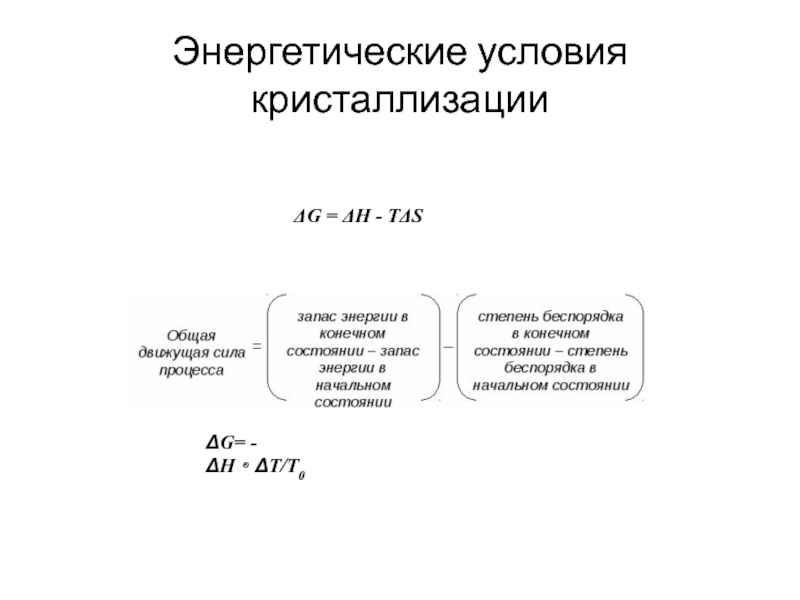
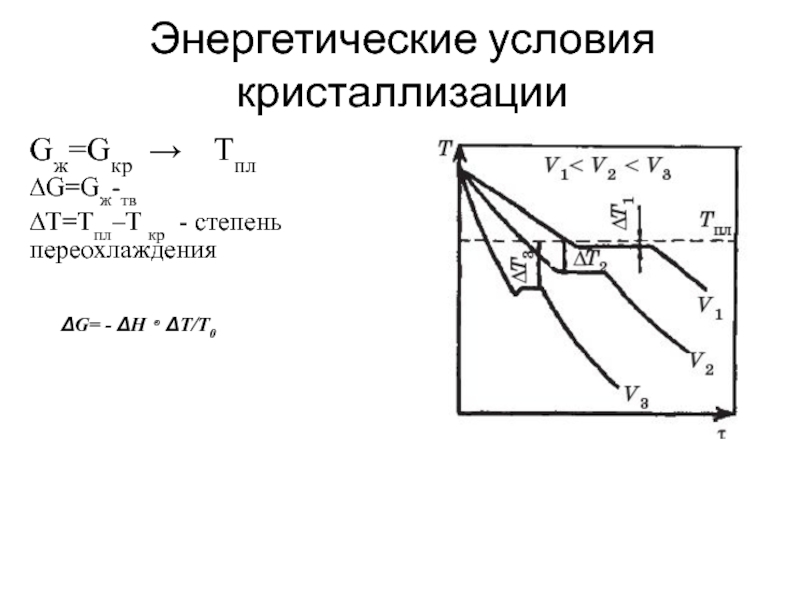
Слайд 4Энергетические условия кристаллизации
Gж=Gкр → Tпл
∆G=Gж-тв
∆T=Tпл–T кр - степень переохлаждения
ΔG=
Слайд 5Энергетические условия кристаллизации
ΔT=T-T0 - переохлаждение
ΔP=P-P0 – пересыщение
Δс=с-с0 - пересыщение
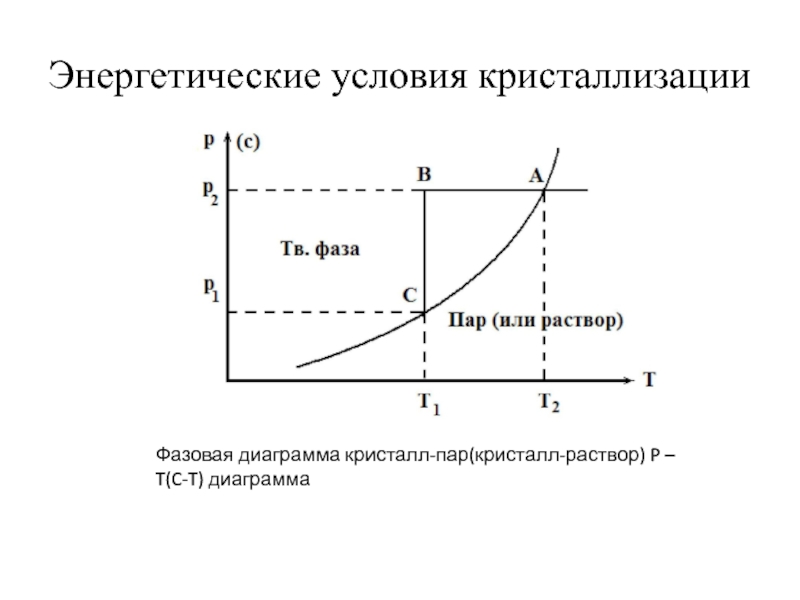
Слайд 6Энергетические условия кристаллизации
Фазовая диаграмма кристалл-пар(кристалл-раствор) P – T(C-T) диаграмма
Слайд 7Энергетические условия кристаллизации
Фаза – однородная часть, характеризующаяся определенным составом, кристаллической
Термодинамическая степень свободы - число переменных - С (T, P, концентрация компонентов)
Правило фаз Гиббса :
с=n+p-f
P=1 (T)
Для двойных систем f=3 – максимально возможное кол. Фаз.
Слайд 8
Эвтектика греч. éutektos — легкоплавящийся) — нонвариантная (при постоянном давлении) точка
Эвтектическая точка
Слайд 11Кинетика кристаллизации
Гиббс – теория зарождения центров кристаллизации.
Переход из неравновесного(метастабильного) состояния
Метастабильное состояние – появление зародышей.
Создание поверхности раздела фаз. Требует затрат свободной энергии до достижении зародышей определенного размера.
Скорость зарождения центров кристаллизации (ЧЦК)
2. Линейная скорость кристаллизации (ЛСК)
3. Объемная скорость кристаллизации
J=C·exp (-ΔGc/RT)
Слайд 20Суммарная(объемная) скорость кристаллизации
v =f(τ,T,c,J,b)
V=8l3
При c = dl/dτ =l/τ= const, T=const
v
Слайд 21Огранка кристалла и скорость роста граней
Vc>Vb>Va
Vc : Va = 3
Анизотропия скорости
Слайд 22Огранка кристалла и скорость роста граней Геометрический отбор
Методы Бриджмана, Обреимова-Шубникова,
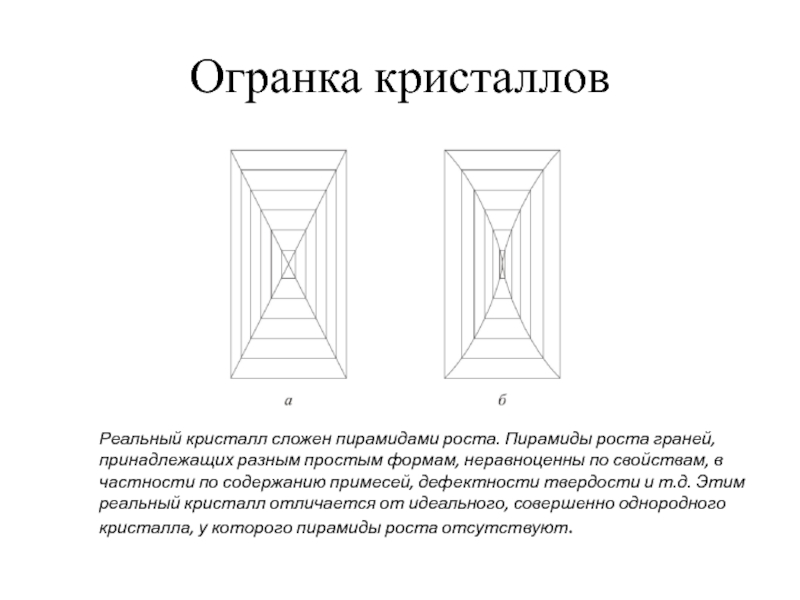
Слайд 26Огранка кристаллов
Реальный кристалл сложен пирамидами роста. Пирамиды роста граней,
принадлежащих разным простым
частности по содержанию примесей, дефектности твердости и т.д. Этим
реальный кристалл отличается от идеального, совершенно однородного
кристалла, у которого пирамиды роста отсутствуют.
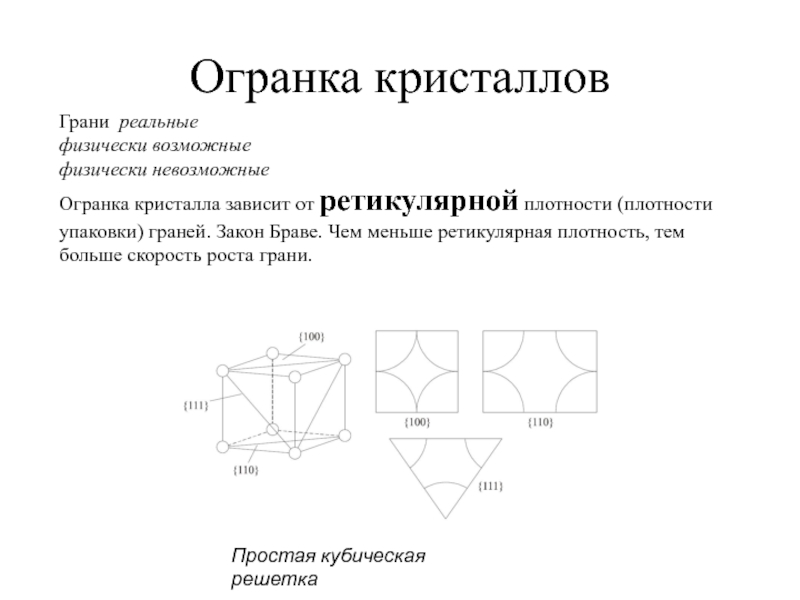
Слайд 27Огранка кристаллов
Грани реальные
физически возможные
физически невозможные
Огранка кристалла зависит от
Простая кубическая решетка
Слайд 28Огранка кристаллов
Объемноцентрированая решетка.
Максимальная ретикулярная плотность для грани [110]
Слайд 29Огранка кристаллов
Гранецентрированная решетка . Максимальная ретикулярная плотность для грани [110]
Слайд 30Огранка кристаллов
Форм роста много
Равновесная форма кристалла одна . Образована плотноупакованным
Пример. Алмаз.Равновесная форма - октаэдр
Формы роста - I) октаэдр, 2) ромбододекаэдр,
3) куб, 4) комбинации (октаэдра, куба, додекаэдра)
Слайд 31Огранка кристаллов
Принцип Гиббса-Вульфа- Кюри
Принцип Гиббса-Вульфа-Кюри. Равновесная форма кристалла соответствует минимуму свободной
ΣσiSi=min (V=const)
Для реальных кристаллов объемная энергия не является постоянной и зависит от дефектности кристалла
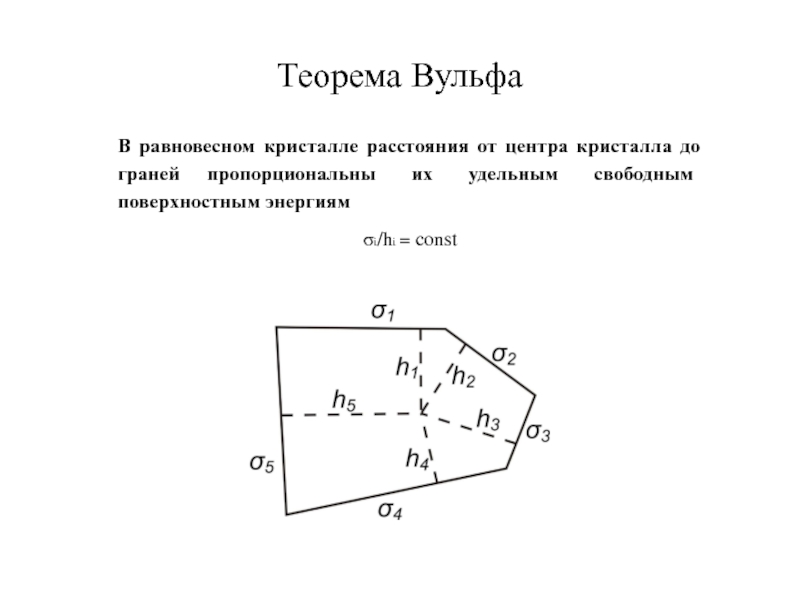
Слайд 32Теорема Вульфа
σi/hi = const
В равновесном кристалле расстояния от центра кристалла до
Слайд 33Метод Шубникова определения равновесной формы кристалла
С медленно растущих граней, принадлежащих равновесной,
Равновесная форма кристалла не изменяется при колебаниях температуры
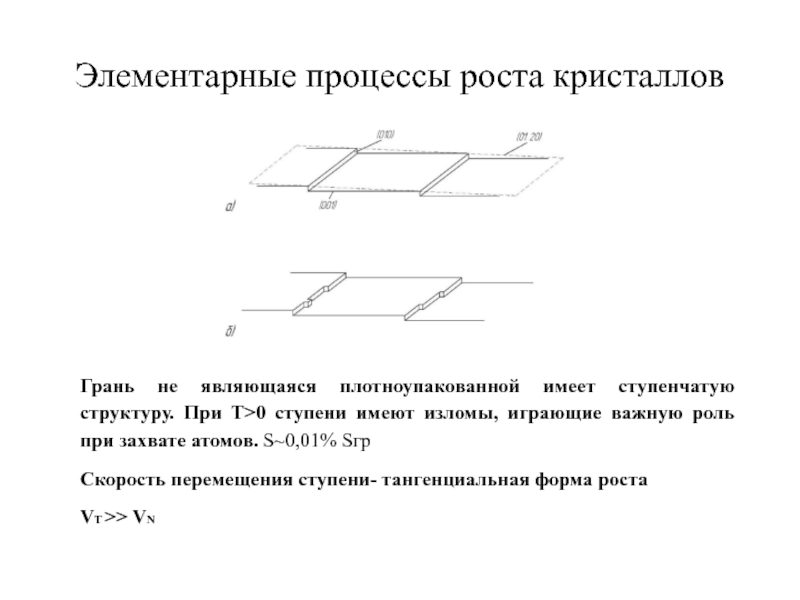
Слайд 34Элементарные процессы роста кристаллов
Грань не являющаяся плотноупакованной имеет ступенчатую структуру. При
Скорость перемещения ступени- тангенциальная форма роста
VT >> VN
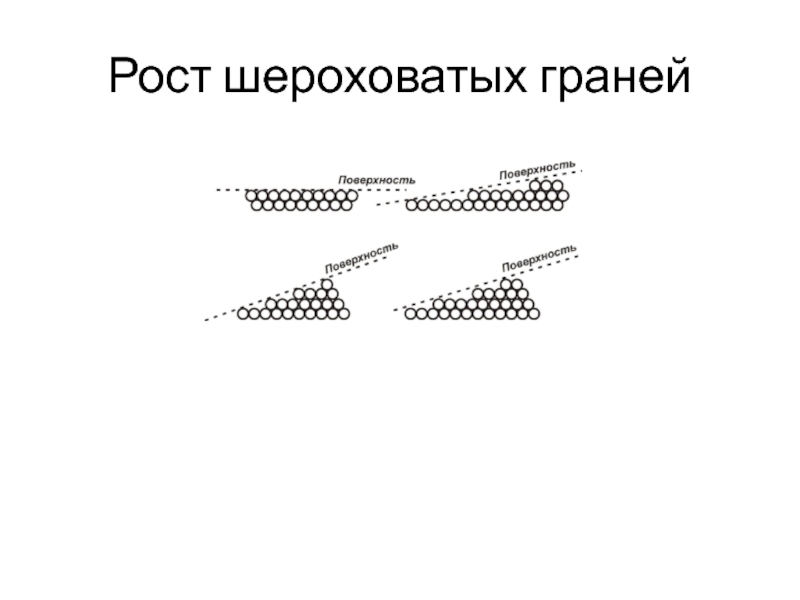
Слайд 36Элементарные процессы роста кристаллов
F- гладкие грани
K,S – шероховатые грани
Скорость роста для
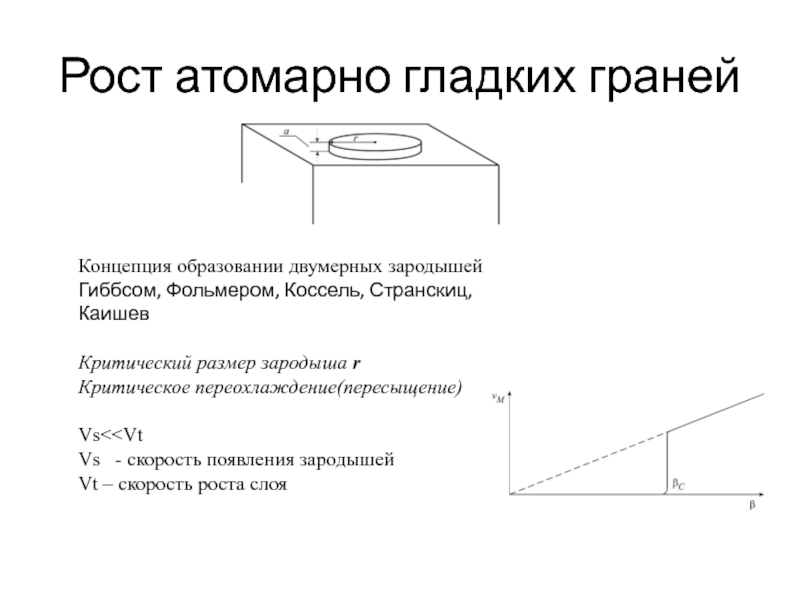
Слайд 37Рост атомарно гладких граней
Концепция образовании двумерных зародышей
Гиббсом, Фольмером, Коссель, Странскиц, Каишев
Критический
Критическое переохлаждение(пересыщение) βc
Vs<
Vt – скорость роста слоя
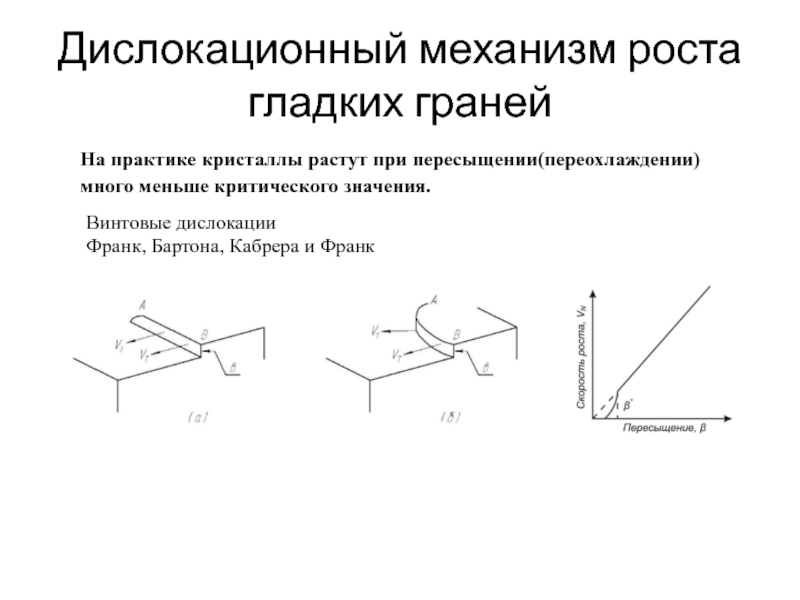
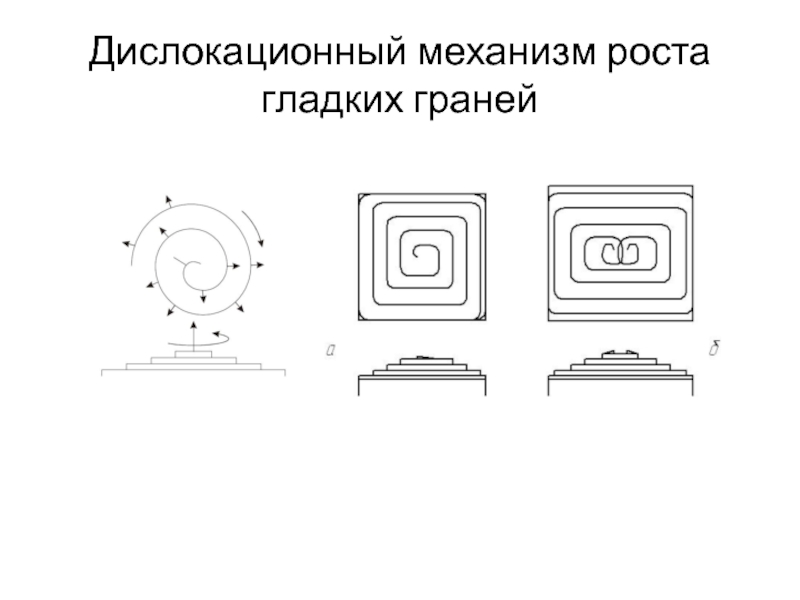
Слайд 38Дислокационный механизм роста гладких граней
Винтовые дислокации
Франк, Бартона, Кабрера и Франк
На
Слайд 40Установка «Гранат-2», компоненты теплового узла и
Компоненты теплового узла: 1 —
Установка «Гранат-2»: 1 — кристаллизационная
камера, 2 — механизм перемещения контейнера
с веществом, 3 — блок управления
Молибденовые трубки
для отжига и роста
Коническая
затравка







![Огранка кристалловОбъемноцентрированая решетка. Максимальная ретикулярная плотность для грани [110]](/img/tmb/5/492861/be1314d8fcf6aa14637dfb2e9137a762-800x.jpg)
![Огранка кристалловГранецентрированная решетка . Максимальная ретикулярная плотность для грани [110]](/img/tmb/5/492861/d0ba2bb48c82737cddec866dfd340e80-800x.jpg)