- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Основные классы неорганических соединений презентация
Содержание
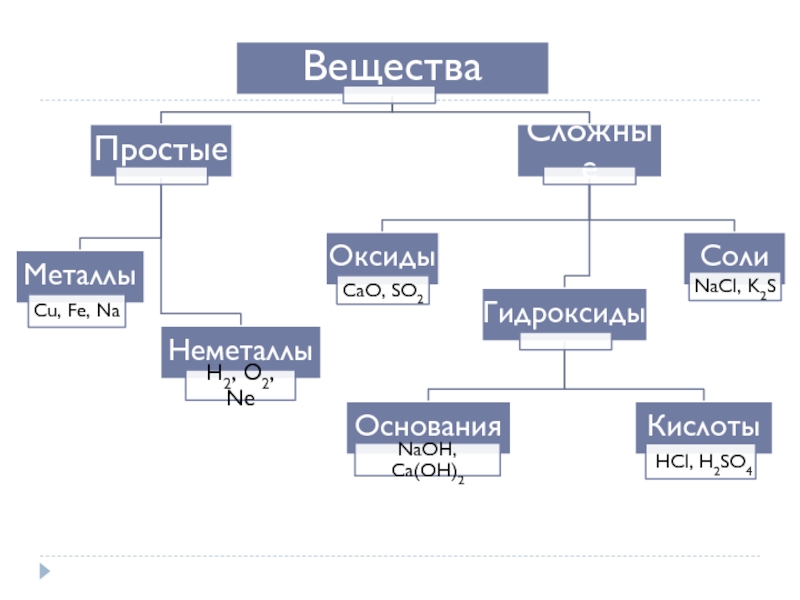
- 1. Основные классы неорганических соединений
- 3. Простые вещества Металлы І группа главная подгруппа
- 4. Металлы. Неметаллы
- 5. Физические свойства простых веществ
- 6. Оксиды Оксиды- это сложные вещества, состоящие из
- 7. Оксиды 1) Несолеобразующие - CO, SiO, N2O,
- 8. Гидриды Гидриды - соединения водорода с металлами
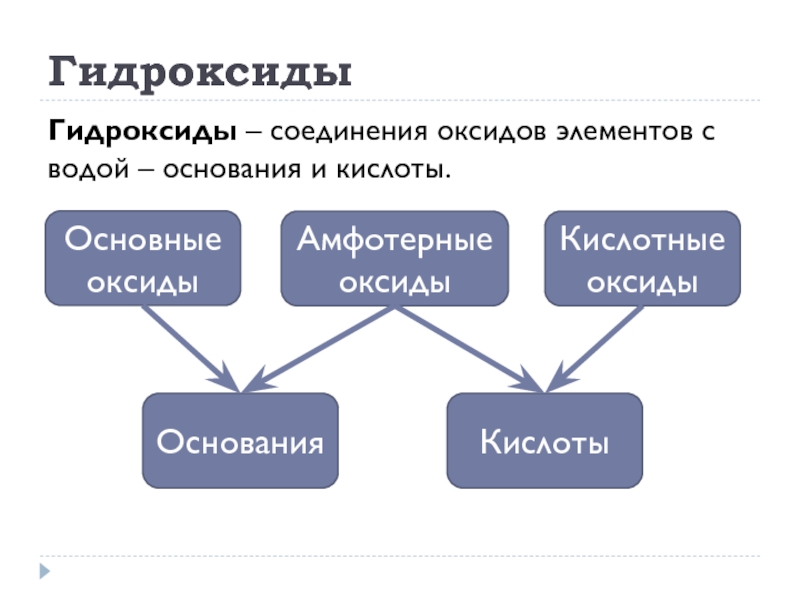
- 9. Гидроксиды Гидроксиды – соединения оксидов элементов с водой – основания и кислоты.
- 10. Основания Основания – сложные вещества, в состав
- 11. Основания По числу гидроксогрупп OH: Однокислотные –
- 12. Методика образования основания из оксида Записать формулу
- 13. Кислоты Кислоты – сложные вещества, молекулы которых
- 14. Кислоты По основности: Одноосновные – HF, HCl
- 15. Название бескислородных кислот HF - фтороводородная (плавиковая)
- 16. Название кислородсодержащих кислот HNO3 - азотная кислота
- 17. Название кислородсодержащих кислот HClO4 - хлорная кислота
- 18. Название кислородсодержащих кислот HBO2 - метаборная кислота
- 19. Методика образования кислоты из оксида Записать формулу
- 20. Названия кислотных остатков Если элемент проявляет более
- 21. Соли 1) Как продукты замены протонов в
- 22. Средние соли Средние соли – сложные соединения,
- 23. Основные соли Основные соли – продукты неполного
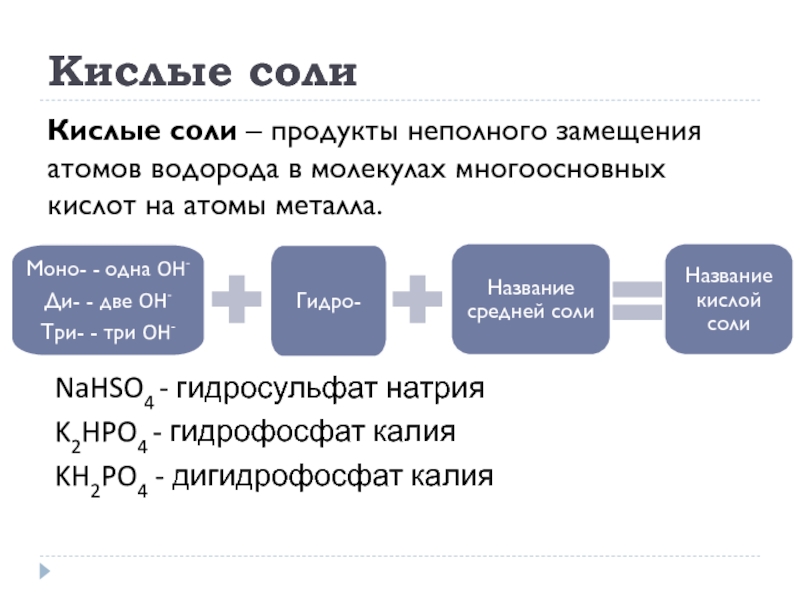
- 24. Кислые соли Кислые соли – продукты неполного
- 25. По числу присутствующих в структуре катионов и
- 26. Комплексные соединения Комплексные соединения – соединения, в
- 28. Номенклатура комплексных соединений Если комплексный – анион:
- 29. Номенклатура комплексных соединений Если комплексный – катион:
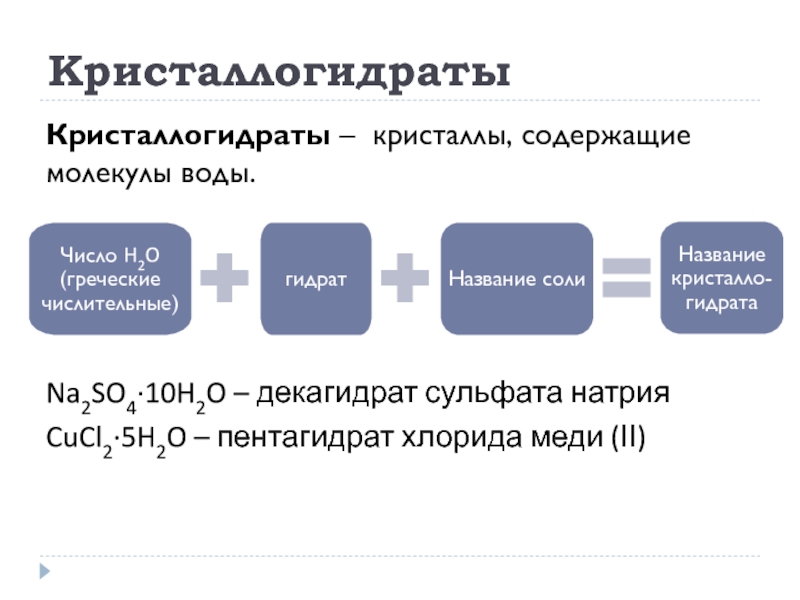
- 30. Кристаллогидраты Кристаллогидраты – кристаллы, содержащие молекулы воды.
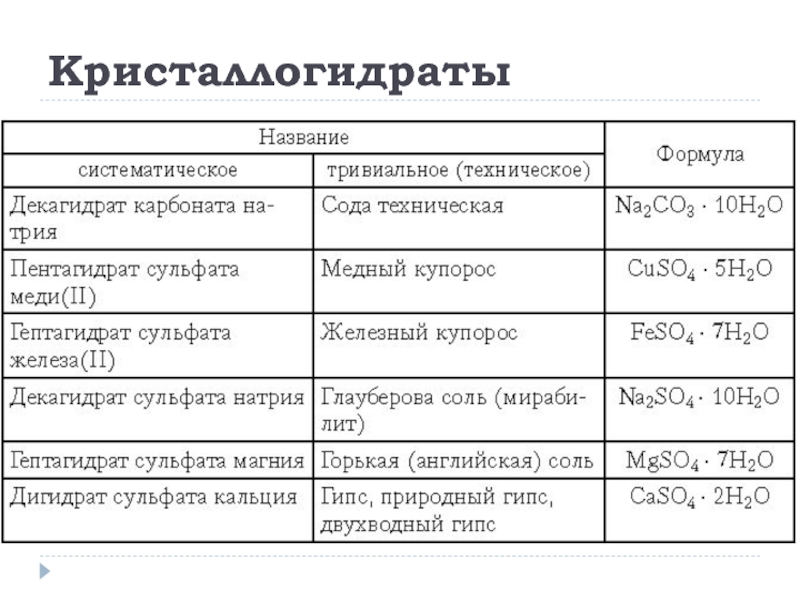
- 31. Кристаллогидраты
Слайд 3Простые вещества
Металлы
І группа главная подгруппа – щелочные металлы
ІІ группа главная подгруппа
Ag, Au, Ru, Rh, Pd, Os, Ir, Pt (иногда Re) – благородные металлы
Неметаллы
V группа главная подгруппа – пниктогены
VІ группа главная подгруппа – халькогены
VІІ группа главная подгруппа – галогены
VІІІ группа главная подгруппа – благородные (инертные) газы
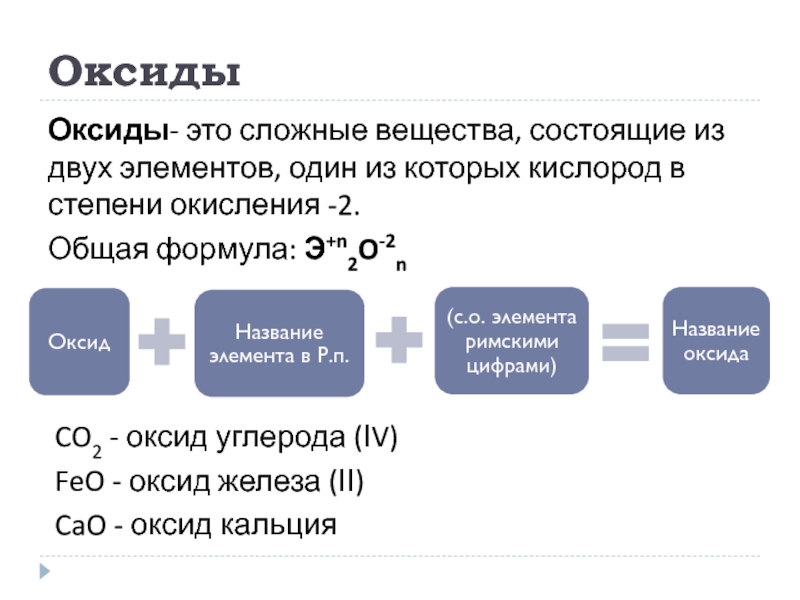
Слайд 6Оксиды
Оксиды- это сложные вещества, состоящие из двух элементов, один из которых
Общая формула: Э+n2O-2n
CO2 - оксид углерода (ІV)
FeO - оксид железа (ІІ)
CaO - оксид кальция
Слайд 7Оксиды
1) Несолеобразующие - CO, SiO, N2O, NO, NO2
2) Солеобразующие
Основные – металлы
При взаимодействии с водой образуют основания
Na2O, K2O, CaO
Амфотерные – металлы со с.о. +3, +4; исключения: BeO, ZnO, CuO, GeO, SnO, PbO
При взаимодействии с водой образуют основания и кислоты
Al2O3, Fe2O3, GeO2
Кислотные – неметаллы; металлы со с.о. +5, +6, +7
При взаимодействии с водой образуют кислоты
Cl2O, CO2, Mn2O7
3) Двойные – Fe3O4 (FeO·Fe2O3), Pb3O4 (PbO·Pb2O3)
Слайд 8Гидриды
Гидриды - соединения водорода с металлами или менее электроотрицательными, чем водород,
LiH, CaH2, AlH3
Иногда к гидридам относят соединения всех химических элементов с водородом.
CH4, NH3, H2O, HCl
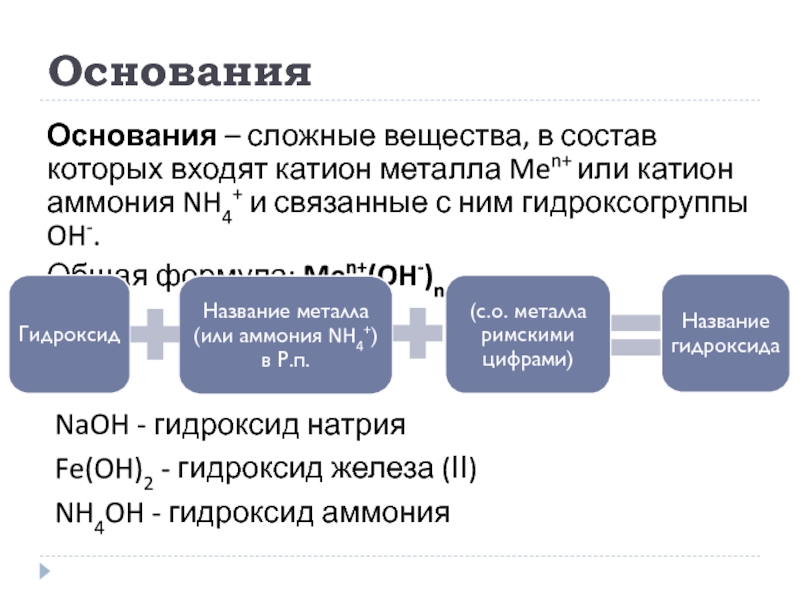
Слайд 10Основания
Основания – сложные вещества, в состав которых входят катион металла Men+
Общая формула: Men+(OH-)n
NaOH - гидроксид натрия
Fe(OH)2 - гидроксид железа (ІІ)
NH4OH - гидроксид аммония
Слайд 11Основания
По числу гидроксогрупп OH:
Однокислотные – NaOH, KOH
Двухкислотные – Ca(OH)2, Ba(OH)2
Многокислотные –
По растворимости в воде:
Растворимые (щелочи) – гидроксиды щелочных (едкие щелочи) и щелочноземельных металлов – LiOH, Ba(OH)2
Нерастворимые – Cu(OH)2, Cr(OH)3
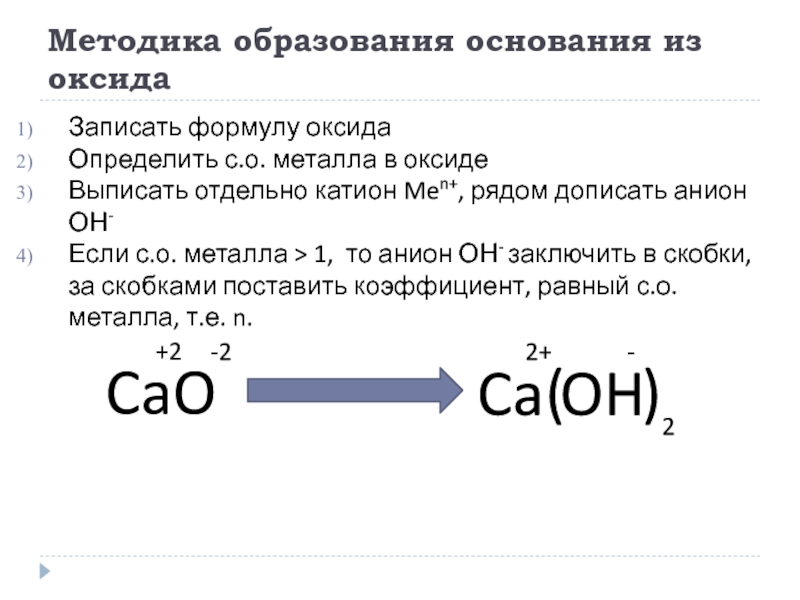
Слайд 12Методика образования основания из оксида
Записать формулу оксида
Определить с.о. металла в оксиде
Выписать
Если с.о. металла > 1, то анион ОН- заключить в скобки, за скобками поставить коэффициент, равный с.о. металла, т.е. n.
CaO
+2
-2
Ca
2+
OH
-
(
)
2
Слайд 13Кислоты
Кислоты – сложные вещества, молекулы которых состоят из атомов водорода Н+
Общая формула: Н+mАm-
Слайд 14Кислоты
По основности:
Одноосновные – HF, HCl
Двухосновные – H2S, H2SO4
Многоосновные – H3PO4,
По составу:
Бескислородные – HCl, HCN
Кислородсодержащие – HNO3, HClO
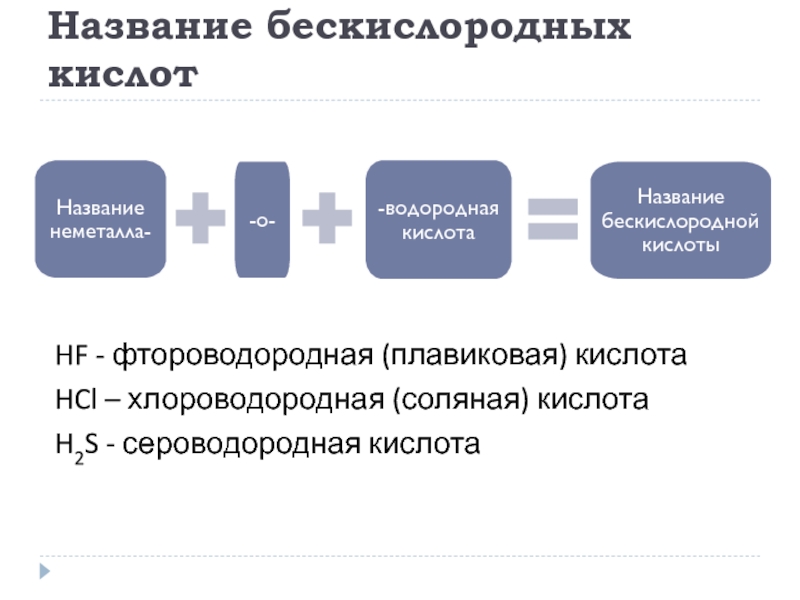
Слайд 15Название бескислородных кислот
HF - фтороводородная (плавиковая) кислота
HCl – хлороводородная (соляная) кислота
H2S
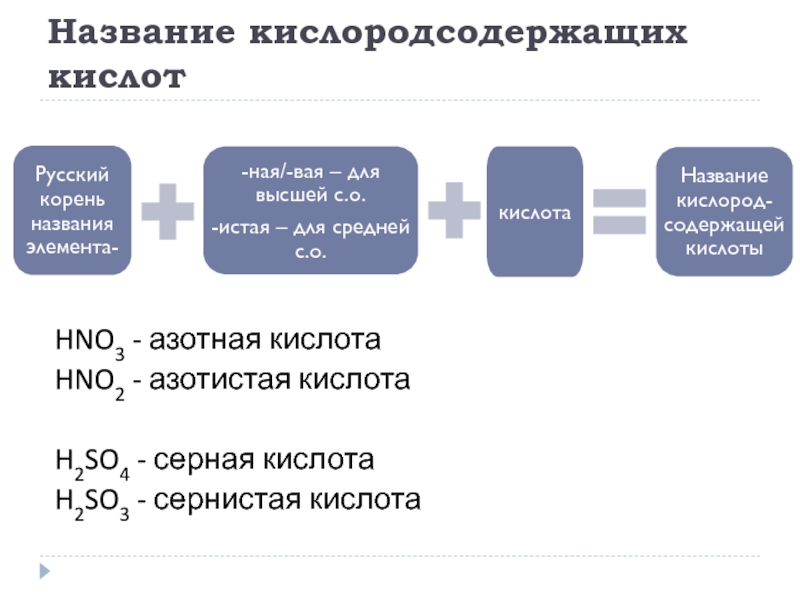
Слайд 16Название кислородсодержащих кислот
HNO3 - азотная кислота
HNO2 - азотистая кислота
H2SO4 - серная
H2SO3 - сернистая кислота
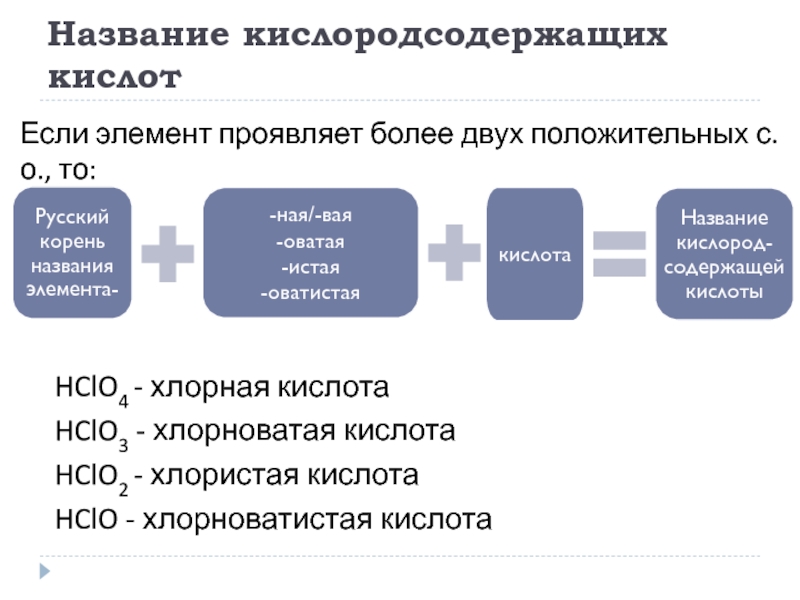
Слайд 17Название кислородсодержащих кислот
HClO4 - хлорная кислота
HClO3 - хлорноватая кислота
HClO2 - хлористая
HClO - хлорноватистая кислота
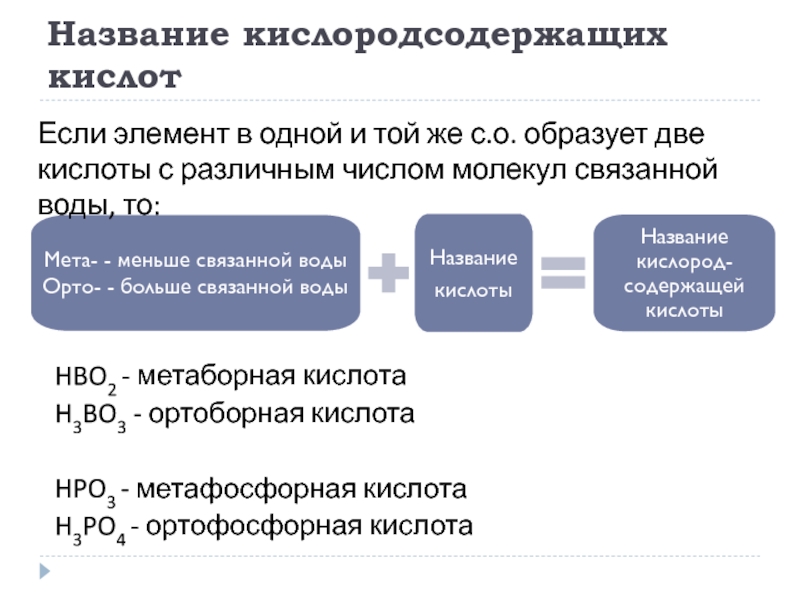
Если элемент проявляет более двух положительных с.о., то:
Слайд 18Название кислородсодержащих кислот
HBO2 - метаборная кислота
H3BO3 - ортоборная кислота
HPO3 - метафосфорная
H3PO4 - ортофосфорная кислота
Если элемент в одной и той же с.о. образует две кислоты с различным числом молекул связанной воды, то:
Слайд 19Методика образования кислоты из оксида
Записать формулу оксида
К оксиду алгебраически прибавить одну
Сократить коэффициенты, если это возможно
Если нужно образовать ортокислоту, то к метакислоте надо добавить еще одну молекулу воды
H2P2O6
+
H2 O
= HPO3
H3PO4
+
H2 O
HPO3
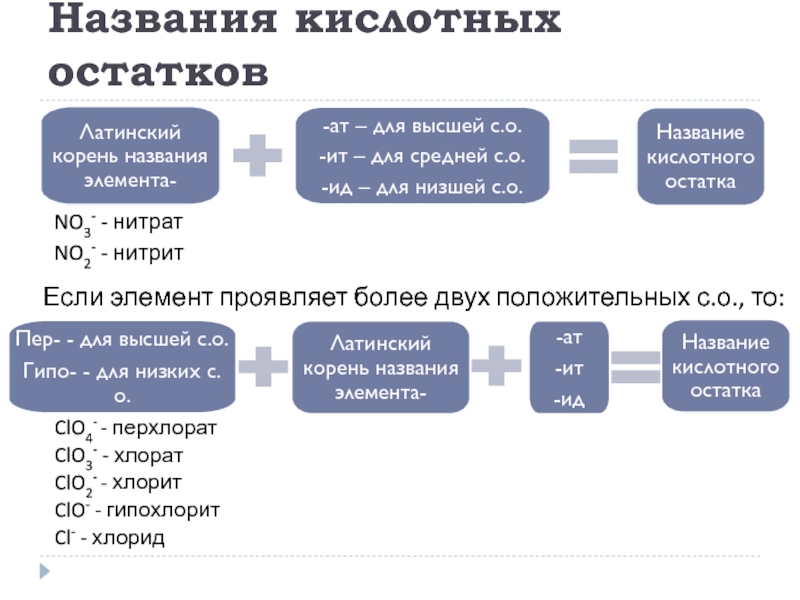
Слайд 20Названия кислотных остатков
Если элемент проявляет более двух положительных с.о., то:
ClO4- -
ClO3- - хлорат
ClO2- - хлорит
ClO- - гипохлорит
Cl- - хлорид
NO3- - нитрат
NO2- - нитрит
Слайд 21Соли
1) Как продукты замены протонов в кислотах или гидроксогрупп в основаниях:
Средние
Основные – (CuOH)2CO3, ZnOHCl
Кислые – K2HPO4, KH2PO4
2) По числу присутствующих в структуре катионов и анионов:
Простые – NaCl, AgI
Двойные – KAl(SO4)2, CaMg(CO3)2
Смешанные - Ca(ClO)Cl, MgClBr
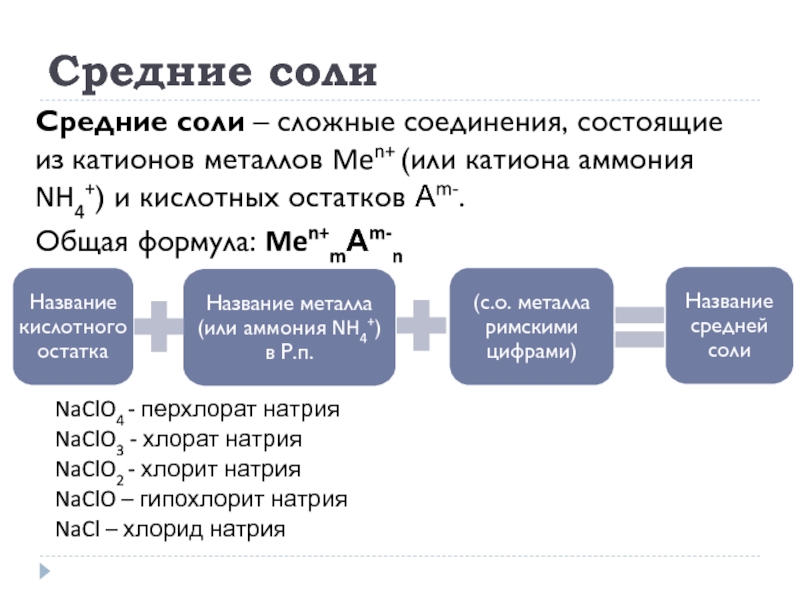
Слайд 22Средние соли
Средние соли – сложные соединения, состоящие из катионов металлов Men+
Общая формула: Men+mАm-n
NaClO4 - перхлорат натрия
NaClO3 - хлорат натрия
NaClO2 - хлорит натрия
NaClO – гипохлорит натрия
NaCl – хлорид натрия
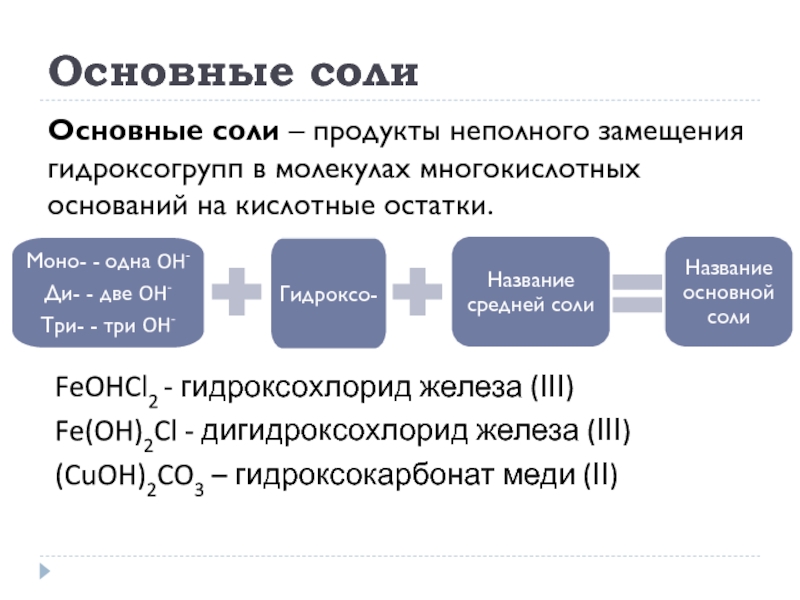
Слайд 23Основные соли
Основные соли – продукты неполного замещения гидроксогрупп в молекулах многокислотных
FeOHCl2 - гидроксохлорид железа (ІІІ)
Fe(OH)2Cl - дигидроксохлорид железа (ІІІ)
(CuOH)2CO3 – гидроксокарбонат меди (ІІ)
Слайд 24Кислые соли
Кислые соли – продукты неполного замещения атомов водорода в молекулах
NaHSO4 - гидросульфат натрия
K2HPO4 - гидрофосфат калия
KH2PO4 - дигидрофосфат калия
Слайд 25По числу присутствующих в структуре катионов и анионов
Двойные соли – соли,
KAl(SO4)2 – сульфат алюминия-калия
Смешанные соли – соли, содержащие два типа кислотных остатков.
Ca(OCl)Cl – гипохлорит-хлорид кальция
Простые соли – соли, состоящие из одного вида катионов и одного вида анионов.
K2SO4 – сульфат калия
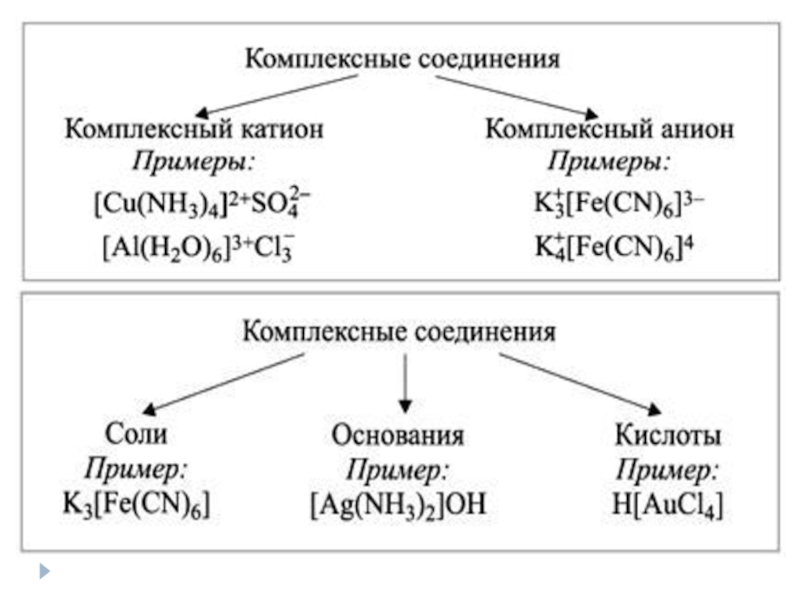
Слайд 26Комплексные соединения
Комплексные соединения – соединения, в состав которых входит комплексный ион,
Слайд 28Номенклатура комплексных соединений
Если комплексный – анион:
1) Число лигандов (греческие числительные)
2) Латинское
3) Соединительная «о», если название лиганда оканчивается на согласную букву
4) Латинское название комплексообразова-теля на –ат с указание с.о.
5) Название катиона внешней сферы в Р.п.
K3[Fe(CN)6] – гексацианоферрат (ІІІ) калия
Na[Al(OH)4(H2O)2] - диакватетрагидроксоалюминат натрия
Слайд 29Номенклатура комплексных соединений
Если комплексный – катион:
1) Число анионов внешней сферы
2) Латинское
3) Число лигандов (греческие числительные)
4) Название лигандов
5) Русское название комплексообразователя в Р.п. с указанием с.о.
6) Если внутренняя сфера комплекса нейтральна, то название комплексообразователя в И.п.
[Zn(NH3)4]Cl2 – (ди)хлорид тетрааммин цинка
[Cr(NH3)3(H2O)3]Cl3 - (три)хлорид триакватриаммин хрома (ІІІ)
[Cr(H2O)3Cl3]·6H2O – гексагидрат трихлоротриаквахром (ІІІ)