- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Комплексные соединения (строение,свойства) презентация
Содержание
- 1. Комплексные соединения (строение,свойства)
- 2. «Только с появлением теории Вернера химия
- 3. Приложения Химический словарик
- 4. Комплексное соединение Главная называют сложное соединение,
- 5. Главная Комплексообразователь обычно является катион (центральный
- 6. Главная Координационное число количество лигандов, которые
- 7. Главная Лиганд [Cu(NH3)4](OH)2
- 8. Главная Внутренняя координационная сфера [Cu(NH3)4](OH)2
- 9. Главная Внешняя координационная сфера [Cu(NH3)4](OH)2
- 10. Главная Нахождение в природе Гемоглобин Хлорофилл Ферменты
- 11. Главная Строение молекулы
- 12. Главная
- 13. Главная Пример
- 14. Лигандами могут быть: а) полярные молекулы
- 15. Главная Координационные соединения образованы металлами побочных
- 16. Главная Строение молекулы Для образования прочных
- 17. Главная Классификация комплексных ионов
- 18. Главная
- 19. Главная
- 20. Главная Химические свойства Диссоциация (первичная)
- 21. Главная Номенклатура Названия комплексов строятся по
- 22. В соединении сначала называют анион, а
- 23. Главная НАЗВАНИЯ КОМПЛЕКСНЫХ АНИОНОВ: Fe -
- 24. Главная
Слайд 2
«Только с появлением теории Вернера химия комплексных соединений утратила характер лабиринта
Слайд 3
Приложения
Химический словарик
Источники
Нахождение в природе
Строение молекулы
Классификация комплексных ионов
Номенклатура
Химические свойства
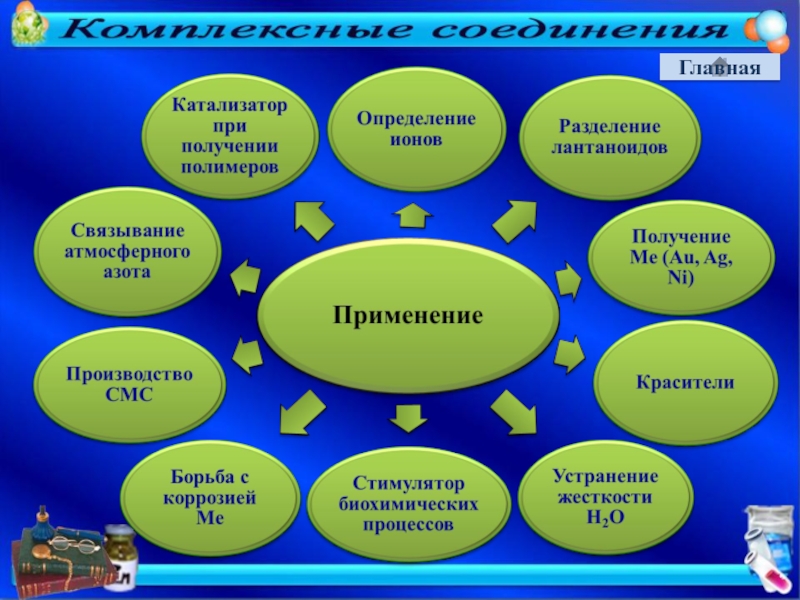
Применение
Взаимодействие сульфата меди (II)
Слайд 4
Комплексное соединение
Главная
называют сложное соединение, образующееся при взаимодействии более простых неизменных частиц
[Cu(NH3)4](OH)2 K2[HgI4]
Слайд 5
Главная
Комплексообразователь
обычно является катион (центральный ион) или нейтральный атом (центральный атом). Наиболее
[Cu(NH3)4](OH)2 K2[HgI4]
Слайд 6
Главная
Координационное число
количество лигандов, которые может присоединять комплексообразователь
[Cu(NH3)4](OH)2
Слайд 7
Главная
Лиганд
[Cu(NH3)4](OH)2
расположено (координировано) определенное число ионов или полярных молекул вокруг центрального иона (атома)–комплексообразователя
Слайд 8
Главная
Внутренняя координационная сфера
[Cu(NH3)4](OH)2
Центральный ион (атом) с лигандами образует внутреннюю координационную сферу соединения, которую при написании заключают в квадратные скобки. (Внутренняя сфера КС в значительной степени сохраняет стабильность при растворении)
Слайд 9Главная
Внешняя координационная сфера
[Cu(NH3)4](OH)2
Ионы, которые располагаются на более далеком расстоянии от комплексообразователя
Слайд 11
Главная
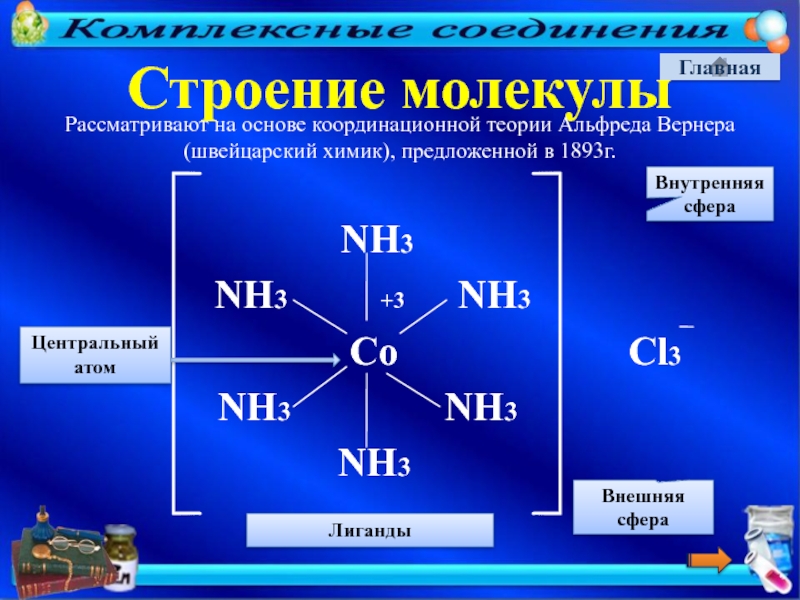
Строение молекулы
NH3 +3 NH3
Co Cl3
NH3 NH3
NH3
Внутренняя сфера
Внешняя сфера
Лиганды
Рассматривают на основе координационной теории Альфреда Вернера (швейцарский химик), предложенной в 1893г.
Слайд 14
Лигандами могут быть:
а) полярные молекулы NH3, H2O, CO, NO.
б) простые ионы
в) сложные ионы CN-, SCN-, NO-2, OH-
Главная
Слайд 15Главная
Координационные соединения образованы металлами побочных подгрупп, имеющими, как правило, незавершенный d
Метод валентных связей (ВС) принимает во внимание донорно-акцепторное происхождение связей в комплексных соединениях. Образование комплексного иона можно объяснить наличием у катионов d-металлов вакантных орбиталей на s-, p-, d- и f- подуровнях:
Co3+
Co0
4s
4р
3d
Строение молекулы
Слайд 16Главная
Строение молекулы
Для образования прочных связей внутри комплексного соединения энергетически выгодно освободить
Co3+
Свободные орбитали атомов кобальта, в свою очередь, являются вакансиями для неподелённой электронной пары азота в молекуле аммиака. Так происходит образование внутренней координационной сферы комплексного соединения:
Co3+
Слайд 17
Главная
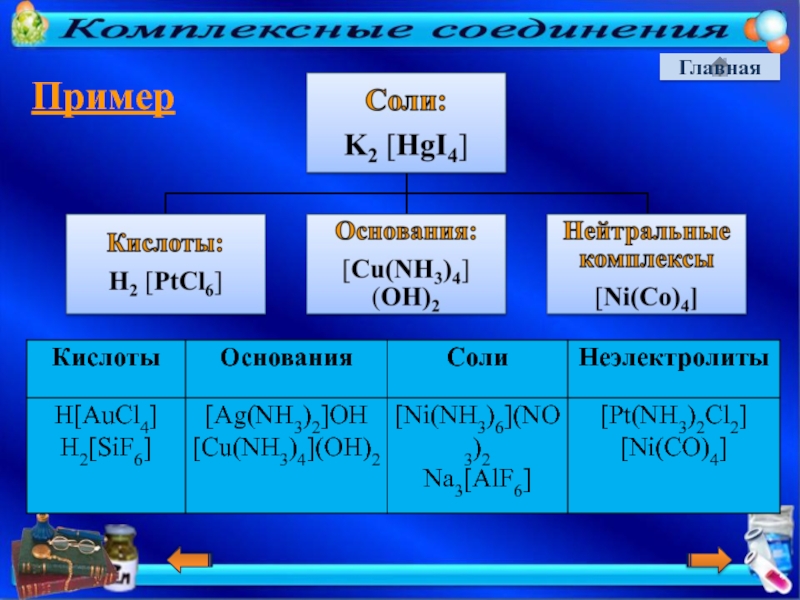
Классификация комплексных ионов
по заряду комплексов:
катионные - [Ni(NH3)4]2+
анионные -
нейтральные - [Co(NH3)4Сl2]0
Слайд 18
Главная
Классификация комплексных ионов
б)по составу и химическим свойствам:
кислоты - H[AuCl4]
основания
соли - [Ni(NH3)6]SO4
Слайд 19
Главная
Классификация комплексных ионов
в)по типу лигандов:
гидроксокомплексы - K2[Zn(OH)4]
аквакомплексы - [Fe(H2O)6]Cl3
комплексы смешанного типа - K[Co(NH3)2Cl4], [Pt(NH3)4(H2O)2]Cl4
Слайд 20
Главная
Химические свойства
Диссоциация (первичная) комплексных соединений
K4[Fe(CN)6] → 4K+ + [Fe(CN)6]4-
K3[Cr(OH)6] →
Na2[Zn(OH)4] → 2Na+ + [Zn(OH)4]2-
[Ag(NH3)2]OH → [Ag(NH3)2]+ + OH-
Слайд 21
Главная
Номенклатура
Названия комплексов строятся по общим правилам IUPAC: читаются и записываются справа
лиганды - с окончанием – о
анионы - с окончанием - ат.
Слайд 22
В соединении сначала называют анион, а затем катион.
При указании внутренней сферы
Cl- - хлоро-
ОН- - гидроксо-
CN- - циано-
Далее называют нейтральные лиганды:
NH3 – аммин
H2O – аква
Главная
Номенклатура
[Cu2+(NH3)4] 2+ SO2- 4 K+ [Al3+(OH)4]- [Zn (NH3)4 Cl2]
cульфат тетрааммин-меди(II) тетрагидроксо дихлоро-тетрааммин
алюминат калия -цинк
Слайд 23Главная
НАЗВАНИЯ КОМПЛЕКСНЫХ АНИОНОВ:
Fe - феррат
Cu - купрат
Ag - аргентат
Au - аурат
Hg
Al - алюминат
Zn - цинкат
От латинского названия комплексообразователя с добавлением суффикса
ат
+3
Номенклатура





2 K2[HgI4]](/img/tmb/5/438974/8d6103d165c58bd605087ad7d8a0b6bc-800x.jpg)
2 K2[HgI4]расположено (координировано) определенное число ионов или полярных молекул вокруг](/img/tmb/5/438974/7888185d329592450382b5b58bc84c38-800x.jpg)
2 K2[HgI4]Центральный ион (атом) с лигандами образует внутреннюю](/img/tmb/5/438974/9b19a86ae7340c8253f245c98a79bc06-800x.jpg)
2 K2[HgI4]Ионы, которые располагаются на более далеком расстоянии](/img/tmb/5/438974/34b0f8e7e96990c4662144200cb91881-800x.jpg)





![ГлавнаяКлассификация комплексных ионовпо заряду комплексов: катионные - [Ni(NH3)4]2+ анионные - [Co(CN)6 ]3- нейтральные - [Co(NH3)4Сl2]0](/img/tmb/5/438974/8401c5ece103f8324791cace71587844-800x.jpg)
![ГлавнаяКлассификация комплексных ионовб)по составу и химическим свойствам: кислоты - H[AuCl4] основания - [Ag(NH3)2]OH соли - [Ni(NH3)6]SO4](/img/tmb/5/438974/fa761631abfb0531042d4cf0fd9d2eaf-800x.jpg)
![ГлавнаяКлассификация комплексных ионовв)по типу лигандов: гидроксокомплексы - K2[Zn(OH)4] аквакомплексы - [Fe(H2O)6]Cl3 ацидокомплексы (лиганды - анионы](/img/tmb/5/438974/fb1489118009b16fb794a70eded8fd8a-800x.jpg)
![ГлавнаяХимические свойства Диссоциация (первичная) комплексных соединенийK4[Fe(CN)6] → 4K+ + [Fe(CN)6]4-K3[Cr(OH)6] → 3K+ + [Cr(OH)6]3-Na2[Zn(OH)4] →](/img/tmb/5/438974/78d53a2e56079034acb53dbac25bffdc-800x.jpg)