- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Комплексные соединения презентация
Содержание
- 1. Комплексные соединения
- 2. УМК «ХИМИЯ» Тема лекции:
- 3. СОДЕРЖАНИЕ Основные понятия Классификация Номенклатура Изомерия
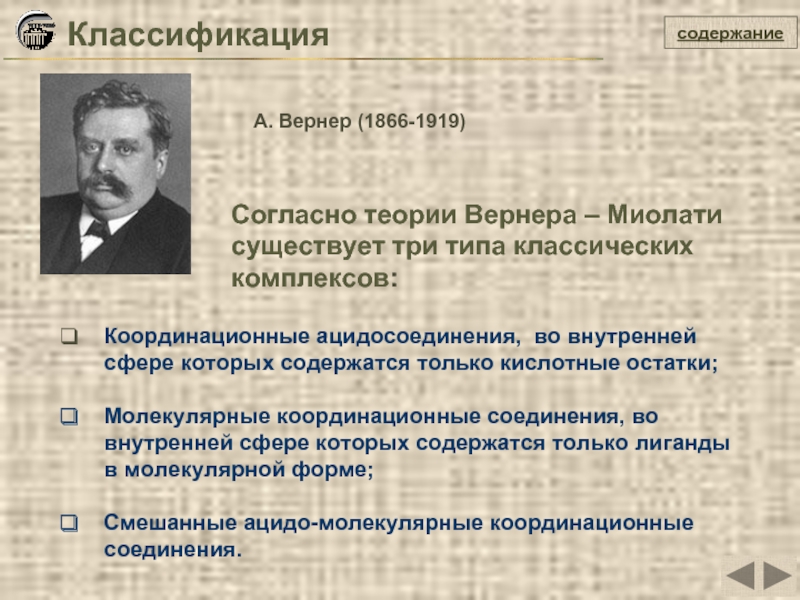
- 6. Классификация Координационные ацидосоединения, во внутренней
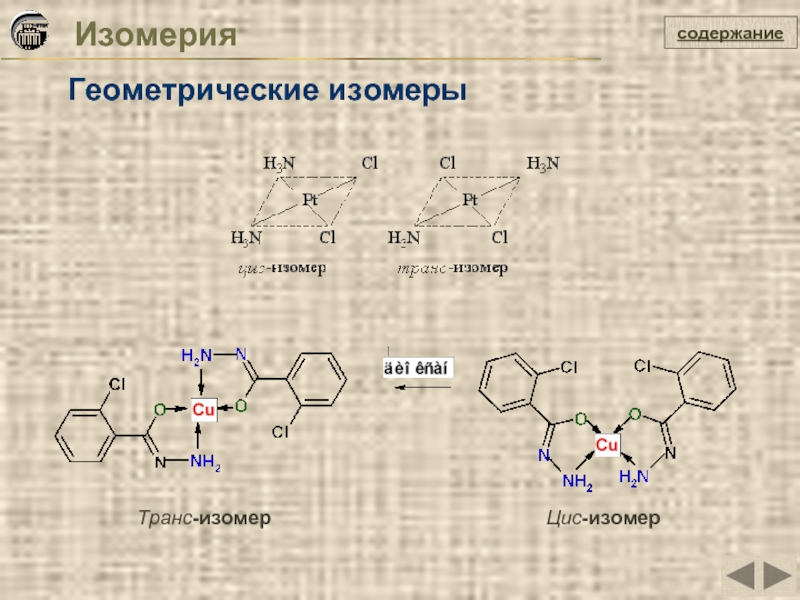
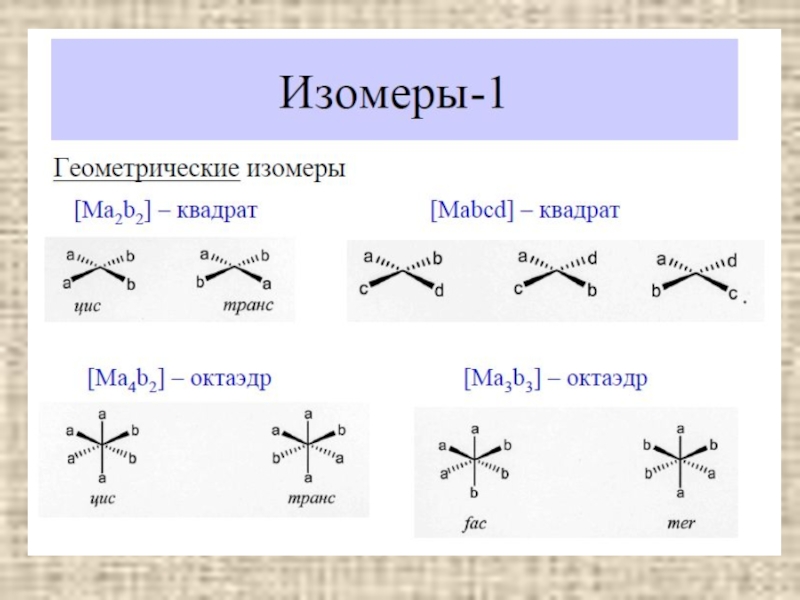
- 9. Изомерия Геометрические изомеры содержание Транс-изомер Цис-изомер
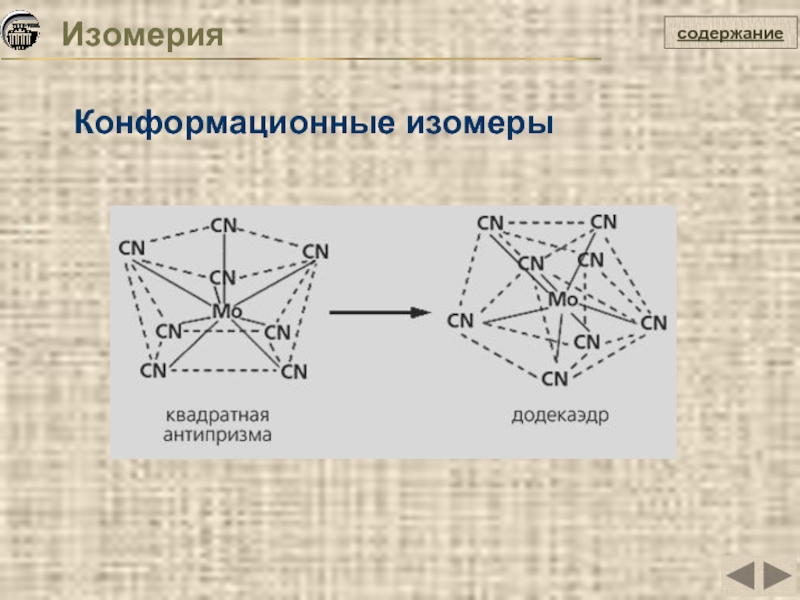
- 14. Изомерия Конформационные изомеры содержание
- 15. Лиганды Типы: содержание
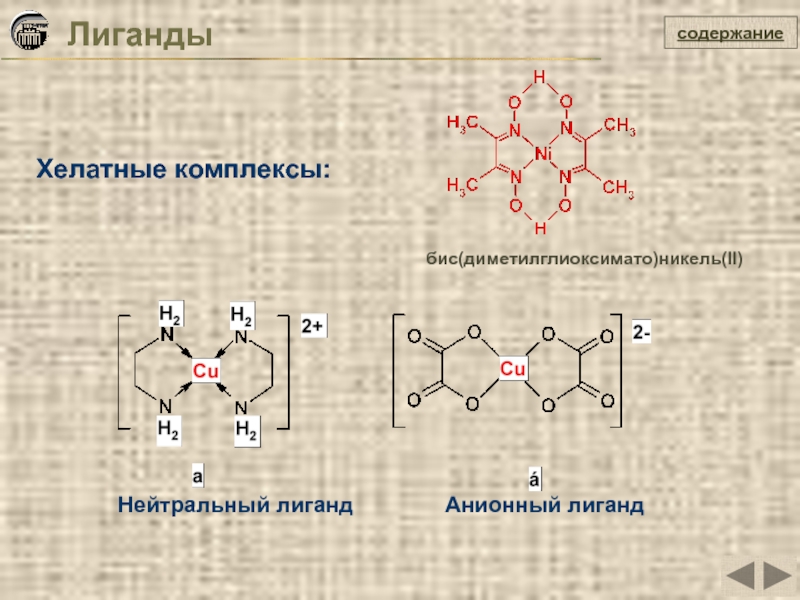
- 16. Хелатные комплексы: Лиганды содержание
- 17. Лиганды Макроциклический содержание
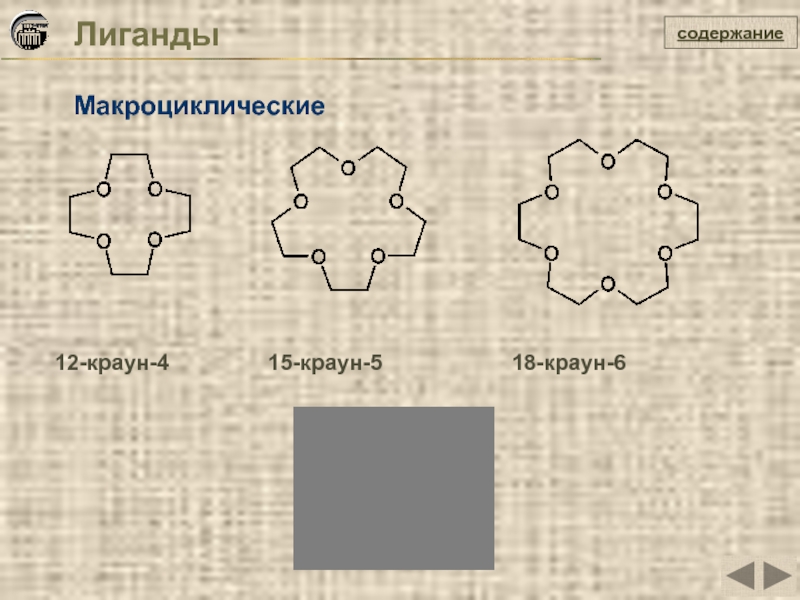
- 18. Лиганды содержание Макроциклические
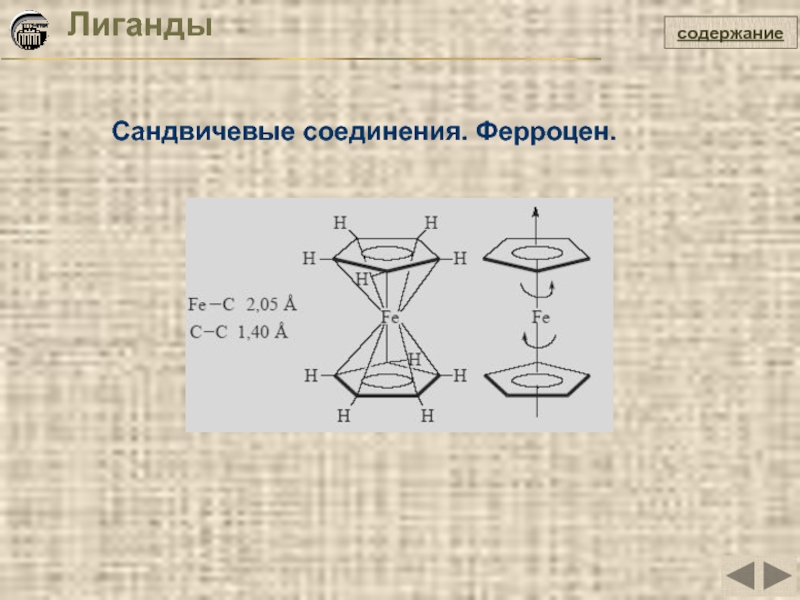
- 19. Лиганды Сандвичевые соединения. Ферроцен. содержание
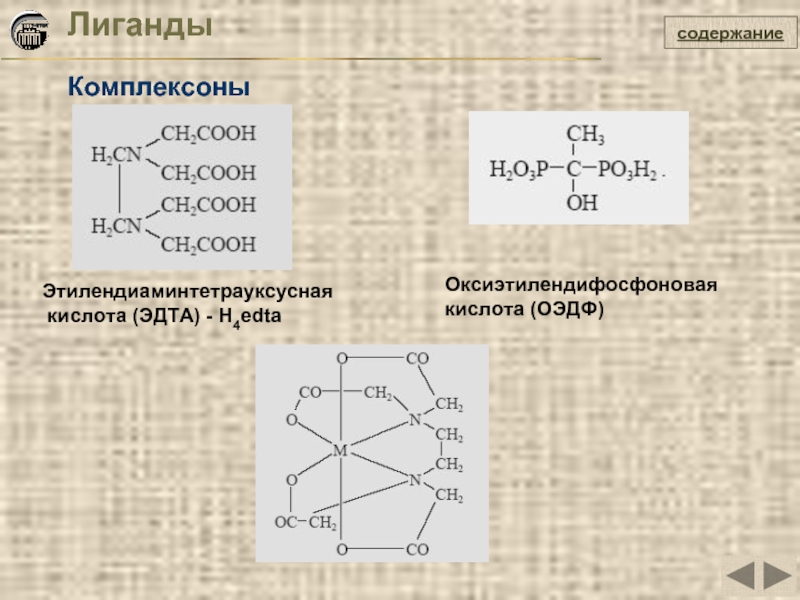
- 20. Лиганды Комплексоны содержание Этилендиаминтетрауксусная
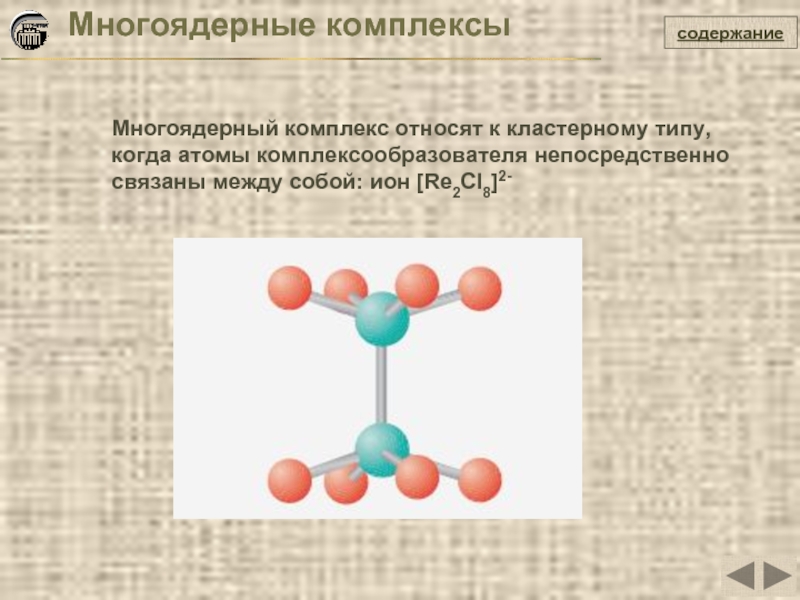
- 21. Многоядерные комплексы Многоядерный комплекс относят к
- 22. Многоядерные комплексы Карбонильные кластеры:
- 23. Строение комплексов Метод ВС
- 26. Строение комплексов Теория кристаллического поля
- 28. Строение комплексов Расщепление d-орбиталей содержание
- 29. Строение комплексов Энергия расщепления октаэдрическим полем
- 30. Строение комплексов Значения величин расщепления кристаллическим полем (Δ0) и энергии спаривания (P) содержание
- 31. Строение комплексов содержание Сильное и
- 32. Строение комплексов содержание Сильное и
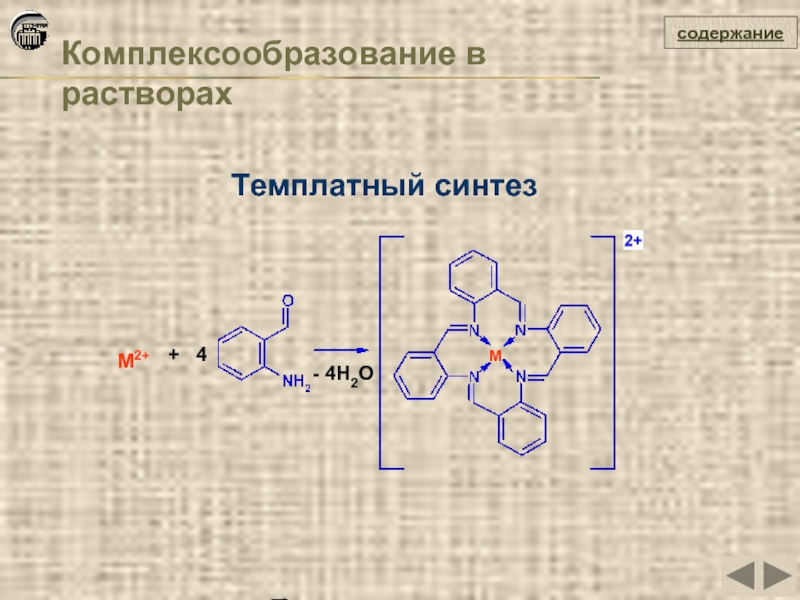
- 36. Комплексообразование в растворах содержание Темплатный
- 38. Устойчивость комплексов содержание [М(H2O)6]n+
- 39. Устойчивость комплексов содержание [М]n+
- 40. Разрушение комплексов содержание
- 41. Устойчивость комплексов содержание Константы нестойкости некоторых комплексов
- 43. Химия комплексных соединений важнейшей является частью неорганической
- 44. Кукушкин Ю.Н. Химия координационных соединений. М.: Высшая
Слайд 3СОДЕРЖАНИЕ
Основные понятия
Классификация
Номенклатура
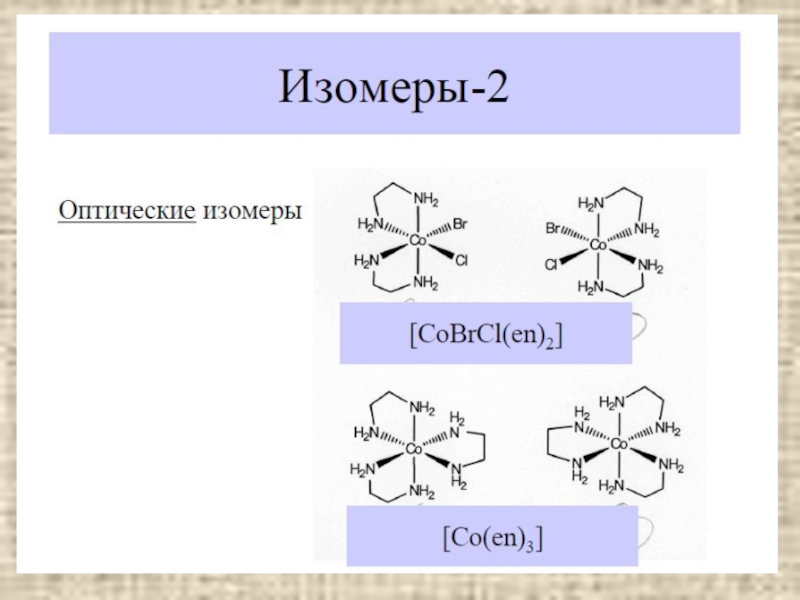
Изомерия
Оптическая
Связевые изомеры
Гидратные и ионизационные изомеры
Конформационные изомеры
Лиганды
Хелатные комплексы
Макроциклические
Сэндвичевые комплексы
Многоядерные комплексы
Строение комплексов
Метод ВС
Теория кристаллического поля
Расщепление Расщепление d Расщепление d-орбиталей
Сильное и слабое поле
Устойчивость комплексов
Литература
Слайд 6Классификация
Координационные ацидосоединения, во внутренней
сфере которых содержатся
Молекулярные координационные соединения, во
внутренней сфере которых содержатся только лиганды
в молекулярной форме;
Смешанные ацидо-молекулярные координационные
соединения.
содержание
Согласно теории Вернера – Миолати существует три типа классических комплексов:
А. Вернер (1866-1919)
Слайд 15Лиганды
Типы:
содержание
нейтральные: H2O, NH3, CO, Н2N-CH2-CH2-NH2
анионы:
Дентатность:
Монодентатные: H2O, NH3, CO, Cl-, OH-, CN-, F-
Полидентатные: Н2N-CH2-CH2-NH2, С2O42-
Слайд 16Хелатные комплексы:
Лиганды
содержание
Нейтральный лиганд
Анионный лиганд
бис(диметилглиоксимато)никель(II)
Слайд 20Лиганды
Комплексоны
содержание
Этилендиаминтетрауксусная
кислота (ЭДТА) - H4edta
Оксиэтилендифосфоновая
кислота (ОЭДФ)
Слайд 21Многоядерные комплексы
Многоядерный комплекс относят к кластерному типу, когда атомы комплексообразователя непосредственно
содержание
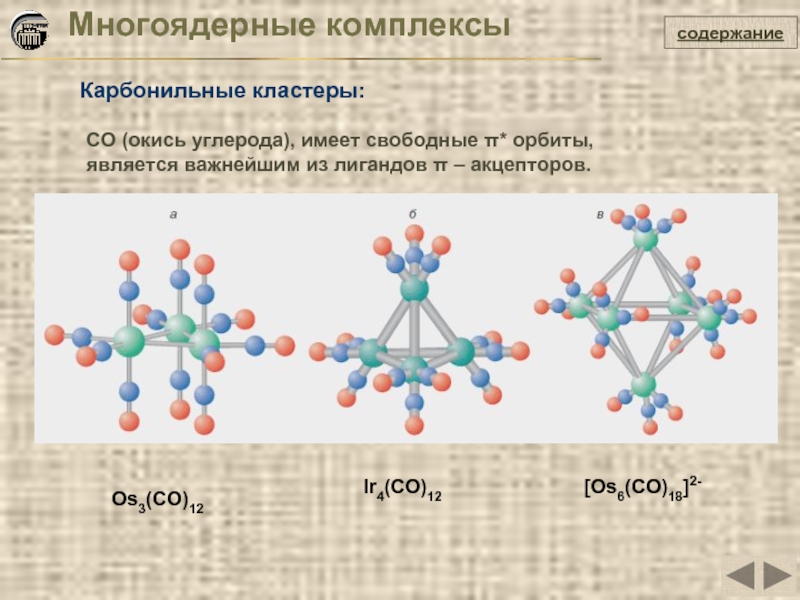
Слайд 22Многоядерные комплексы
Карбонильные кластеры:
содержание
Os3(CO)12
CO (окись углерода), имеет свободные π* орбиты, является
Ir4(CO)12
[Os6(CO)18]2-
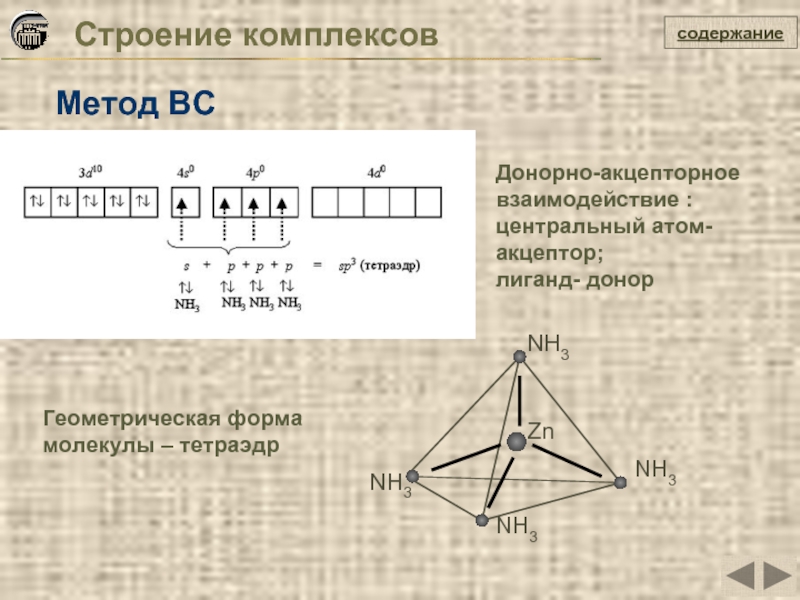
Слайд 23Строение комплексов
Метод ВС
Zn
NH3
NH3
NH3
NH3
Геометрическая форма молекулы – тетраэдр
содержание
Донорно-акцепторное
взаимодействие : центральный атом-
лиганд- донор
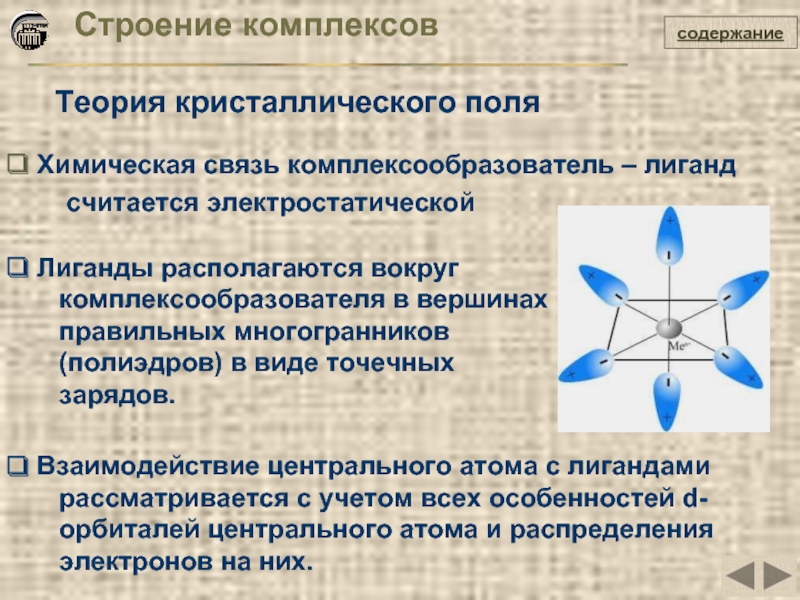
Слайд 26Строение комплексов
Теория кристаллического поля
Химическая связь комплексообразователь – лиганд
Лиганды располагаются вокруг
комплексообразователя в вершинах
правильных многогранников
(полиэдров) в виде точечных
зарядов.
Взаимодействие центрального атома с лигандами
рассматривается с учетом всех особенностей d-
орбиталей центрального атома и распределения
электронов на них.
содержание
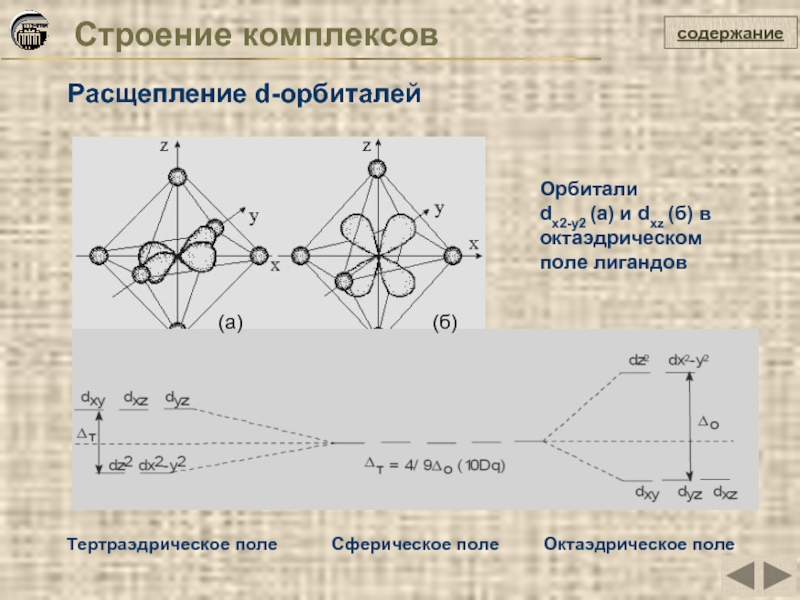
Слайд 28Строение комплексов
Расщепление d-орбиталей
содержание
Орбитали
dх2-у2 (а) и dxz (б) в октаэдрическом поле
(а)
(б)
Тертраэдрическое поле Сферическое поле Октаэдрическое поле
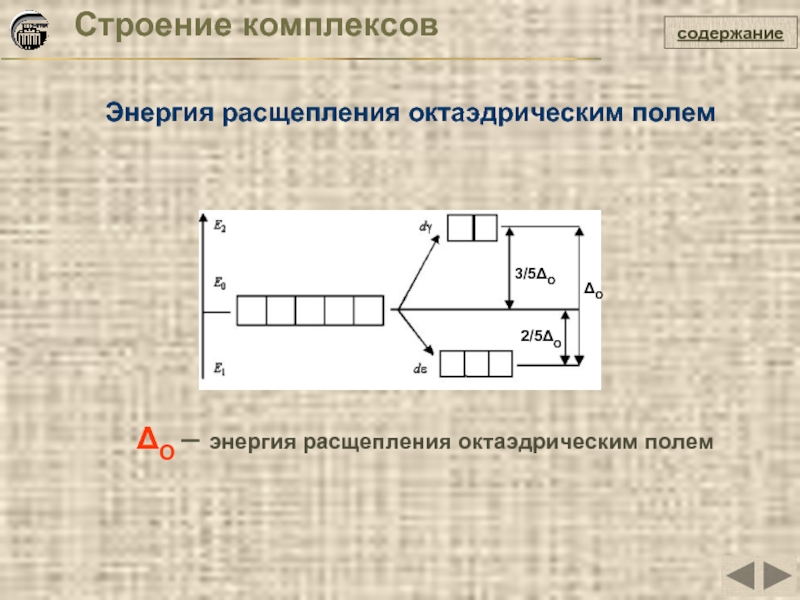
Слайд 29Строение комплексов
Энергия расщепления октаэдрическим полем
содержание
ΔO – энергия расщепления октаэдрическим полем
ΔO
2/5ΔO
3/5ΔO
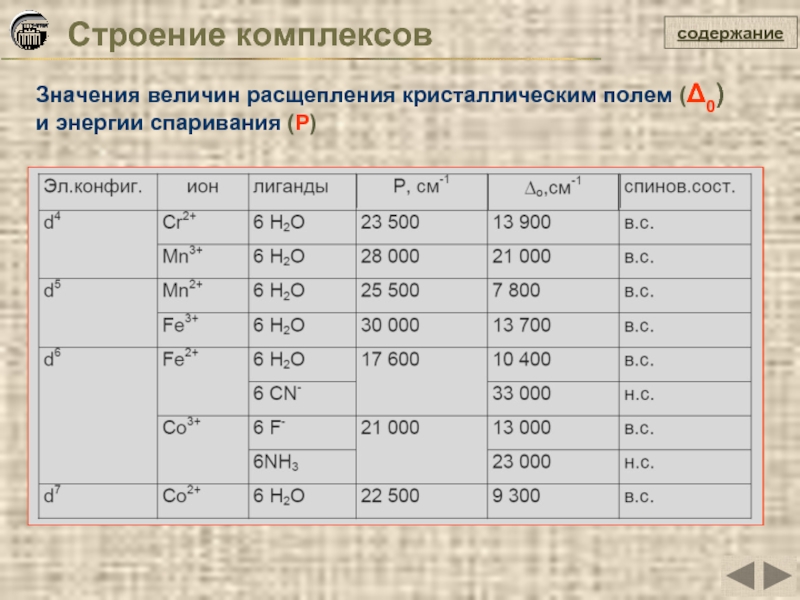
Слайд 30Строение комплексов
Значения величин расщепления кристаллическим полем (Δ0) и энергии спаривания (P)
содержание
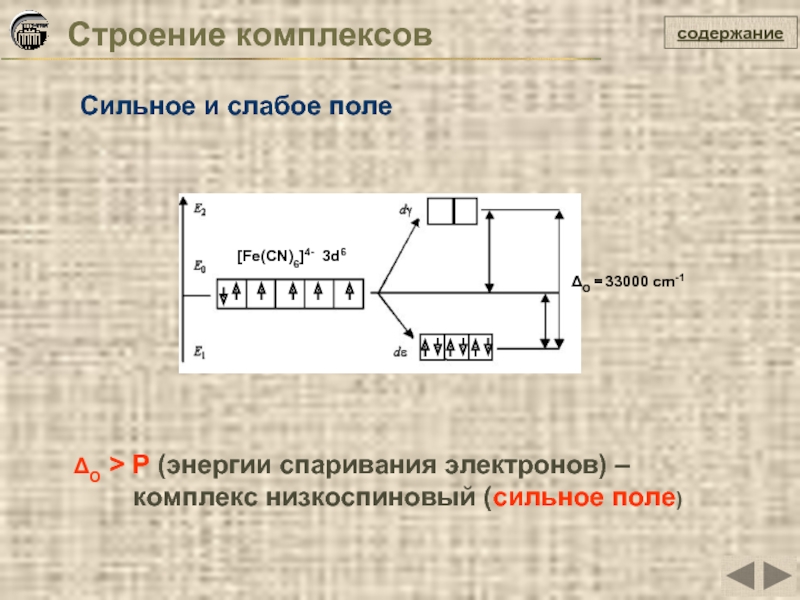
Слайд 31Строение комплексов
содержание
Сильное и слабое поле
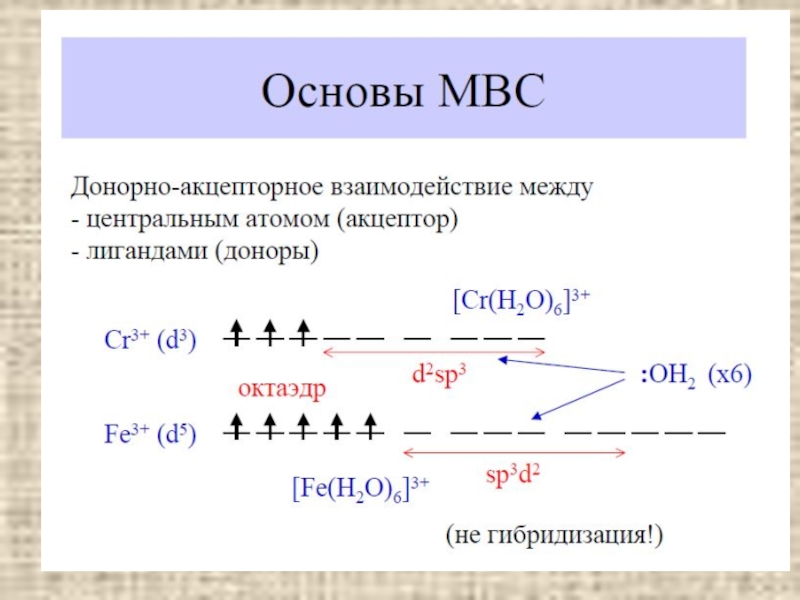
ΔO > P (энергии спаривания электронов) –
комплекс низкоспиновый (сильное поле)
[Fe(CN)6]4- 3d6
ΔO = 33000 cm-1
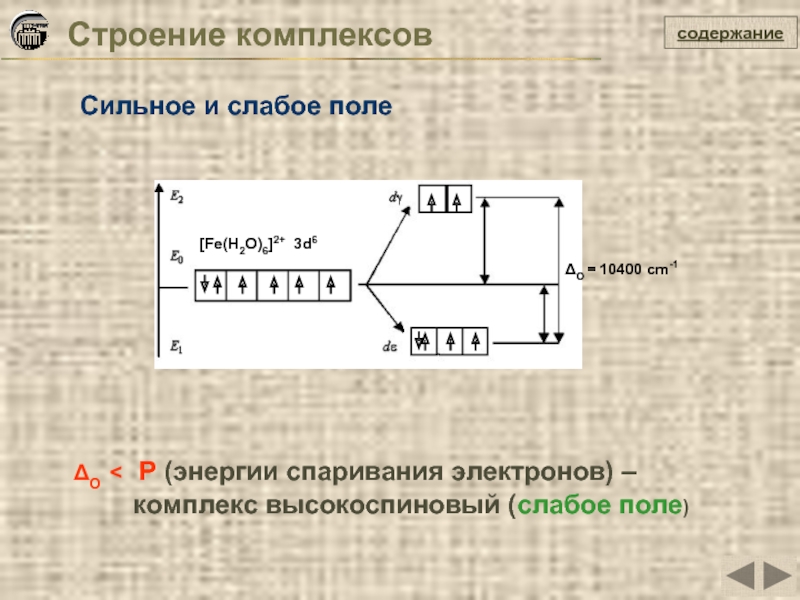
Слайд 32Строение комплексов
содержание
Сильное и слабое поле
ΔO < P (энергии спаривания электронов) –
комплекс высокоспиновый (слабое поле)
[Fe(H2O)6]2+ 3d6
ΔO = 10400 cm-1
Слайд 38Устойчивость комплексов
содержание
[М(H2O)6]n+ + m L
Куст =
[M(L)m n+]
[L]m
[Mn+]
Кнест =
1
Куст
Слайд 39Устойчивость комплексов
содержание
[М]n+ + L [ML]n+
К1 =
[MLn+]
[L]
[Mn+]
К2 =
ΔG0 = –RT ln(β)
β = К1К2…Km
[МL] n+ + L [ML2]n+
[ML2n+]
[MLn+]
[L]
Слайд 43Химия комплексных соединений важнейшей является частью неорганической химии.
Знание о природе
Выводы и заключения
содержание
Слайд 44Кукушкин Ю.Н. Химия координационных соединений. М.: Высшая школа, 1985.
Гринберг А.А.
Вернер А. Новые воззрения в области неорганической химии. Л.: ОНТИ, 1936.
Коттон Ф., Уилкинсон Дж. Современная неорганическая химия. М.: Мир, 1969.
Дятлова Н.М., Темкина В.Я., Попов К.И. Комплексоны и комплексонаты металлов. М.: Химия, 1988.
О.В. Михайлов. Многоликая изомерия координационных соединений //Природа, 2002, №5.
О.В. Михайлов. Что такое темплатный синтез// Соросвский образовательный журнал, 1999, № 10.
Список литературы
содержание










![ЛигандыМакроциклическийсодержание [Ni(H2O)6]2+ + n L [Ni(L)n(H2O)2]2+ + 4H2O](/img/tmb/3/232338/895773c0b850cfc3a8d23683f8b9e157-800x.jpg)






![Устойчивость комплексовсодержание [М(H2O)6]n+ + m L [M(L)m(H2O)k]n+ + (6-k)H2O Куст =[M(L)m n+][L]m](/img/tmb/3/232338/64ba191ae8b45e57c31636286220dc99-800x.jpg)
![Устойчивость комплексовсодержание [М]n+ + L [ML]n+ ; К1 =[MLn+][L][Mn+] К2 =ΔG0 = –RT ln(β)β = К1К2…Km](/img/tmb/3/232338/f250d992dc3c44c71417bd4f66426a2d-800x.jpg)