- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Комплексные соединения презентация
Содержание
- 1. Комплексные соединения
- 2. Комплексные соединения (координационные соединения) – сложные
- 3. Двойная соль или комплексное соединение? KCr(SO4)2∙
- 4. Теорию комплексных соединений –(координационную теорию), разработал в
- 5. Положения координационной теории Вернера в
- 6. Вокруг центрального атома (иона-комплексообразователя) находятся противоположно заряженные
- 7. Природа химической связи в комплексных соединениях
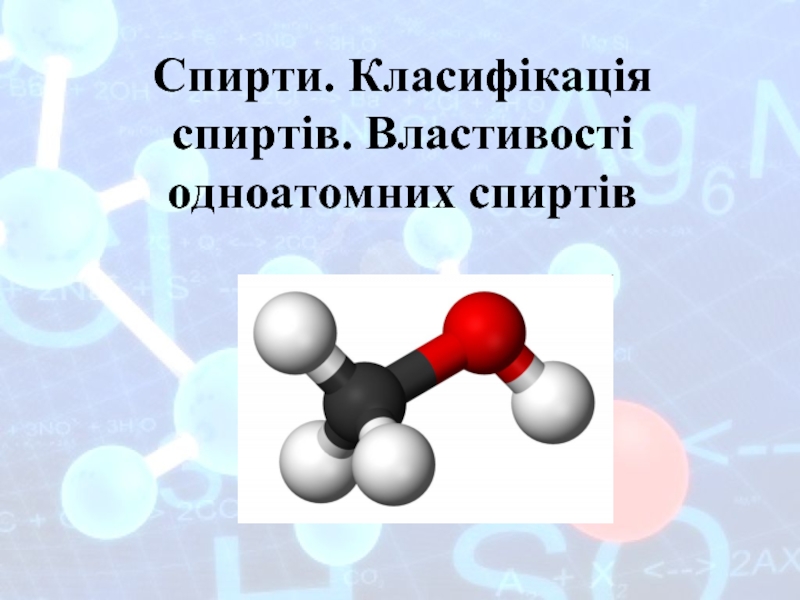
- 8. Электронное строение атома бериллия Be
- 9. Механизм образования комплексного иона [Al(OH)4]-
- 10. Донорно-акцепторный механизм: лиганд предоставляет электронную
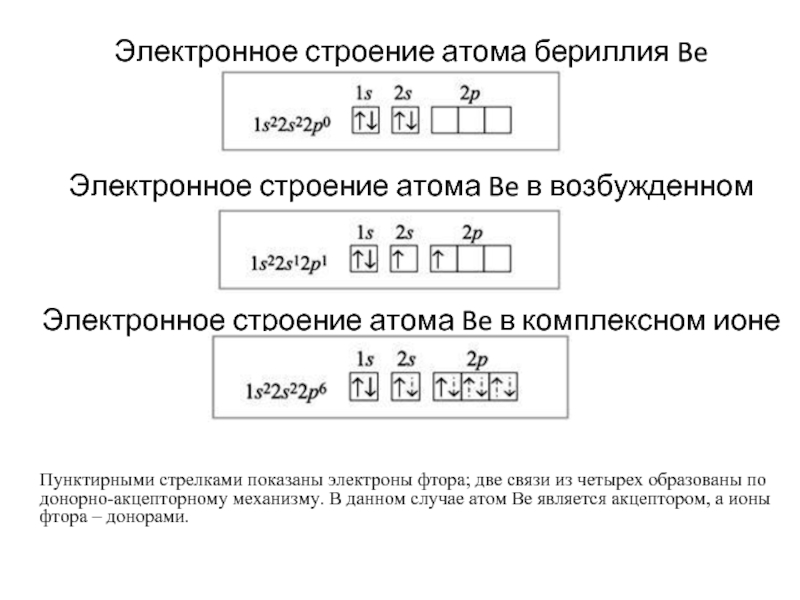
- 11. Строение комплексного соединения K3 [Fe(CN)6] Ион-
- 13. Заряд комплексного иона равен алгебраической сумме зарядов
- 14. ЦЕНТРАЛЬНЫЙ АТОМ (ц. а.) (ион-комплексообразователь) Чаще всего
- 15. Координационное число (к. ч.) Координационное число (к.
- 16. Заряд центрального иона является основным фактором, влияющим на координационное число
- 17. чаще всего кч устойчивого комплекса в два
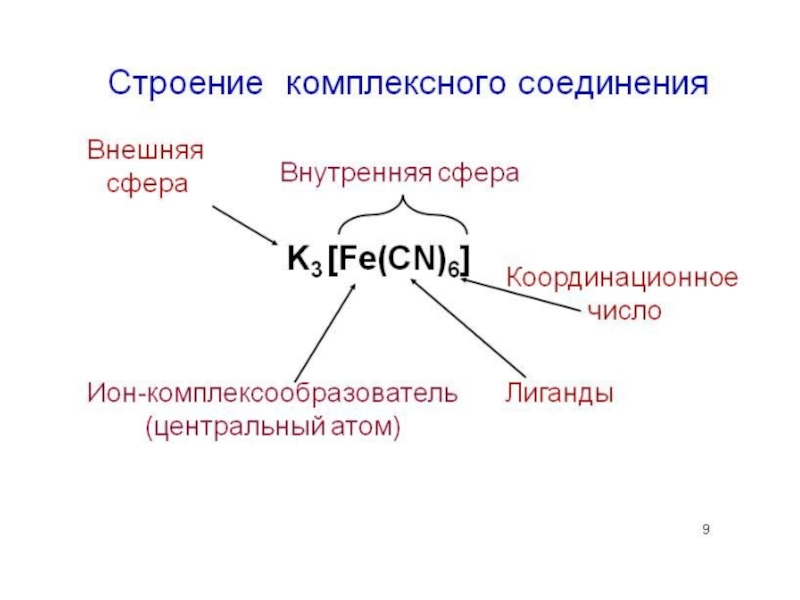
- 18. Na[BF4]
- 19. Na3[AlF6]
- 20. ЛИГАНДЫ Лигандами могут быть: нейтральные молекулы H2O,
- 21. Дентатность лиганда определяется числом координационных мест, занимаемых лигандом
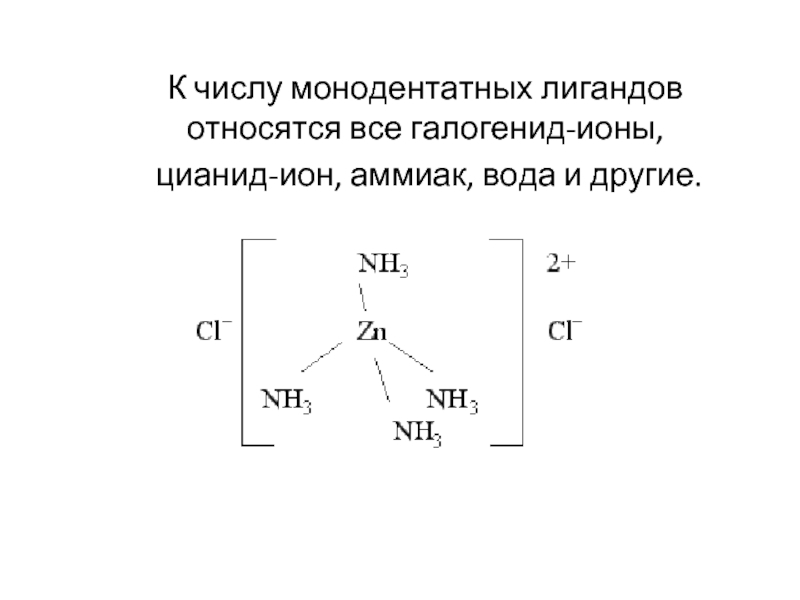
- 22. К числу монодентатных лигандов относятся все галогенид-ионы, цианид-ион, аммиак, вода и другие.
- 23. -монодентатные лиганды, содержат 1 донорный атом
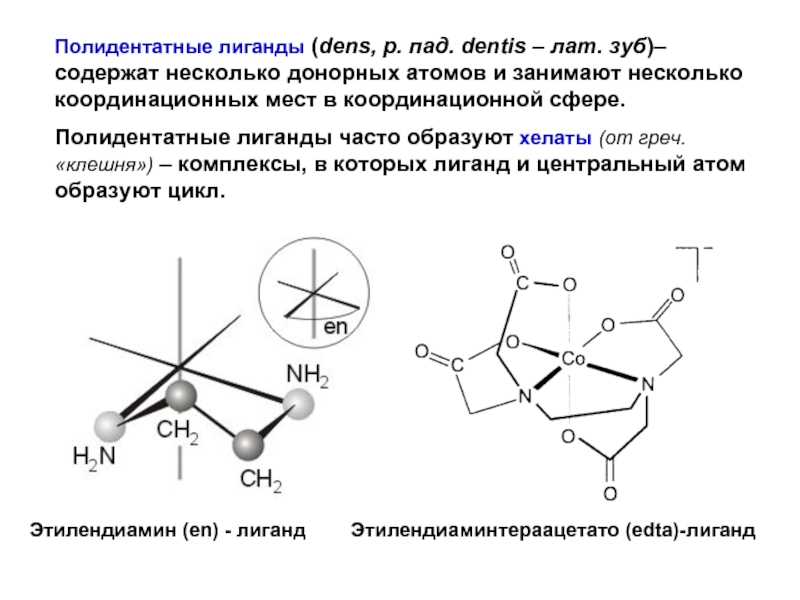
- 24. Полидентатные лиганды (dens, р. пад. dentis –
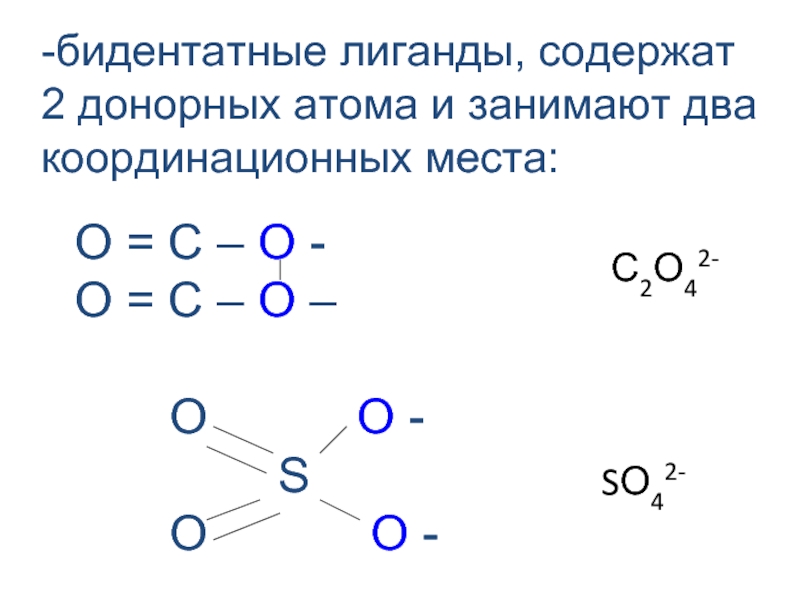
- 25. -бидентатные лиганды, содержат 2 донорных атома и
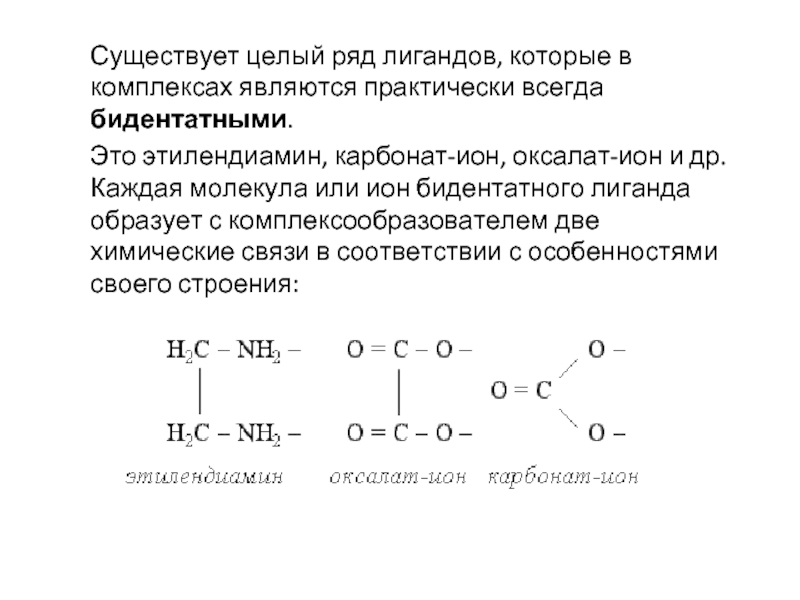
- 26. Существует целый ряд лигандов, которые в комплексах
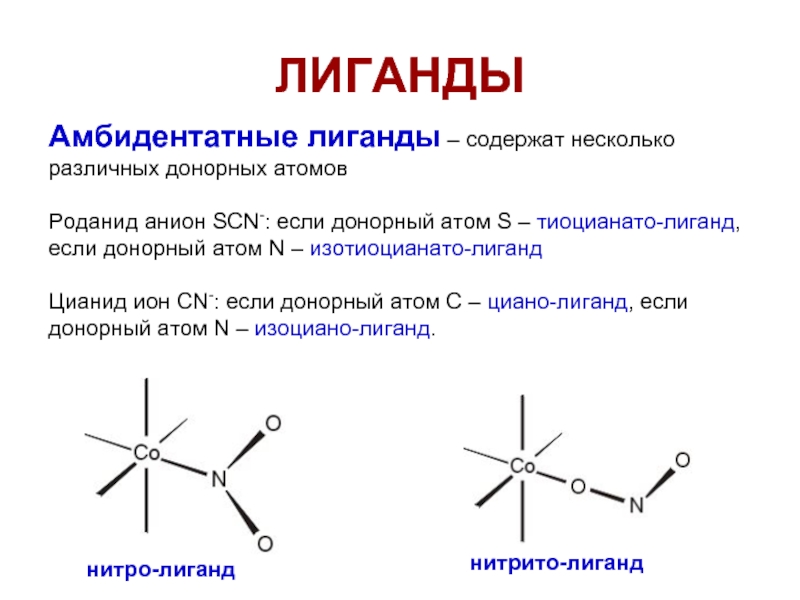
- 27. ЛИГАНДЫ Амбидентатные лиганды – содержат несколько различных
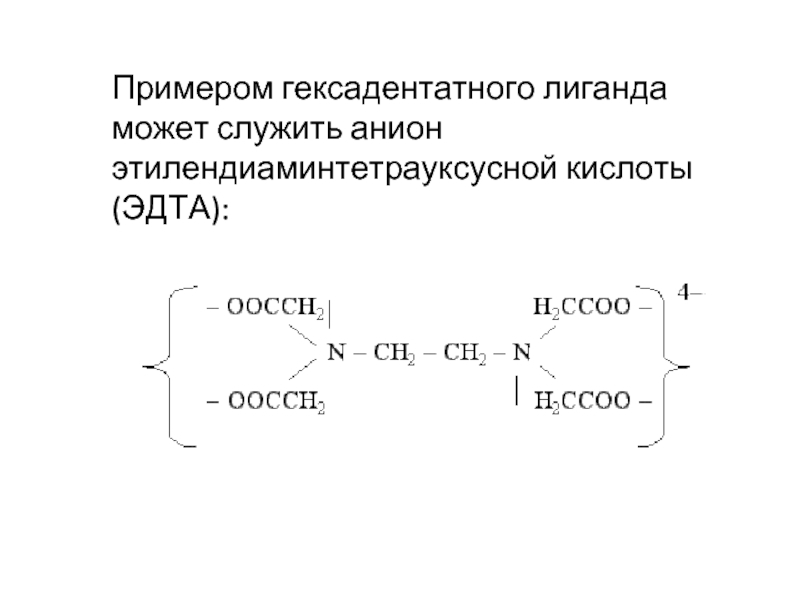
- 28. Примером гексадентатного лиганда может служить анион этилендиаминтетрауксусной кислоты (ЭДТА):
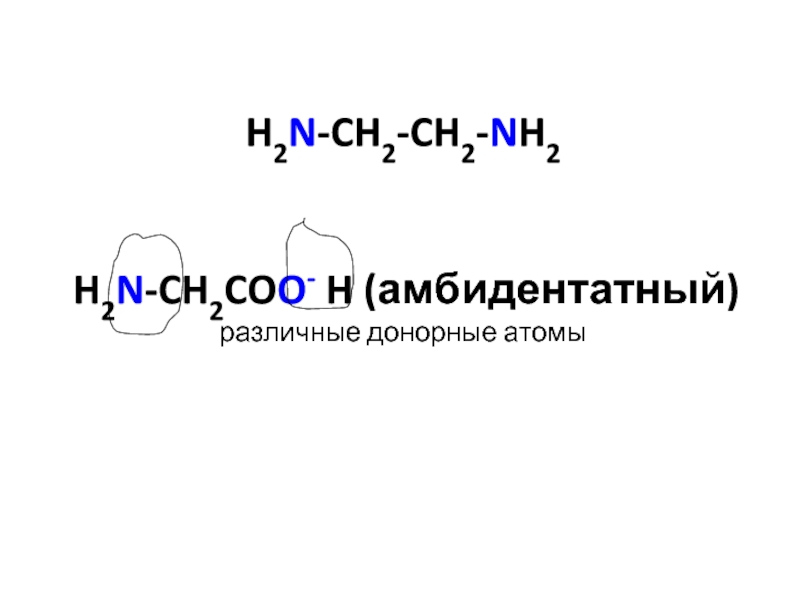
- 29. H2N-CH2-CH2-NH2 H2N-CH2COO- H (амбидентатный) различные донорные атомы
- 30. 1. По заряду внутренней сферы Классификация комплексных соединений
- 31. [Cu(NH3)4]SO4 Na3[Co(NO2)6]
- 32. [Cu(NH3)4]SO4 Na3[Co(NO2)6] [Pt(NH3)2Cl2] [Cr(H2O)2(NH3)3
- 33. По природе лиганда 1) Аммиакаты — комплексы, в которых
- 34. 4) Ацидокомплексы — комплексы, в которых лигандами являются кислотные остатки.
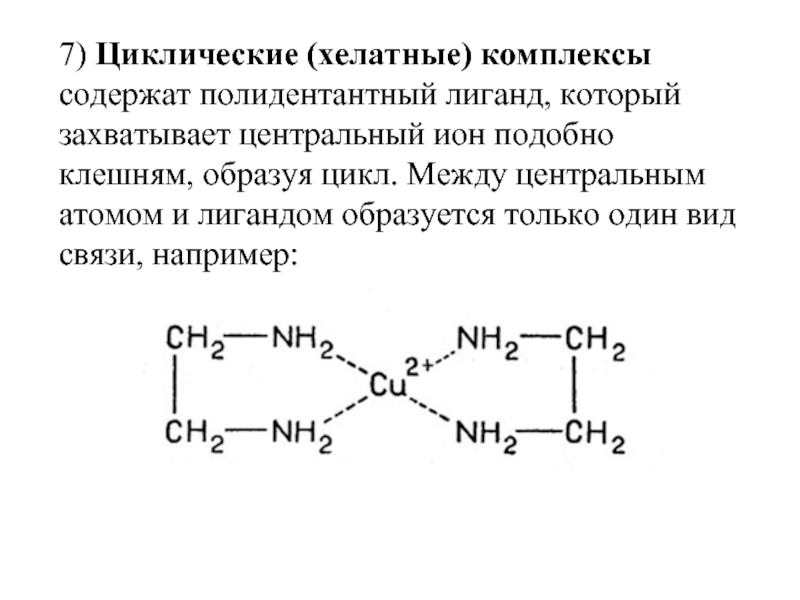
- 35. 7) Циклические (хелатные) комплексы содержат полидентантный лиганд,
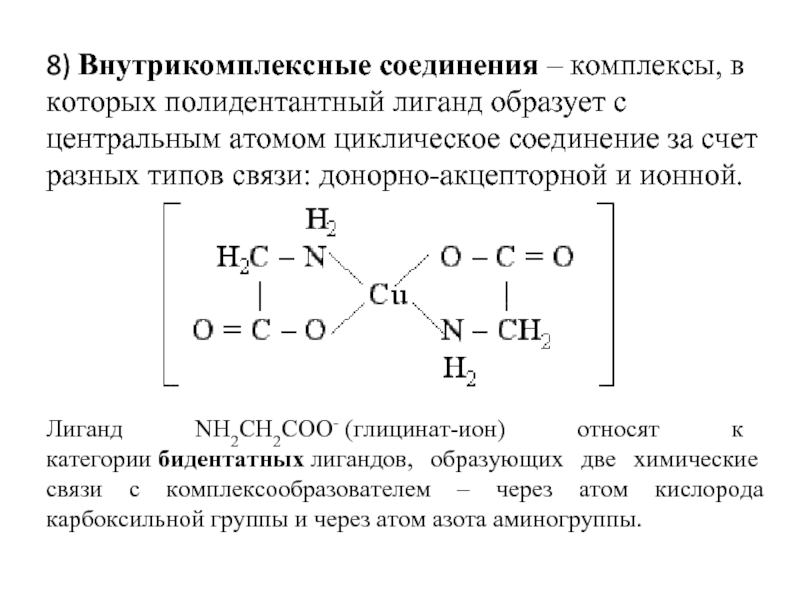
- 36. 8) Внутрикомплексные соединения – комплексы, в которых
- 37. Номенклатура Основы современной номенклатуры комплексных соединений
- 38. Названия некоторых важнейших лигандов
- 39. Номенклатура комплексных соединений K3 [Fe(CN)6] Гексацианоферрат(III) калия
- 40. Соль содержит комплексный катион [Cо(NH3)4Cl2]Cl
- 41. Соль содержит комплексный анион K4[Fe(CN)6]
- 42. Нейтральный комплекс [Co2(CO)8] октакарбонилдикобальт [Сo(NH3)3 (NO2)2Cl]
- 43. Упражнение 1 Первое основание Рейзе [Pt(NH3)4](OH)2
- 44. Упражнение 2 Гексанитрокобальтат(III) натрия Na3[Co(NO2)6] Гидроксид диаммминсеребра(I)
- 45. Комплексные соединения в растворах
- 46. Химические свойства Комплексные соединения можно условно разделить
- 47. Комплексные соединения в растворах Первичная диссоциация комплексных
- 48. Если во внешней сфере комплексного соединения находятся
- 49. 2. Обратимая диссоциация комплексов. Комплексные ионы подвергаются обратимой
- 50. Вторичная диссоциация комплексов [Ag(NH3)2]+ [Ag(NH3)]+
- 51. K4 [Fe(CN)6]
- 52. K4 [Fe(CN)6]→ 4 K+ + [Fe(CN)6 ] 4- первичная диссоциация
- 53. [Fe(CN)6 ] 4- ↔ Fe2+ +6(CN)- вторичная
- 54. [Ni(NH3)6]2+ Кн = 2*10-9 (непрочный комплекс) Куст.=1/ Кн
- 55. Кн и Ку относятся только к комплексному иону! Не забывайте !
- 56. Вернер подтверждает Вернера 1893-4 гг. не были
- 57. Ряды Вернера - Миолати 1 [Pt(NH3)6]Cl4 2 [Pt(NH3)5Cl]Cl3 3 [Pt(NH3)4Cl2]Cl2
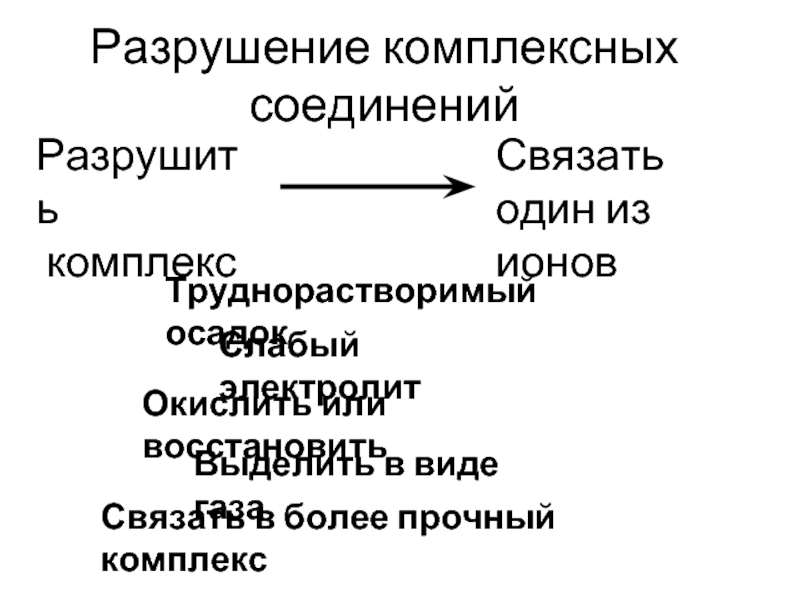
- 58. Разрушение комплексных соединений Труднорастворимый осадок Слабый электролит
- 59. [Ag (NH3)2]+↔ Ag+ + 2 NH3 Кн = 9,3 ·10-8
- 60. [Ag (NH3)2]++ KI =AgI↓+ NH3 +K+
- 61. [Ag (NH3)2]+↔ Ag+ + 2 NH3
- 62. 2. При действии сильных кислот происходит разрушение гидроксокомплексов,
- 63. 3. Нагревание (термолиз) всех аммиакатов приводит к их разложению, например: [Cu(NH3)4]SO4 → CuSO4 + 4NH3
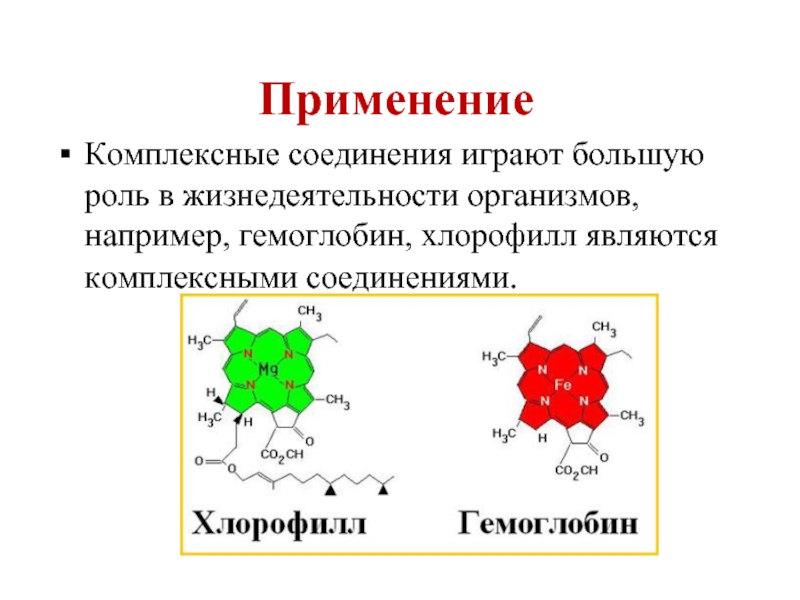
- 64. Применение Комплексные соединения играют большую роль в
- 65. Комплексные соединения используются для извлечения металлов из
- 66. Для получения чистых железа, никеля, кобальта используют
- 67. K4[Fe(CN)6] - желтая кровяная соль, содержащий ион
- 68. K3[Fe(CN)6] - красная кровяная соль является реактивом
- 69. Комплексные цианиды серебра K[Ag(CN)2] применяют для гальванического
- 70. Таким образом, с использованием комплексных соединений
- 73. Задание Определите структуру молекул, дайте название
Слайд 2Комплексные соединения
(координационные соединения) – сложные химические вещества, в составе которых
Слайд 3 Двойная соль или комплексное соединение?
KCr(SO4)2∙ 12H2O – хромокалиевые квасцы
KCr(SO4)2∙ 12H2O
= K+ + Cr3+ + 2SO42- + 12H2O
Fe(CN)3.3KCN = 3K+ + Fe3+ + 6CN-
Красная кровяная соль
не определяются в растворе
Слайд 4Теорию комплексных соединений –(координационную теорию), разработал в 1893 г. швейцарский химик
Его научная деятельность проходила в Цюрихском университете. Ученый синтезировал много новых комплексных соединений, систематизировал ранее известные и вновь полученные комплексные соединения и разработал экспериментальные методы доказательства их строения.
Слайд 5Положения координационной теории Вернера
в центре комплексного соединения находится центральный ион
Ионами –коплексообразователями являются катионы металлов, а также некоторые неметаллы, например В, Р, Si.
Наибольшую склонность к комплексо-образованию проявляют ионы d-элементов.
Слайд 6Вокруг центрального атома (иона-комплексообразователя) находятся противоположно заряженные ионы или нейтральные молекулы,
Ион-комплексообразователь и лиганды cоставляют внутреннюю сферу комплекса, которую обозначают квадратными скобками.
Число сигма - связей, которые образует центральный атом с лигандами, называется координационным числом (к.ч.).
Слайд 7Природа химической связи
в комплексных соединениях
Во внутренней сфере между комплексообразователем
Роль донора (поставщика электронов) играет лиганд, а акцептором, принимающим электроны, является комплексообразователь.
Донорно-акцепторная связь возникает как результат перекрывания свободных валентных орбиталей комплексообразователя с заполненными орбиталями донора.
Между внешней и внутренней сферой существует ионная связь.
Слайд 8Электронное строение атома бериллия Be
Электронное строение атома Be в возбужденном состоянии
Электронное
Пунктирными стрелками показаны электроны фтора; две связи из четырех образованы по донорно-акцепторному механизму. В данном случае атом Be является акцептором, а ионы фтора – донорами.
Слайд 10Донорно-акцепторный механизм:
лиганд предоставляет электронную пару (основание Льюиса), а центральный
Координационные (комплексные) соединения характерны прежде всего для d- элементов (а также f – элементов) – есть вакантные орбитали металла и они способны принимать электронную пару от лиганда.
Слайд 11Строение комплексного соединения
K3 [Fe(CN)6]
Ион-
Комплексо-
образователь
Лиганды
Координационное
число
Внутренняя сфера
Внешняя
сфера
[Cu(NH3)4]Cl2
Внутренняя сфера
Внешняя
сфера
Слайд 13Заряд комплексного иона равен алгебраической сумме зарядов иона-комплексообразователя и лигандов.
[Cu(NH3)4] SO4
комплексный ион
Слайд 14ЦЕНТРАЛЬНЫЙ АТОМ (ц. а.)
(ион-комплексообразователь)
Чаще всего центральными атомами являются ионы металлов d-элементов:
В состав некоторых комплексных соединений могут входить и ионы щелочных и щелочно-земельных металлов (Na, Ca, Mg).
Слайд 15Координационное число (к. ч.)
Координационное число (к. ч.) не является неизменной величиной.
Даже для одних и тех же комплексообразователей и лигандов координационное число зависит от:
заряда ц. а.
размера ц.а.
агрегатного состояния вещества, от концентрации, температуры.
Слайд 17чаще всего кч устойчивого комплекса в два раза больше степени окисления
КЧ = 2Z
Эмпирическое правило:
Слайд 20ЛИГАНДЫ
Лигандами могут быть:
нейтральные молекулы H2O, NH3, CO,
карбамида (NH2)2CO,
этилендиамина NH2CH2CH2NH2,
α-аминоуксусной
этилендиаминтетрауксусной кислоты (ЭДТА).
- ионы (CN-, F-, Cl-, Br-, I-, NO2-, OH-, C2O42-, CO32- )
Слайд 21Дентатность лиганда определяется числом координационных мест, занимаемых лигандом в координационной сфере комплексообразователя.
Различают монодентатные лиганды, занимающие во внутренней сфере одно место, бидентатные лиганды, занимающие два места, и полидентатные лиганды, занимающие несколько мест.
Слайд 22К числу монодентатных лигандов относятся все галогенид-ионы,
цианид-ион, аммиак, вода и
Слайд 23-монодентатные лиганды, содержат 1 донорный атом (H2 O, NH3, OH-, Cl-,
Лат. dentalus – имеющий зубы
Слайд 24Полидентатные лиганды (dens, р. пад. dentis – лат. зуб)– содержат несколько
Полидентатные лиганды часто образуют хелаты (от греч. «клешня») – комплексы, в которых лиганд и центральный атом образуют цикл.
Этилендиаминтераацетато (edta)-лиганд
Этилендиамин (en) - лиганд
Слайд 25-бидентатные лиганды, содержат 2 донорных атома и занимают два координационных места:
O O - S O O -
Слайд 26Существует целый ряд лигандов, которые в комплексах являются практически всегда бидентатными.
Это этилендиамин, карбонат-ион, оксалат-ион и др. Каждая молекула или ион бидентатного лиганда образует с комплексообразователем две химические связи в соответствии с особенностями своего строения:
Слайд 27ЛИГАНДЫ
Амбидентатные лиганды – содержат несколько различных донорных атомов
Роданид анион SCN-: если
Цианид ион CN-: если донорный атом C – циано-лиганд, если донорный атом N – изоциано-лиганд.
нитро-лиганд
нитрито-лиганд
Слайд 28Примером гексадентатного лиганда может служить анион этилендиаминтетрауксусной кислоты (ЭДТА):
Слайд 32[Cu(NH3)4]SO4
Na3[Co(NO2)6]
[Pt(NH3)2Cl2]
[Cr(H2O)2(NH3)3 Cl]Br2
Сульфат тетраамминмеди (II)
Гексанитрокобальтат (III) натрия
Дихлородиамминплатина
Бромид хлородиакватриамминхрома (III)
Слайд 33По природе лиганда
1) Аммиакаты — комплексы, в которых лигандами служат молекулы аммиака, например:
[Cu(NH3)4]SO4,
2) Аквакомплексы — комплексы, в которых лигандом выступает вода:
[Co(H2O)6]Cl2, [Al(H2O)6]Cl3 и др.
3) Карбонилы — комплексные соединения, в которых лигандами являются молекулы оксида углерода(II):
[Fe(CO)5], [Ni(CO)4].
Слайд 344) Ацидокомплексы — комплексы, в которых лигандами являются кислотные остатки.
K2[PtCl4], H2[CoCl4], H2[SiF6].
5) Гидроксокомплексы — комплексы, в
Na2[Zn(OH)4], Na2[Sn(OH)6] и др.
6) Смешанные комплексы включают в себя различные лиганды. Например:
[Pt(NH3)2Cl2], (NH4)2[Co2(C2O4)2(OH)2]
Слайд 357) Циклические (хелатные) комплексы содержат полидентантный лиганд, который захватывает центральный ион
Слайд 368) Внутрикомплексные соединения – комплексы, в которых полидентантный лиганд образует с
Лиганд NH2CH2COO- (глицинат-ион) относят к категории бидентатных лигандов, образующих две химические связи с комплексообразователем – через атом кислорода карбоксильной группы и через атом азота аминогруппы.
Слайд 37Номенклатура
Основы современной номенклатуры комплексных соединений были заложены Альфредом Вернером. До его
красная кровяная соль желтая кровяная соль
K3[Fe(CN)6] K4[Fe(CN)6]
Слайд 39Номенклатура комплексных соединений
K3 [Fe(CN)6]
Гексацианоферрат(III) калия
[Cu(NH3)4]Cl2
Хлорид тетраамминмеди(II)
+3
+2
Порядок перечисления лигандов:
Анионные: H-, O2-, OH-,
органические в алфавитном порядке
Нейтральные: NH3, H2O и т.д.
Катионные: N2H5+ и т.д.
H2O – аква
NH3 – аммин
Cl- – хлоро-
NO2- - нитро
CN- - циано-
SCN- - родано-
1 – моно
2 – ди
3 – три
4 – тетра
5 – пента
6 – гекса
Слайд 40Соль содержит комплексный катион
[Cо(NH3)4Cl2]Cl
хлорид дихлоротетраамминкобальта (III)
-называют анион соли (хлорид);
-называют
-называют лиганды, представляющие собой нейтральные молекулы (аммин), указывая их количество (4-тетра);
-называют центральный ион в русской транскрипции в родительном падеже (кобальта)
- указывают в скобках заряд иона-комплексообразователя римскими цифрами (III)
Слайд 41 Соль содержит комплексный анион
K4[Fe(CN)6]
гексацианоферрат (II) калия
-называют лиганды-анионы с окончанием
-называют комплексообразователь, используя латинское название элемента с прибавлением суффикса «ат» (феррат);
-указывают в скобках заряд иона-комплексообразователя римскими цифрами (II);
-называют катион внешней сферы в родительном падеже (калия)
Слайд 42Нейтральный комплекс
[Co2(CO)8]
октакарбонилдикобальт
[Сo(NH3)3 (NO2)2Cl]
хлородинитритотриамминкобальт
-названия комплексов без внешней сферы состоят из одного слова;
-указывается
-называют центральный атом в именительном падеже (в случае многоядерных комплексов – с указанием числа центральных атомов).
Слайд 43Упражнение 1
Первое основание Рейзе [Pt(NH3)4](OH)2
Соль Чугаева [Pt(NH3)5Cl]Cl3
Соль Цейзе K[PtCl3C2H4]
Пурпуреосоль
Кроцеосоль [Co(NH3)4(NO2)2]Cl
Слайд 44Упражнение 2
Гексанитрокобальтат(III) натрия
Na3[Co(NO2)6]
Гидроксид диаммминсеребра(I)
[Ag(NH3)2]OH реактив Толленса
Тетраиодомеркурат(II) калия
K2[HgI4]
Тетрароданомеркурат(II) аммония
(NH4)2[Hg(SCN)4]
Слайд 46Химические свойства
Комплексные соединения можно условно разделить на две большие группы: электролиты и неэлектролиты.
К неэлектролитам относят нейтральные комплексы.
1. Отщепление ионов внешней сферы
Комплексы, имеющие ионную внешнюю сферу, в растворе подвергаются диссоциации на комплексный ион и ионы внешней сферы и ведут себя в разбавленных растворах как сильные электролиты.
[Cu(NH3)4]SO4 = [Cu(NH3)4]2+ + SO42-
K3[Fe(CN)6] = 3K+ + [Fe(CN)6]3-
Слайд 47Комплексные соединения в растворах
Первичная диссоциация комплексных соединений
K3[Fe(CN)6] = 3K+ + [Fe(CN)6]3-
[Cu(NH3)4]SO4
[Ag(NH3)2]Cl = [Ag(NH3)2]+ + Cl-
Слайд 48Если во внешней сфере комплексного соединения находятся гидроксид-ионы, то это соединение
Пример соединения этого типа – гидроксид тетраамминцинка (II):
[Zn(NH3)4](OH)2 = [Zn(NH3)4]2+ + 2OH-
Комплексные соединения с внешнесферными катионами водорода, например, тетрафторобората водорода в водном растворе нацело подвергаются протолизу. Они являются сильными кислотами:
H[BF4] + H2O = [BF4]- + H3O+
Слайд 49 2. Обратимая диссоциация комплексов.
Комплексные ионы подвергаются обратимой электролитической диссоциации как слабые электролиты.
[Ag(NH3)2]Cl → [Ag(NH3)2]+ + Cl–
(первичная диссоциация)
[Ag(NH3)2]+ ↔
(вторичная диссоциация)
Вторичная диссоциация подчиняется закону действия масс и характеризуется соответствующей константой равновесия, которая называется константой нестойкости комплексного иона:
Слайд 50Вторичная диссоциация комплексов
[Ag(NH3)2]+ [Ag(NH3)]+ + NH3
[Ag(NH3)]+ Ag+
[Ag+] [NH3]2
KH = = 9,3.10-8
[ [Ag(NH3)2]+ ]
Диссоциация комплексов (или реакции обмена лигандов на молекулы растворителя) количественно характеризуется константами нестойкости комплексов Kн .
[Ag(NH3)2]+ Ag+ + 2NH3
Слайд 53[Fe(CN)6 ] 4- ↔ Fe2+ +6(CN)-
вторичная диссоциация
Константа нестойкости (Кн):
Kн = 1ּ10-31
(очень
Слайд 56Вернер подтверждает Вернера
1893-4 гг. не были периодом
утверждения теории.
Вернер 20
не оставлял лаборатории
Для установления состава соединений
Вернер использовал:
Химический метод
Измерение электропроводности
Химический метод
При действии AgNO3
на 1 моль CrCl3. 6NH3 → осаждается 3 моль Cl-
[Cr(NH3)6]Cl3
на 1 моль CrCl3. 5NH3 → осаждается 2 моль Cl-
[Cr(NH3)5Cl]Cl2
на 1 моль CrCl3. 4NH3 → осаждается 1 моль Cl-
[Cr(NH3)4Cl2]Cl
Слайд 57Ряды Вернера - Миолати
1 [Pt(NH3)6]Cl4
2 [Pt(NH3)5Cl]Cl3
3 [Pt(NH3)4Cl2]Cl2
4 [Pt(NH3)3Cl3]Cl
5 [Pt(NH3)2Cl4]
6 K[Pt(NH3)Cl5]
7 K2[PtCl6]
Диаграмма молярной электропроводности соединений
μ, Ом-1.см2.моль-1
В 1893 г.
измерения молярной электропроводности установили
закономерности ее изменения в ряду комплексных соединений.
В основе метода – способность электролитов проводить эл. ток
в зависимости от наличия свободных ионов в растворе
Слайд 58Разрушение комплексных соединений
Труднорастворимый осадок
Слабый электролит
Окислить или восстановить
Выделить в виде газа
Связать в
Слайд 60[Ag (NH3)2]++ KI =AgI↓+ NH3 +K+
[Ag (NH3)2]++2CN- = [Ag(CN)2]- +2NH3
Кн = 8·10-22
Слайд 622. При действии сильных кислот происходит разрушение гидроксокомплексов, например:
а) при недостатке кислоты
Na3[Al(OH)6]
б) при избытке кислоты
Na3[Al(OH)6] + 6HCl = 3NaCl + AlCl3 + 6H2O
Слайд 633. Нагревание (термолиз) всех аммиакатов приводит к их разложению, например:
[Cu(NH3)4]SO4 → CuSO4 + 4NH3
Слайд 64Применение
Комплексные соединения играют большую роль в жизнедеятельности организмов, например, гемоглобин, хлорофилл
Слайд 65Комплексные соединения используются для извлечения металлов из руд. Например, для отделения
4Au + O2 + 8NaCN + 2H2O = 4Na[Au(CN)2] + 4NaOH
Из полученного раствора золото выделяют действием цинковых стружек:
2Na[Au(CN)2] + Zn = Na2[Zn(CN)4] + 2Au
Слайд 66Для получения чистых железа, никеля, кобальта используют термическое разложение карбонилов металлов.
[Fe(CO)5] (ж) →Fe(т) + 5CO(г)
Слайд 67K4[Fe(CN)6] - желтая кровяная соль, содержащий ион железа Fe2+, является реактивом
4Fe3+ + 3[Fe(CN)6]4- = Fe4[Fe(CN)6]3
берлинская лазурь
Fe4[Fe(CN)6]3 гексацианоферрат (II) железа (III) используется как краситель.
Слайд 68K3[Fe(CN)6] - красная кровяная соль является реактивом на обнаружение ионов Fe2+ в
3Fe2+ + 2[Fe(CN)6]3- = Fe3[Fe(CN)6]2
турнбуллева синь
Fe3[Fe(CN)6]2 гексацианоферрат (III) железа (II)
Слайд 69Комплексные цианиды серебра K[Ag(CN)2] применяют для гальванического серебрения, так как при
В машиностроительной технологии широко используют K2[Ni(CN)4], из которого электролизом хорошо осаждается никель (процесс никелирования).
Многие КС обладают каталитической активностью, поэтому их широко используют в неорганическом и органическом синтезах.
Слайд 70
Таким образом, с использованием комплексных соединений связана возможность получения многообразных химических
Слайд 71
[Ag(NH3)2]OH – гидроксид диамминсеребра (I)
[Ag(NH3)2]OH → [Ag(NH3)2]+ + OH–
[Ag(NH3)2]+ ↔ Ag+ + 2 NH3
Слайд 72
Na[Al(OH)4] – тетрагидроксоалюминат натрия
Na[Al(OH)4] →Na+ + [Al(OH)4]–
[Al(OH)4]– ↔ Al 3+ + 4 OH–
Слайд 73Задание
Определите структуру молекул, дайте название комплексу, запишите уравнения первичной и
[Cu(NH3)4]SO4
Na2[Zn(OH)4]
[Cu(NH3)4]Cl2
[Co(NH3)3H2OCl2]NO3
Li[AlH4]
(NH4)2[PtCl4(OH)2]







![Механизм образования комплексного иона[Al(OH)4]-](/img/tmb/2/135412/336a5adf84b6d7ad1ea3f10109d1233a-800x.jpg)

![Строение комплексного соединенияK3 [Fe(CN)6]Ион-Комплексо-образовательЛигандыКоординационное числоВнутренняя сфераВнешняя сфера[Cu(NH3)4]Cl2Внутренняя сфераВнешняя сфера](/img/tmb/2/135412/2f52f56025d7e9b089cd2adab78b3e5b-800x.jpg)





![Na[BF4] Na3[AlF6]rB3+ = 0,02 нмrAl3+ = 0,057 нм](/img/tmb/2/135412/1b10c38ac1981dfbfae08db9f24f8331-800x.jpg)
![Na3[AlF6] Na [AlCl4] Al3+rF_ = 0,133 нмrCl- = 0,181 нм](/img/tmb/2/135412/b43b852367a43a4646b0cc1a666775e0-800x.jpg)



![[Cu(NH3)4]SO4 Na3[Co(NO2)6] [Co(NH3)4Cl2]Cl [Pt(NH3)2Cl2] [Fe(CO)5]](/img/tmb/2/135412/30d189b827157c60abfe77ba0f288368-800x.jpg)
![[Cu(NH3)4]SO4Na3[Co(NO2)6] [Pt(NH3)2Cl2] [Cr(H2O)2(NH3)3 Cl]Br2Сульфат тетраамминмеди (II)Гексанитрокобальтат (III) натрияДихлородиамминплатинаБромид хлородиакватриамминхрома (III)](/img/tmb/2/135412/cf81b02dc9231387cefe47271e76a123-800x.jpg)
![По природе лиганда1) Аммиакаты — комплексы, в которых лигандами служат молекулы аммиака, например: [Cu(NH3)4]SO4, [Co(NH3)6]Cl3, [Pt(NH3)6]Cl4 и др.2) Аквакомплексы — комплексы,](/img/tmb/2/135412/54453a5f34a42bab58443709d32b631a-800x.jpg)
![4) Ацидокомплексы — комплексы, в которых лигандами являются кислотные остатки.K2[PtCl4], H2[CoCl4], H2[SiF6].5) Гидроксокомплексы — комплексы, в которых в качестве лигандов](/img/tmb/2/135412/5663b60d6070d3f4bb32a1a08685b2a9-800x.jpg)


![Номенклатура комплексных соединенийK3 [Fe(CN)6]Гексацианоферрат(III) калия[Cu(NH3)4]Cl2Хлорид тетраамминмеди(II)+3+2Порядок перечисления лигандов:Анионные: H-, O2-, OH-, простые анионы, многоатомные анионы,](/img/tmb/2/135412/a4f1c65438199ec918d0aa443799a6dd-800x.jpg)
![Соль содержит комплексный катион[Cо(NH3)4Cl2]Cl хлорид дихлоротетраамминкобальта (III)-называют анион соли (хлорид);-называют входящие во внутреннюю сферу лиганды-анионы](/img/tmb/2/135412/8ae72a260009a5561e67c73b8302be70-800x.jpg)
![Соль содержит комплексный анионK4[Fe(CN)6] гексацианоферрат (II) калия-называют лиганды-анионы с окончанием на «о» с указанием](/img/tmb/2/135412/fc3380f2ea593249a95e3b6248f3f0cf-800x.jpg)
![Нейтральный комплекс[Co2(CO)8] октакарбонилдикобальт[Сo(NH3)3 (NO2)2Cl] хлородинитритотриамминкобальт-названия комплексов без внешней сферы состоят из одного слова;-указывается число и названия лигандов](/img/tmb/2/135412/292177882845e217d4f44145ff02c6de-800x.jpg)
2Соль Чугаева [Pt(NH3)5Cl]Cl3Соль Цейзе K[PtCl3C2H4]Пурпуреосоль [Co(NH3)5Cl]Cl2 Кроцеосоль [Co(NH3)4(NO2)2]Cl](/img/tmb/2/135412/d1ebc05d3730678528e41f3200cab335-800x.jpg)
![Упражнение 2Гексанитрокобальтат(III) натрия Na3[Co(NO2)6]Гидроксид диаммминсеребра(I) [Ag(NH3)2]OH реактив ТолленсаТетраиодомеркурат(II) калия K2[HgI4] реактив НесслераТетрароданомеркурат(II) аммония (NH4)2[Hg(SCN)4]](/img/tmb/2/135412/99c2da1fd5e5f6296ce8e461edbc5118-800x.jpg)


![Комплексные соединения в растворахПервичная диссоциация комплексных соединенийK3[Fe(CN)6] = 3K+ + [Fe(CN)6]3-[Cu(NH3)4]SO4 = [Cu(NH3)4]2+ + SO42-[Ag(NH3)2]Cl](/img/tmb/2/135412/deda75a44d5e6c70653b172b936517d5-800x.jpg)

![2. Обратимая диссоциация комплексов.Комплексные ионы подвергаются обратимой электролитической диссоциации как слабые электролиты.[Ag(NH3)2]Cl → [Ag(NH3)2]+ + Cl– (первичная диссоциация)[Ag(NH3)2]+ ↔ Ag+ + 2 NH3 (вторичная диссоциация)Вторичная](/img/tmb/2/135412/bb8f140655b080317764502b7c6a9fbd-800x.jpg)
![Вторичная диссоциация комплексов[Ag(NH3)2]+ [Ag(NH3)]+ + NH3[Ag(NH3)]+ Ag+ + NH3 [Ag+]](/img/tmb/2/135412/db8ddb2a297cb25bcd38e36dda40511b-800x.jpg)
![K4 [Fe(CN)6]](/img/tmb/2/135412/5c3baed99b86f0db3846ef432fce3a7f-800x.jpg)
![K4 [Fe(CN)6]→ 4 K+ + [Fe(CN)6 ] 4- первичная диссоциация](/img/tmb/2/135412/dabefe16d28a1ad4a15f5d1e6fef8c0b-800x.jpg)
![[Fe(CN)6 ] 4- ↔ Fe2+ +6(CN)- вторичная диссоциацияКонстанта нестойкости (Кн):Kн = 1ּ10-31 (очень прочный комплекс)](/img/tmb/2/135412/1a085298a72d52bfd69f00efde200561-800x.jpg)
![[Ni(NH3)6]2+ Кн = 2*10-9 (непрочный комплекс)Куст.=1/ Кн](/img/tmb/2/135412/44a492d26edfe78eefcb6f2b88e9ba91-800x.jpg)


![Ряды Вернера - Миолати1 [Pt(NH3)6]Cl42 [Pt(NH3)5Cl]Cl33 [Pt(NH3)4Cl2]Cl24 [Pt(NH3)3Cl3]Cl5 [Pt(NH3)2Cl4]6 K[Pt(NH3)Cl5]7 K2[PtCl6]Диаграмма молярной электропроводности соединений μ, Ом-1.см2.моль-1В 1893 г. А.Вернер совместно с А.](/img/tmb/2/135412/14498c3576aea56d49a3a463e4e669ef-800x.jpg)
![[Ag (NH3)2]+↔ Ag+ + 2 NH3 Кн = 9,3 ·10-8](/img/tmb/2/135412/0ca3d08d024e90fd38126d35f301d57f-800x.jpg)
![[Ag (NH3)2]++ KI =AgI↓+ NH3 +K+ ПРAgI = 1,5·10 -16](/img/tmb/2/135412/5fec94b50fa3c8a29e6f46969d036d50-800x.jpg)
![[Ag (NH3)2]+↔ Ag+ + 2 NH3](/img/tmb/2/135412/1ad515869437cc14ce15e48a66ffb0e2-800x.jpg)
![2. При действии сильных кислот происходит разрушение гидроксокомплексов, например:а) при недостатке кислотыNa3[Al(OH)6] + 3HCl = 3NaCl](/img/tmb/2/135412/a4e1cbef301db0f3459742095853ea89-800x.jpg)
![3. Нагревание (термолиз) всех аммиакатов приводит к их разложению, например:[Cu(NH3)4]SO4 → CuSO4 + 4NH3](/img/tmb/2/135412/2e0ea886c80e894868f2584a75fc838b-800x.jpg)


![K4[Fe(CN)6] - желтая кровяная соль, содержащий ион железа Fe2+, является реактивом на ионы железа Fe3+ в](/img/tmb/2/135412/648a8f356013e2d31b68f883310a1260-800x.jpg)
![K3[Fe(CN)6] - красная кровяная соль является реактивом на обнаружение ионов Fe2+ в растворе:3Fe2+ + 2[Fe(CN)6]3- = Fe3[Fe(CN)6]2](/img/tmb/2/135412/1d4f607e6aceeba71273c9c7fd3bafb2-800x.jpg)
![Комплексные цианиды серебра K[Ag(CN)2] применяют для гальванического серебрения, так как при электролизе растворов обычных солей](/img/tmb/2/135412/2ffe42da75cc589f06ad07cd2d1c5034-800x.jpg)

![[Ag(NH3)2]OH – гидроксид диамминсеребра (I)[Ag(NH3)2]OH → [Ag(NH3)2]+ + OH–[Ag(NH3)2]+ ↔ Ag+ + 2 NH3](/img/tmb/2/135412/2b9f371768fd49713824c0f13770a10f-800x.jpg)
![Na[Al(OH)4] – тетрагидроксоалюминат натрияNa[Al(OH)4] →Na+ + [Al(OH)4]–[Al(OH)4]– ↔ Al 3+ + 4 OH–](/img/tmb/2/135412/6b0bfe9ef34decd8215b6f41ea85c5d3-800x.jpg)
![Задание Определите структуру молекул, дайте название комплексу, запишите уравнения первичной и вторичной диссоциации, К нест.[Cu(NH3)4]SO4Na2[Zn(OH)4][Cu(NH3)4]Cl2[Co(NH3)3H2OCl2]NO3Li[AlH4](NH4)2[PtCl4(OH)2]](/img/tmb/2/135412/c30ffbd4e97ce9b3700c946db90e0dcf-800x.jpg)