- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Комплексные соединения презентация
Содержание
- 1. Комплексные соединения
- 2. Комплексное соединение - сложное соединение, образующееся при
- 3. [Cu(NH3)4]SO4 Na[Al(OH)4] NaOH Al(OH)3
- 4. Комплексными соединениями, или просто комплексами, называют соединения,
- 5. [Co(NH3)6]3+ - комплекс [Co(NH3)6]Cl3 – комплексное соединение
- 6. Основные положения координационной теории Комплексообразователь (центральный катион)
- 7. Вокруг комплексообразователя расположены лиганды – частицы, обладающие
- 8. Основные положения координационной теории Координационное число –
- 9. Основные положения координационной теории Комплексообразователь и лиганды составляют внутреннюю сферу комплекса. 4. [Cu(NH3)4]+2
- 10. СТРОЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ N H
- 11. [N-3H+14]Cl-1 КОМПЛЕКСНЫЙ ИОН [NH4]+ ВНУТРЕННЯЯ СФЕРА: КОМПЛЕКСООБРАЗОВАТЕЛЬ N-3 ЛИГАНДЫ H+ ВНЕШНЯЯ СФЕРА АНИОН Cl-
- 12. Строение комплексного соединения K3 [Fe(CN)6] Ион-комплексообразователь (центральный
- 13. Лиганд – ион или нейтральная молекула, которые
- 14. Примеры лигандов Анионы бескислородных кислот F-, Cl-,
- 15. Донорный атом O OH- - гидроксо-лиганд O2-
- 16. (OH)- 4 [Zn+x Na+ (+1) + x
- 17. РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ: Na3[AlF6] Ответ:
- 18. Строение комплексных соединений Координационные соединения образованы металлами
- 19. Строение комплексных соединений Для образования прочных связей
- 20. Классификация комплексных соединений по заряду
- 21. Классификация По заряду комплекса [Cr(H2O)4]3+Cl3 [PtCl4(NH3)2] K2[PtCl6]2- [Cu(NH3)4]2+[PtCl4]2-
- 22. Классификация По составу внешней сферы H2[PtCl6] Na3[AlF6] [Pt(NH3)2Cl2] [Ag(NH3)2]OH
- 23. Классификация По виду лигандов [Fe(H2O)6]SO4 K[Au(CN)4] [Zn(NH3)4]Cl2 [CoCl(NH3)3(H2O)2](NO3)2
- 24. НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ 2- 4- 3- 5-
- 25. НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ НАЗВАНИЯ АНИОНОВ: Fe -
- 26. тетра гидроксо цинкат НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Na+2
- 27. НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Na3[AlF6] Na[Al(OH)4] K4[Fe(CN)6] Гексафтороалюминат натрия Тетрагидроксоалюминат натрия Гексационоферрат (II) калия
- 28. НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ [Cu(NH3)4]SO4 Сульфат тетраамминмеди (II) [Ag(NH3)2]Cl Хлорид диамминсеребра Хлорид гексааквахрома (III) [Cr(H2O)6]Cl3
- 29. Ответ: K2[PtCl6] Гексахлороплатинат (IV) калия Нитрат хлоронитротетраамминкобальта
- 30. ПОЛУЧЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Лабораторный опыт. Получение
- 31. Химические свойства комплексных соединений 1. В растворе
- 32. ХИМИЧЕСКИЕ СВОЙСТВА 2. Реакции по внешней
- 33. ХИМИЧЕСКИЕ СВОЙСТВА 3. Реакции с участием лигандов
- 34. 5. Нагревание (термолиз) всех аммиакатов приводит к их разложению, например: [Cu(NH3) 4]SO4 = CuSO4 + 4NH3 .
- 35. Они связывают катионы металлов в различные
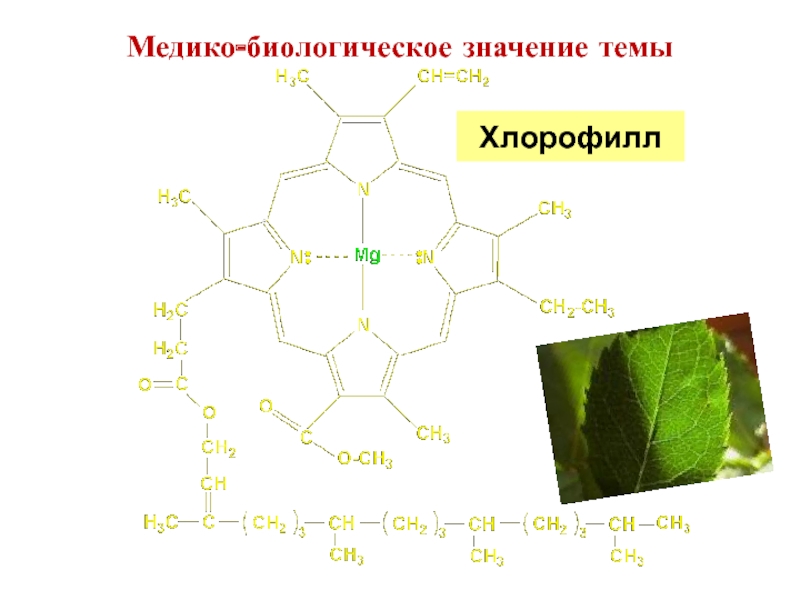
- 36. Хлорофилл Медико-биологическое значение темы
- 37. Гемоглобин крови (HHb), выполняющий функцию
- 38. В легких, где парциальное
- 39. Медико-биологическое значение темы
- 40. B12 (Co[C62H88N13O14P])CN B12 - это хелат Co3+ c порфирином Медико-биологическое значение темы
- 41. Медико-биологическое значение темы Цитохром
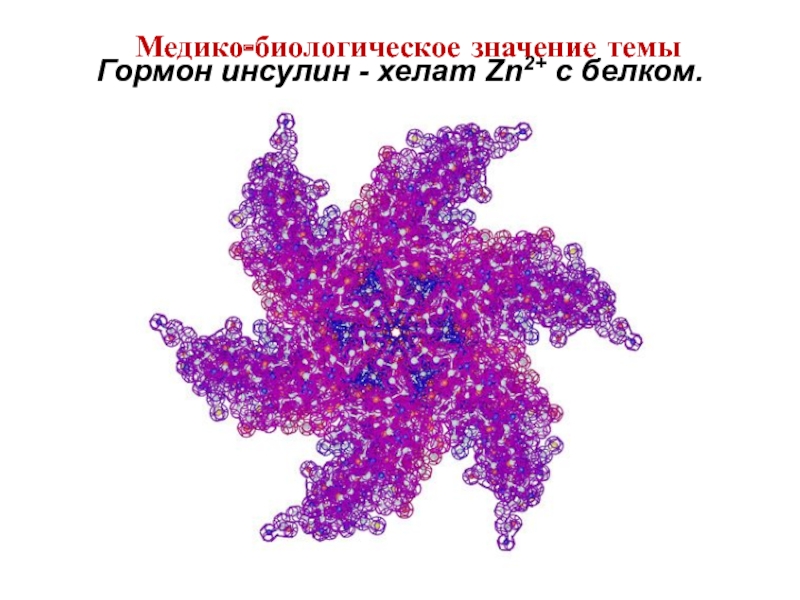
- 42. Гормон инсулин - хелат Zn2+ c белком. Медико-биологическое значение темы
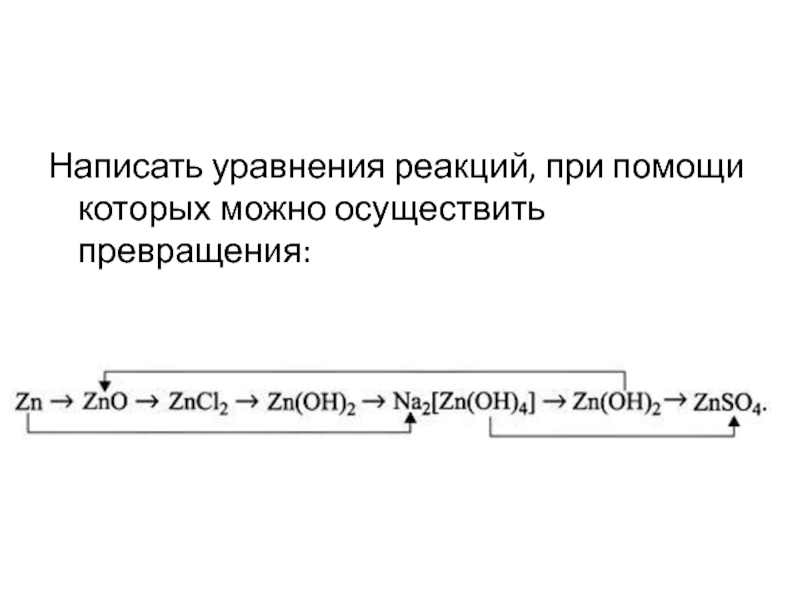
- 43. Написать уравнения реакций, при помощи которых можно осуществить превращения:
- 44. Лиганды
- 45. Полидентатные лиганды присоединяются
- 46. Хелаты. Комплексоны. Краун-эфиры Н-р, комплексон -I:
- 47. [Pt2+(Еn)2]2+ этилендиаминплатина (II) Хелаты. Комплексоны. Краун-эфиры
- 48. [Co3+(Еn)3]3+ этилендиаминкобальт(II) Хелаты. Комплексоны. Краун-эфиры
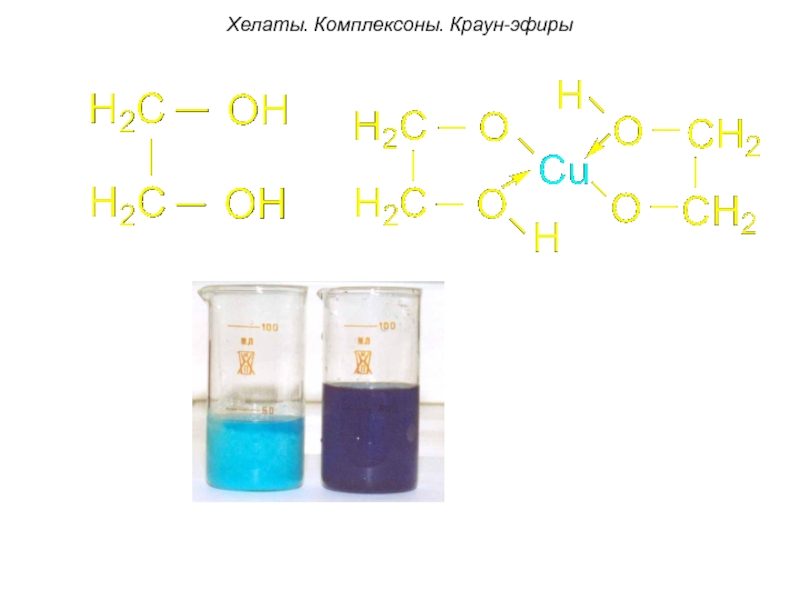
- 49. Хелаты. Комплексоны. Краун-эфиры Для удобства координации молекулы
- 50. Хелаты. Комплексоны. Краун-эфиры
- 51. Хелаты. Комплексоны. Краун-эфиры
- 52. Хелаты. Комплексоны. Краун-эфиры
- 53. Хелаты. Комплексоны. Краун-эфиры
- 54. Хелаты. Комплексоны. Краун-эфиры
- 55. Хелаты. Комплексоны. Краун-эфиры
- 56. Хелаты. Комплексоны. Краун-эфиры Например, краун-4 избирательно
- 57. СПАСИБО ЗА ВАШЕ ВНИМАНИЕ!
Слайд 2Комплексное соединение - сложное соединение, образующееся при взаимодействии более простых структурных
Слайд 4Комплексными соединениями, или просто комплексами, называют соединения, имеющие в своем составе
Слайд 5[Co(NH3)6]3+ - комплекс
[Co(NH3)6]Cl3 – комплексное соединение (соль).
[Fe(CO)5] – комплекс и комплексное
Комплекс означает центральный атом или ион металла, окруженный набором лигандов.
Слайд 6Основные положения координационной теории
Комплексообразователь (центральный катион) - катион металла, который обладает
Катионы:
металлов (d-элементов):
Сu+2, Co+3, Fe+3, Hg+2 и др.
(реже р-элементы): Al+3
(иногда неметаллы):В+3, Si+4.
1
K3 [Fe(CN)6]
+3
+
Слайд 7Вокруг комплексообразователя расположены лиганды – частицы, обладающие неподеленными электронными парами.
Основные положения
2.
Молекулы:
H2O, NH3,
Анионы:
CN-, OH-, Cl-, Br-, NO2-
..
..
..
Слайд 8Основные положения координационной теории
Координационное число – количество лигандов, которые может присоединять
3.
Координационное число – обычно в 2 раза больше, чем С.О. центрального иона.
+1 (2)
+2 (4, 6)
+3 (6, 4)
+4 (8, 6)
[Cu(NH3)4]+2
+2
Слайд 9Основные положения координационной теории
Комплексообразователь и лиганды составляют внутреннюю сферу
4.
[Cu(NH3)4]+2
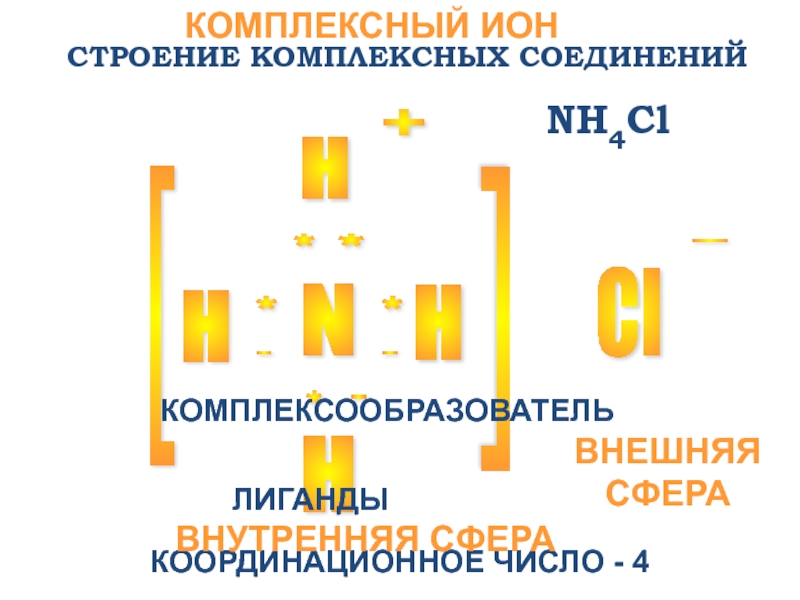
Слайд 10СТРОЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
N
H
H
H
Cl
+
-
[
[
*
*
*
*
*
.
.
.
NH4Cl
H
КОМПЛЕКСООБРАЗОВАТЕЛЬ
ЛИГАНДЫ
КООРДИНАЦИОННОЕ ЧИСЛО - 4
ВНУТРЕННЯЯ СФЕРА
ВНЕШНЯЯ СФЕРА
КОМПЛЕКСНЫЙ ИОН
Слайд 11[N-3H+14]Cl-1
КОМПЛЕКСНЫЙ ИОН
[NH4]+
ВНУТРЕННЯЯ СФЕРА:
КОМПЛЕКСООБРАЗОВАТЕЛЬ
N-3
ЛИГАНДЫ
H+
ВНЕШНЯЯ СФЕРА
АНИОН
Cl-
Слайд 12Строение комплексного соединения
K3 [Fe(CN)6]
Ион-комплексообразователь
(центральный атом)
Лиганды
Координационное
число
Внутренняя сфера
Внешняя
сфера
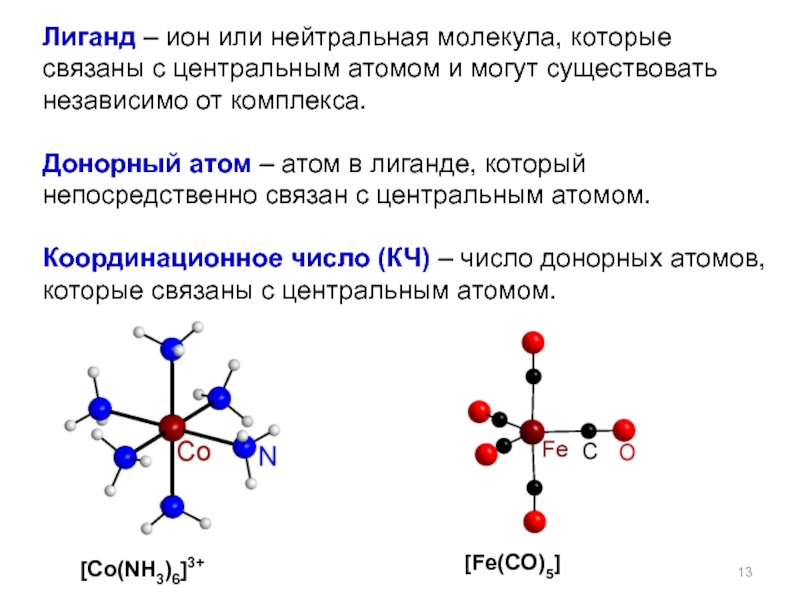
Слайд 13Лиганд – ион или нейтральная молекула, которые связаны с центральным атомом
Донорный атом – атом в лиганде, который непосредственно связан с центральным атомом.
Координационное число (КЧ) – число донорных атомов, которые связаны с центральным атомом.
[Co(NH3)6]3+
[Fe(CO)5]
Слайд 14Примеры лигандов
Анионы бескислородных кислот
F-, Cl-, Br-, I- (фторо-лиганд и т.д.)
Пример: K2[HgI4]
Донорный атом O
Остатки кислородсодержащих кислот
CH3COO- - ацетато-лиганд
CO32- - карбонато-лиганд
C2O42- - оксалато-лиганд
SO42- - сульфато-лиганд
Пример: K3[Fe(C2O4)3] –
триоксалатоферрат(III) калия
Слайд 15Донорный атом O
OH- - гидроксо-лиганд
O2- - оксо-лиганд
O22- - пероксо-лиганд
K2[Zn(OH)4] – тетрагидроксоцинкат(II)
Электоронейтральные молекулы с донорными атомами O: H2O – аква-лиганд
[Fe(H2O)6](ClO4)3 – перхлорат гексаакважелеза(III)
Слайд 17РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ:
Na3[AlF6]
Ответ: Na+3[Al+3F-6]
K[MgCl3]
Na[Al(OH)4]
Na4[Fe(CN)6]
Na3[Al(OH)6]
[Cu(NH3)4]Cl2
Ответ: Na+[Al+3(OH)-4]
Ответ: K+[Mg+2Cl-3]
Ответ:Na+4[Fe+2(CN)-6]
Ответ:Na+3[Al+3(OH)-6]
Ответ:[Cu+2(NH3)04]Cl-2
Слайд 18Строение комплексных соединений
Координационные соединения образованы металлами побочных подгрупп, имеющими, как правило,
Образование комплексного иона можно объяснить наличием у катионов d-металлов вакантных орбиталей на s-, p-, d- и f- подуровнях, которые принимают участие в донорно-акцепторном механизме образования связей в комплексных соединениях.
Co3+
Co0
4s
4р
3d
Слайд 19Строение комплексных соединений
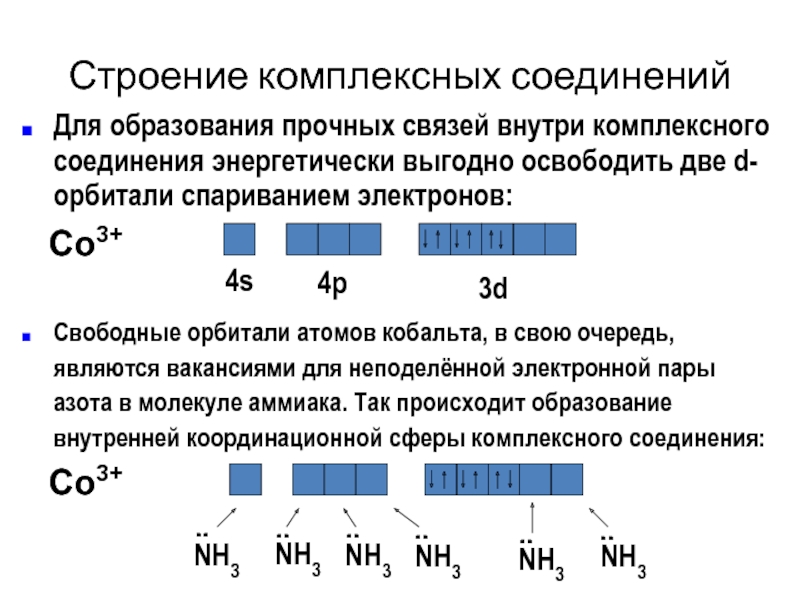
Для образования прочных связей внутри комплексного соединения энергетически выгодно
Co3+
Свободные орбитали атомов кобальта, в свою очередь, являются вакансиями для неподелённой электронной пары азота в молекуле аммиака. Так происходит образование внутренней координационной сферы комплексного соединения:
Co3+
Слайд 20Классификация комплексных соединений
по заряду комплекса
по виду лигандов
по составу внешней сферы
Слайд 21Классификация
По заряду комплекса
[Cr(H2O)4]3+Cl3
[PtCl4(NH3)2]
K2[PtCl6]2-
[Cu(NH3)4]2+[PtCl4]2-
Слайд 24НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
2-
4-
3-
5-
6-
ди-
три-
тетра-
пента-
гекса-
ЧИСЛИТЕЛЬНЫЕ:
НАЗВАНИЯ ЛИГАНДОВ:
H2O - аква
NH3 - амин
СO - карбонил
OН- -
(СN)- - циано
F-, Cl-, Br-, I- - фторо-, хлоро-, бромо-, йодо-
(NO3)- - нитро
Слайд 25НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
НАЗВАНИЯ АНИОНОВ:
Fe - феррат
Cu - купрат
Ag - аргентат
Au -
Hg - меркурат
Al - алюминат
Zn - цинкат
От латинского названия комплексообразователя с добавлением суффикса
-ат
Слайд 26тетра
гидроксо
цинкат
НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
Na+2
4]
(OH)-
[Zn+2
натрия
[Cr+3
(H2O)0
6]
Cl-3
хлорид
аква
гекса
xрома (III)
K+2
[Hg+2
I-
4]
тетра
йодо
меркурат (II)
калия
Слайд 27НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Na3[AlF6]
Na[Al(OH)4]
K4[Fe(CN)6]
Гексафтороалюминат натрия
Тетрагидроксоалюминат натрия
Гексационоферрат (II) калия
Слайд 28НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
[Cu(NH3)4]SO4
Сульфат тетраамминмеди (II)
[Ag(NH3)2]Cl
Хлорид диамминсеребра
Хлорид гексааквахрома (III)
[Cr(H2O)6]Cl3
Слайд 29Ответ: K2[PtCl6]
Гексахлороплатинат (IV) калия
Нитрат хлоронитротетраамминкобальта (III)
Гексагидроксохромат (III) натрия
СОСТАВЬТЕ ФОРМУЛЫ ВЕЩЕСТВ
Ответ: [Co(NH3)4(NO3)Cl]NO3
Ответ:
Нитрат гексаамминникеля (II)
Ответ: [Ni(NH3)6](NO3)2
Слайд 30ПОЛУЧЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
Лабораторный опыт.
Получение тетрагидроксоалюмината натрия
AlCl3+3NaOH = Al(OH)3↓+3NaCl
Al(OH)3 + NaOH
Лабораторный опыт.
Получение гидроксида тетраамминмеди (II)
CuCl2+2NH3 +2H2O = Cu(OH)2↓+NH4Cl
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
Слайд 31Химические свойства комплексных соединений
1. В растворе комплексные соединения ведут себя как
[Pt(NH3)4]Cl2 = [Pt(NH3)4] 2+ + 2Cl –,
K2[PtCl4] = 2K+ + [PtCl4] 2–
[Cu(NH3)4]SO4 ↔ [Cu(NH3)4]2+ + SO42-
Слайд 32ХИМИЧЕСКИЕ СВОЙСТВА
2. Реакции по внешней сфере
FeCl3+K4[Fe(CN)6]→KFe[Fe(CN)6]↓+3KCl
[Cu(NH3)4]SO4+BaCl2→
→[Cu(NH3)4]Cl2+BaSO4↓
Слайд 33ХИМИЧЕСКИЕ СВОЙСТВА
3. Реакции с участием лигандов
[Cu(NH3)4]SO4+4HCl→4NH4Cl+CuSO4
4. Реакции по центральному иону
Обменные:
[Ag(NH3)2]Cl +
Окислительно-восстановительные:
2[Ag(NH3)2]OH+R-C=O
H
→2Ag↓+RCOONH4+H2O+3NH3
Слайд 345. Нагревание (термолиз) всех аммиакатов приводит к их разложению, например:
[Cu(NH3) 4]SO4 = CuSO4 +
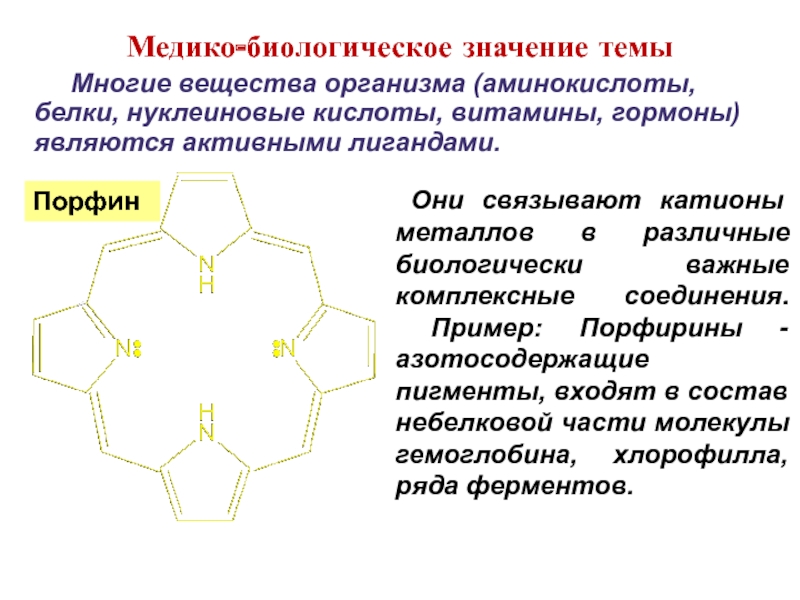
Слайд 35 Они связывают катионы металлов в различные биологически важные комплексные соединения.
Медико-биологическое значение темы
Порфин
Многие вещества организма (аминокислоты, белки, нуклеиновые кислоты, витамины, гормоны) являются активными лигандами.
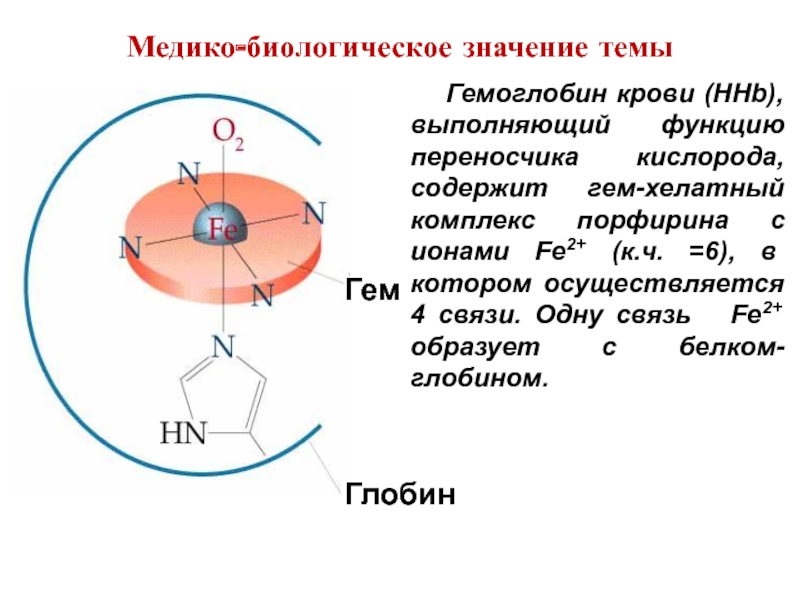
Слайд 37 Гемоглобин крови (HHb), выполняющий функцию переносчика кислорода, содержит гем-хелатный
Гем
Глобин
Медико-биологическое значение темы
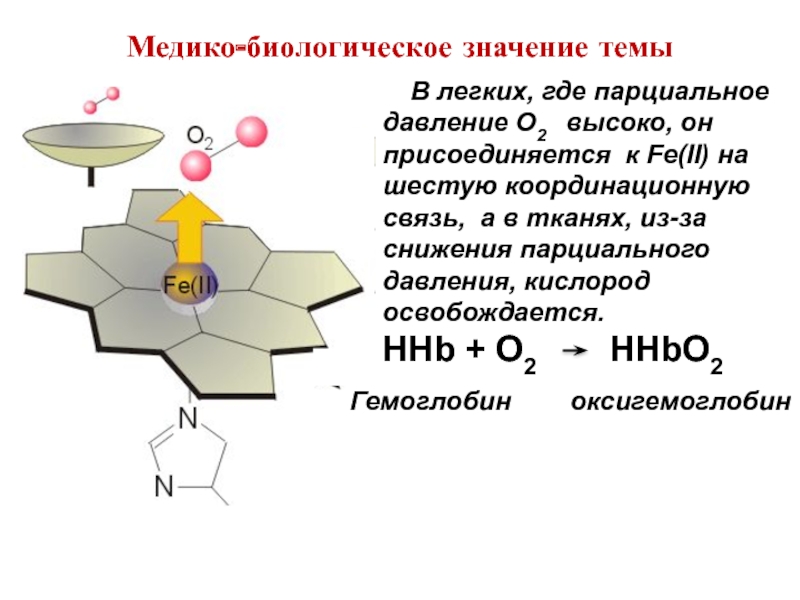
Слайд 38 В легких, где парциальное давление O2 высоко,
HHb + O2 HHbO2
Медико-биологическое значение темы
Гемоглобин оксигемоглобин
Слайд 39
Медико-биологическое значение темы
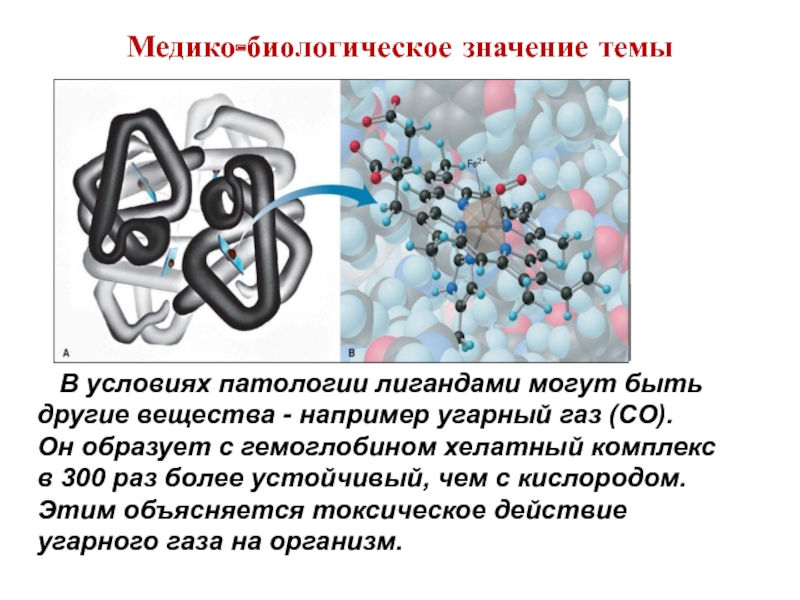
В условиях патологии лигандами могут быть другие
Он образует с гемоглобином хелатный комплекс в 300 раз более устойчивый, чем с кислородом. Этим объясняется токсическое действие угарного газа на организм.
Слайд 40
B12 (Co[C62H88N13O14P])CN
B12 - это хелат Co3+ c порфирином
Медико-биологическое значение темы
Слайд 41
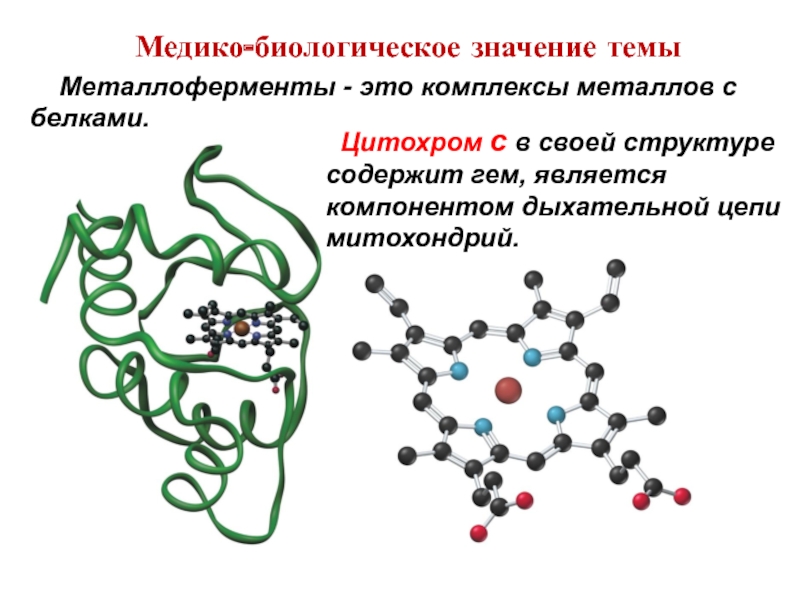
Медико-биологическое значение темы
Цитохром с в своей структуре содержит гем, является
Металлоферменты - это комплексы металлов с белками.
Слайд 44
Лиганды могут присоединяться к комплексообразователю посредством одного
лиганды обладают координационной емкостью - дентатностью.
Монодентатные лиганды присоединяются к комплексообразователю одним атомом и образуют одну координационную связь.
Например: H2O, NH3, Cl-, CN-, OH- и др.
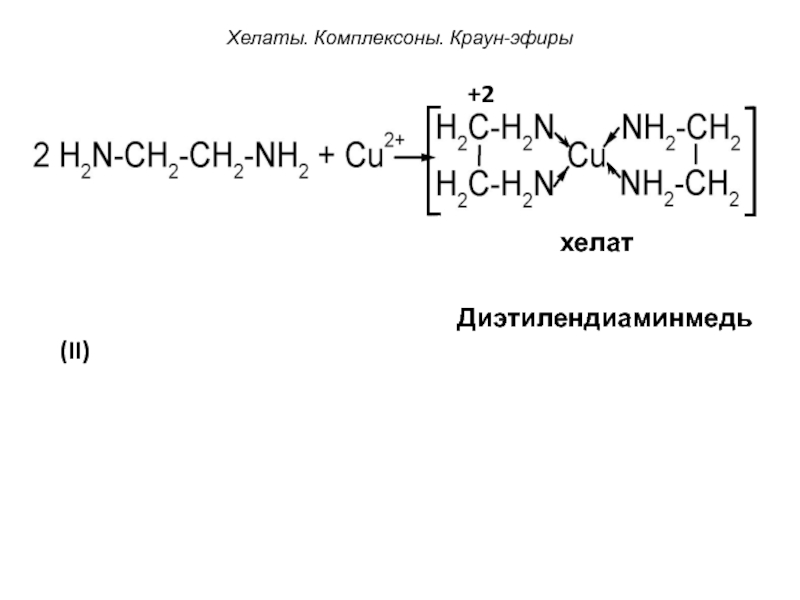
Хелаты. Комплексоны
Слайд 45 Полидентатные лиганды присоединяются к комплексообразователю посредством нескольких
Например: функциональные органические соединения.
Большое практическое значение имеют комплексоны – полидентатные лиганды, содержащие несколько функциональных групп и образующие прочные комплексы практически со всеми двухзарядными ионами металлов (Ca2+, Mg2+, Zn2+, Cu2+, Pt2+…).
Хелаты. Комплексоны. Краун-эфиры
Слайд 46Хелаты. Комплексоны. Краун-эфиры
Н-р, комплексон -I:
содержит два атома азота.
За счет электронных пар этих атомов этилендиамин присоединяется к комплексообразователю двумя координационными связями.
Этилендиамин
En
Слайд 49Хелаты. Комплексоны. Краун-эфиры
Для удобства координации молекулы
полидентатных лигандов сворачиваются в циклы.
таких комплексах комплексообразователь зажат
«клешней» лигандов.
Комплексы, содержащие полидентатные лиганды, называются хелатами (от греч. chelate - клешня).
Термин «хелат»,
1920 г. Морган и Дрю
Слайд 52
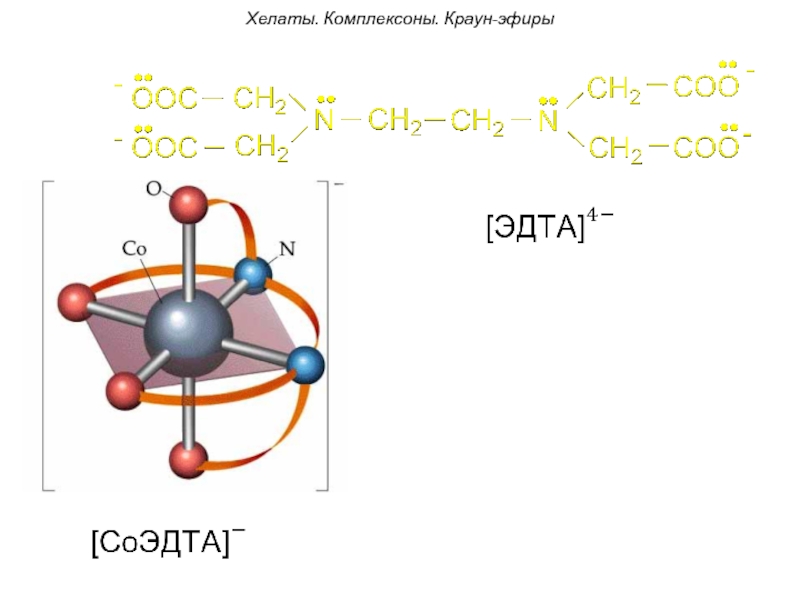
Хелаты. Комплексоны. Краун-эфиры
Обычно хелаты гораздо устойчивее комплексных
Наиболее известными комплексонами высшего порядка являются:
комплексон -II этилендиаминтетрауксусная кислота (ЭДТА)
комплексон- III двузамещенная натриевая соль ЭДТА - Трилон Б: Na2[H2Tr]
Слайд 54
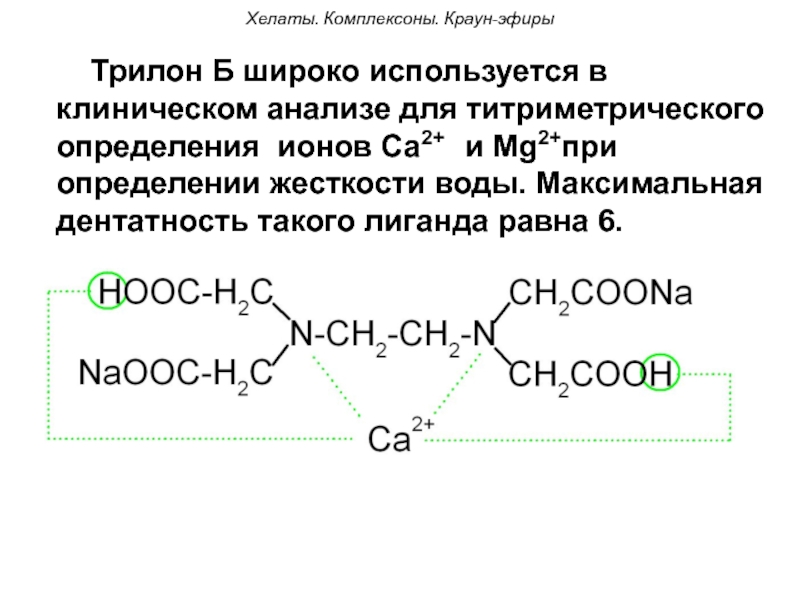
Хелаты. Комплексоны. Краун-эфиры
Трилон Б широко используется в клиническом
Слайд 55
Хелаты. Комплексоны. Краун-эфиры
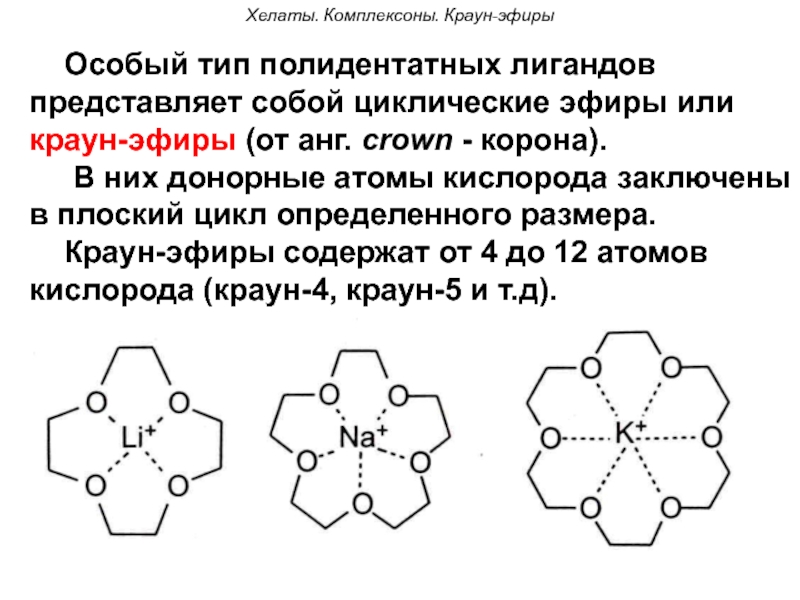
Особый тип полидентатных лигандов представляет собой циклические
В них донорные атомы кислорода заключены в плоский цикл определенного размера.
Краун-эфиры содержат от 4 до 12 атомов кислорода (краун-4, краун-5 и т.д).
Полости краун-эфиров имеют строго определенные размеры. Поэтому краун-эфиры могут избирательно связывать ионы металлов, размеры которых близки к размерам полости.
Слайд 56Хелаты. Комплексоны. Краун-эфиры
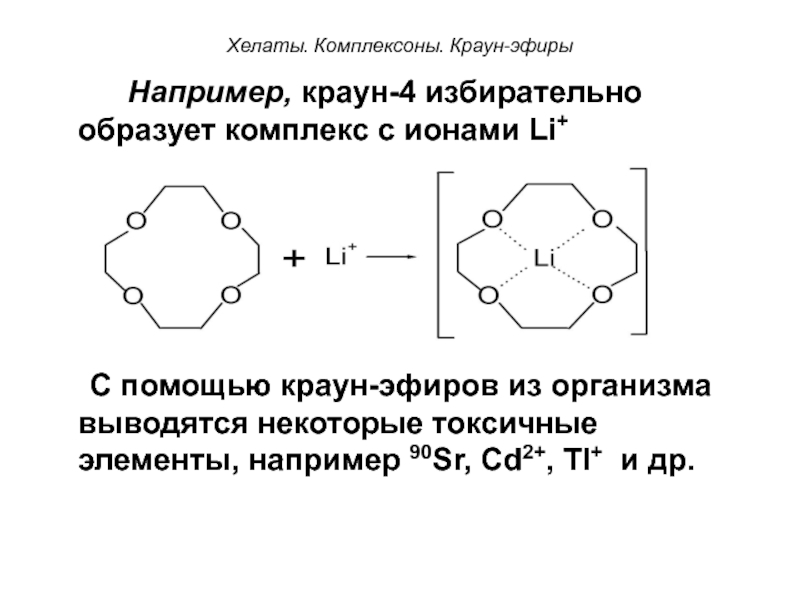
Например, краун-4 избирательно образует комплекс с ионами Li+
С помощью краун-эфиров из организма выводятся некоторые токсичные элементы, например 90Sr, Cd2+, Tl+ и др.


![[Cu(NH3)4]SO4 Na[Al(OH)4] NaOHAl(OH)3](/img/tmb/5/429832/809cc3958751255364ad213da4476e3d-800x.jpg)

![[Co(NH3)6]3+ - комплекс[Co(NH3)6]Cl3 – комплексное соединение (соль).[Fe(CO)5] – комплекс и комплексное соединениеКомплекс означает центральный атом](/img/tmb/5/429832/983e4875742fc4eab6de7617aad413b1-800x.jpg)



![Основные положения координационной теории Комплексообразователь и лиганды составляют внутреннюю сферу комплекса.4.[Cu(NH3)4]+2](/img/tmb/5/429832/225b57dc8f6883fa12c600ca3a5f7592-800x.jpg)
![[N-3H+14]Cl-1КОМПЛЕКСНЫЙ ИОН[NH4]+ВНУТРЕННЯЯ СФЕРА:КОМПЛЕКСООБРАЗОВАТЕЛЬ N-3ЛИГАНДЫH+ВНЕШНЯЯ СФЕРААНИОНCl-](/img/tmb/5/429832/4e3e805bbee636430b9a25d436720815-800x.jpg)
![Строение комплексного соединенияK3 [Fe(CN)6]Ион-комплексообразователь(центральный атом)ЛигандыКоординационное числоВнутренняя сфераВнешняя сфера](/img/tmb/5/429832/217043629735d93dc5098ddc41414f11-800x.jpg)
![Примеры лигандовАнионы бескислородных кислотF-, Cl-, Br-, I- (фторо-лиганд и т.д.)Пример: K2[HgI4] – тетраиодомеркурат(II) калияДонорный атом](/img/tmb/5/429832/cb3c86382e992dbd161cbd28a7c777af-800x.jpg)
![Донорный атом OOH- - гидроксо-лигандO2- - оксо-лигандO22- - пероксо-лигандK2[Zn(OH)4] – тетрагидроксоцинкат(II) калияЭлекторонейтральные молекулы с донорными](/img/tmb/5/429832/ca388acc51ddc0071c861bd2cb659c4d-800x.jpg)
![(OH)-4[Zn+xNa+(+1)+ x+ (-1)]2·2·4 = 0x = 0-2+4x = +2Na2+[Zn+2(OH)-4]](/img/tmb/5/429832/ef76f978d6f80fe336af763107401dc9-800x.jpg)
![РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ:Na3[AlF6]Ответ: Na+3[Al+3F-6]K[MgCl3]Na[Al(OH)4]Na4[Fe(CN)6]Na3[Al(OH)6][Cu(NH3)4]Cl2Ответ: Na+[Al+3(OH)-4]Ответ: K+[Mg+2Cl-3]Ответ:Na+4[Fe+2(CN)-6]Ответ:Na+3[Al+3(OH)-6]Ответ:[Cu+2(NH3)04]Cl-2](/img/tmb/5/429832/0dd4a64e14788137704319197b5db02b-800x.jpg)

![Классификация По заряду комплекса[Cr(H2O)4]3+Cl3[PtCl4(NH3)2]K2[PtCl6]2-[Cu(NH3)4]2+[PtCl4]2-](/img/tmb/5/429832/e2f96d6011159c956bb345e8559b1ea9-800x.jpg)
![Классификация По составу внешней сферыH2[PtCl6]Na3[AlF6][Pt(NH3)2Cl2][Ag(NH3)2]OH](/img/tmb/5/429832/85df35ed2679d450acb8cb3c6218b273-800x.jpg)
![Классификация По виду лигандов[Fe(H2O)6]SO4K[Au(CN)4][Zn(NH3)4]Cl2[CoCl(NH3)3(H2O)2](NO3)2](/img/tmb/5/429832/ea3a48baf8470a287ad2f3339e9595fd-800x.jpg)


-[Zn+2натрия[Cr+3(H2O)06]Cl-3хлоридаквагексаxрома (III)K+2[Hg+2I-4]тетрайодомеркурат (II)калия](/img/tmb/5/429832/c59f158723e4662cf3370c712c4d53b2-800x.jpg)
![НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯNa3[AlF6]Na[Al(OH)4]K4[Fe(CN)6]Гексафтороалюминат натрияТетрагидроксоалюминат натрияГексационоферрат (II) калия](/img/tmb/5/429832/8eaab20ff4a0980cc8c17e76c110dfbc-800x.jpg)
![НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ[Cu(NH3)4]SO4Сульфат тетраамминмеди (II)[Ag(NH3)2]ClХлорид диамминсеребраХлорид гексааквахрома (III)[Cr(H2O)6]Cl3](/img/tmb/5/429832/01fe9463a8874fe884a3bebae7f3525b-800x.jpg)
![Ответ: K2[PtCl6]Гексахлороплатинат (IV) калияНитрат хлоронитротетраамминкобальта (III)Гексагидроксохромат (III) натрияСОСТАВЬТЕ ФОРМУЛЫ ВЕЩЕСТВОтвет: [Co(NH3)4(NO3)Cl]NO3Ответ: Na3[Cr(OH)6]Нитрат гексаамминникеля (II)Ответ: [Ni(NH3)6](NO3)2](/img/tmb/5/429832/2f0af6cd1c61b4818f70f2b229ef2e9b-800x.jpg)
![ПОЛУЧЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙЛабораторный опыт. Получение тетрагидроксоалюмината натрияAlCl3+3NaOH = Al(OH)3↓+3NaClAl(OH)3 + NaOH = Na[Al(OH)4]Лабораторный опыт. Получение](/img/tmb/5/429832/481be7dc76765577c161cbdce9ba5299-800x.jpg)

![ХИМИЧЕСКИЕ СВОЙСТВА2. Реакции по внешней сфереFeCl3+K4[Fe(CN)6]→KFe[Fe(CN)6]↓+3KCl[Cu(NH3)4]SO4+BaCl2→ →[Cu(NH3)4]Cl2+BaSO4↓](/img/tmb/5/429832/2f8dc10823f9df15e7d5500be27f8868-800x.jpg)
![ХИМИЧЕСКИЕ СВОЙСТВА3. Реакции с участием лигандов[Cu(NH3)4]SO4+4HCl→4NH4Cl+CuSO44. Реакции по центральному ионуОбменные:[Ag(NH3)2]Cl + KI → AgI↓ +](/img/tmb/5/429832/1677143b83656a5f82c3bdb6ff12d807-800x.jpg)
![5. Нагревание (термолиз) всех аммиакатов приводит к их разложению, например:[Cu(NH3) 4]SO4 = CuSO4 + 4NH3 .](/img/tmb/5/429832/1f9f70ee32bf1c8f2ff8ac811ef731bf-800x.jpg)
![B12 (Co[C62H88N13O14P])CNB12 - это хелат Co3+ c порфирином Медико-биологическое значение темы](/img/tmb/5/429832/5a6a46920901be27a3f8d42a9074c775-800x.jpg)



![[Pt2+(Еn)2]2+ этилендиаминплатина (II) Хелаты. Комплексоны. Краун-эфиры](/img/tmb/5/429832/d34ad90376f884aa745db111c933d025-800x.jpg)
![[Co3+(Еn)3]3+ этилендиаминкобальт(II) Хелаты. Комплексоны. Краун-эфиры](/img/tmb/5/429832/c16c418369019dfcbf7e67217a6c1c6c-800x.jpg)