- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Титриметрический анализ. Сущность титриметрического анализа презентация
Содержание
- 1. Титриметрический анализ. Сущность титриметрического анализа
- 2. Титриметрический анализ основан на точном измерении количества
- 3. Титрованный, или стандартный, раствор - раствор, концентрация
- 4. В титриметрическом анализе может быть использована не
- 5. Объемный анализ - метод количественного анализа, где
- 10. Классификация методов титриметрического анализа В соответствии с
- 11. В зависимости от применяемого реактива различают следующие
- 12. 3. Методы осаждения и комплексообразования.
- 13. аргентометрию, в которой используют реакцию иона серебра
- 14. Индикаторы и принцип их выбора Одним
- 16. Цвет индикатора будет зависеть от соотношения концентраций
- 17. Например, малиновая окраска фенолфталеина появляется в щелочной
- 19. Таким образом, приступая к определению содержания кислот
- 20. Для правильного выбора индикатора сначала изучают, как
- 22. Основные приемы титрования Титрование щелочи кислотой
- 23. В методах обратного титрования (или, как их
- 24. Не вступившее в реакцию избыточное количество вещества
- 25. Третьим основным видом титриметрических определений является титрование
- 26. Метод нейтрализации включает все аналитические реакции между
- 27. При титровании сильной кислоты сильной щелочью снижается
- 28. По мере титрования концентрация ионов водорода [Н+]
- 29. Когда будет прибавлено 99% щелочи (1/=19,8 мл),
- 30. При прибавлении 20 мл 0,1н. раствора NaOH
- 31. Если после достижения точки эквивалентности добавить к
- 32. Метод оксидиметрии В объемном анализе методом
- 33. Если титруют раствором окислителя восстановленную форму анализируемого
- 34. Существуют различные способы определения точки эквивалентности при
- 35. ПЕРМАНГАНАТОМЕТРИЯ – метод объемного (титриметрического) химического анализа,
- 36. В этом методе анализа рабочим раствором служит
- 37. Последняя реакция имеет наибольшее значение в количественном
- 38. Титрование ведут постепенным прибавлением раствора перманганата калия
- 39. Когда определяемый восстановитель полностью прореагирует, следующая капля
- 40. Методом перманганатометрии можно анализировать и восстановители и
- 41. В основе метода иодометрии лежит реакция восстановления
- 42. Основным рабочим раствором в иодометрии служит раствор
- 43. При титровании этим соединением раствора, содержащего восстановитель,
- 44. Многие аналитические иодометрические реакции протекают с невысокой
- 45. При анализе окислителей используют следующий прием обратного
- 46. Титрование ведут с индикатором, в качестве которого
- 47. МЕТОДЫ ОСАЖДЕНИЯ В объемном анализе используются некоторые
- 48. Принципиальное отличие объемного анализа методом осаждения от
- 49. В качестве осадителей используют растворы нитрата серебра
Слайд 2Титриметрический анализ основан на точном измерении количества реактива, израсходованного на реакцию
с определяемым веществом.
Титр (от фран. titre - титул, качество, заглавие, от лат. Titulus-надпись). В аналитической химии титр-один из способов выражения концентрации раствора.
Титр показывает число граммов растворенного вещества в 1 мл раствора.
Титр (от фран. titre - титул, качество, заглавие, от лат. Titulus-надпись). В аналитической химии титр-один из способов выражения концентрации раствора.
Титр показывает число граммов растворенного вещества в 1 мл раствора.
Слайд 3Титрованный, или стандартный, раствор - раствор, концентрация которого известна с высокой
точностью.
Титрование - прибавление титрованного раствора к анализируемому для определения точно эквивалентного количества.
Титрующий раствор часто называют рабочим раствором или титрантом.
Например, если кислота титруется щелочью, раствор щелочи называется титрантом.
Момент титрования, когда количество добавленного титранта химически эквивалентно количеству титруемого вещества, называется точкой эквивалентности.
Титрование - прибавление титрованного раствора к анализируемому для определения точно эквивалентного количества.
Титрующий раствор часто называют рабочим раствором или титрантом.
Например, если кислота титруется щелочью, раствор щелочи называется титрантом.
Момент титрования, когда количество добавленного титранта химически эквивалентно количеству титруемого вещества, называется точкой эквивалентности.
Слайд 4В титриметрическом анализе может быть использована не любая химическая реакция.
Реакции,
применяемые в титриметрии, должны удовлетворять следующим основным требованиям:
1) реакция должна протекать количественно, т. е. константа равновесия реакции должна быть достаточно велика;
2) реакция должна протекать с большой скоростью;
3) реакция не должна осложняться протеканием побочных
реакций;
4) должен существовать способ определения окончания реакции.
Если реакция не удовлетворяет хотя бы одному из этих требований, она не может быть использована в титриметрическом анализе.
1) реакция должна протекать количественно, т. е. константа равновесия реакции должна быть достаточно велика;
2) реакция должна протекать с большой скоростью;
3) реакция не должна осложняться протеканием побочных
реакций;
4) должен существовать способ определения окончания реакции.
Если реакция не удовлетворяет хотя бы одному из этих требований, она не может быть использована в титриметрическом анализе.
Слайд 5Объемный анализ - метод количественного анализа, где искомое вещество определяют по
объему реактива с точно известной концентрацией, затраченному на реакцию с этим веществом.
По сравнению с гравиметрическим объемный метод требует меньшей затраты времени, хотя и обладает меньшей точностью. Это связано с тем, что определение массы вещества на аналитических весах можно сделать с большей точностью, чем визуально (на глаз) определить объем раствора при помощи бюретки.
По сравнению с гравиметрическим объемный метод требует меньшей затраты времени, хотя и обладает меньшей точностью. Это связано с тем, что определение массы вещества на аналитических весах можно сделать с большей точностью, чем визуально (на глаз) определить объем раствора при помощи бюретки.
Слайд 10Классификация методов титриметрического анализа
В соответствии с характером используемых реакций различают следующие
методы титриметрического анализа.
1. Метод нейтрализации. В основе метода лежит реакция между кислотой и щелочью:
н++он – = н2о.
Этим методом определяют кислоты, основания и многие вещества, образующие при растворении и диссоциации ионы водорода и гидроксида.
2. Метод оксидиметрии. Под этим названием объединен ряд методов, основанных на реакциях окисления и восстановления. Титрование здесь ведется растворами окислителей или восстановителей.
1. Метод нейтрализации. В основе метода лежит реакция между кислотой и щелочью:
н++он – = н2о.
Этим методом определяют кислоты, основания и многие вещества, образующие при растворении и диссоциации ионы водорода и гидроксида.
2. Метод оксидиметрии. Под этим названием объединен ряд методов, основанных на реакциях окисления и восстановления. Титрование здесь ведется растворами окислителей или восстановителей.
Слайд 11В зависимости от применяемого реактива различают следующие методы:
перманганатометрию, где используется
реакция окисления перманганатом калия;
иодометрию - используются реакции окисления элементным йодом или восстановление иодид-ионами;
хроматометрию - используется реакция окисления бихроматом калия;
броматометрию - используется реакция окисления броматом калия; цериметрию - используется реакция окисления солями четырехвалентного церия;
ванадометрию - используется реакция окисления ванадат-ионами;
титанометрию - используется реакция восстановления солями трехвалентного титана.
иодометрию - используются реакции окисления элементным йодом или восстановление иодид-ионами;
хроматометрию - используется реакция окисления бихроматом калия;
броматометрию - используется реакция окисления броматом калия; цериметрию - используется реакция окисления солями четырехвалентного церия;
ванадометрию - используется реакция окисления ванадат-ионами;
титанометрию - используется реакция восстановления солями трехвалентного титана.
Слайд 123. Методы осаждения и комплексообразования.
В эти группы объединены методы, основанные
на осаждении определенного иона в форме малорастворимого соединения или связывании его в малодиссоциированный комплекс.
В зависимости от применяемых реагентов различают следующие методы осаждения:
В зависимости от применяемых реагентов различают следующие методы осаждения:
Слайд 13аргентометрию, в которой используют реакцию иона серебра с галогенид-ионами;
роданометрию, в
которой используют реакцию иона серебра с роданид-ионом NCS-;
меркурометрию, где используется реакция иона ртути (Hg22+) с хлорид-ионом)
В комплексометрическом титровании применяют реакцию катионов металлов с аминополикарбоновыми кислотами.
меркурометрию, где используется реакция иона ртути (Hg22+) с хлорид-ионом)
В комплексометрическом титровании применяют реакцию катионов металлов с аминополикарбоновыми кислотами.
Слайд 14
Индикаторы и принцип их выбора
Одним из важнейших условий выполнения объемного определения
является фиксирование точки эквивалентности - момента, когда количество определяемого вещества эквивалентно количеству вступившего в реакцию с ним вещества стандартного раствора.
Точка эквивалентности определяется при помощи индикатора, который представляет собой органическое вещество со слабо выраженными кислотными или основными свойствами.
Точка эквивалентности определяется при помощи индикатора, который представляет собой органическое вещество со слабо выраженными кислотными или основными свойствами.
Слайд 16Цвет индикатора будет зависеть от соотношения концентраций различно окрашенных ионов Ind-
и молекул HInd. Если среда будет кислой, то цвет раствора будет определяться цветом недиссоциированных молекул, в щелочной среде раствор будет иметь окраску, присущую ионам Ind-.
Цвет индикатора обычно изменяется в определенном интервале значений рН.
Цвет индикатора обычно изменяется в определенном интервале значений рН.
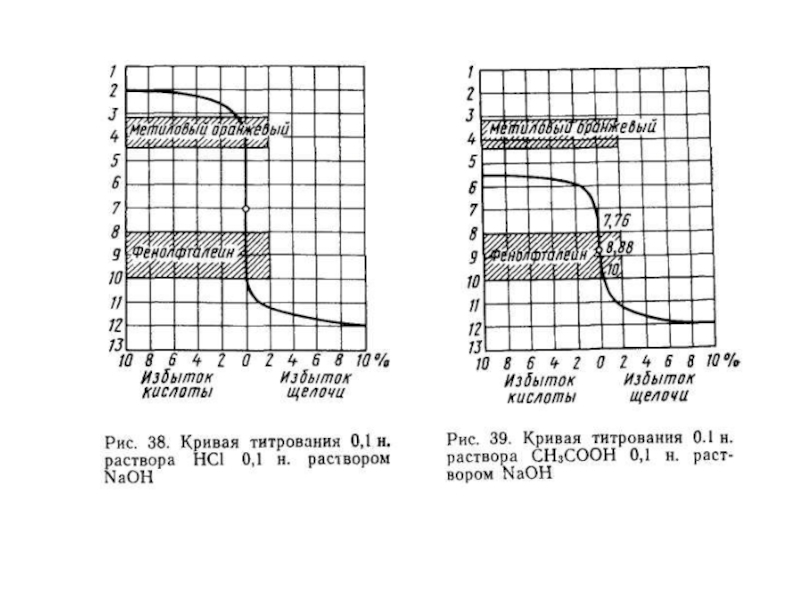
Слайд 17Например, малиновая окраска фенолфталеина появляется в щелочной среде при рН 8,9-9,8.
Этот интервал называется интервалом перехода окраски индикатора. В пределах этого интервала есть значение рН (для фенолфталеина рН 9), при котором цвет раствора имеет наиболее яркую окраску.
Это значение рН называется показателем титрования и обозначается рТ. Для лакмуса интервал перехода окраски из красной (кислая среда) в синюю (щелочная среда) лежит в пределах рН от 5 до 8, а наиболее отчетливо переход окраски воспринимается при рН 7, это и будет показателем титрования для лакмуса: рТ 7.
Это значение рН называется показателем титрования и обозначается рТ. Для лакмуса интервал перехода окраски из красной (кислая среда) в синюю (щелочная среда) лежит в пределах рН от 5 до 8, а наиболее отчетливо переход окраски воспринимается при рН 7, это и будет показателем титрования для лакмуса: рТ 7.
Слайд 19Таким образом, приступая к определению содержания кислот или оснований в растворе,
следует заранее знать, какая реакция среды установится в точке эквивалентности. Реакция среды в точке эквивалентности не всегда будет нейтральной.
В результате взаимодействия кислоты с основанием образуются соль и вода. Соли в водном растворе подвергаются гидролизу, в результате чего изменяется концентрация ионов водорода и гидроксида, а следовательно, и реакция среды.
В результате взаимодействия кислоты с основанием образуются соль и вода. Соли в водном растворе подвергаются гидролизу, в результате чего изменяется концентрация ионов водорода и гидроксида, а следовательно, и реакция среды.
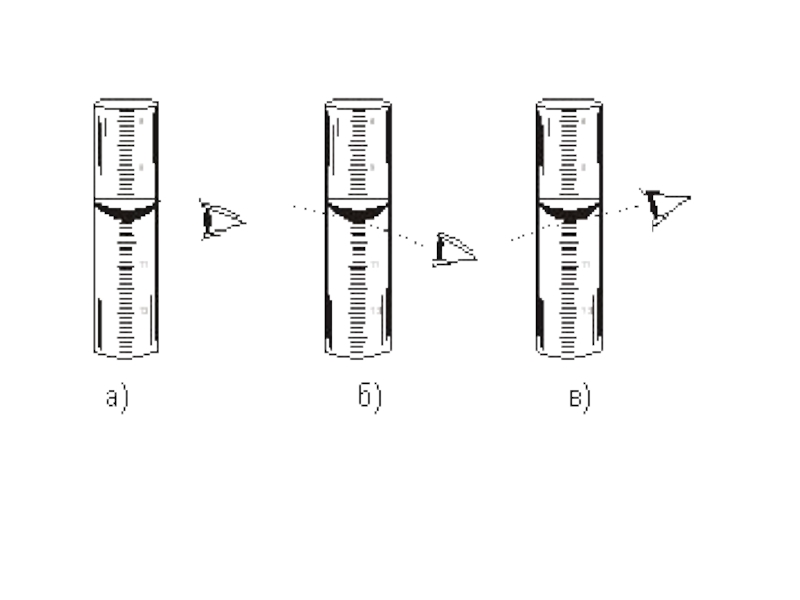
Слайд 20Для правильного выбора индикатора сначала изучают, как меняется рН раствора в
процессе титрования. К раствору кислоты (или щелочи) добавляют малыми порциями раствор щелочи (или кислоты) при помощи рН-метра определяют рН.
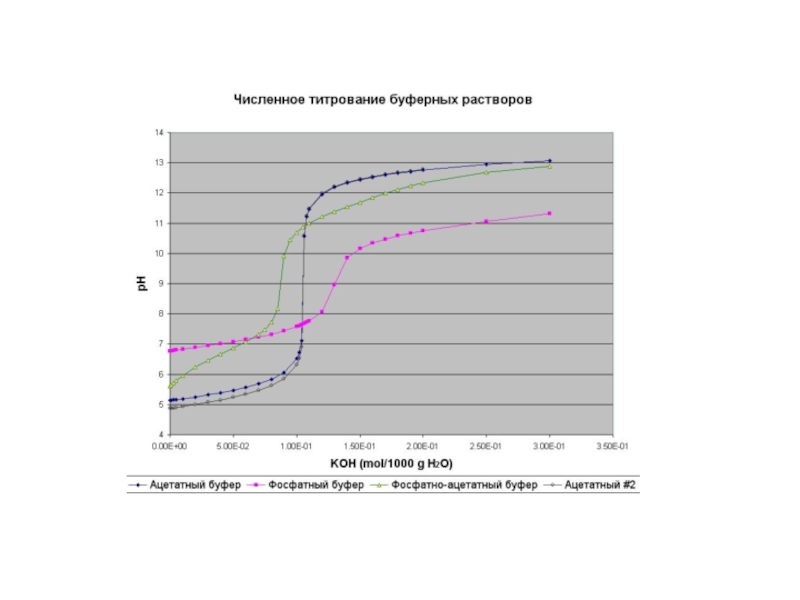
По полученным данным строят кривую титрования: на оси абцисс откладывают количество кислоты или щелочи, находящейся в избытке в данный момент; на оси ординат – соответствующее этому избытку значение рН.
По графику определяют скачек титрования, а за точку эквивалентности принимают точку, лежащую на середине отрезка прямой (соответствующего скачку титрования).
По полученным данным строят кривую титрования: на оси абцисс откладывают количество кислоты или щелочи, находящейся в избытке в данный момент; на оси ординат – соответствующее этому избытку значение рН.
По графику определяют скачек титрования, а за точку эквивалентности принимают точку, лежащую на середине отрезка прямой (соответствующего скачку титрования).
Слайд 22Основные приемы титрования
Титрование щелочи кислотой является типичным примером прямого титрования. В
методах прямого титрования определяемое вещество непосредственно реагирует с титрантом. Для проведения анализа этим методом достаточно одного рабочего раствора.
Слайд 23В методах обратного титрования (или, как их еще называют, методах титрования
по остатку) используются два титрованных рабочих раствора: основной и вспомогательный.
В обратном титровании к анализируемому раствору сначала добавляют заведомый избыток титрованного раствора (основного рабочего раствора).
В обратном титровании к анализируемому раствору сначала добавляют заведомый избыток титрованного раствора (основного рабочего раствора).
Слайд 24Не вступившее в реакцию избыточное количество вещества оттитровывают вторым раствором (вспомогательным
рабочим раствором).
Содержание искомого компонента легко рассчитывают, так как известно общее количество вещества (основного рабочего раствора), введенного в раствор, и количество вещества, не вступившее в реакцию.
Содержание искомого компонента легко рассчитывают, так как известно общее количество вещества (основного рабочего раствора), введенного в раствор, и количество вещества, не вступившее в реакцию.
Слайд 25Третьим основным видом титриметрических определений является титрование заместителя, или титрование по
замещению (косвенное титрование).
В этом методе к определяемому веществу добавляют специальный реагент, вступающий с ним в реакцию. Один из продуктов взаимодействия затем оттитровывают рабочим раствором.
В этом методе к определяемому веществу добавляют специальный реагент, вступающий с ним в реакцию. Один из продуктов взаимодействия затем оттитровывают рабочим раствором.
Слайд 26Метод нейтрализации включает все аналитические реакции между ионом водорода и гидроксид-ионом.
Различают
АЦИДИМЕТРИЧЕСКОЕ титрование (от acidium - кислота), в котором в качестве титранта используют растворы кислот, и АЛКАЛИМЕТРИЧЕСКОЕ титрование (от alcalis – щелочь), где титрантом служат растворы гидроксида натрия и калия.
Слайд 27При титровании сильной кислоты сильной щелочью снижается концентрация ионов водорода Н+.
Допустим
в колбе для титрования находится 20 мл 0,1н. раствора НСI, который титруют из бюретки 0,1 н. раствором NaOH.
Слайд 28По мере титрования концентрация ионов водорода [Н+] будет снижаться, изменится соответственно
и рН раствора.
Когда к кислоте прибавлено 18 мл 0,1 н. раствор NaOH, т.е. 90% от количества, необходимого для нейтрализации, останется 10% кислоты от исходного количества, т.е. концентрация ее будет ,01 г-экв/л, [Н+] = 0,01 и рН = 2.
Когда к кислоте прибавлено 18 мл 0,1 н. раствор NaOH, т.е. 90% от количества, необходимого для нейтрализации, останется 10% кислоты от исходного количества, т.е. концентрация ее будет ,01 г-экв/л, [Н+] = 0,01 и рН = 2.
Слайд 29Когда будет прибавлено 99% щелочи (1/=19,8 мл), концентрация НСI cнижается до
0,001г-экв/л, [Н+] = 0,001 и рН = 3. При добавлении 99,9% щелочи (V= 19,98 мл) концентрация НС1 составит 0,0001 г-экв/л, [Н+] = 0,0001 и рН=4.
Слайд 30При прибавлении 20 мл 0,1н. раствора NaOH в раствор введено эквивалентное
кислоте количество щелочи – достигнута точка эквивалентности. Произошла нейтрализация кислоты, рН раствора равен 7.
Слайд 31Если после достижения точки эквивалентности добавить к раствору еще 0,02 мл
01н. раствора NaOH (перетитровать раствор), появится избыток ионовОН–, реакция раствора станет щелочной, рН = 10.
Если продолжать добавлять раствор щелочи, концентрация ОН– будет возрастать и рН увеличиваться.
Если продолжать добавлять раствор щелочи, концентрация ОН– будет возрастать и рН увеличиваться.
Слайд 32Метод оксидиметрии
В объемном анализе методом оксидиметрии используют реакции, связанные с изменением
степени окисления анализируемого вещества, – реакции окисления – восстановления.
Окислительно-восстановительное титрование основано на том, что анализируемое вещество может существовать в двух формах – восстановленной и окисленной.
Окислительно-восстановительное титрование основано на том, что анализируемое вещество может существовать в двух формах – восстановленной и окисленной.
Слайд 33Если титруют раствором окислителя восстановленную форму анализируемого вещества, то по мере
титрования она переходит в окисленную форму и потенциал системы меняется.
В точке эквивалентности анализируемое вещество полностью переходит в окисленную форму и происходит резкое изменение потенциала. Такой скачок потенциала свидетельствует о достижении точки эквивалентности.
В точке эквивалентности анализируемое вещество полностью переходит в окисленную форму и происходит резкое изменение потенциала. Такой скачок потенциала свидетельствует о достижении точки эквивалентности.
Слайд 34Существуют различные способы определения точки эквивалентности при окислительно-восстановительном титровании.
Скачок потенциала можно
измерить с помощью специальных приборов.
Иногда применяют окислительно-восстановительные индикаторы.
Иногда применяют окислительно-восстановительные индикаторы.
Слайд 35ПЕРМАНГАНАТОМЕТРИЯ – метод объемного (титриметрического) химического анализа, основанный на применении стандартного
(имеющего строго определенную концентрацию) раствора перманганата калия KMnO4. При действии восстановителей перманганат-ион в кислотной среде переходит в бесцветный катион марганца(2+):
Слайд 36В этом методе анализа рабочим раствором служит раствор перманганата калия КМnС4.
Это соединение является сильным окислителем.
В зависимости от условий реакции молекула перманганата может приобрести от 1 до 5 электронов: в щелочной среде, в нейтральной среде и в кислой среде.
Слайд 37Последняя реакция имеет наибольшее значение в количественном анализе.
Большая часть анализов
методом перманганатометрии проводится в кислой среде.
Слайд 38Титрование ведут постепенным прибавлением раствора перманганата калия к подкисленному раствору анализируемого
вещества, обладающего свойствами восстановителя.
Раствор, содержаний ионы МпО4–, окрашен в красно-фиолетовый цвет, а растворы, содержащие ионы Мп2+, бесцветны.
Пока в титруемом растворе имеется восстановитель, прибавленный перманганат обесцвечивается.
Раствор, содержаний ионы МпО4–, окрашен в красно-фиолетовый цвет, а растворы, содержащие ионы Мп2+, бесцветны.
Пока в титруемом растворе имеется восстановитель, прибавленный перманганат обесцвечивается.
Слайд 39Когда определяемый восстановитель полностью прореагирует, следующая капля раствора перманганата окрасит раствор
в розовый цвет. По появлению розовой окраски судят о достижении точки эквивалентности.
Если анализируемый раствор окрашен так, что в нем трудно заметить появление розовой окраски, в титруемый раствор добавляют индикатор – дифениламин.
В присутствии даже незначительного избытка перманганата он окрашивает раствор в синий цвет.
Если анализируемый раствор окрашен так, что в нем трудно заметить появление розовой окраски, в титруемый раствор добавляют индикатор – дифениламин.
В присутствии даже незначительного избытка перманганата он окрашивает раствор в синий цвет.
Слайд 40Методом перманганатометрии можно анализировать и восстановители и окислители.
Восстановители определяют прямым
титрованием, окислители – обратным: сначала к анализируемому раствору добавляют точно отмеренный объем титрованного раствора восстановителя, а затем избыток восстановителя оттитровывают раствором перманганата.
Слайд 41В основе метода иодометрии лежит реакция восстановления элементного иода до иодид-ионов
и окисления иодид-ионов в элементный иод.
Методом иодометрии ведут определение как восстановителей, так и окислителей.
Методом иодометрии ведут определение как восстановителей, так и окислителей.
ИОДОМЕТРИЯ
Слайд 42Основным рабочим раствором в иодометрии служит раствор иода. Поскольку иод мало
растворим в воде, его растворяют в 10 – 15%-ном растворе иодида калия. При этом образуется комплексное соединение:
I2+KI=K[I3],
которое легко диссоциирует, выделяя элементный иод.
I2+KI=K[I3],
которое легко диссоциирует, выделяя элементный иод.
Слайд 43При титровании этим соединением раствора, содержащего восстановитель, по мере прибавления иод
восстанавливается в иодид-ионы.
В точке эквивалентности, когда все анализируемое вещество прореагировало с иодом, следующая капля раствора иода вызовет изменение окраски индикатора – крахмала в синий цвет.
В точке эквивалентности, когда все анализируемое вещество прореагировало с иодом, следующая капля раствора иода вызовет изменение окраски индикатора – крахмала в синий цвет.
Слайд 44Многие аналитические иодометрические реакции протекают с невысокой скоростью, и определение ведут
обратным титрованием.
К анализируемому раствору добавляют заведомо в избытке раствор иода и через некоторое время оттитровывают избыток иода титрованием раствором тиосульфата натрия.
К анализируемому раствору добавляют заведомо в избытке раствор иода и через некоторое время оттитровывают избыток иода титрованием раствором тиосульфата натрия.
Слайд 45При анализе окислителей используют следующий прием обратного титрования. К анализируемому раствору
добавляют заведомый избыток иодида калия.
При этом протекает окисление его в элементный иод, который образуется в количестве, эквивалентном количеству анализируемого окислителя.
Выделившийся иод оттитровывают раствором анализируемого вещества.
При этом протекает окисление его в элементный иод, который образуется в количестве, эквивалентном количеству анализируемого окислителя.
Выделившийся иод оттитровывают раствором анализируемого вещества.
Слайд 46Титрование ведут с индикатором, в качестве которого используют крахмал, образующий в
присутствии иода интенсивно окрашенное синее соединение.
При титровании раствором иода первая избыточная капля титранта вызывает появление неисчезающей синей окраски.
При титровании иода раствором тиосульфата синий раствор обесцвечивается в точке эквивалентности.
В этом случае крахмал прибавляют в самом конце титрования, когда иода останется очень мало.
При титровании раствором иода первая избыточная капля титранта вызывает появление неисчезающей синей окраски.
При титровании иода раствором тиосульфата синий раствор обесцвечивается в точке эквивалентности.
В этом случае крахмал прибавляют в самом конце титрования, когда иода останется очень мало.
Слайд 47МЕТОДЫ ОСАЖДЕНИЯ
В объемном анализе используются некоторые реакции, приводящие к образованию осадка.
К этим реакциям предъявляются иные требования, чем к реакциям осаждения в гравиметрическом анализе: использование эквивалентного количества осадителя, быстрое образование практически нерастворимого осадка, возможность определения точки эквивалентности в реакции осаждения.
Слайд 48Принципиальное отличие объемного анализа методом осаждения от гравиметрического состоит в том,
что о количестве вещества судят по объему рабочего раствора, израсходованного на титрование, а образующийся осадок не исследуется.
Слайд 49В качестве осадителей используют растворы нитрата серебра (аргентометрия), нитрата одновалентной ртути
(меркурометрия), нитрата двухвалентной ртути (меркуриметрия).
























![По мере титрования концентрация ионов водорода [Н+] будет снижаться, изменится соответственно и рН раствора.Когда к](/img/tmb/4/364164/b9e58b61588c3c40a0a3a946af06e621-800x.jpg)
![Когда будет прибавлено 99% щелочи (1/=19,8 мл), концентрация НСI cнижается до 0,001г-экв/л, [Н+] = 0,001](/img/tmb/4/364164/c5670e414ac4c173986dabf8f3b52b72-800x.jpg)