- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Коллигативные свойства растворов презентация
Содержание
- 1. Коллигативные свойства растворов
- 2. Раствор – это физико-химическая система, состоящая из
- 3. Истинные растворы - растворенное вещество диспергировано в
- 4. Сольваты ( гидраты) – соединения растворителя
- 5. В ряде случаев гидратная вода удерживается твердой
- 6. Термодинамика растворения Энтальпийный фактор: 1)Разрушение крист. решетки
- 7. Растворение твердого вещества - ∆H раств <
- 8. Самопроизвольное растворение: ΔG < 0,
- 9. (моль/л или М). (моль/кг)
- 10. Неэлектролиты, не диссоцируют простые вещества,
- 11. Электролиты Распад молекулы на ионы - увеличение
- 12. Свойства раствора Концентрация + диссоциация реальное
- 13. Коллигативные свойства (от лат. colligatus — обобщать)
- 14. 3.* Осмос и осмотическое давление. Закон Вант-Гоффа.
- 15. Осмос – движение растворителя (воды) через полупроницаемую
- 16. Доп. материал: Если P >
- 17. Pосм = RTС (идеальные растворы)
- 18. Если молекула распадается на n ионов (NaCl
- 19. *Метод определения степени диссоциации α. пример
- 20. 0,05 М раствор NaCl i
- 21. Осмотическое давление биологических жидкостей создается ионами (Na+
- 22. Типы растворов, используемых в медицине Pосм
- 23. Онкотическое давление – осмотическое давление, обусловленное белками
- 24. Изоосмия - условие существования человека и высших
- 25. Изотонические растворы, используемые в медицине Росм =
- 26. Осмос определяет распределение воды в организме Росм
- 27. *Понижение давления пара над раствором. Закон Рауля
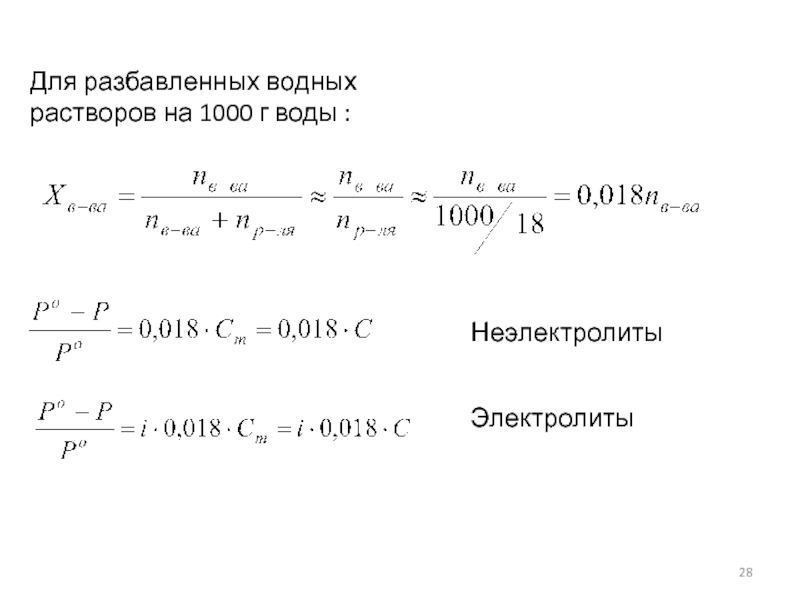
- 28. Для разбавленных водных
- 29. если раствор состоит из двух летучих
- 30. *Повышение температуры кипения раствора,
- 31. ΔТзам = K ∙ Сm ≈ K
Слайд 2Раствор – это физико-химическая система, состоящая из двух или более компонентов.
Состав (компоненты):
растворитель и растворенные вещества
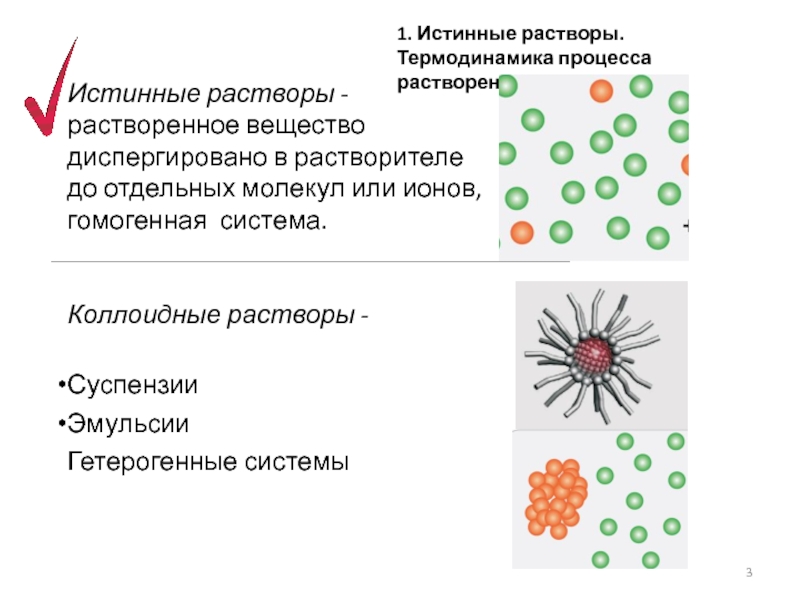
Слайд 3Истинные растворы - растворенное вещество диспергировано в растворителе до отдельных молекул
гомогенная система.
Коллоидные растворы -
Суспензии
Эмульсии
Гетерогенные системы
1. Истинные растворы. Термодинамика процесса растворения
Слайд 4
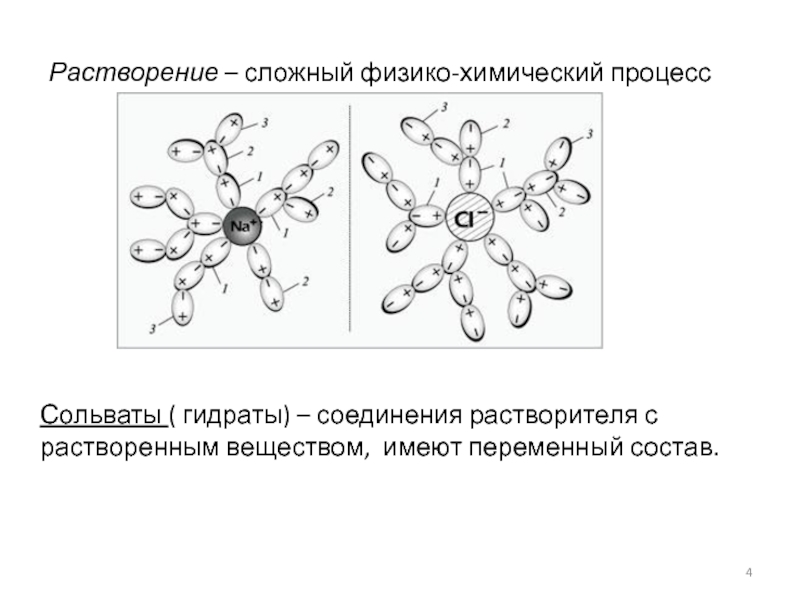
Сольваты ( гидраты) – соединения растворителя с растворенным веществом, имеют переменный
Растворение – сложный физико-химический процесс
Слайд 5В ряде случаев гидратная вода удерживается твердой фазой
кристаллогидраты
CuSO4 ⋅ 5H2O
CuSO4
гипс CaSO4 ⋅ 2H2O,
глауберова соль Na2SO4 ⋅ 10H2O,
железный купорос FeSO4⋅7H2O,
медный купорос CuSO4 ⋅ 5H2O,
квасцы NaAl(SO4)2 ·12H2O, KAl (SO4)2 ·12H2O
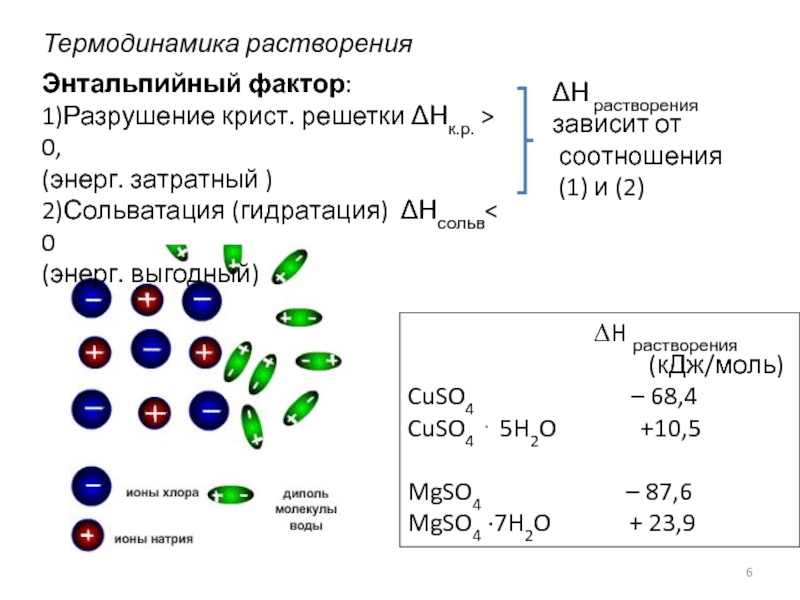
Слайд 6Термодинамика растворения
Энтальпийный фактор:
1)Разрушение крист. решетки ΔНк.р. > 0,
(энерг. затратный )
2)Сольватация (гидратация)
(энерг. выгодный)
ΔН растворения
зависит от
соотношения
(1) и (2)
∆H растворения
(кДж/моль)
CuSO4 – 68,4
CuSO4 ⋅ 5H2O +10,5
MgSO4 – 87,6
MgSO4 ·7H2O + 23,9
Слайд 7Растворение твердого вещества -
∆H раств < 0 или > 0 (от
Растворение жидкости или газа -
∆H раств < 0
(нет затрат на разрушение крист. решетки, только «выгодный» процесс сольватации)
.
Слайд 8Самопроизвольное растворение:
ΔG < 0,
Энтропийный фактор:
При растворении тв. в-ва и жидк. ΔS > 0
При растворении газа ∆S < 0
При достижении равновесия ΔG = 0
μ (чистого в-ва) = μ (в-ва в растворе).
Слайд 9
(моль/л или М).
(моль/кг)
Xр-ля + X в-ва = 1.
Мольная доля
Массовое
содержание
Молярность
Моляльность
Концентрация
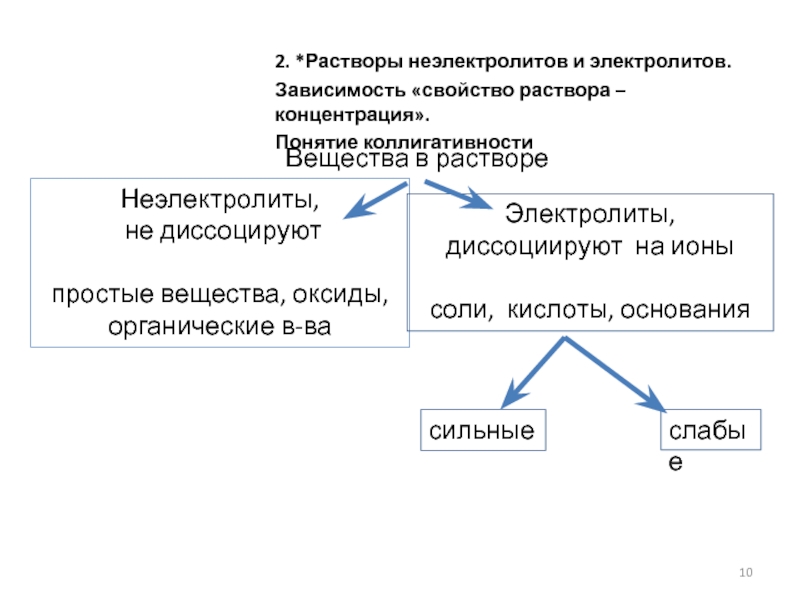
Слайд 10Неэлектролиты,
не диссоцируют
простые вещества, оксиды, органические в-ва
Электролиты,
диссоциируют на ионы
соли, кислоты, основания
сильные
слабые
Вещества в растворе
2. *Растворы неэлектролитов и электролитов.
Зависимость «свойство раствора – концентрация».
Понятие коллигативности
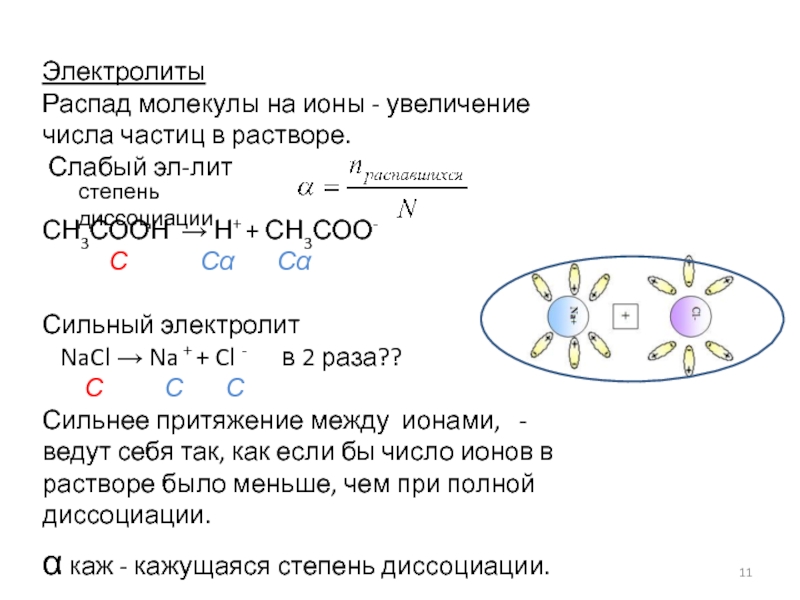
Слайд 11Электролиты
Распад молекулы на ионы - увеличение числа частиц в растворе.
СН3СООН → Н+ + СН3СОО-
С Сα Сα
Сильный электролит
NaCl → Na + + Cl - в 2 раза??
С С С
Сильнее притяжение между ионами, - ведут себя так, как если бы число ионов в растворе было меньше, чем при полной диссоциации.
α каж - кажущаяся степень диссоциации.
степень диссоциации
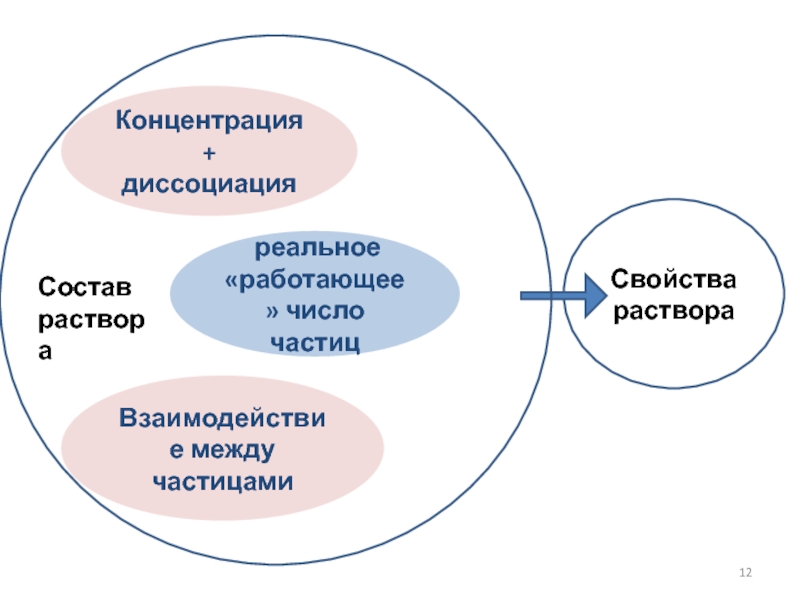
Слайд 12Свойства раствора
Концентрация + диссоциация
реальное «работающее» число частиц
Взаимодействие между частицами
Состав
раствора
Слайд 13Коллигативные свойства (от лат. colligatus — обобщать) – зависят не от
осмотическое давление P осм,
понижение давления пара ∆P,
повышение температуры кипения ∆Tкип,
понижение температуры замерзания ∆Tзам,
относительно
растворителя.
коллигативность – обобщенные действия всех частиц раствора
Слайд 143.* Осмос и осмотическое давление. Закон Вант-Гоффа. Изотонический коэффициент. Осмоляльность и
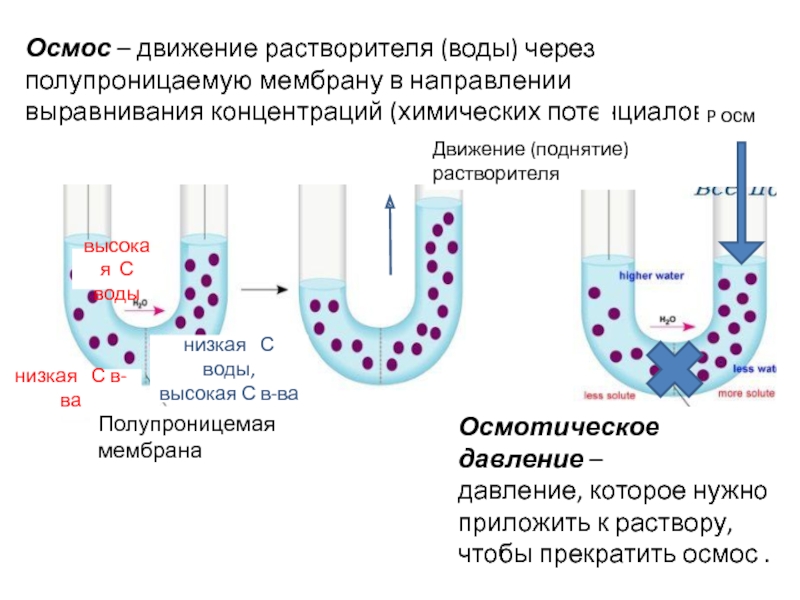
Слайд 15Осмос – движение растворителя (воды) через полупроницаемую мембрану в направлении выравнивания
P осм
Движение (поднятие)
растворителя
Осмотическое давление –
давление, которое нужно приложить к раствору, чтобы прекратить осмос .
высокая С воды
низкая С воды,
высокая С в-ва
низкая С в-ва
Полупроницемая мембрана
Слайд 16 Доп. материал:
Если P > P осм – обратный осмос
Нужно
из более конц. раствора в менее конц. раствор или в чистый
растворитель.
Очистка воды методом обратного осмоса - для получения «Воды очищенной» и «Воды для инъекций».
Слайд 17Pосм = RTС (идеальные растворы)
CИ: Pосм
Если Pосм [атм], C [ моль/л], R = 0,082 (л . атм)/моль. K
Pосм = i RTС (реальные растворы)
i - изотонический коэффициент
(во сколько раз в растворе больше частиц по сравнению с идеальным раствором неэлектролита)
Вант-Гофф: движение частиц в растворе - по законам газов,
Pосм может быть выражена через уравнение состояние газа
Слайд 18Если молекула распадается на n ионов (NaCl – 2, ZnCl2 –
количество исходных молекул N,
степень диссоциации — α или α каж
количество диссоциировавших молекул N·α
при этом образуются N·α·n ионов,
общее количество частиц в растворе N — N·α + N·α·n
Слайд 19*Метод определения степени диссоциации α.
пример
0,05 М раствор NaCl при 25°С
Используем формулу Вант-Гоффа для электролита,
переведем концентрацию в размерность СИ
0,05 моль/л = 50 моль /м3
Это кажущаяся степень диссоциации
i >1 – эл. диссоциация (если i =1 нет диссоциации)
Слайд 20
0,05 М раствор NaCl
i = 1,9 (вместо 2,0 )
0,05 М
i =1,3 (вместо 2,0).
Учет межионных взаимодействий и числа частиц
теор. вычисления измерения Pосм
Теория Дебая и Хюккеля:
ионная сила и активность
Теория Вант Гоффа:
изотонический коэффициент
Нобелевская премия 1901 г.
за законы химической динамики
и осмотического давления
в растворах
Нобелевская премия 1936 г.
за исследования
дипольных явлений
Доп. материал:
Слайд 21Осмотическое давление биологических жидкостей создается ионами (Na+ К+, Сl-, НСО3- и
Их суммарная концентрация - осмолярность
в молях (осмолях) на литр (осмоль/л).
плазма крови – 280-300, СМЖ – 270-290, моча – 600-1200 милиосмоль/л.
Эта величина должна быть использована в уравнении Вант-Гоффа для жидкостей сложного состава.
Осмоляльность – концентрация тех же частиц, растворенных в килограмме воды, (осмоль/кг).
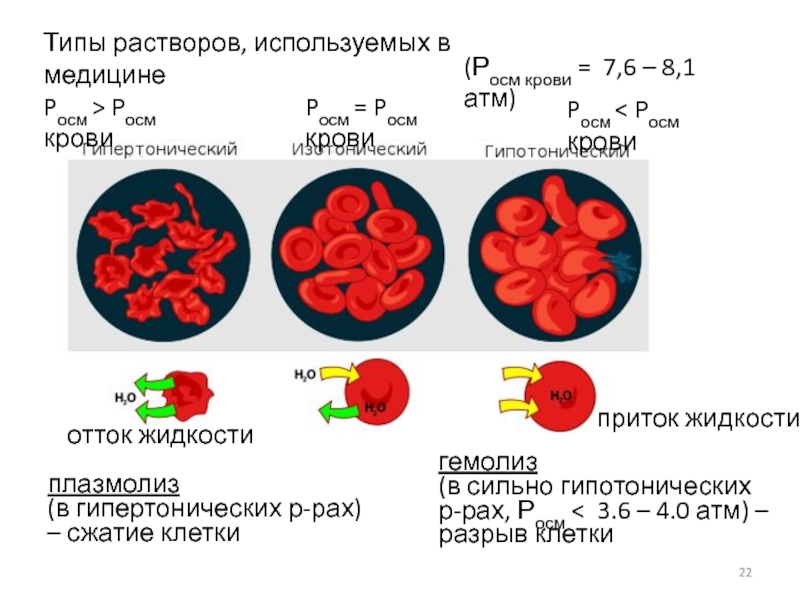
Слайд 22Типы растворов, используемых в медицине
Pосм > Pосм крови
Pосм = Pосм
Pосм < Pосм крови
отток жидкости
приток жидкости
плазмолиз
(в гипертонических р-рах) – сжатие клетки
гемолиз
(в сильно гипотонических
р-рах, Росм < 3.6 – 4.0 атм) –
разрыв клетки
(Росм крови = 7,6 – 8,1 атм)
Слайд 23Онкотическое давление – осмотическое давление, обусловленное белками крови
Ронк = 0,03 –
Ронк крови > Ронк тканей
Ронк обеспечивает удержание воды в крови. Снижение содержания белка в плазме крови ведет к потере воды плазмой и отеку тканей, а увеличение — к задержке воды в крови.
В плазме наиболее значимый компонент - NaCl.
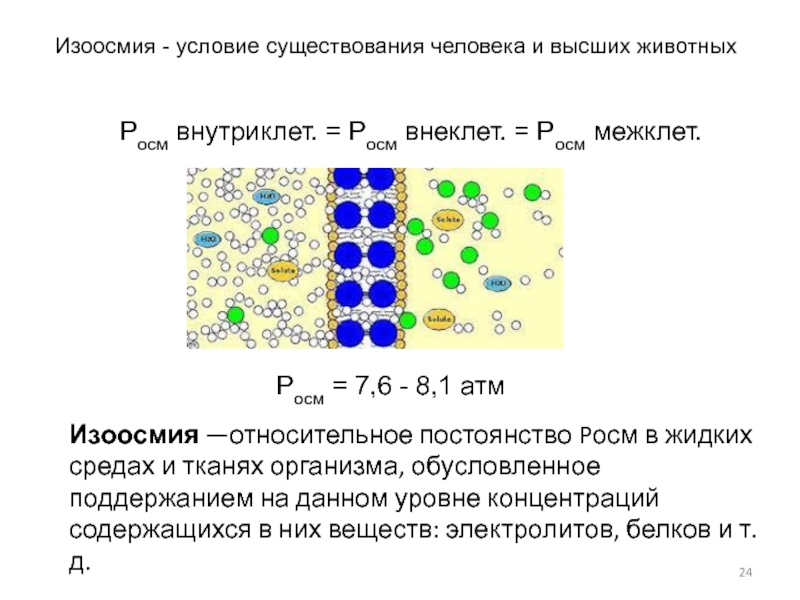
Слайд 24Изоосмия - условие существования человека и высших животных
Росм = 7,6 -
Изоосмия —относительное постоянство Pосм в жидких средах и тканях организма, обусловленное поддержанием на данном уровне концентраций содержащихся в них веществ: электролитов, белков и т. д.
Росм внутриклет. = Росм внеклет. = Росм межклет.
Слайд 25Изотонические растворы, используемые в медицине
Росм = СRT = С . 0,082
С = 0,3 осмоль/л
0,9 % водный раствор хлорида натрия,
5 % водный раствор глюкозы.
Раствор Рингера
NaCl, KCl и CaCl2
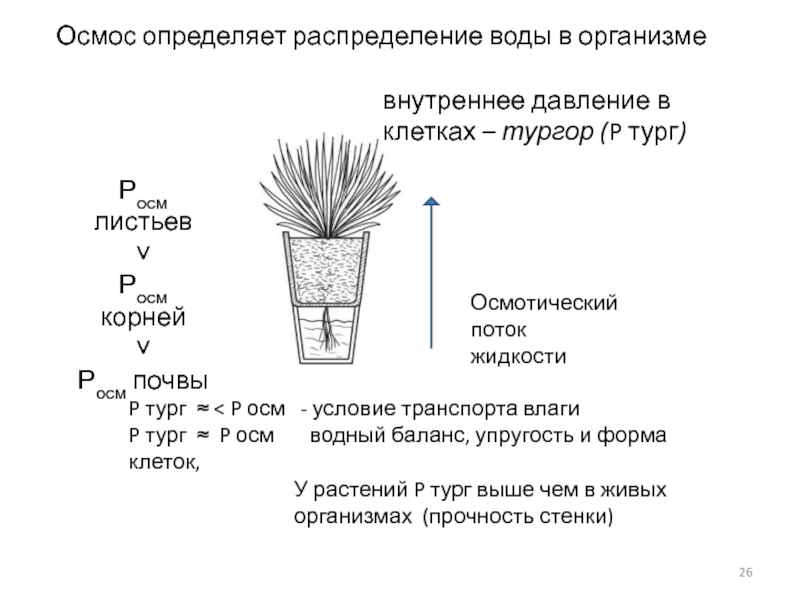
Слайд 26Осмос определяет распределение воды в организме
Росм листьев
˅
Росм корней
˅
Росм почвы
внутреннее давление
Осмотический поток жидкости
P тург ≈ < P осм - условие транспорта влаги
P тург ≈ P осм водный баланс, упругость и форма клеток,
У растений P тург выше чем в живых организмах (прочность стенки)
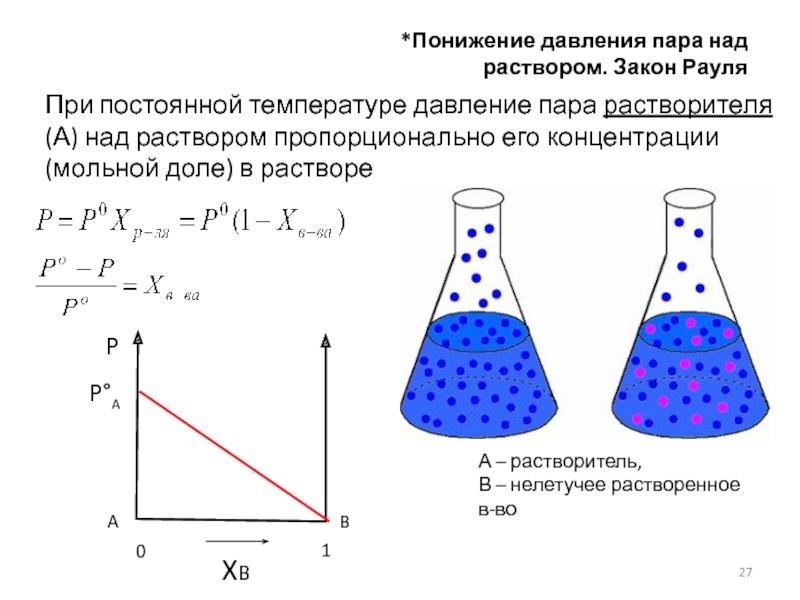
Слайд 27*Понижение давления пара над раствором. Закон Рауля
При постоянной температуре давление пара
А – растворитель,
В – нелетучее растворенное в-во
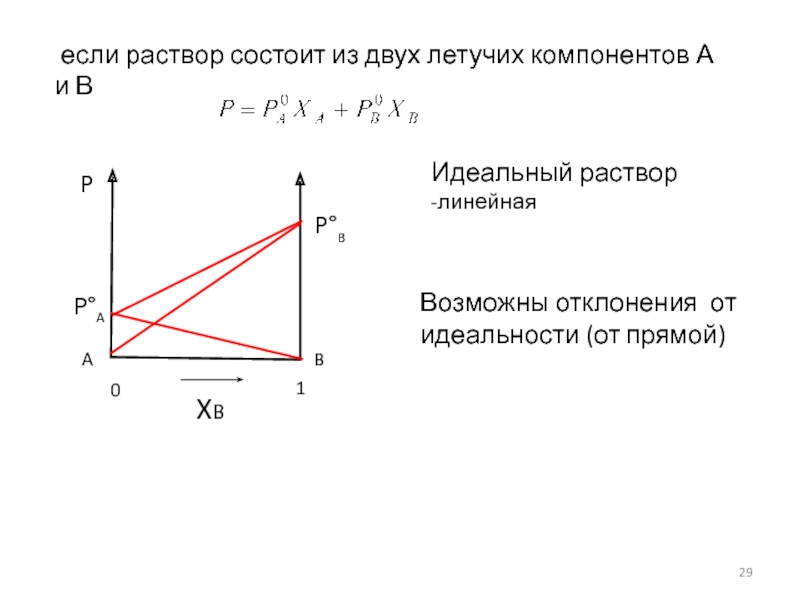
Слайд 29 если раствор состоит из двух летучих компонентов А и В
Возможны отклонения от идеальности (от прямой)
Идеальный раствор
-линейная
Слайд 30
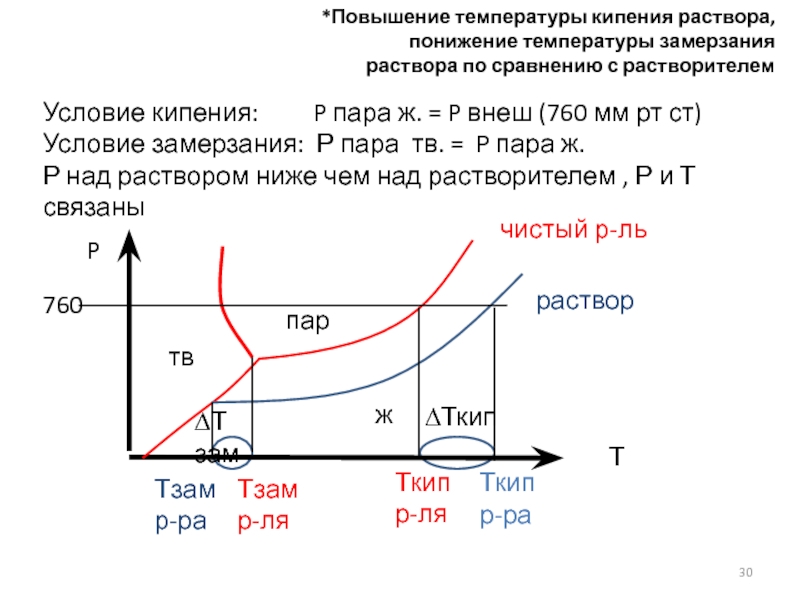
*Повышение температуры кипения раствора,
понижение температуры замерзания
раствора по сравнению с
Условие кипения: P пара ж. = P внеш (760 мм рт ст)
Условие замерзания: Р пара тв. = P пара ж.
Р над раствором ниже чем над растворителем , Р и Т связаны
P
Т
760
тв
пар
ж
чистый р-ль
раствор
Ткип
р-ля
Ткип
р-ра
Тзам
р-ра
Тзам
р-ля
∆Ткип
∆Т зам
Слайд 31ΔТзам = K ∙ Сm ≈ K ∙ С
ΔТкип = E
неэлектролиты электролиты
ΔТзам = i ∙ K ∙ Сm ≈ i ∙ K ∙ С
ΔТкип = i ∙ E ∙ Сm ≈ i ∙ E ∙ С
К – криоскопическая постоянная, град∙кг/моль
Е – эбулиоскопическая постоянная , град∙кг/моль








![Pосм = RTС (идеальные растворы)CИ: Pосм [ Па = Н/м2], C [ моль/м3],](/img/tmb/4/383252/7bdfbb4c2e7f06069f495efd9d62d9b6-800x.jpg)