- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Классификация реагентов и реакций в органической химии. (Лекция 4) презентация
Содержание
- 1. Классификация реагентов и реакций в органической химии. (Лекция 4)
- 2. Основные определения Реакционная способность - способность вещества
- 4. Типы реагентов Кислотные реагенты - доноры протона
- 5. Типы реагентов Нуклеофилы - частицы, образую-щие новую
- 6. Типы реагентов Радикалы - свободные атомы или
- 7. Способы разрыва ковалентной связи Гомолитический (свободнорадикальный) (гомолиз) Гетеролитический (ионный) (гетеролиз)
- 8. Признаки классификации органических реакций
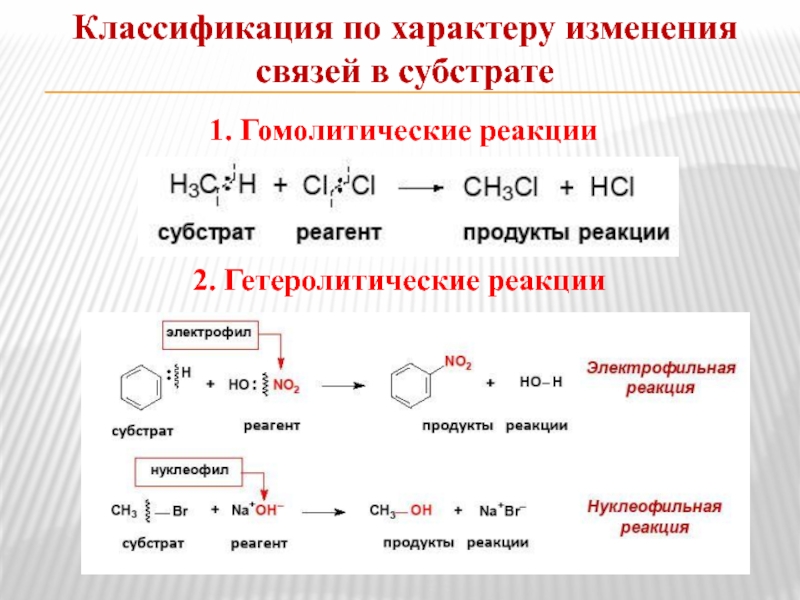
- 9. Классификация по характеру изменения связей в субстрате
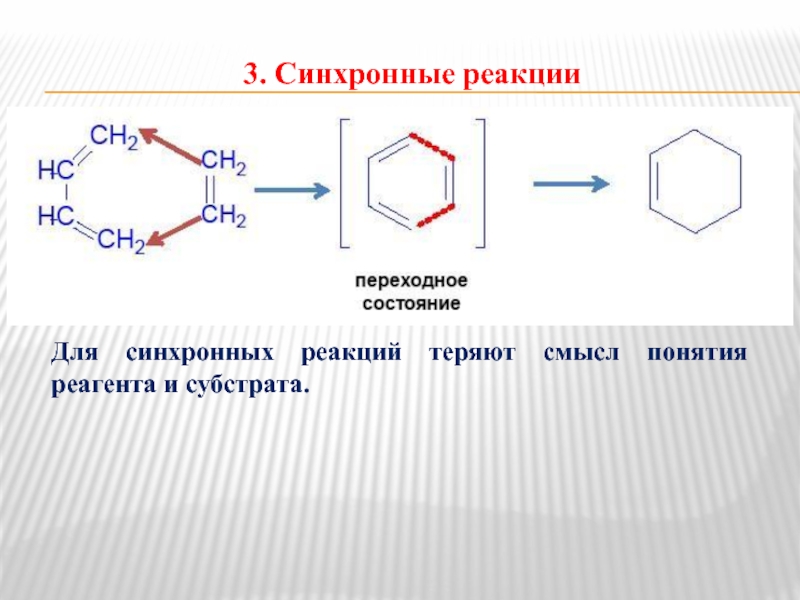
- 10. 3. Синхронные реакции Для синхронных реакций теряют смысл понятия реагента и субстрата.
- 11. Классификация по типу реагента
- 12. Классификация по направлению реакции
- 13. Классификация по числу частиц Мономолекулярные (диссоциативные) Бимолекулярные (ассоциативные)
- 14. Понятие о механизме реакции Механизм реакции -
- 15. Факторы, определяющие реакционную способность органических соединений
- 16. Включают оценку энергии промежуточных частиц или переходного
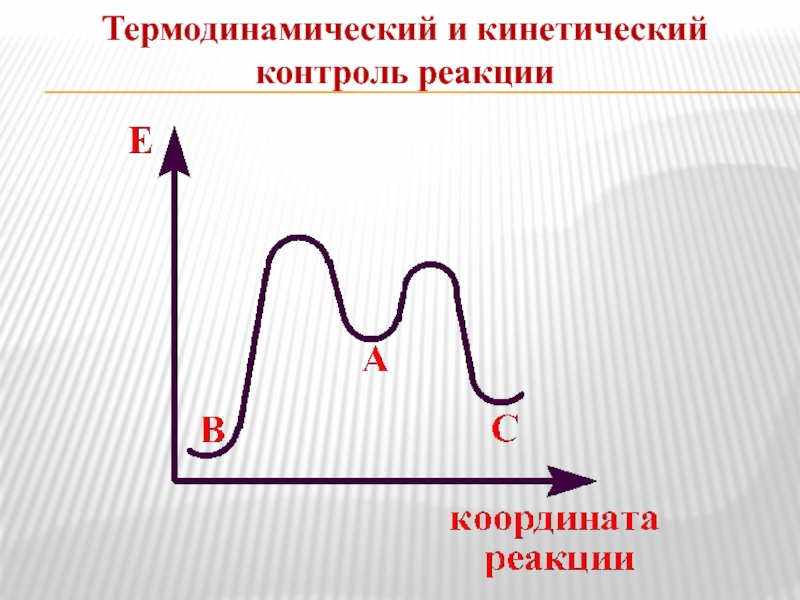
- 17. Термодинамический и кинетический контроль реакции
Слайд 2Основные определения
Реакционная способность - способность вещества вступать в ту или иную
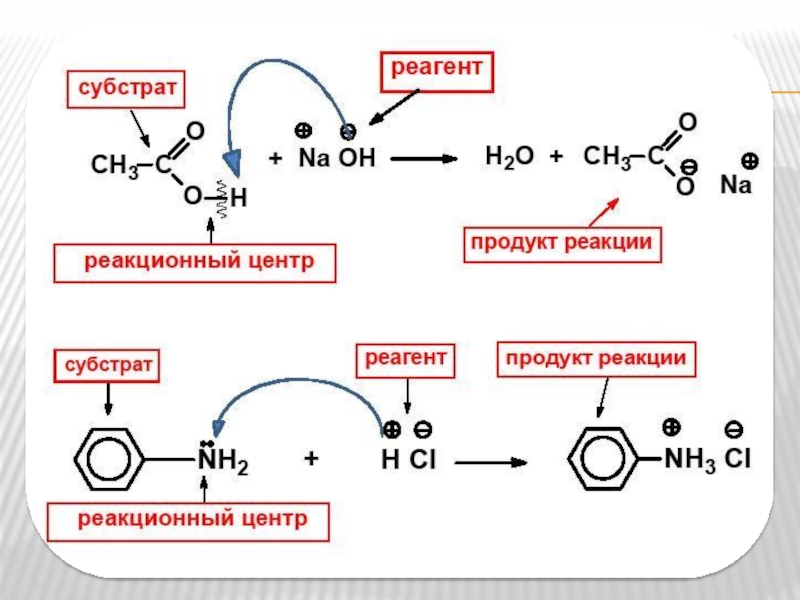
Реакционный центр - атом или группа атомов в молекуле, непосредственно участвующие в химической реакции.
Субстрат - вещество, реакционная способность которого по отношению к реагенту рассматривается в данной химической реакции.
Реагент - действующее на субстрат вещество (реакционная частица).
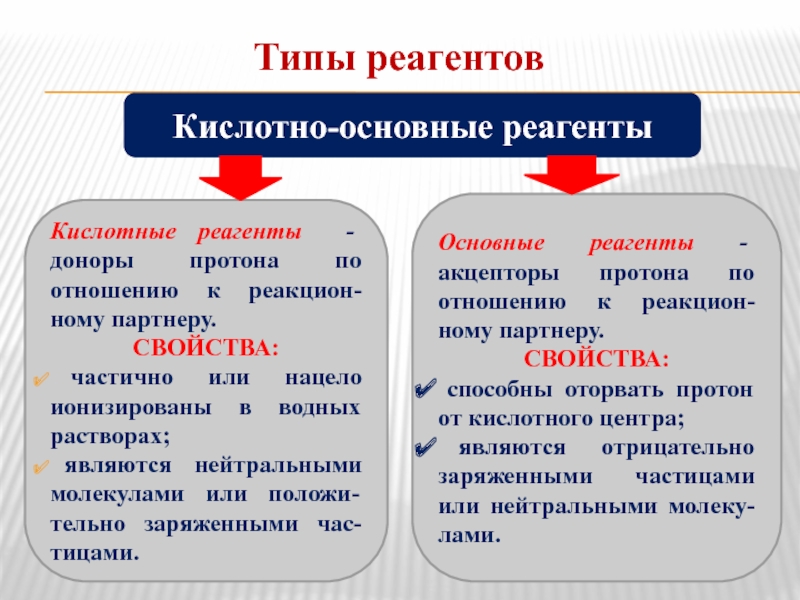
Слайд 4Типы реагентов
Кислотные реагенты - доноры протона по отношению к реакцион-ному партнеру.
СВОЙСТВА:
являются нейтральными молекулами или положи-тельно заряженными час-тицами.
Кислотно-основные реагенты
Основные реагенты - акцепторы протона по отношению к реакцион-ному партнеру.
СВОЙСТВА:
способны оторвать протон от кислотного центра;
являются отрицательно заряженными частицами или нейтральными молеку-лами.
Слайд 5Типы реагентов
Нуклеофилы - частицы, образую-щие новую ковалентную связь за счет своей
СВОЙСТВА:
обладают повышенной элект-ронной плотностью, взаимодейст-вуют с любым атомом (кроме водорода), несущим частичный или полный положительный заряд;
нуклеофил заряжен отрицательно или имеет неподеленную пару электронов (или π-связь).
Символ Nu– или Nu
Нуклеофильные и электрофильные реагенты
Электрофилы – частицы, образу-ющие новую ковалентную связь за счет пары электронов партнера.
СВОЙСТВА:
имеют недостаток электронов;
взаимодействуют с реакцион-ным центром партнера с повы-шенной электронной плотнос-тью;
имеют атом, несущий частич-ный или полный положительный
заряд или обладают вакантной орбиталью.
Символ E+ или E
Слайд 6Типы реагентов
Радикалы - свободные атомы или частицы с неспаренным электроном.
Символ R
Окислители
Символ [O] (или Ox)
Восстановители - нейтральные молекулы или ионы, отдающие электроны или атомы водорода органическому субстрату.
Символ [H] (или Red)
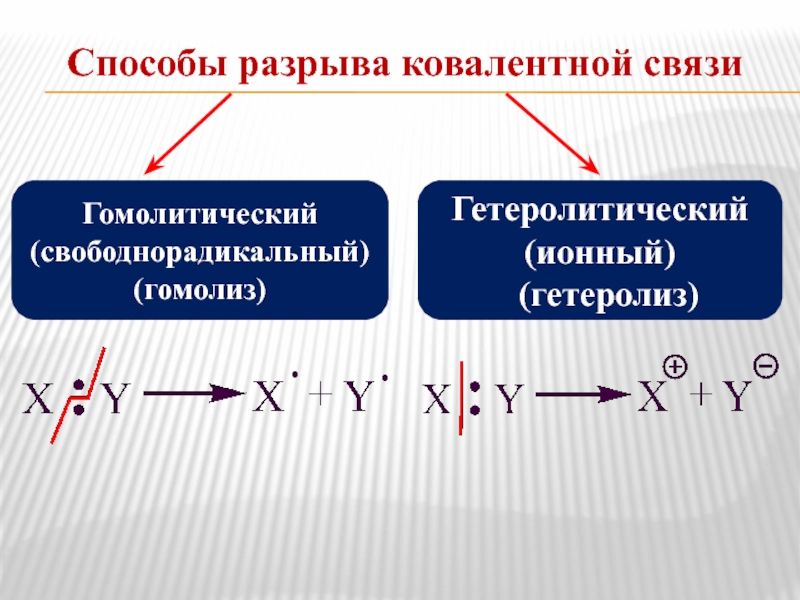
Слайд 7Способы разрыва ковалентной связи
Гомолитический (свободнорадикальный) (гомолиз)
Гетеролитический (ионный)
(гетеролиз)
Слайд 8Признаки классификации органических реакций
по
по типу реагента;
по направлению реакции;
по числу молекул, принимающих участие в стадии, определяющей скорость реакции.
Слайд 9Классификация по характеру изменения связей в субстрате
1. Гомолитические реакции
2. Гетеролитические
Слайд 11Классификация по типу реагента
Радикальные
(R)
Электрофильные
(E)
Нуклеофильные
(N)
Окислительные
[O]
Восстановительные
[H]
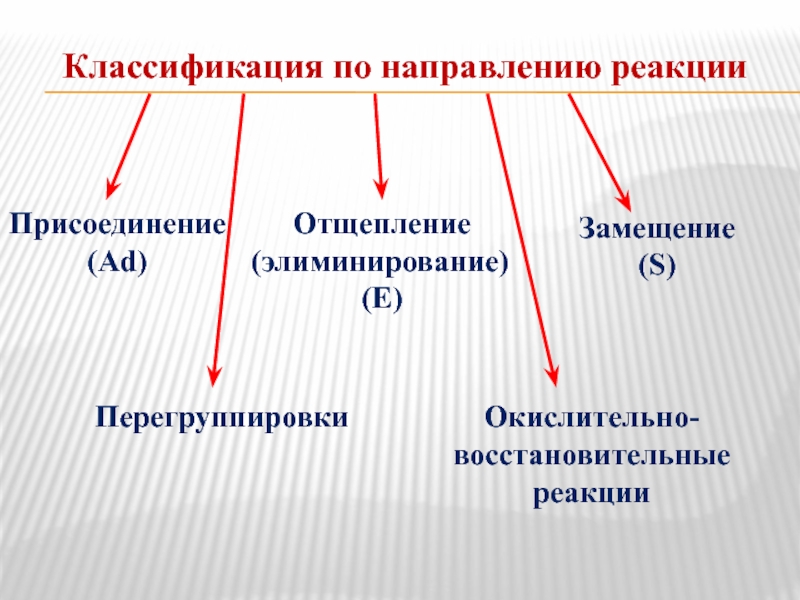
Слайд 12Классификация по направлению реакции
Присоединение
(Ad)
Отщепление
(элиминирование)
(E)
Замещение
(S)
Перегруппировки
Окислительно-
восстановительные
реакции
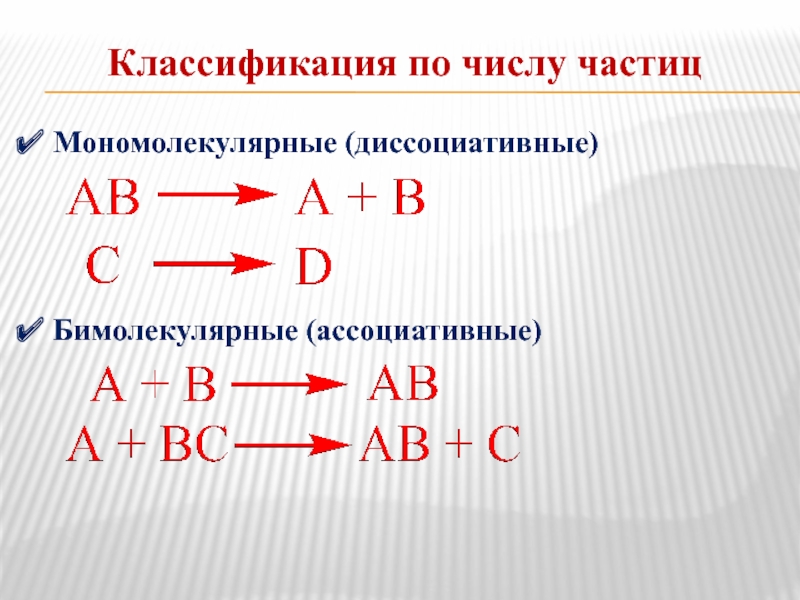
Слайд 13Классификация по числу частиц
Мономолекулярные (диссоциативные)
Бимолекулярные (ассоциативные)
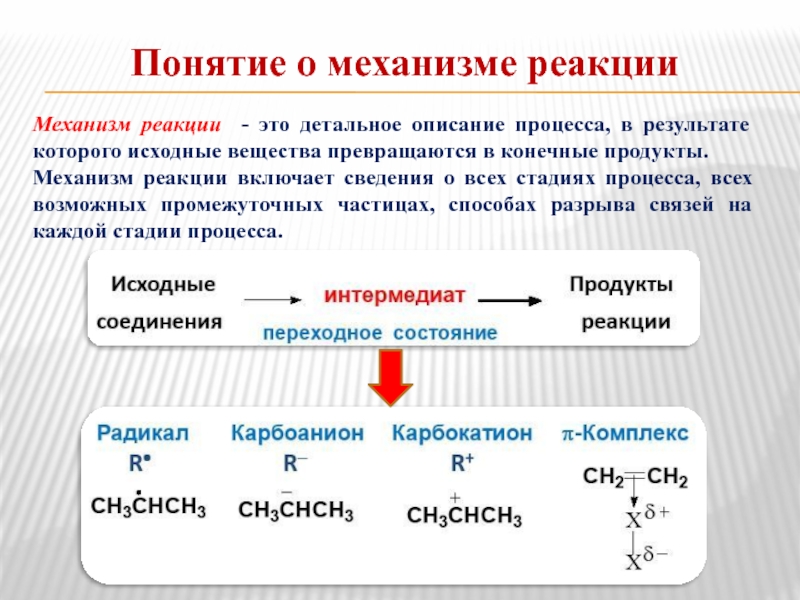
Слайд 14Понятие о механизме реакции
Механизм реакции - это детальное описание процесса, в
Механизм реакции включает сведения о всех стадиях процесса, всех возможных промежуточных частицах, способах разрыва связей на каждой стадии процесса.
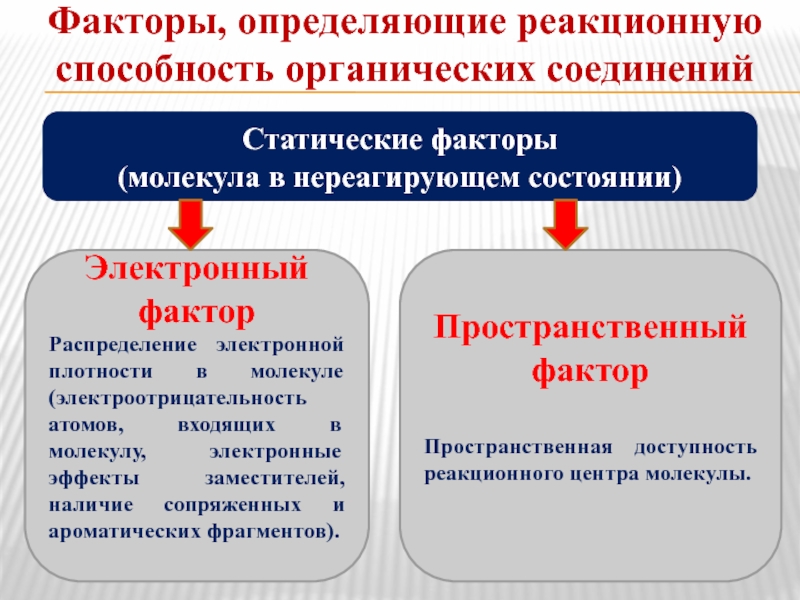
Слайд 15Факторы, определяющие реакционную способность органических соединений
Статические факторы
(молекула в нереагирующем состоянии)
Электронный фактор
Распределение
Пространственный фактор
Пространственная доступность реакционного центра молекулы.
Слайд 16Включают оценку энергии промежуточных частиц или переходного состояния.
Чем больше возможностей для
Динамические факторы
(молекула в реагирующем состоянии)





![Классификация по типу реагента Радикальные(R)Электрофильные(E)Нуклеофильные(N)Окислительные[O]Восстановительные[H]](/img/tmb/5/495546/9e9b9db420021f1b6603deb593f0f0d8-800x.jpg)