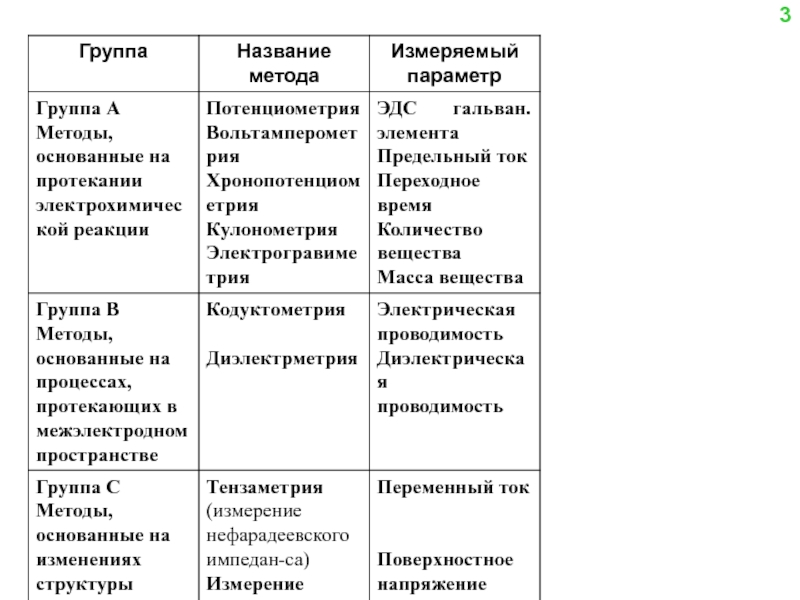
∙ методы, основанные на протекании электродной реакции (группа А);
∙ методы, не связанные с протеканием электродной реакции (группа В);
∙ методы, связанные с изучением изменения структуры двойного слоя (группа С).
Классификация по способу выполнения :
∙ прямые методы, в которых концентрация компонента определяется непосредственно из величины регистрируемого электрохимического параметра (ионометрия, прямая амперометрия, потенциостатическая кулонометрия);
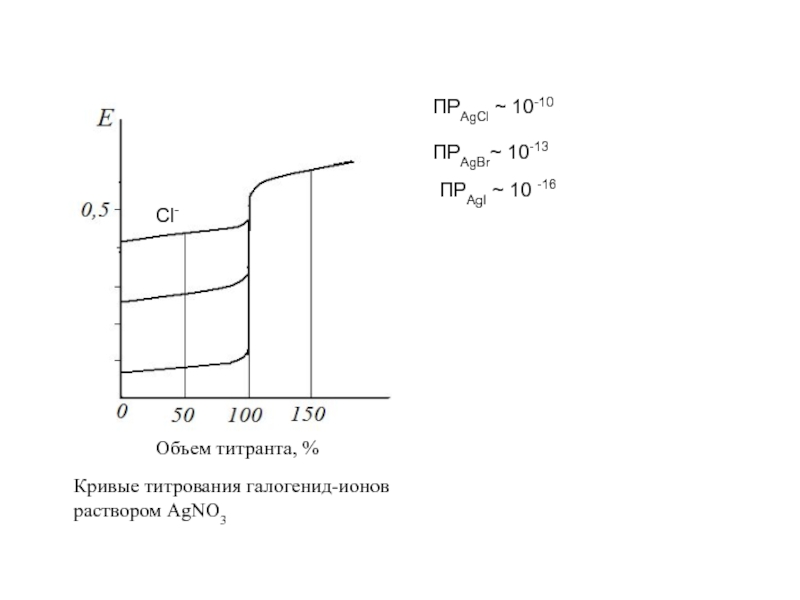
∙ косвенные методы или титриметрия с электрохимическими способами индикации конечной точки титрования (потенциометрическое, амперометрическое, кулонометрическое титрование)
∙ инверсионные методы, в которых с помощью электрохимической реакции обычно на поверхности рабочего электрода проводят предварительное концентрирование анализируемого вещества, а затем его определение путем проведения той же реакции в обратном направлении (инверсионная вольтамперометрия)
1



![y = [B+] = [A-] − [H+] + Kw / [H+] (4) y =](/img/tmb/4/331716/b2daa3bb812974866aa92424da696b03-800x.jpg)

![[H+] pH P=2,3([H+]+[OH-])](/img/tmb/4/331716/7db90afbd1086ef85c917b0bb28b85c0-800x.jpg)
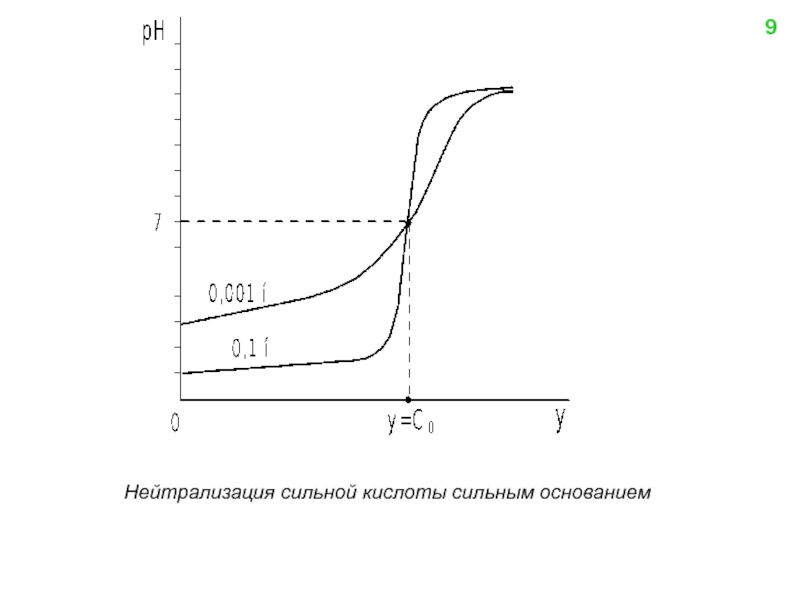
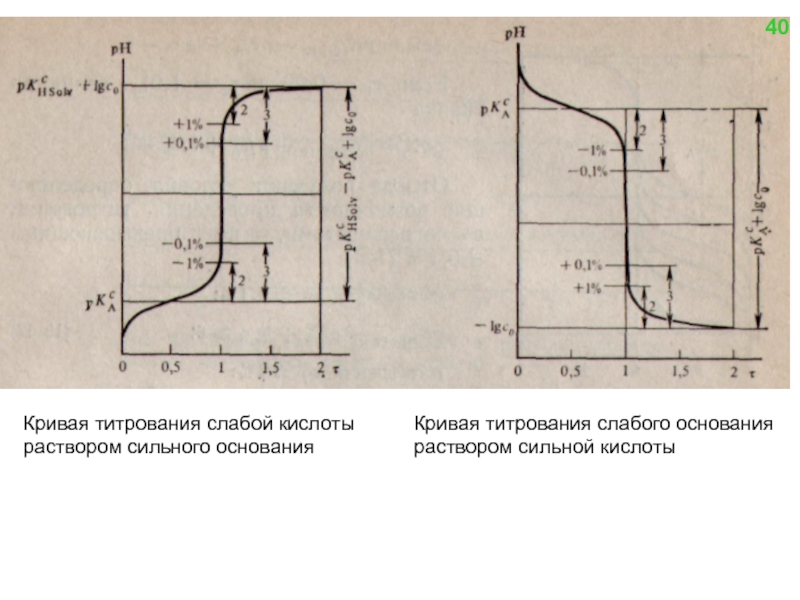
![Нейтрализация слабой кислоты сильным основанием y = [B+] = [A-] − [H+] + Kw /](/img/tmb/4/331716/a53b72b71356d55151171ee9526f735e-800x.jpg)
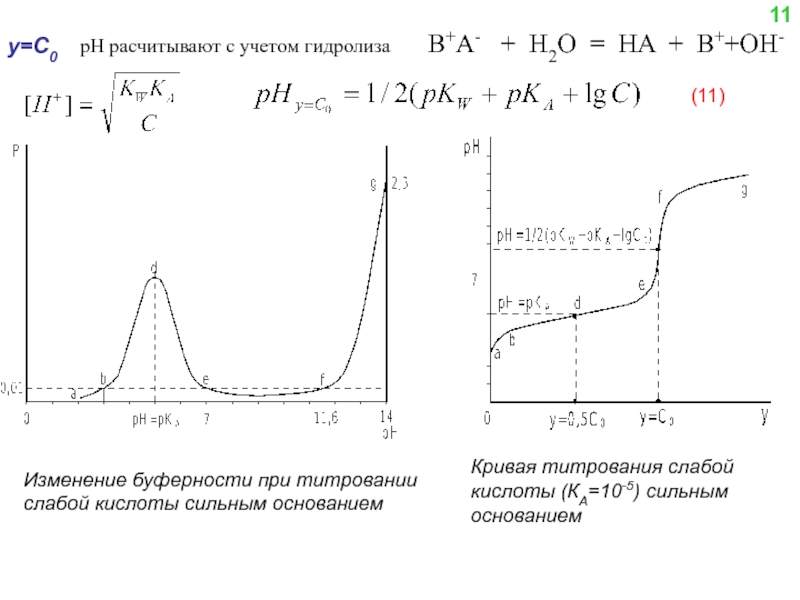
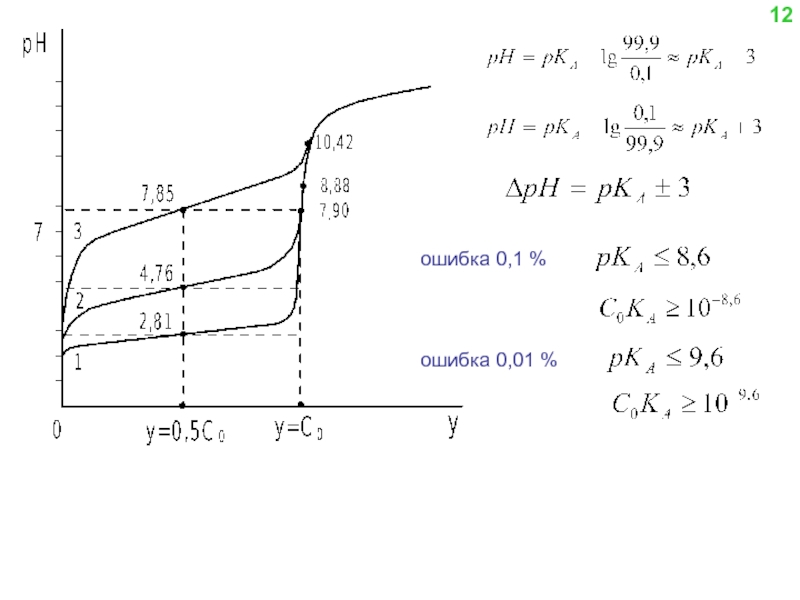

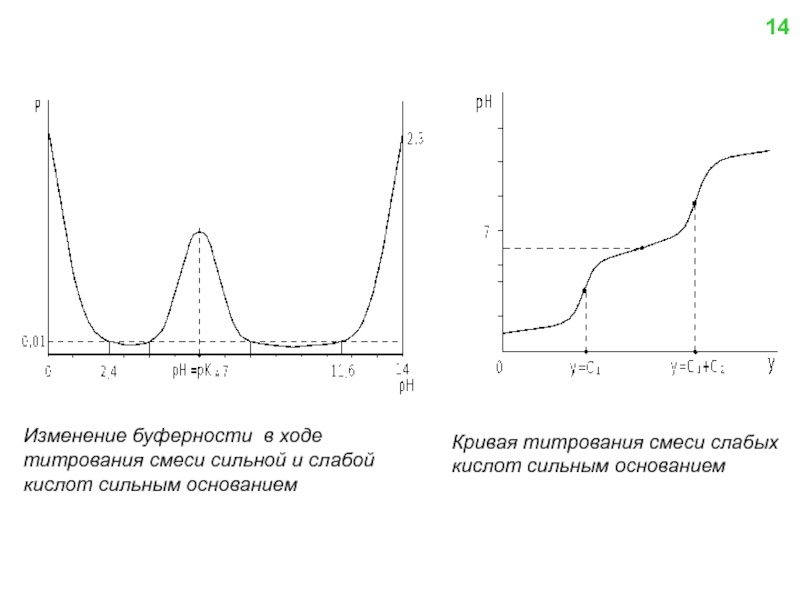































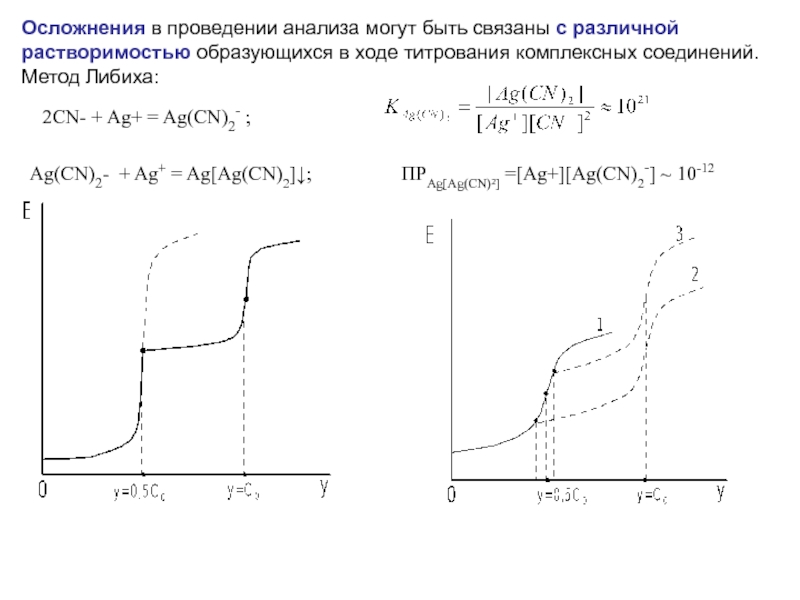

![Образующийся при титровании комплексонат СaY2- характеризуется константой устойчивости βCaY2-:(8) Из уравнения (8) находим [Y4-] и](/img/tmb/4/331716/0ba96f883c7b3af57fc3c42a0804dd56-800x.jpg)