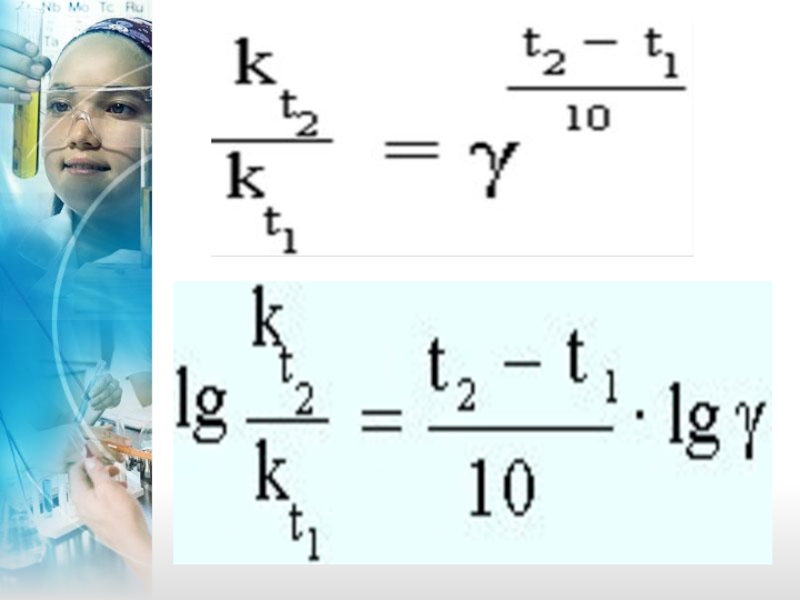- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Кинетика. Химическое равновесие презентация
Содержание
- 1. Кинетика. Химическое равновесие
- 2. Кинетика – это раздел химии, изучающий скорость,
- 3. Скорость химической реакции –
- 4. Скорость реакции для гомогенных систем: для гетерогенных систем:
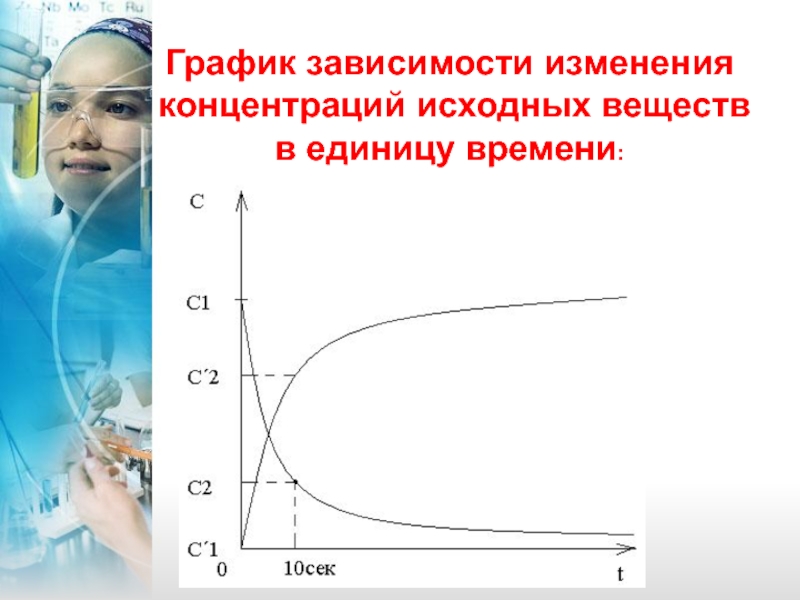
- 5. График зависимости изменения концентраций исходных веществ в единицу времени:
- 6. Мгновенная скорость – это
- 7. Скорость реакции зависит от: - концентрации
- 8. Зависимость скорости реакции от концентрации впервые была
- 9. Например для процесса: aA + bB
- 10. Большинство процессов происходит через несколько элементарных стадий,
- 11. Скорость многостадийной реакции определяется скоростью самой медленной
- 12. Сложные реакции могут быть: - последовательные (идут
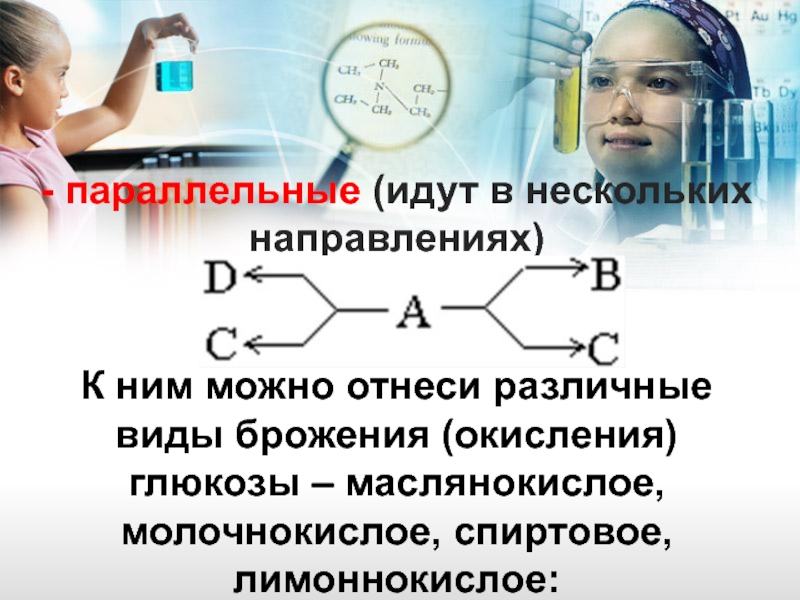
- 13. - параллельные (идут в нескольких направлениях)
- 15. - сопряженные (это такие две реакции, одна
- 16. - конкурирующие – это сложные реакции, в
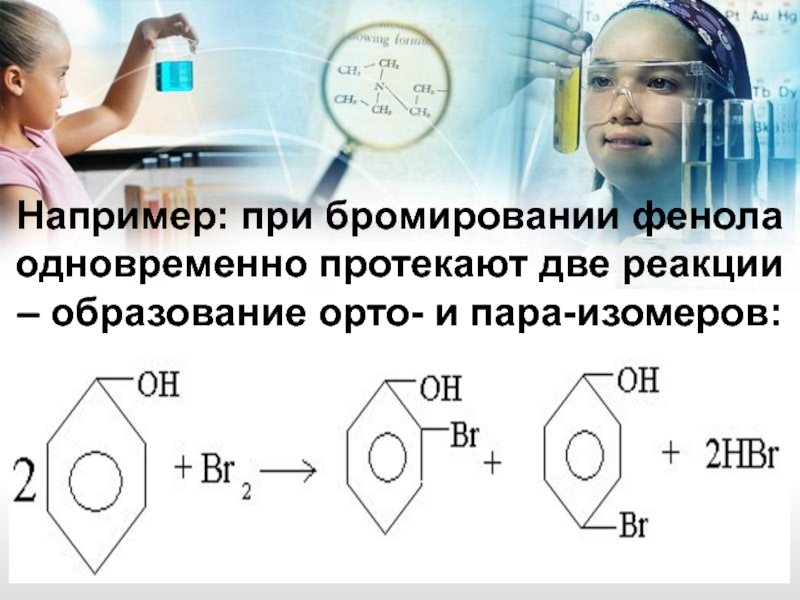
- 17. Например: при бромировании фенола
- 18. Кинетические уравнения могут быть I
- 19. К уравнениям второго порядка относятся реакции
- 20. В биохимических процессах нет реакций,
- 21. Период полупревращения Для реакций I порядка:
- 22. Кинетические закономерности распределения лекарственных препаратов во внутренней
- 23. Экспериментальные методы определения скорости реакций: химические, физические
- 24. Зависимость скорости реакции от температуры – Закон
- 26. Уравнение Аррениуса:
- 27. Где: k – постоянная скорости реакции; А
- 28. Энергия активации - избыточная энергия, необходимая для
- 30. Скорость реакции для газообразных веществ зависит от
- 31. Катализаторы изменяют скорость химической реакции, сохраняя при
- 32. Катализ подразделяют на положительный (каталитический) и отрицательный
- 33. Различают катализ гомогенный (реагирующие вещества и катализатор
- 34. Микрогетерогенный катализ – в нем используют
- 35. Характерные особенности ферментов: - Высокая эффективность
- 36. - Высокая специфичность, которая осуществляет специфический контакт
- 37. Активаторами ферментов могут быть ионы
- 38. Теорию ферментативного катализа предложили Мехаэллис и Ментен в 1913 году.
- 39. Они вывели формулу зависимости стационарной скорости
- 40. Где: Vм, Kм – постоянные величины для
- 42. Леонор Михаэлис, Мод Ментен и их грустная
- 43. В настоящее время развивается медицинская энзимология
- 44. Принцип Ле-Шателье самостоятельно. Уравнение изотермы:
- 45. Из уравнения видно, что меньшим значениям ΔG
- 46. Расчет энтальпии:
- 47. По уравнению изобары видно, что экзотермические
- 48. Благодарю за внимание!
Слайд 2Кинетика – это раздел химии, изучающий скорость, механизмы, факторы, от которых
Некоторые реакции протекают быстро, за тысячные доли секунд. Это реакции нейтрализации, ионного обмена, взрыва.
Медленные реакции: коррозия, большинство биологических процессов. Белки в организме обновляются за 0,5 года, а неорганические ткани за 4-7 лет.
Слайд 3
Скорость химической реакции – это изменение концентрации исходных веществ
.
Слайд 7 Скорость реакции зависит от:
- концентрации реагентов
- агрегатного состояния (газ, жидкость,
- природы растворителя
- поверхности реагирующих веществ
- давления
- температуры
- катализатора
Слайд 8Зависимость скорости реакции от концентрации впервые была сформулирована в 1867 году
Скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях их стехиометрических коэффициентов.
Слайд 9
Например для процесса:
aA + bB ↔ cC + dD
Скорость прямой реакции:
V
Скорость обратной реакции:
V = k2∙[C]c ∙[D]d
величины a, b, c, d – порядок реакции по веществу A, B, C, D, а сумма их называется общим порядком.
Слайд 10Большинство процессов происходит через несколько элементарных стадий, в которых принимают участие
1, 2, 3 молекулы.
Число молекул, участвующих в определенных стадиях называют молекулярностью. Чаще одно-, двухмолекулярные, редко - трехмолекулярные .
Слайд 11Скорость многостадийной реакции определяется скоростью самой медленной стадии.
В зависимости от механизма
Слайд 12Сложные реакции могут быть:
- последовательные (идут через несколько разных промежуточных стадий,
A→B→C→D→…
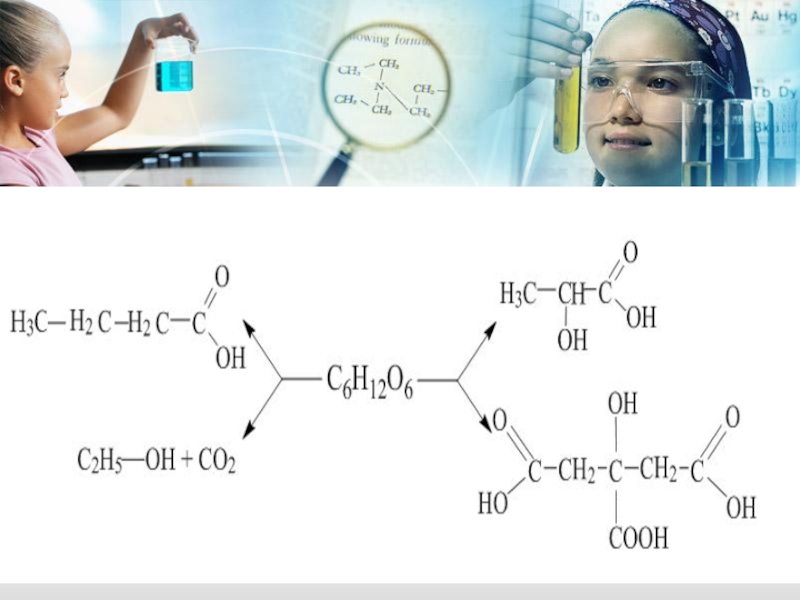
Например: биологическое окисление глюкозы, реакции фотосинтеза, перекисного окисления липидов – цепные радикальные реакции.
Слайд 13- параллельные (идут в нескольких направлениях)
К ним можно отнеси различные виды
Слайд 15- сопряженные (это такие две реакции, одна из которых вызывает в
Бывают случаи когда реакция термодинамики невыгодна (∆G > 0), однако она может осуществляться путем сопряжения со второй, выгодной реакцией, где ∆G << 0.
Например, большинство реакций, происходящих в организме сопряжены с гидролизом АТФ.
Слайд 16- конкурирующие – это сложные реакции, в которых одно и тоже
A + B1 → X1
A + B2 → X2
Слайд 17 Например: при бромировании фенола одновременно протекают две реакции – образование орто-
Слайд 18 Кинетические уравнения могут быть I и II порядка, которые
Ʈ – время взаимодействия;
Сo(х)– первоначальная концентрация вещества;
С(х) – конечная концентрация вещества.
Слайд 19К уравнениям второго порядка относятся реакции
соединения и обмена:
А + В
А + В → С + D
Молекулярность и порядок равны 2.
Константа второго порядка рассчитывается:
Слайд 20
В биохимических процессах
нет реакций, имеющих
порядок более второго.
Количественной характеристикой протекания
Слайд 21Период полупревращения
Для реакций I порядка:
Ʈ½ = 0,693/ k1
Для реакций II
Ʈ ½ = 1/(Co∙k2)
Слайд 22Кинетические закономерности распределения лекарственных препаратов во внутренней среде изучаются фарамакокинетикой. Основная
Слайд 23Экспериментальные методы определения скорости реакций: химические, физические и биохимические методы.
Химические: гравиметрия,
Физические: спектральные методы, метод ЭПР (электронный парамагнитный резонанс), ЯМР (ядерно-магнитный резонанс).
Слайд 24Зависимость скорости реакции от температуры – Закон Вант – Гоффа: при
Слайд 27Где: k – постоянная скорости реакции;
А - предэкспоненциальный множитель, который отражает
е – основание натурального логарифма;
T – температура (в Кельвинах);
R = 8,31Дж/моль∙Кл;
Eакт – энергия активации.
Слайд 28Энергия активации - избыточная энергия, необходимая для вступления реагирующих веществ в
Энергия активации обычно находится в пределах:
40 - 200 кДж/моль
Слайд 30Скорость реакции для газообразных веществ зависит от давления: с повышением давления
Слайд 31Катализаторы изменяют скорость химической реакции, сохраняя при этом свой состав, они
чтобы ускорить процесс + К:
А + К → АК
АК + В → С + К
Слайд 32Катализ подразделяют на положительный (каталитический) и отрицательный (ингибирующий). В организме ингибиторы
Слайд 33Различают катализ гомогенный (реагирующие вещества и катализатор находятся в одной фазе:
Слайд 34
Микрогетерогенный катализ – в нем используют ВМС в коллоидном состоянии, т.е.
Слайд 35Характерные особенности ферментов:
- Высокая эффективность (в тысячи раз эффективнее химических катализаторов).
2 H2O2 → 2 H2O + O2
В организме под действием фермента каталазы скорость данной реакции повышается в 3∙1011.
Слайд 36- Высокая специфичность, которая осуществляет специфический контакт активного центра фермента с
- Проявляют свою активность в определенных интервалах температуры и pH-среды при t˚ = 36,9 – 42,0; pH = 1,5 – 9 (в крови - 7,36).
Слайд 37 Активаторами ферментов могут быть ионы металлов и сложные органические
Слайд 39
Они вывели формулу зависимости стационарной скорости ферментативной реакции (Vст) от концентрации
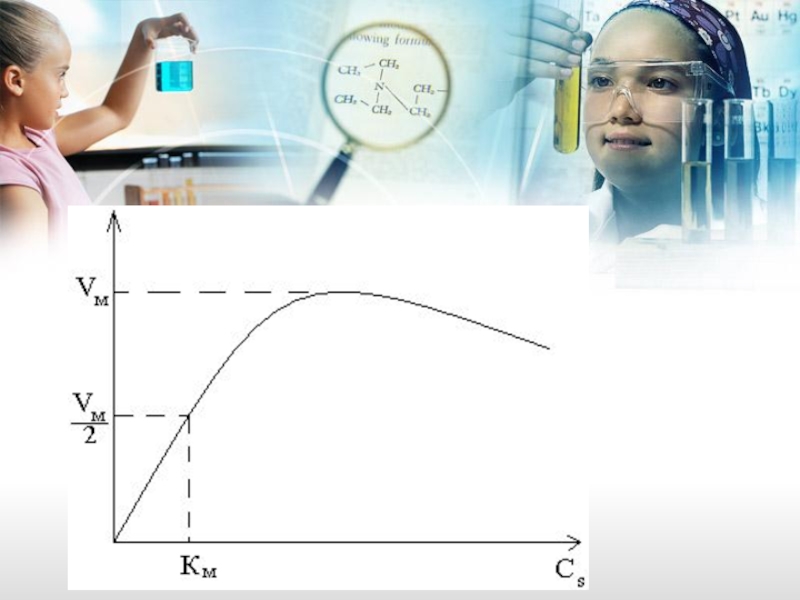
Слайд 40Где: Vм, Kм – постоянные величины для определенных ферментов.
Vм – это
Величина Kм численно равна такой концентрации субстрата, при которой
Vст = ½ ∙Vм. Константа Михаэлиса зависит от температуры, pH-среды и природы субстрата.
Слайд 42Леонор Михаэлис, Мод Ментен и их грустная кривая ,
говорящая о
опять же после 7 тортов , восьмой не захочешь
вот такой грустно-философский взгляд на их открытие.
Слайд 43
В настоящее время развивается медицинская энзимология – наука, занимающаяся изучением применения
При производстве антибиотиков используется ферментативный катализ.
Слайд 44Принцип Ле-Шателье самостоятельно.
Уравнение изотермы:
∆G = -2,3∙R∙T∙lg Kpавн.
Химическое равновесие:
=
Слайд 45Из уравнения видно, что меньшим значениям ΔG отвечают большие величины Кр,
Слайд 47
По уравнению изобары видно, что экзотермические реакции
(∆Н < 0) идут
а эндотермические (∆Н > 0)
- в прямом направлении при повышении температуры.







![Например для процесса:aA + bB ↔ cC + dDСкорость прямой реакции:V = k1∙[A]a ∙[B]b Скорость](/img/tmb/5/411576/b7c5cd9dc04eab43909b40cc7fddc3e8-800x.jpg)