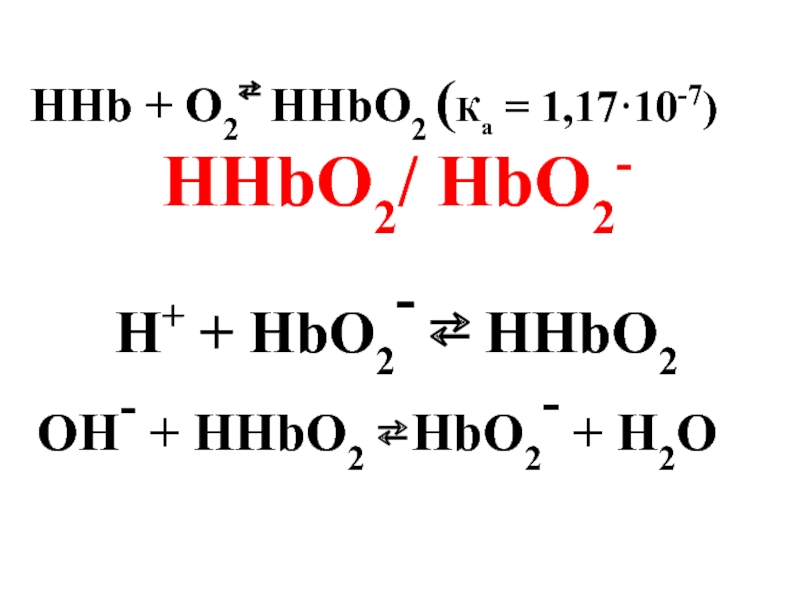- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Растворы электролитов. Буферные растворы. Лекция 4 презентация
Содержание
- 1. Растворы электролитов. Буферные растворы. Лекция 4
- 2. 4.1 Сильные и слабые электролиты 4.2. Кислотность
- 3. 4.1. Электролиты – это вещества, диссоциирующие в
- 4. К слабым электролитам относятся соединения, частично (обратимо)
- 5. Равновесие между молекулами и ионами в растворе
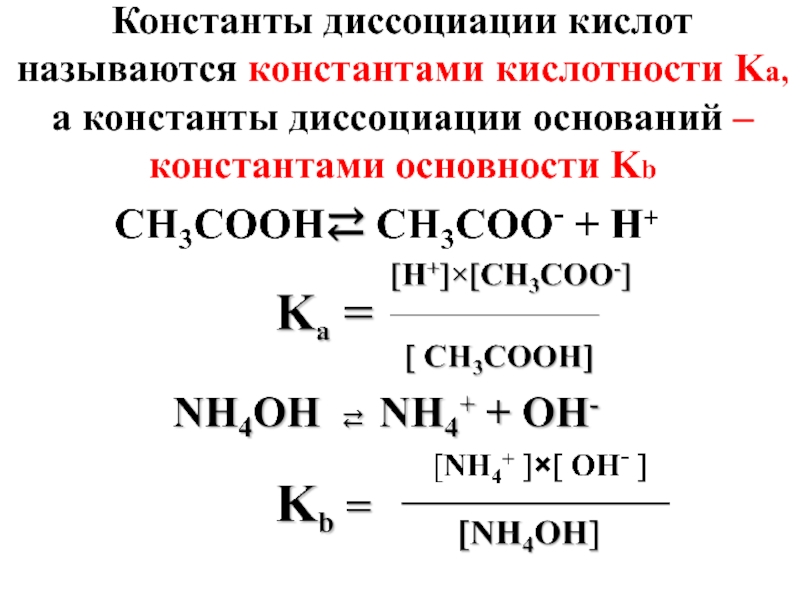
- 6. Константы диссоциации кислот называются константами кислотности Ka, а константы диссоциации оснований – константами основности Kb
- 7. Слабые электролиты подчиняются закону разбавления Оствальда: при
- 8. Сильные электролиты - это соединения, полностью диссоциирующие в водных растворах (α = 100%)
- 9. Из-за высокой концентрации ионов в растворе сильного
- 10. В растворе сильного электролита вокруг каждый ион
- 11. Во внешнем электрическом поле ион и его
- 12. Концентрация ионов, рассчитанная по электропроводности, меньше, чем
- 13. а) удерживают воду в виде гидратов; б)
- 14. в) влияют на растворимость биологически активных соединений.
- 15. 4.2 Кислотность является важной характеристикой как водных
- 16. Для характеристики кислотности используется водородный показатель (рН)
- 17. Реже для характеристики реакции среды используется гидроксильный
- 18. Для одного раствора рН + рОН = 14
- 19. Константа равновесия, описывающая диссоциацию воды (ионное
- 20. В кислой среде: [H+] > [OH-] рН
- 21. Шкала рН [Н+],M pH 1
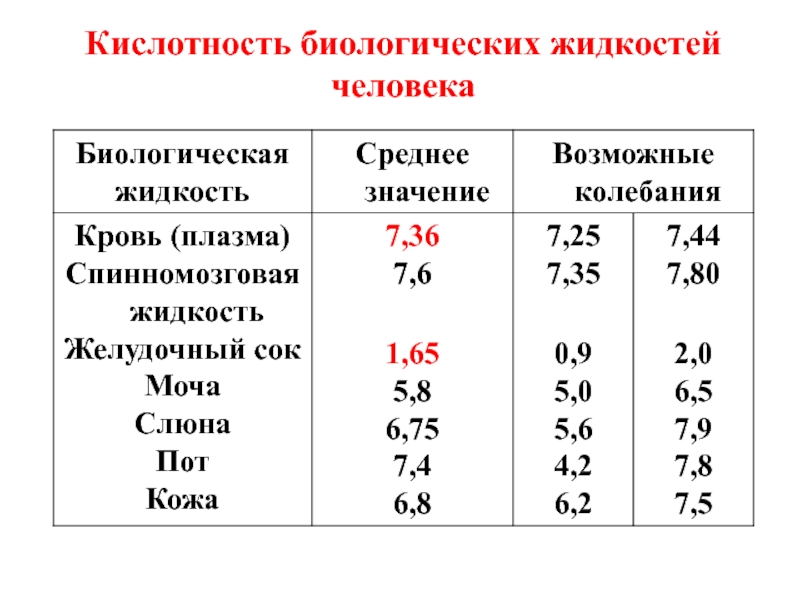
- 22. Кислотность биологических жидкостей человека
- 23. Для биологических жидкостей характерен кислотно-основной гомеостаз (постоянство значений рН), обусловленный действием биологических буферных систем.
- 24. Нарушение кислотно-основного равновесия приводит: к ацидозу
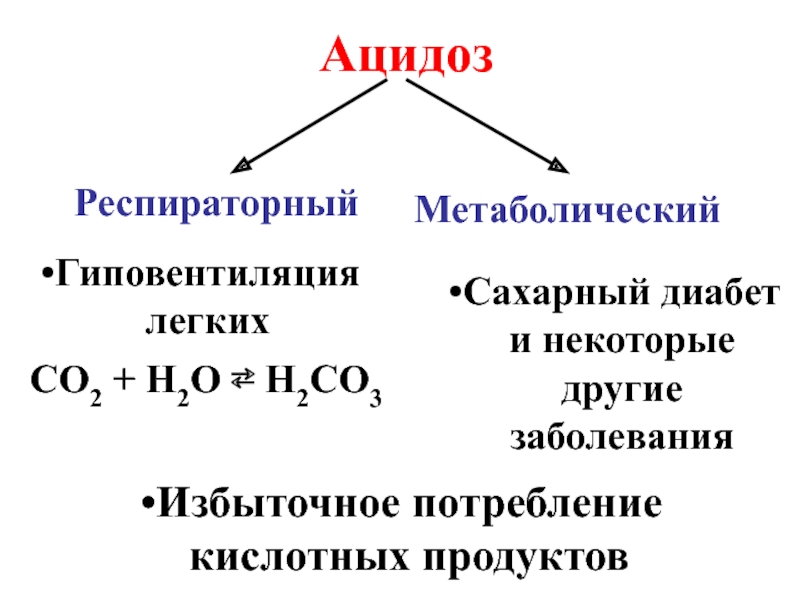
- 25. Ацидоз Респираторный Метаболический Гиповентиляция легких CO2 +
- 26. Здоровая диета должна содержать 60% основных и 40% кислотных компонентов пищи.
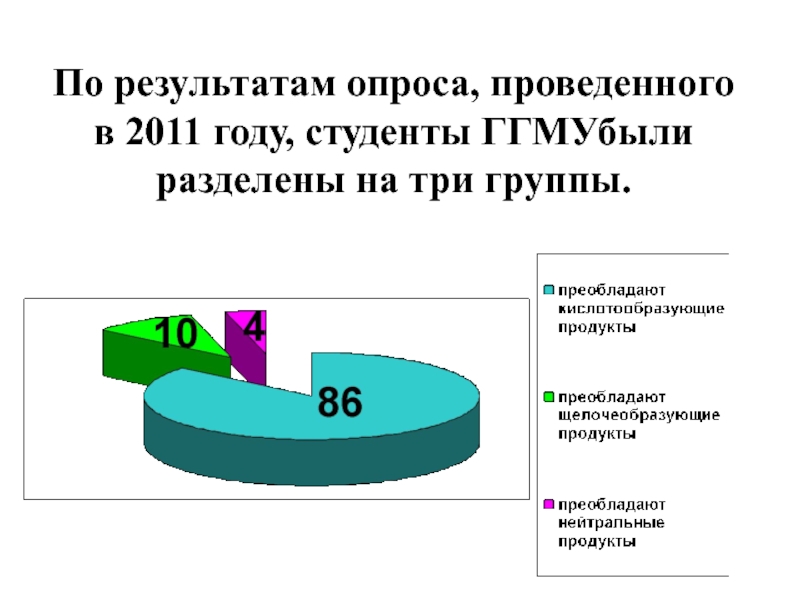
- 27. По результатам опроса, проведенного в 2011 году, студенты ГГМУбыли разделены на три группы.
- 28. Алкалоз Гипервентиля-ция легких (неврастения) Избыточное потребление щелочных продуктов
- 29. Опасность изменения рН связана 1) со
- 30. 3) с изменением скорости биохимических реакций, катализируемых
- 31. Коррекция ацидоза - внутривенное введение 4%-ного раствора
- 32. Коррекция алкалоза- внутривенное введение растворов аскорбиновой кислоты (5% или 15%).
- 33. 4.3 Буферными называют растворы, рН которых не
- 34. Протолитическая теория кислот и оснований Бренстеда-Лоури (1923)
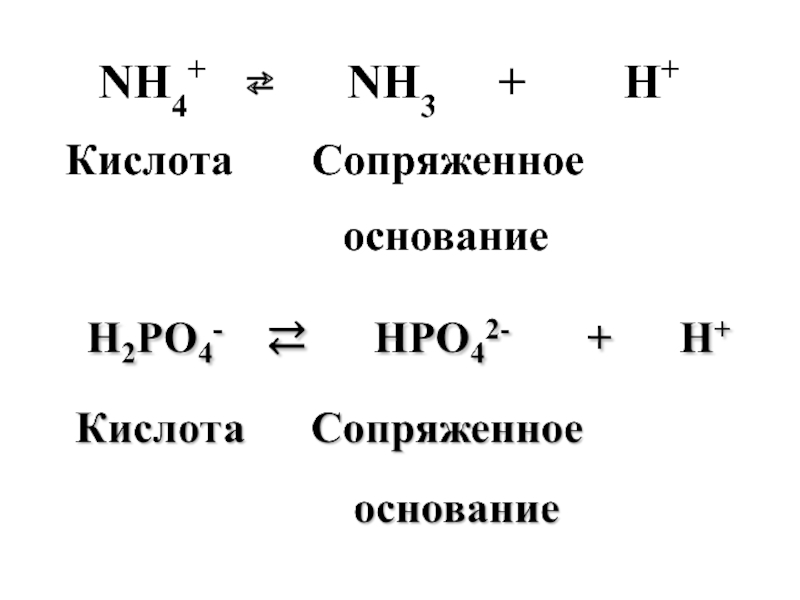
- 35. Различают: кислоты–молекулы (CH3COOH), кислоты-катионы (NH4+), кислоты–анионы (H2PO4-)
- 36. Каждая кислота сопряжена со своим основанием. Основание – это акцептор протонов.
- 37. Cопряженные пары кислот и оснований СH3COOH ⇄
- 38. NH4+ ⇄
- 39. Поскольку буферный раствор содержит кислоту и сопряженное
- 40. Классификация буферных растворов Ацетатный буфер: СН3СООН/СН3СООNa Механизм
- 41. 2) Слабое основание/его соль Аммиачный буфер: NН3/NН4Сl
- 42. 3) Две кислые соли Гидрофосфатный буфер :
- 43. 4) кислая соль/средняя соль Карбонатный буфер:
- 44. Уравнение Гендерсона- Гассельбаха позволяет рассчитать рН буферного
- 45. Буферная емкость раствора (В, ммоль/л) - это
- 46. Буферная емкость зависит: от концентрации: чем выше
- 47. Характеристиками биологических буферных систем являются: Bк –
- 48. Из буферных систем организма наибольшей емкостью характеризуются
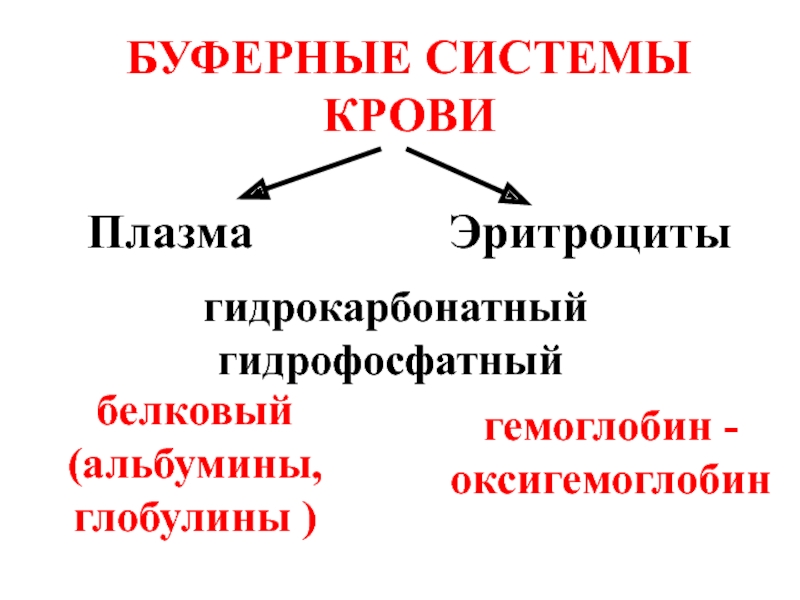
- 49. БУФЕРНЫЕ СИСТЕМЫ КРОВИ Плазма
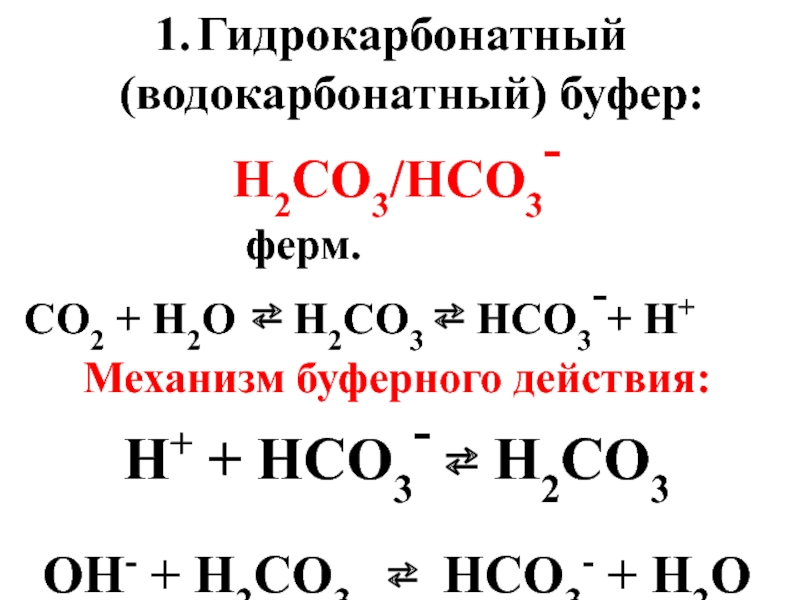
- 50. Гидрокарбонатный (водокарбонатный) буфер: H2CO3/HCO3-
- 51. В крови [HCO3]
- 52. Гидрокарбонатный буфер связан со всеми буферными системами
- 53. Анализируя содержание НСО3- в крови можно диагностировать наличие дыхательных и метаболических нарушений.
- 54. 2. Гидрофосфатная буферная система Н2PO4-/HPO42-
- 55. Однако эта система играет решающую роль в
- 56. 3.Гемоглобин-оксигемоглобин: ННb/Нb- ННb - слабая кислота
- 57. HHb + O2⇄ HHbO2 (Ка = 1,17·10-7)
- 58. Буферная система гемоглобин-оксигемоглобин обеспечивает 75% буферной емкости крови.
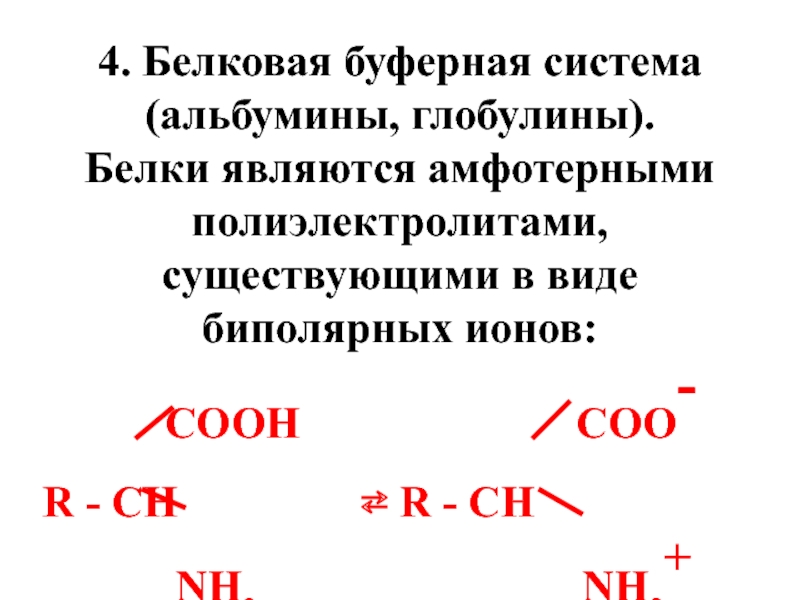
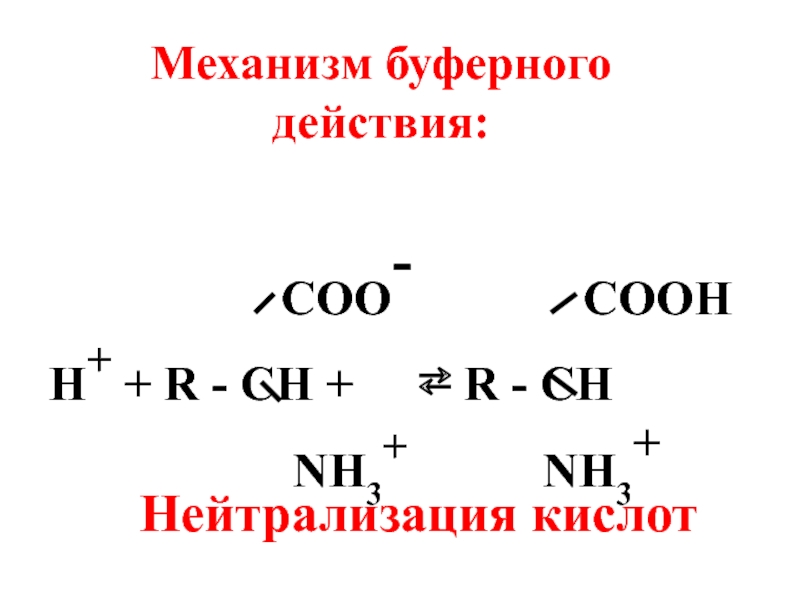
- 59. 4. Белковая буферная система (альбумины, глобулины).
- 62. Вк (альбуминов) = 10 ммоль/л Вк (глобулинов)
- 63. Буферные системы организма обеспечивают кислотно-основной гомеостаз человека.
- 64. Благодарим за внимание!!!
Слайд 24.1 Сильные и слабые электролиты
4.2. Кислотность водных растворов и биологических жидкостей.
4.3 Буферные растворы.
План
Слайд 34.1. Электролиты – это вещества, диссоциирующие в растворах на ионы. К
Слайд 4К слабым электролитам относятся соединения, частично (обратимо) диссоциирующие в водных растворах:
а)
б)труднорастворимыи основания, NH4OH
в) вода.
Слайд 5Равновесие между молекулами и ионами в растворе описываются с помощью констант
Слайд 6Константы диссоциации кислот называются константами кислотности Ka, а константы диссоциации оснований
Слайд 7Слабые электролиты подчиняются закону разбавления Оствальда:
при разбавление раствора водой степень электролитической
, так как
Слайд 9Из-за высокой концентрации ионов в растворе сильного электролита создается электромагнитное поле,
I =
ci -молярная концентрация каждого иона в растворе, zi -заряд каждого иона
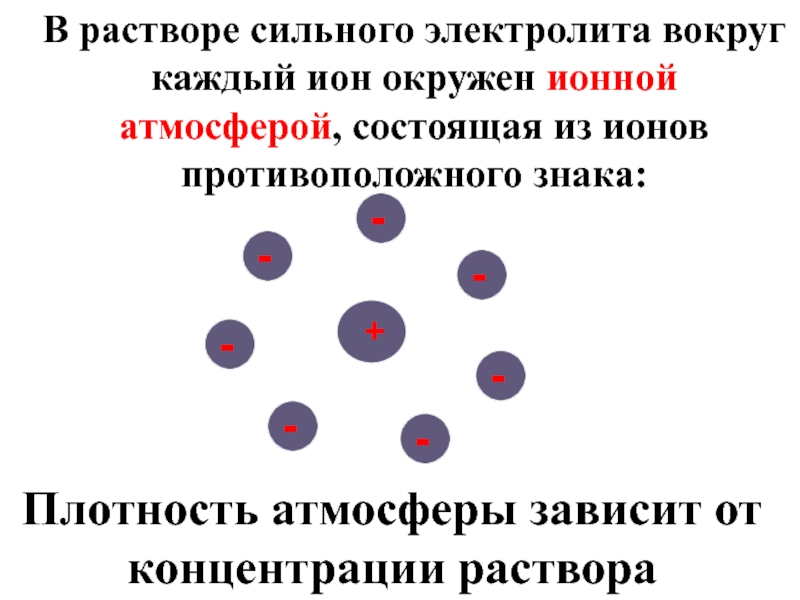
Слайд 10В растворе сильного электролита вокруг каждый ион окружен ионной атмосферой, состоящая
+
-
-
-
-
-
-
-
Плотность атмосферы зависит от концентрации раствора
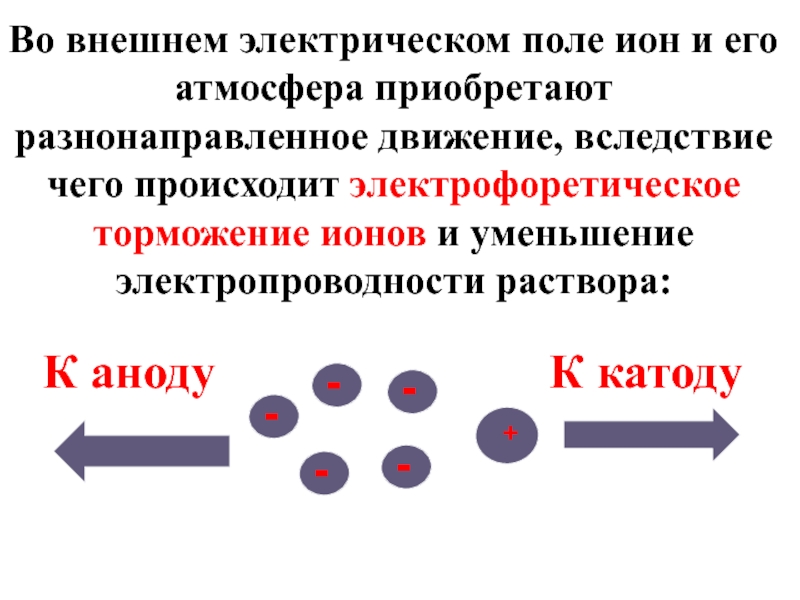
Слайд 11Во внешнем электрическом поле ион и его атмосфера приобретают разнонаправленное движение,
+
-
-
-
-
-
К катоду
К аноду
Слайд 12Концентрация ионов, рассчитанная по электропроводности, меньше, чем их истинная концентрация. «Кажущаяся»
Слайд 13а) удерживают воду в виде гидратов;
б) создают осмотическое давление биологических жидкостей.
Электролиты в организме:
Слайд 14в) влияют на растворимость биологически активных соединений. В разбавленных растворах наблюдается
Слайд 154.2 Кислотность является важной характеристикой как водных растворов, так и биологических
Слайд 16Для характеристики кислотности используется водородный показатель (рН) :
рН = -
а для сильных кислот лучше использовать формулу
рН = - lg аН+
-
Слайд 17Реже для характеристики реакции среды используется гидроксильный показатель (рОН):
рОН =
а для щелочей лучше использовать формулу
рОН = - lg аOH-
Слайд 19
Константа равновесия, описывающая диссоциацию воды (ионное произведение воды),
В нейтральном растворе
[H+] = [OH-] = √10-14 = 10-7моль/л
Соответственно
рН = -lg 10-7 = 7
рOН = -lg 10-7 = 7
Слайд 21Шкала рН
[Н+],M
pH
1
0 5 7 9 14
Сильнокислая среда
Сильнощелочная среда
Слабокислая
среда
Слабощелочная среда
Нейтральная среда
↓
Слайд 23Для биологических жидкостей характерен кислотно-основной гомеостаз (постоянство значений рН), обусловленный действием
Слайд 24Нарушение кислотно-основного равновесия приводит:
к ацидозу – увеличение кислотности внутренней среды
к алкалозу –увеличение ее щелочности.
Слайд 25Ацидоз
Респираторный
Метаболический
Гиповентиляция легких
CO2 + H2O ⇄ H2CO3
Сахарный диабет и некоторые другие заболевания
Избыточное
Слайд 29Опасность изменения рН связана
1) со снижением активности ферментов и гормонов, активных
Слайд 303) с изменением скорости биохимических реакций, катализируемых катионами Н+.
При изменении
Слайд 31Коррекция ацидоза - внутривенное введение 4%-ного раствора NaHCO3:
Антацидными (гипоцидными) называются лекарственные препараты, снижающие кислотность биологических жидкостей
Слайд 334.3 Буферными называют растворы, рН которых не изменяется при добавлении небольших
Слайд 34Протолитическая теория кислот и оснований Бренстеда-Лоури (1923) объясняет механизм буферного действия.
Слайд 39Поскольку буферный раствор содержит кислоту и сопряженное с ней основание, он
Слайд 40Классификация буферных растворов
Ацетатный буфер: СН3СООН/СН3СООNa
Механизм буферного действия
НCl + CH3COONa ⇄ CH3COOH
Нейтрализация добавленной кислоты
NaOH+ CH3COOH ⇄ CH3COONa + H2O
Нейтрализация добавленной щелочи
1)Слабая кислота/ ее соль
Слайд 412) Слабое основание/его соль
Аммиачный буфер: NН3/NН4Сl
Механизм буферного действия
НCl + NH3 ⇄
Нейтрализация добавленной кислоты
NaOH+ NH4Cl ⇄ NH3 + NaCl + H2O
Нейтрализация добавленной щелочи
Слайд 423) Две кислые соли
Гидрофосфатный буфер : NаН2PO4/Nа2НPO4
Механизм буферного действия
НCl + Na2HPO4
Нейтрализация добавленной кислоты
NaOH+ NаH2PO4 ⇄ Na2HPO4 + H2O
Нейтрализация добавленной щелочи
Слайд 43 4) кислая соль/средняя соль
Карбонатный буфер: NаНСO3/Nа2СO3
Механизм буферного действия
НCl + Na2СO3
Нейтрализация добавленной кислоты
NaOH+ NаHСO3 ⇄ Na2СO3 + H2O
Нейтрализация добавленной щелочи
Слайд 44Уравнение Гендерсона- Гассельбаха позволяет рассчитать рН буферного раствора:
рН =рКа - lg
[сопряженное основание]
_
рКа = - lg Ka
Слайд 45Буферная емкость раствора (В, ммоль/л) - это количества сильных кислот или
Слайд 46Буферная емкость зависит:
от концентрации: чем выше концентрация раствора, тем больше его
2) от соотношения концентраций компонентов
[комп. 1]
Вmax при ----------- = 1
[комп. 2]
Слайд 47Характеристиками биологических буферных систем являются:
Bк – буферная емкость по кислоте,
Bщ –
Как правило, Bк > Bщ В организме человека в спокойном состоянии ежесуточно образуется количество кислоты, эквивалентное 2,5 л HCl (конц).
Слайд 48Из буферных систем организма наибольшей емкостью характеризуются буферные системы крови. Они
Слайд 49БУФЕРНЫЕ СИСТЕМЫ КРОВИ
Плазма Эритроциты
гидрофосфатный
белковый (альбумины,
глобулины )
гемоглобин -
оксигемоглобин
Слайд 50Гидрокарбонатный (водокарбонатный) буфер:
H2CO3/HCO3-
СО2 + Н2О ⇄ Н2СО3 ⇄ НСО3-+ Н+
Механизм буферного действия:
Н+ + НСО3- ⇄ Н2СО3
ОН- + Н2СО3 ⇄ НСО3- + Н2О
Слайд 51В крови [HCO3]
[H2CO3] 1 избыток гидрокарбоната создает щелочной резерв крови
Вк = 40 ммоль/л;
Вщ = 1-2 ммоль/л.
=
_
Слайд 52Гидрокарбонатный буфер связан со всеми буферными системами вне- и внутри-клеточных жидкостей.
Слайд 53Анализируя содержание НСО3- в крови можно диагностировать наличие дыхательных и метаболических
Слайд 542. Гидрофосфатная буферная система Н2PO4-/HPO42-
Вк = 1-2 ммоль/л;
Низкая буферная емкость объясняется низкой концентрацией ионов в крови.
Слайд 55Однако эта система играет решающую роль в других биологических жидкостях: в
Слайд 563.Гемоглобин-оксигемоглобин: ННb/Нb-
ННb - слабая кислота
(Ка = 6,37·10-9)
Н+ + Нb- ⇄
ОН- + ННb ⇄ Hb- + H2O
Слайд 594. Белковая буферная система (альбумины, глобулины).
Белки являются амфотерными полиэлектролитами, существующими
COOH COO-
R - CH ⇄ R - CH
NH2 NH3+
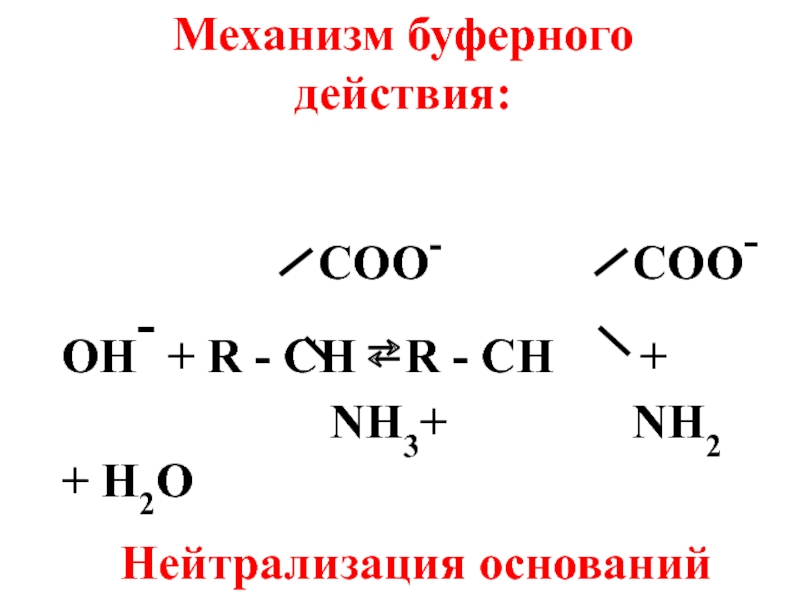
Слайд 61
OH- + R - CH ⇄ R - CH +
NH3+ NH2
+ H2O
Нейтрализация оснований
Механизм буферного действия:












![Для характеристики кислотности используется водородный показатель (рН) : рН = - lg[H+], а для сильных кислот](/img/tmb/4/330780/ebf45941598f4ac403e8f36b05a44bcd-800x.jpg)
![Реже для характеристики реакции среды используется гидроксильный показатель (рОН): рОН = - lg[OH-], а для](/img/tmb/4/330780/96313761b6ad6274984831f304158525-800x.jpg)


![В кислой среде: [H+] > [OH-]рН < 7, рОН > 7В щелочной среде: [H+] < [OH-]pH >](/img/tmb/4/330780/99aa8938870270273bd9bba071d72bcb-800x.jpg)
![Шкала рН[Н+],MpH 1 10-5 10-7 10-9](/img/tmb/4/330780/43a2f847f23fddd64a5f2a4e0227fa43-800x.jpg)


















![Уравнение Гендерсона- Гассельбаха позволяет рассчитать рН буферного раствора:рН =рКа - lg [кислота] [сопряженное основание]_рКа](/img/tmb/4/330780/96a2a9ecc502b6bd88f78af06a9a3964-800x.jpg)




![В крови [HCO3] 40](/img/tmb/4/330780/118a89f6b3bf2d339240b92f60c09f02-800x.jpg)