- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Исследование реакции хлорирования этилена, получение дихлорэтана презентация
Содержание
- 1. Исследование реакции хлорирования этилена, получение дихлорэтана
- 2. Основные свойства Этилен СН2 = СН2. –
- 3. Выход продуктов реакции Условия процесса:[6] Температура –
- 4. Материальный баланс
- 5. Реакция присоединения хлора к этилену CH2=CH2+Cl2 →
- 6. Механизм реакции 1. Зарождение цепи (фотоинициирование): λ
- 7. Механизм ингибирования Cl2+hυ → 2Ċl; реагируют с
- 8. Спасибо за внимание
- 9. Список использованных источников 1 Промышленные хлорорганические продукты.
Слайд 1Министерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение высшего
«Волгоградский государственный технический университет»
Химико-технологический факультет
Кафедра «Технология высокомолекулярных и волокнистых материалов»
Исследование реакции хлорирования этилена
С целью получения дихлорэтана
Семестровая работа по дисциплине:
«Радикальные реакции в химической технологии»
Выполнил:
Студент группы ТНГМ-1.3П
Пастухов Е. А.
Проверил:
Профессор, д.х.н. Навроцкий В. А.
Волгоград, 2017 г.
Слайд 2Основные свойства
Этилен СН2 = СН2.
– молекулярная масса – 28
– плотность –
– растворимость в воде при н. у. – 0,281г/дм3
– температура кипения – минус 103,710 С
– температура плавления – минус 169,50 С
Хлор СL2
– молекулярная масса – 35
– плотность – 3,214 кг/м3
– растворимость в воде при н. у. – 7,4г/дм3
– температура кипения – минус 34,050 С
– температура плавления – минус 101,60 С
1,2-Дихлорэтан СН2Сl – CН2Cl.
– молекулярная масса – 98
– плотность – 1282 кг/м3
– температура кипения – 83,47 0С
– температура плавления – минус 35,36 0С
Слайд 3Выход продуктов реакции
Условия процесса:[6]
Температура – 265 0С;
Давление – 0,89 МПа;
Избыток этилена
В присутствии некоторого количества кислорода;
С применением дейтериевой лампы ДДС-30.
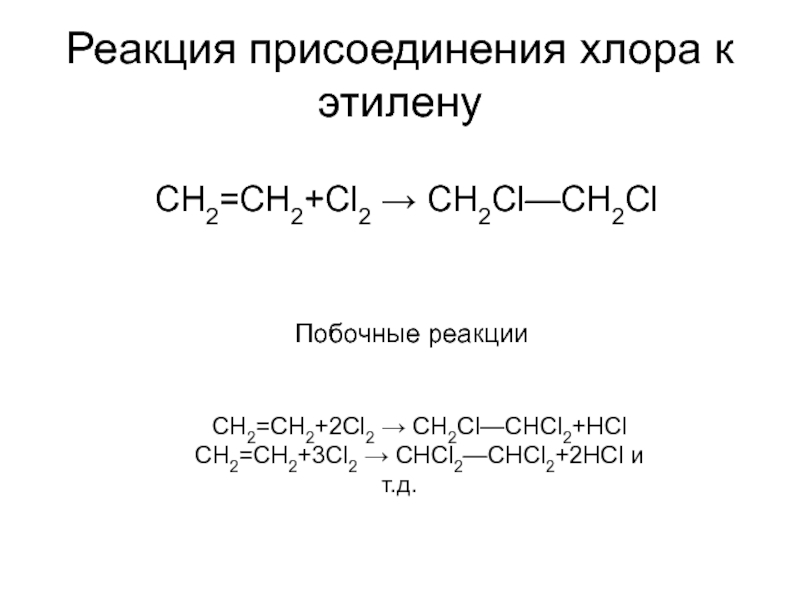
Слайд 5Реакция присоединения хлора к этилену
CH2=CH2+Cl2 → СН2Сl—СН2Сl
Побочные реакции
CH2=CH2+2Cl2 → СН2Сl—СНСl2+HCl
CH2=CH2+3Cl2
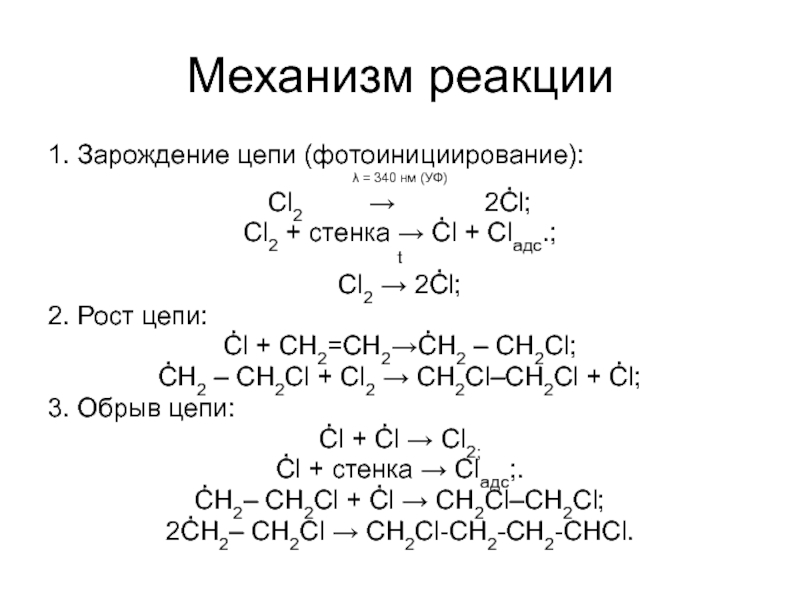
Слайд 6Механизм реакции
1. Зарождение цепи (фотоинициирование):
λ = 340 нм (УФ)
Cl2
Cl2 + стенка → Ċl + Clадс.;
t
Cl2 → 2Ċl;
2. Рост цепи:
Ċl + CH2=CH2→ĊH2 – CH2Cl;
ĊH2 – CH2Cl + Cl2 → CH2Cl–CH2Cl + Ċl;
3. Обрыв цепи:
Ċl + Ċl → Cl2;
Ċl + стенка → Clадс;.
ĊH2– CH2Cl + Ċl → CH2Cl–CH2Cl;
2ĊH2– CH2Cl → CH2Cl-CH2-CH2-CHCl.
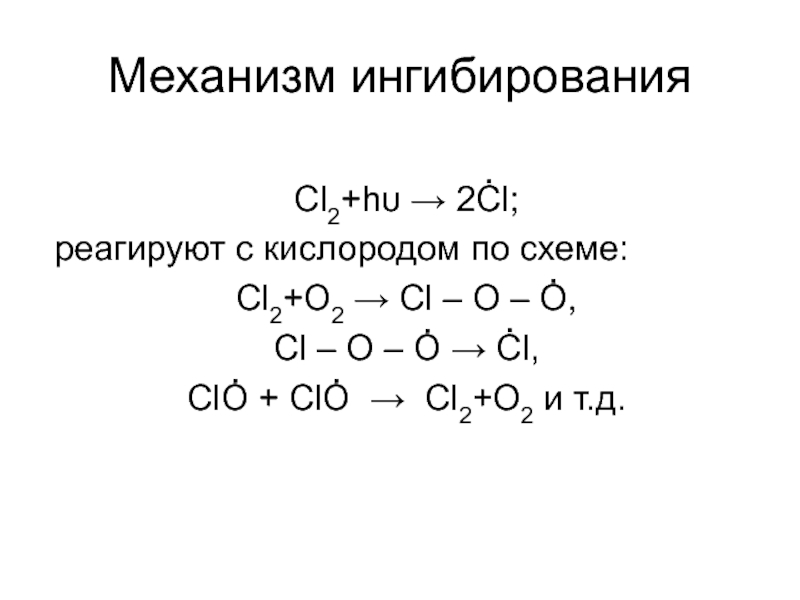
Слайд 7Механизм ингибирования
Cl2+hυ → 2Ċl;
реагируют с кислородом по схеме:
Cl2+О2 → Cl –
Cl – O – Ȯ → Ċl,
ClȮ + ClȮ → Cl2+O2 и т.д.
Слайд 9Список использованных источников
1 Промышленные хлорорганические продукты. Справочник / Под ред. Л.А.
2 ГОСТ 25070-2013 – Этилен. Технические условия.
3 ГОСТ 6718-93 – Хлор. Технические условия.
4 ГОСТ 1942-86 – 1,2-Дихлорэтан технический. Технические условия.
5 Потехин В. Н., Потехин В. В. Основы теории химических процессов технологии органических веществ и нефтепереработки.: Учебник для ВУЗов. – 2е изд., - СПб: Химиздат, 2007 – 944 с.
6 Исследование процесса хлорирования этилена. Трегер Ю.А., Трусов Л.И., Розанов В.Н., Силина И.С., Мурашова О.П., Яськова В.Я., Брук Л.Г. ВЕСТНИК МИТХТ ИМ. М.В. ЛОМОНОСОВА. Том. 8. – №3., 2013 г.
7 Тимофеев В. С. Принципы технологии основного органического синтеза: Учеб. пособие для ВУЗов/ В. С. Тимофеев, Л. А. Серафимов. – 2е изд., перераб. М – Высш. шк., 2003. – 536 с.
8 Травень В. Ф, Органическая химия в 2-х томах / В. Ф. Травень. – Москва : Академкнига, 2004. – 728с., ил.
9 Лебедев Н.Н. Химия и технология основного органического и нефтехимического синтеза: Учебник для вузов. – М. Химия, 1988. – 592 с.
10 ТУ 6–01–1130–92 Государственный стандарт союза ССР. 1,1,2-триихлорэтан технический. Технические условия
11 ТУ 6–01–1134–92 Государственный стандарт союза ССР. 1,1,2,2-тетрахлорэтан технический. Технические условия


![Выход продуктов реакцииУсловия процесса:[6]Температура – 265 0С;Давление – 0,89 МПа;Избыток этилена – 10% от стехиометрического;В](/img/tmb/5/480603/88006587e63ee9d67f3edc9a3d71a91e-800x.jpg)