- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Ионная химическая связь презентация
Содержание
- 1. Ионная химическая связь
- 2. Благородные газы Благородные или инертные газы
- 3. Строение атомов благородных газов +2 2
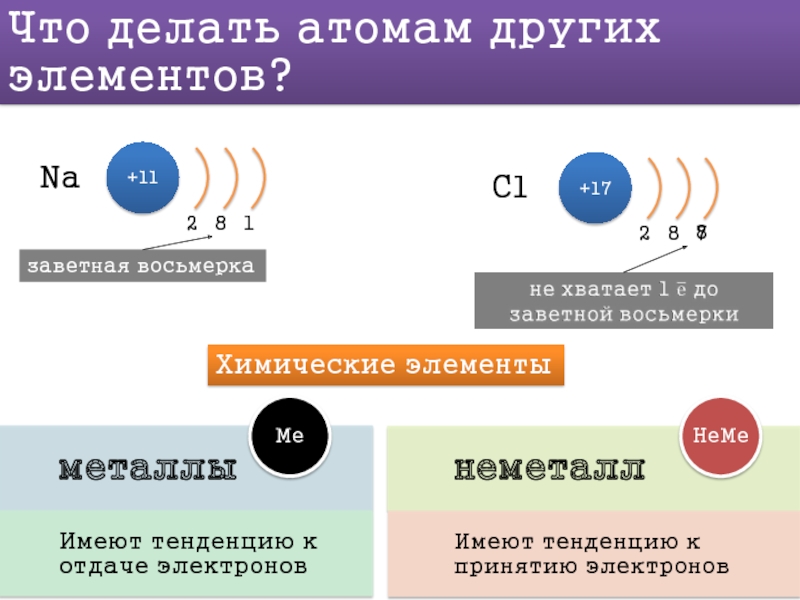
- 4. Что делать атомам других элементов? Na +11
- 5. Черным и зеленым обозначены символы элементов
- 6. Элементы IV группы, главной подгруппы Sn +50
- 7. Свойство усиливается Значение увеличивается Значение
- 8. Изменение свойств атомов химических элементов в периоде
- 9. Ионная химическая связь Na +11
- 10. Ионная химическая связь Схема образования ионной связи
Слайд 2Благородные газы
Благородные или инертные газы
Названы так, потому что эти элементы отличаются
Слайд 3Строение атомов благородных газов
+2
2
He
Ne
+10
2
8
Ar
+18
2
8
8
Kr
+36
2
8
18
8
Xe
+54
2
8
18
8
32
Rn
+54
2
8
18
8
32
32
Атомы благородных газов имеют на внешнем (последнем) уровне
Слайд 5
Черным и зеленым обозначены символы элементов – металлов
Красным обозначены символы элементов
Слайд 6Элементы IV группы, главной подгруппы
Sn
+50
2
8
18
4
32
Si
+18
2
8
4
У атома кремния 4 внешних электрона находятся
У атома олова 4 внешних электрона находятся на большом расстоянии от ядра, сила притяжения этих электронов к ядру невелика, поэтому атом кремния –металл (отдает электроны)
Вывод: способность принимать или отдавать электроны зависит не только от того, сколько электронов на внешнем уровне, но и от того, как далеко эти электроны находятся от ядра
Слайд 7
Свойство усиливается
Значение увеличивается
Значение неизменно
Свойство ослабевает
Значение уменьшается
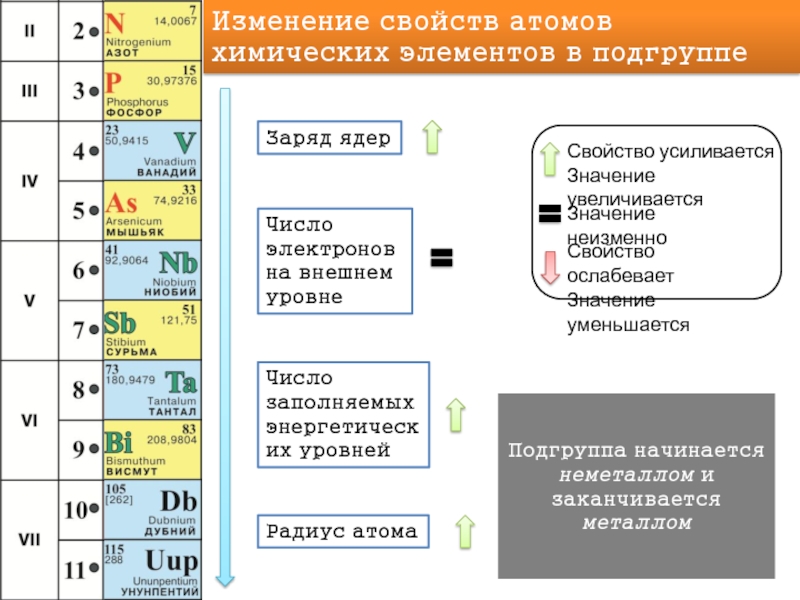
Изменение свойств атомов химических элементов в
Заряд ядер
Число электронов на внешнем уровне
Число заполняемых энергетических уровней
Радиус атома
Подгруппа начинается неметаллом и заканчивается металлом
Слайд 8Изменение свойств атомов химических элементов в периоде
Свойство усиливается
Значение увеличивается
Значение неизменно
Свойство ослабевает
Значение
Заряд ядер
Число электронов на внешнем уровне
Число заполняемых энергетических уровней
Радиус атома
Период начинается металлом и заканчивается неметаллом
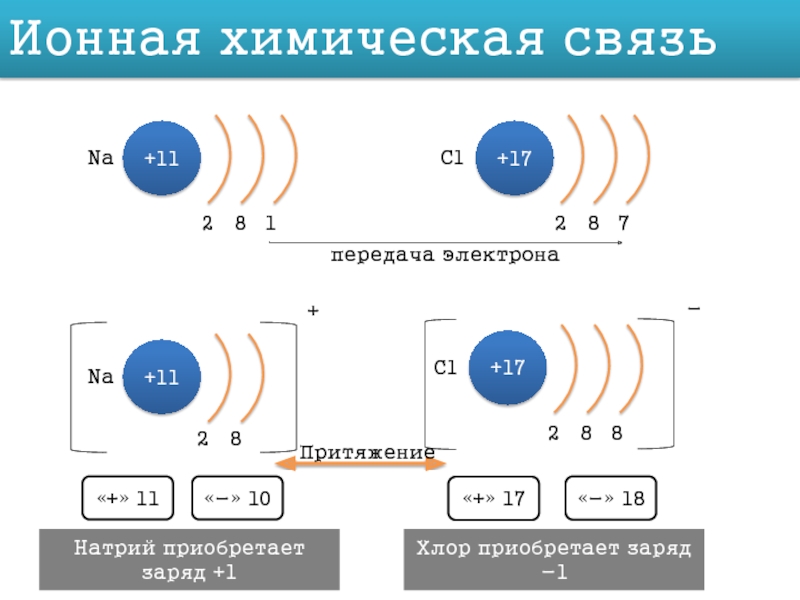
Слайд 9Ионная химическая связь
Na
+11
2
8
1
Cl
+17
2
8
7
передача электрона
Na
+11
+
2
8
Cl
+17
2
8
8
-
«+» 11
«-» 10
Натрий приобретает заряд +1
«+» 17
«-» 18
Хлор
Притяжение
Слайд 10Ионная химическая связь
Схема образования ионной связи
атом
атом
ион
ион
ионное
соединение
атом
атом
ион
ион
ионное
соединение
Ион – частица, в
Ионная химическая связь – это связь между ионами