- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция 7. Электрофильное замещение в ароматических системах презентация
Содержание
- 1. Лекция 7. Электрофильное замещение в ароматических системах
- 2. Электрофильное присоединение по Марковникову Получается только вещество
- 3. Пероксидный эффект Хараша В присутствии пероксидов присоединение
- 4. Электрофильное замещение в ароматических системах Лекция 7
- 5. Качественные реакции на ненасыщенность для алкенов и
- 6. Строение молекулы бензола Схема образования π-связей в
- 7. Арены и алкены: действие электрофилов Для ароматических соединений характерные реакции электрофильного замещения (SE)
- 8. Электрофилы Электрофильные реагенты (Е, Е+) – это
- 9. Сила электрофилов 1.1. Сильные электрофилы NO2+(Ион
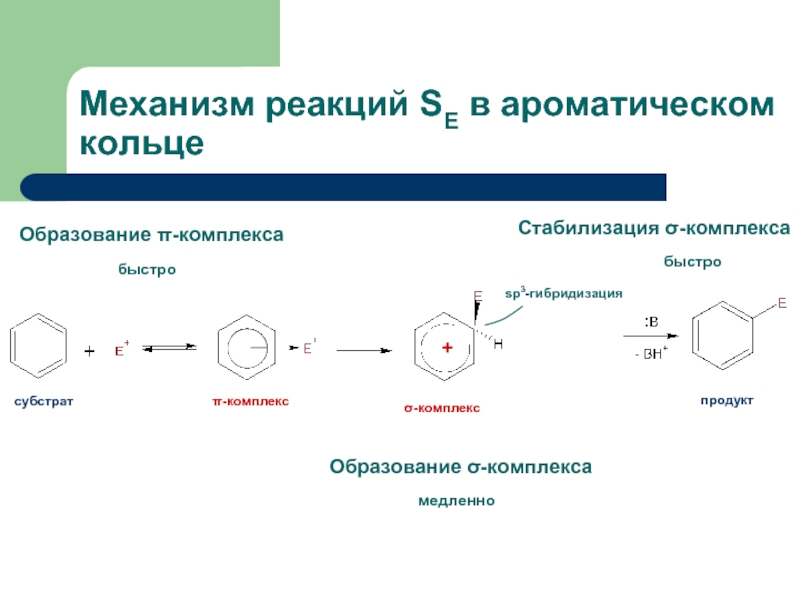
- 10. Механизм реакций SE в ароматическом кольце
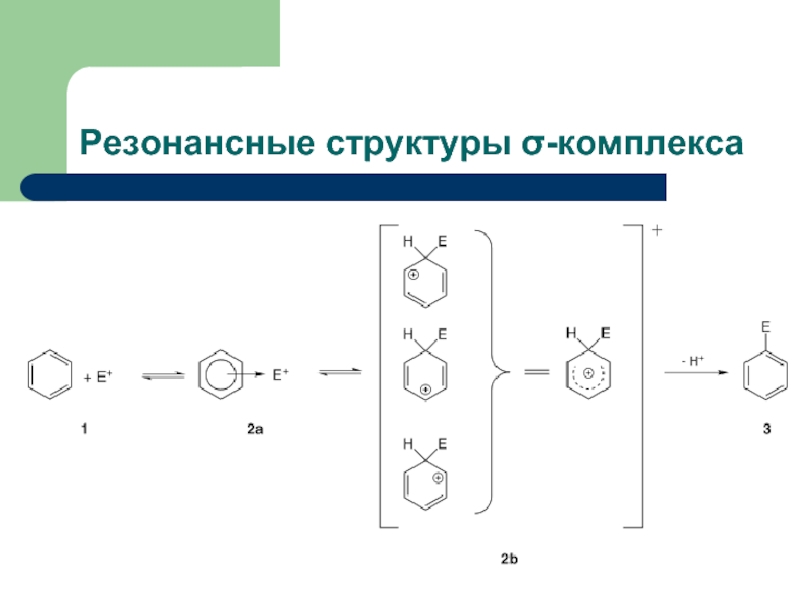
- 11. Резонансные структуры σ-комплекса
- 12. Энергетическая диаграмма реакции SE в ароматическом кольце V = k[ArH][E+] Реакция второго порядка
- 13. Устойчивость аренониевых ионов Мезитилен образует аренониевый ион
- 14. Стабильные аренониевые ионы
- 15. Как заместитель в бензольном кольце влияет на
- 16. Изомерные σ-комплексы "ипсо" обозначает атаку или замещение в
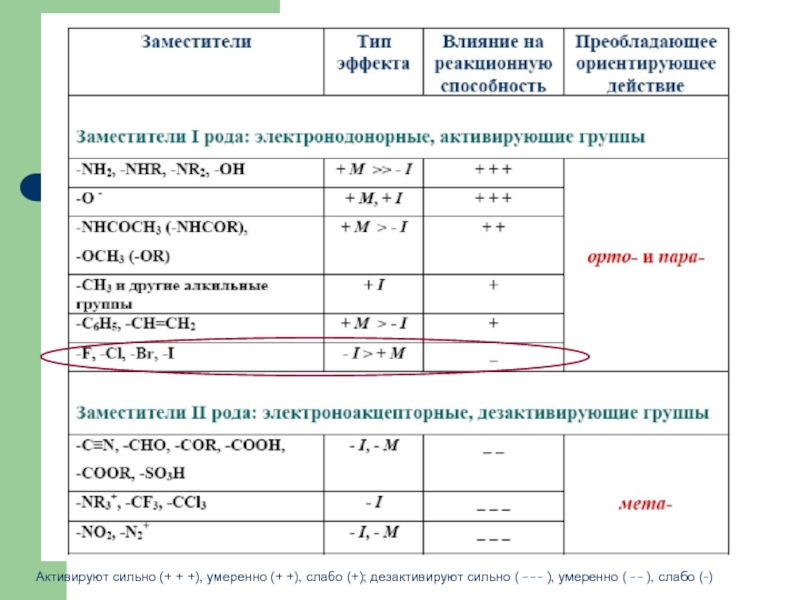
- 17. Влияние заместителей на скорость SE Электронодонорные заместители
- 18. Правила ориентации в монозамещенных аренах Ориентирующее влияние
- 19. Активируют сильно (+ + +), умеренно (+
- 20. Статический фактор: влияние электронакцепторов на ориентацию SE
- 21. Статический фактор: влияние электронодоноров на ориентацию SE
- 22. Электрофильное замещение в монозамещенных бензолах: статический фактор
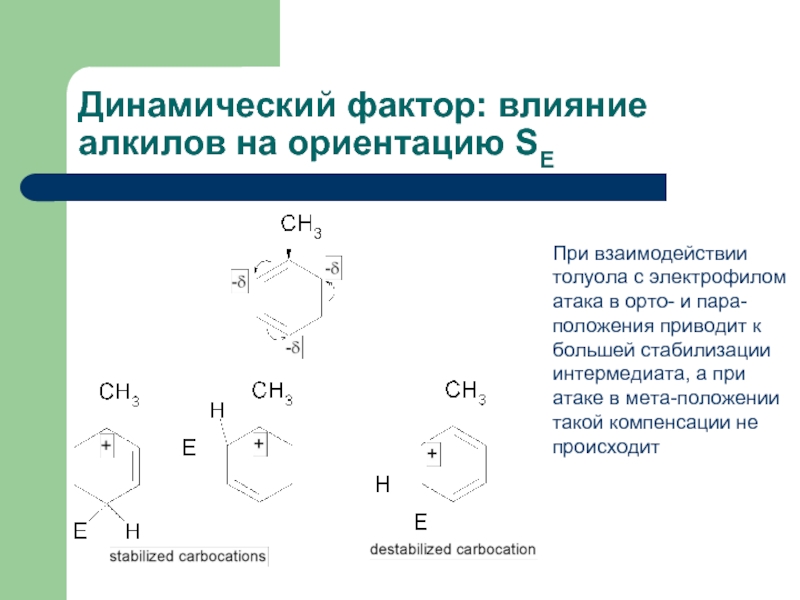
- 23. Динамический фактор: влияние алкилов на ориентацию SE
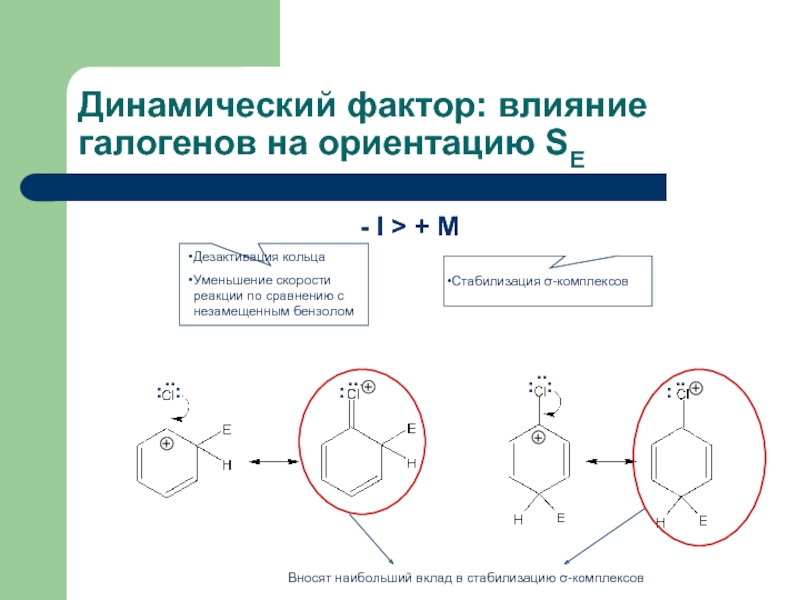
- 24. Динамический фактор: влияние галогенов на ориентацию SE
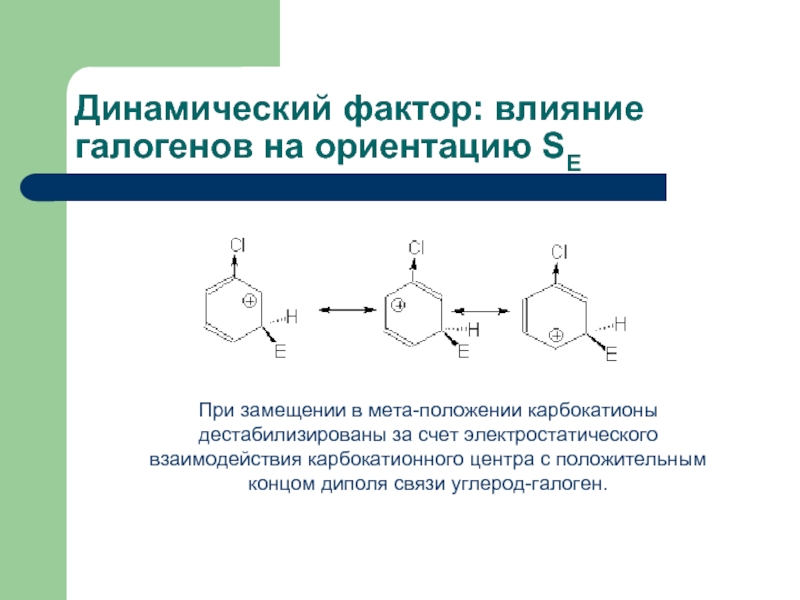
- 25. При замещении в мета-положении карбокатионы дестабилизированы
- 26. Во всех граничных формулах происходит электростатическое
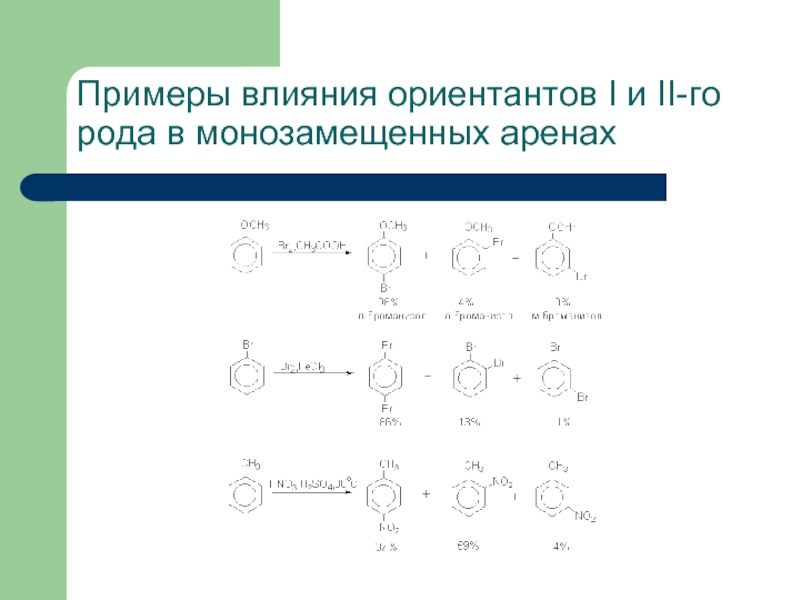
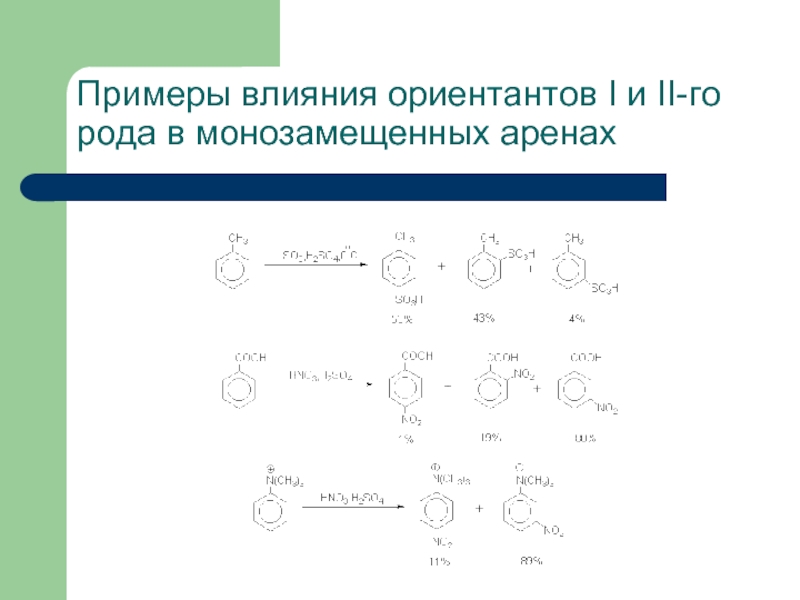
- 27. Примеры влияния ориентантов I и II-го рода в монозамещенных аренах
- 28. Примеры влияния ориентантов I и II-го рода в монозамещенных аренах
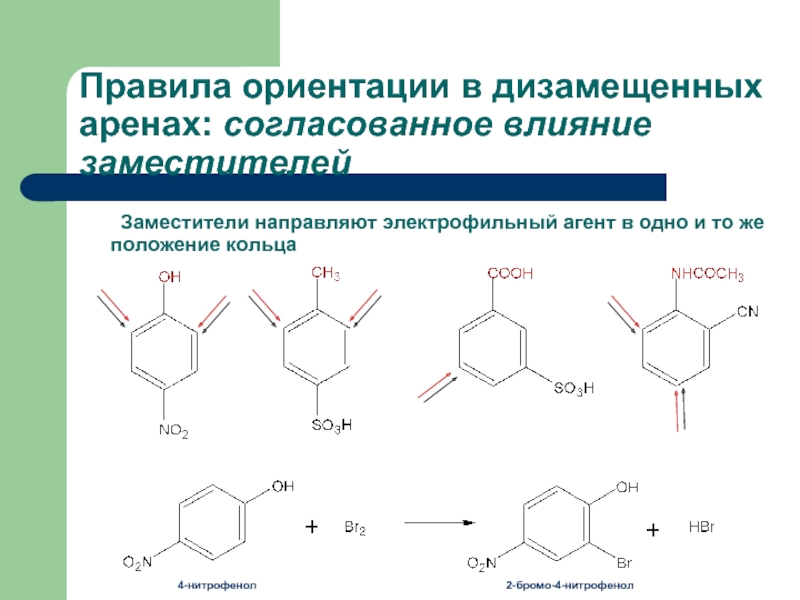
- 29. Правила ориентации в дизамещенных аренах: согласованное влияние
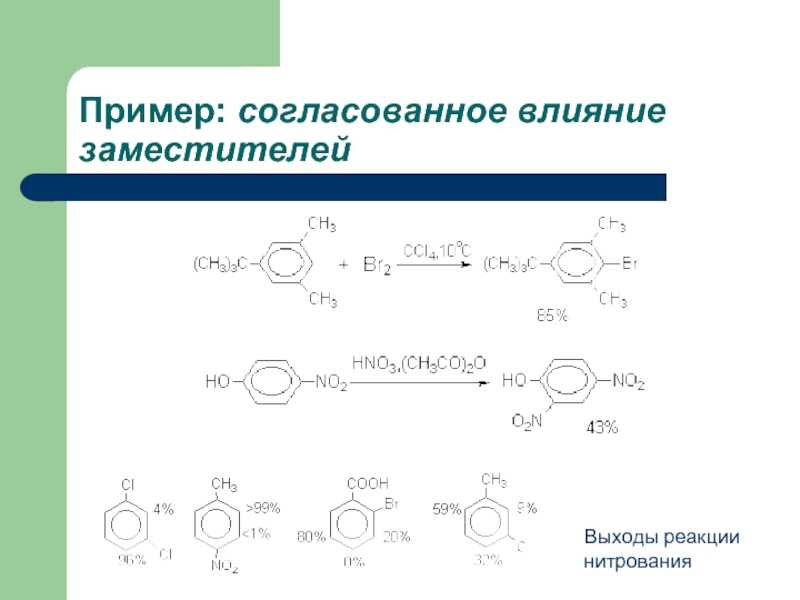
- 30. Пример: согласованное влияние заместителей Выходы реакции нитрования
- 31. Ориентирующее влияние одного заместителя не совпадает по
- 32. Если в бензольном кольце имеются сильная и
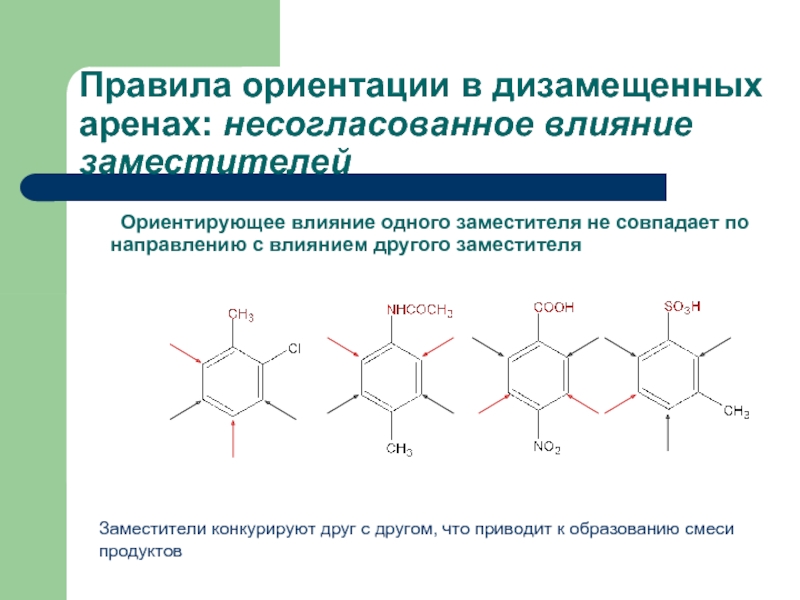
- 33. Правила ориентации в дизамещенных аренах: несогласованное
- 34. Реакции электрофильного замещения (SE) аренов
- 35. Галогенирование моноядерных аренов π-комплекс σ-комплекс δ+
- 36. Нитрование моноядерных аренов: синтез 2,4,6-тринитротолуола толуол орто-нитротолуол пара-нитротолуол олеум 2,4,6-тринитротолуол тротил
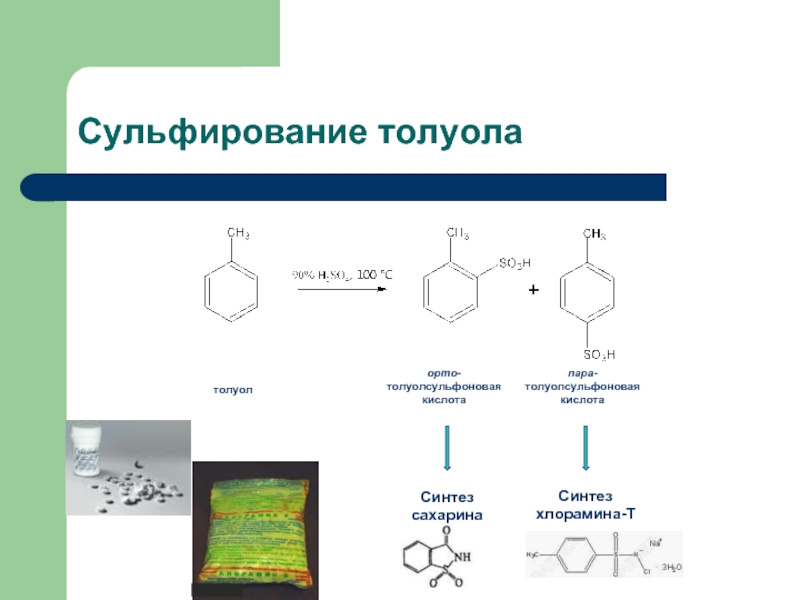
- 37. Сульфирование толуола
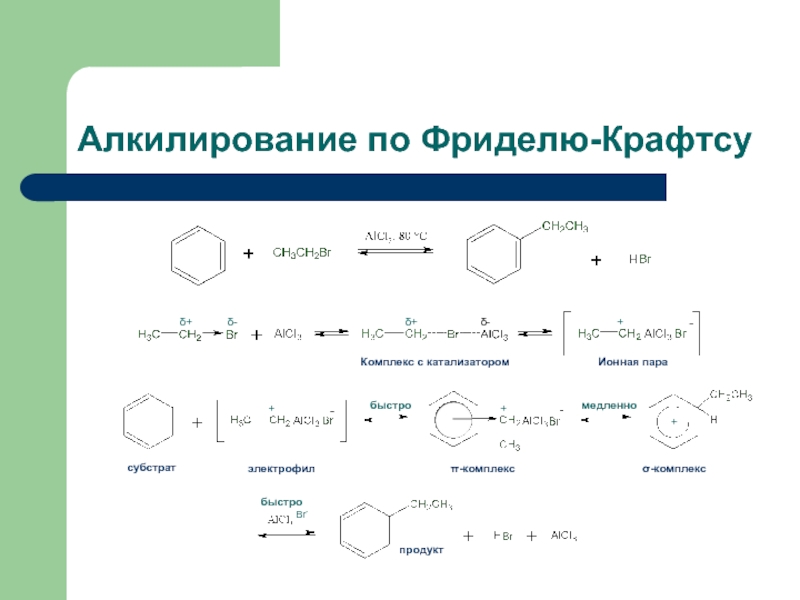
- 38. Реакция Фриделя-Крафтса Введение в бензольное кольцо алкильных
- 39. Алкилирование по Фриделю-Крафтсу
- 40. Ограничения реакции алкилирования Фриделя-Крафтса Обратимая реакция (обратная
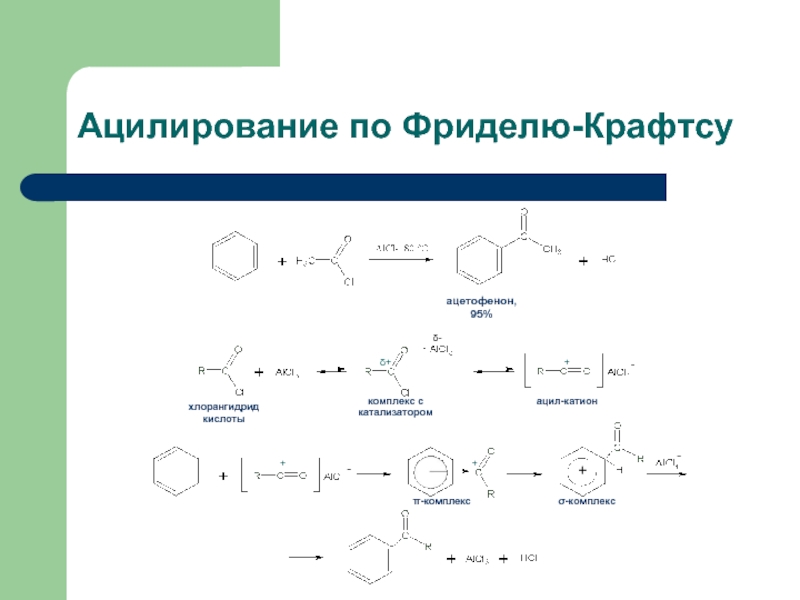
- 41. Ацилирование по Фриделю-Крафтсу - +
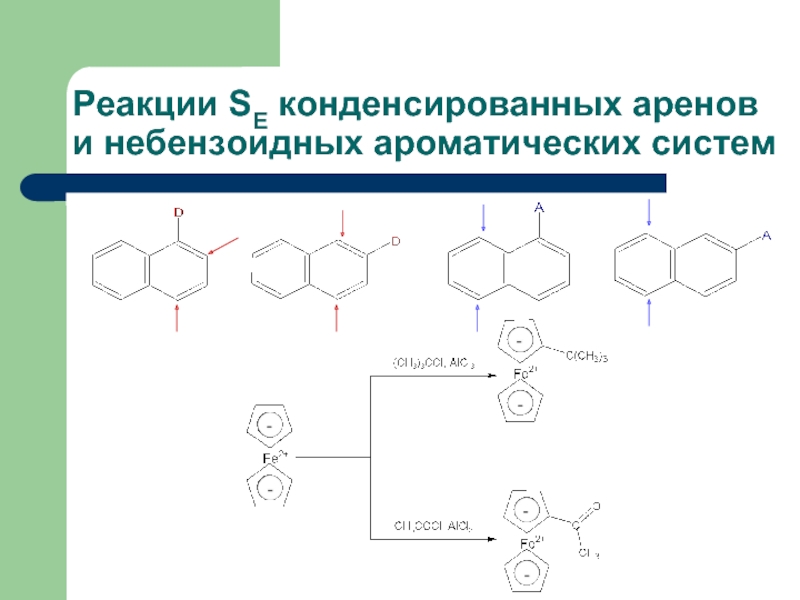
- 42. Реакции SE конденсированных аренов и небензоидных ароматических
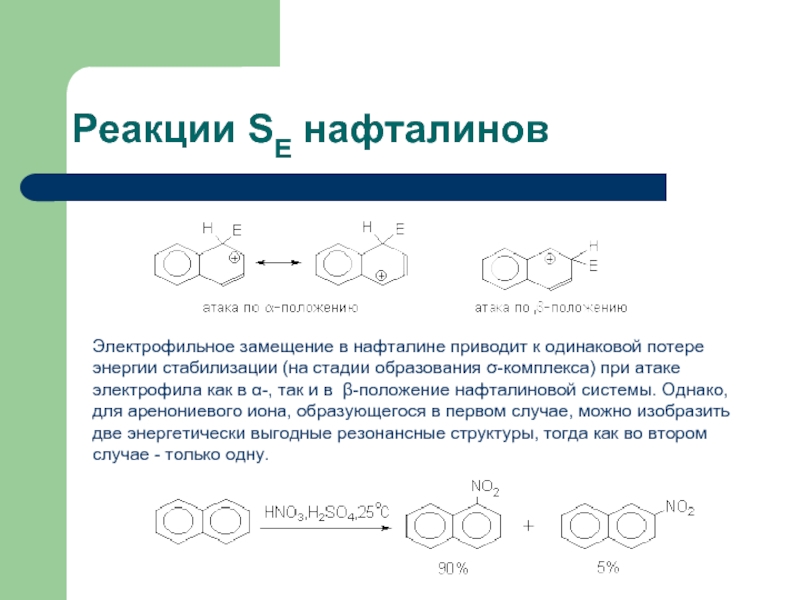
- 43. Реакции SE нафталинов Электрофильное
- 44. Реакции SE конденсированных аренов и небензоидных ароматических систем
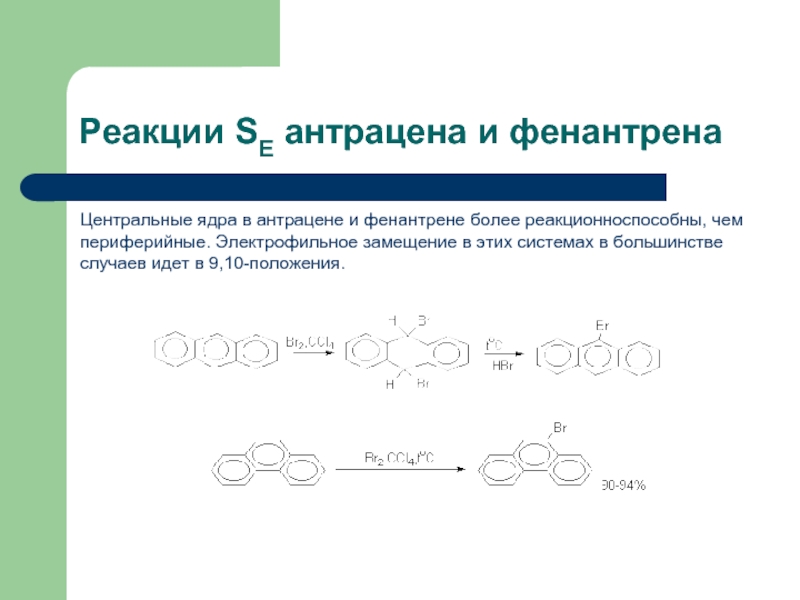
- 45. Реакции SE антрацена и фенантрена Центральные
- 46. Благодарю за внимание!
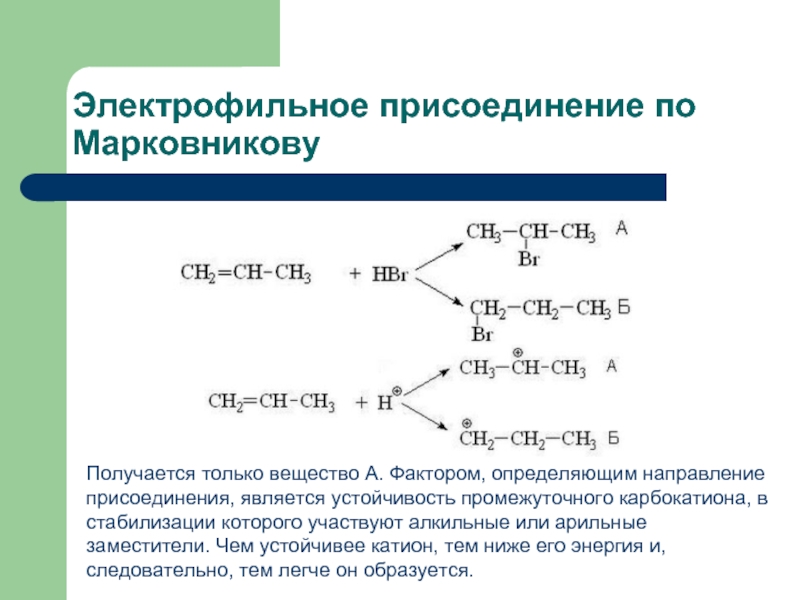
Слайд 2Электрофильное присоединение по Марковникову
Получается только вещество А. Фактором, определяющим направление присоединения,
Слайд 3Пероксидный эффект Хараша
В присутствии пероксидов присоединение бромистого водорода к алкенам идет
Слайд 5Качественные реакции на ненасыщенность для алкенов и алкинов
Обесцвечивание бромной воды
Обесцвечивание раствора
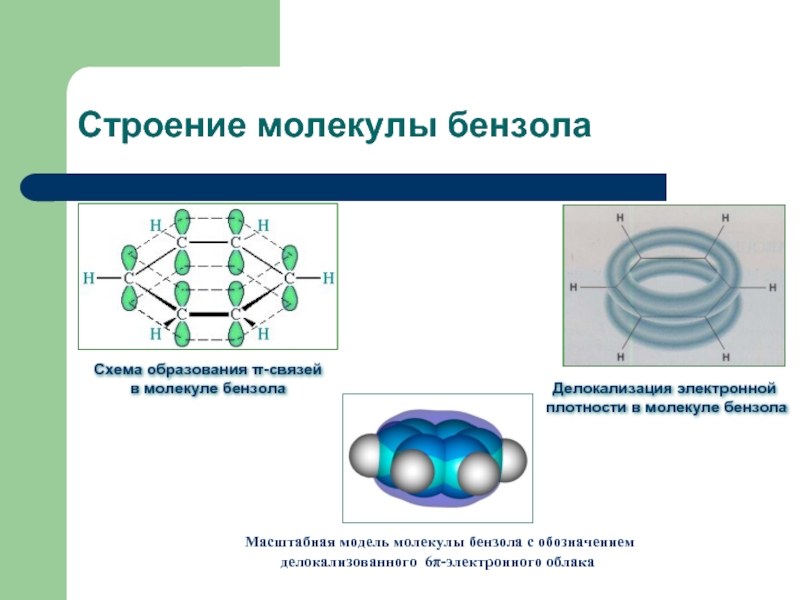
Слайд 6Строение молекулы бензола
Схема образования π-связей
в молекуле бензола
Делокализация электронной
плотности в молекуле
Масштабная модель молекулы бензола с обозначением делокализованного 6π-электронного облака
Слайд 7Арены и алкены: действие электрофилов
Для ароматических соединений характерные реакции электрофильного замещения
Слайд 8Электрофилы
Электрофильные реагенты (Е, Е+) – это частицы, образующие новые ковалентные связи
- положительно заряженные ионы
H+ Hal+ NO2+ NO+
- нейтральные молекулы, имеющие электронодефицитный центр
Слайд 9Сила электрофилов
1.1. Сильные электрофилы
NO2+(Ион нитрония, нитроил-катион); комплексы Cl2 или Br2 с различными кислотами
1.2. Электрофилы средней силы
Комплексы алкилгалогенидов или ацилгалогенидов с кислотами Льюиса (RCl·AlCl3, RBr·GaBr3, RCOCl·AlCl3 и др.); комплексы спиртов с сильными кислотами Льюиса и Бренстеда (ROH·BF3, ROH·H3PO4, ROH·HF).
1.3. Слабые электрофилы
Катионы диазония ArNN+, иминия CH2=N+H2, нитрозония NO+ (нитрозоил-катион); оксид углерода (IV) СО2 (один из самых слабых электрофилов).
Слайд 12Энергетическая диаграмма реакции SE
в ароматическом кольце
V = k[ArH][E+]
Реакция второго порядка
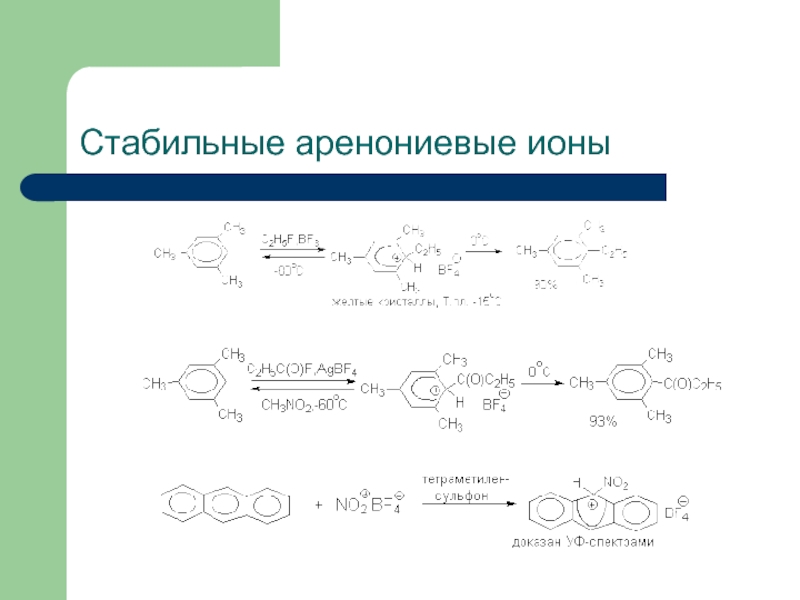
Слайд 13Устойчивость аренониевых ионов
Мезитилен образует аренониевый ион при взаимодействии с HF в
При использовании в качестве кислоты Льюиса SbF5 образуется соль с противоионом SbF6-, которая более стабильна и не разлагается даже при +50оС.
Устойчивость σ-комплексов растет при наличии в ароматическом ядре электронодонорных заместителей, участвующих в делокализации положительного заряда, а также при наличии комплексных противоионов типа BF4- или SbF6- (слабые основания).
Слайд 15Как заместитель в бензольном кольце влияет на скорость SE в целом?
Как
Влияние строения субстрата на SE
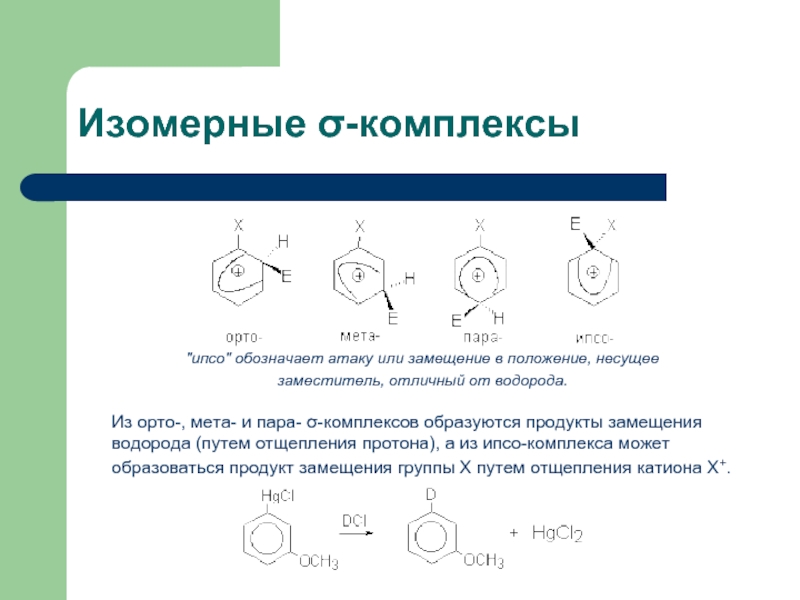
Слайд 16Изомерные σ-комплексы
"ипсо" обозначает атаку или замещение в положение, несущее заместитель, отличный от
Из орто-, мета- и пара- σ-комплексов образуются продукты замещения водорода (путем отщепления протона), а из ипсо-комплекса может образоваться продукт замещения группы Х путем отщепления катиона Х+.
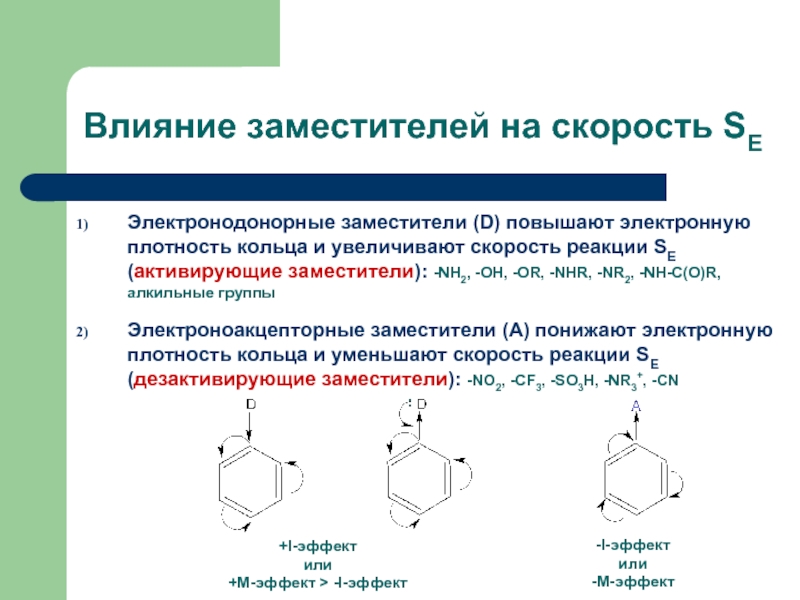
Слайд 17Влияние заместителей на скорость SE
Электронодонорные заместители (D) повышают электронную плотность кольца
Электроноакцепторные заместители (А) понижают электронную плотность кольца и уменьшают скорость реакции SE (дезактивирующие заместители): -NO2, -CF3, -SO3H, -NR3+, -CN
+I-эффект
или
+М-эффект > -I-эффект
-I-эффект
или
-М-эффект
:
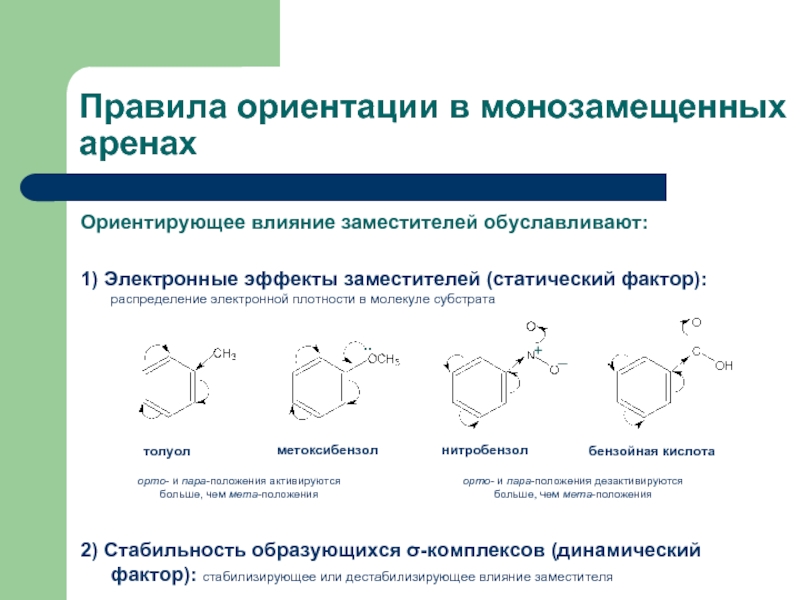
Слайд 18Правила ориентации в монозамещенных аренах
Ориентирующее влияние заместителей обуславливают:
1) Электронные эффекты заместителей
2) Стабильность образующихся σ-комплексов (динамический фактор): стабилизирующее или дестабилизирующее влияние заместителя
толуол
метоксибензол
нитробензол
бензойная кислота
орто- и пара-положения активируются больше, чем мета-положения
орто- и пара-положения дезактивируются больше, чем мета-положения
Слайд 19Активируют сильно (+ + +), умеренно (+ +), слабо (+); дезактивируют
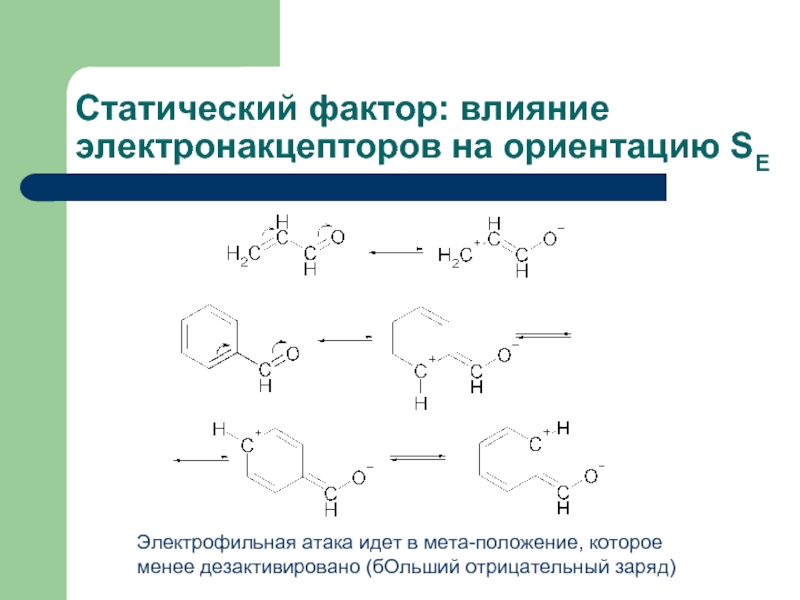
Слайд 20Статический фактор: влияние электронакцепторов на ориентацию SE
Электрофильная атака идет в мета-положение,
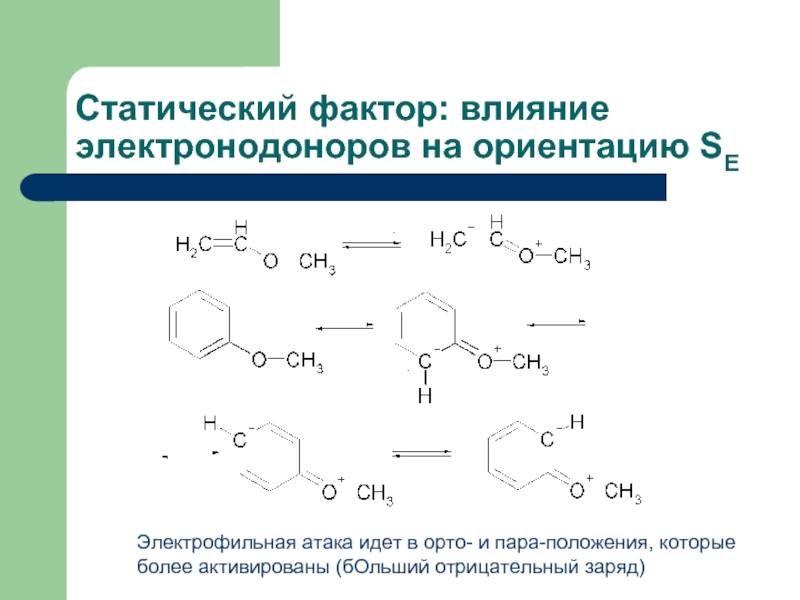
Слайд 21Статический фактор: влияние электронодоноров на ориентацию SE
Электрофильная атака идет в орто-
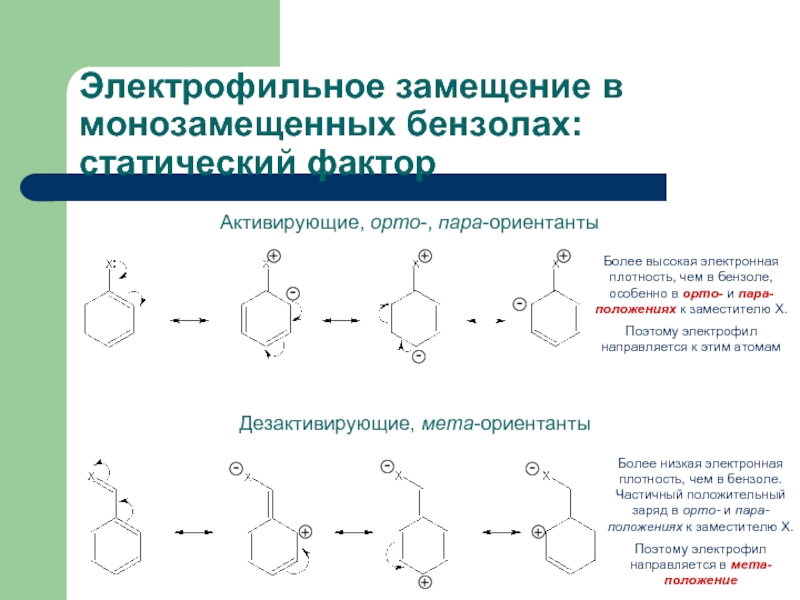
Слайд 22Электрофильное замещение в монозамещенных бензолах: статический фактор
Активирующие, орто-, пара-ориентанты
:
Дезактивирующие, мета-ориентанты
Более высокая
Поэтому электрофил направляется к этим атомам
Более низкая электронная плотность, чем в бензоле. Частичный положительный заряд в орто- и пара-положениях к заместителю Х.
Поэтому электрофил направляется в мета-положение
Слайд 23Динамический фактор: влияние алкилов на ориентацию SE
При взаимодействии толуола с электрофилом
Слайд 24Динамический фактор: влияние галогенов на ориентацию SE
- I > + M
Вносят
Слайд 25
При замещении в мета-положении карбокатионы дестабилизированы за счет электростатического взаимодействия карбокатионного
Динамический фактор: влияние галогенов на ориентацию SE
Слайд 26
Во всех граничных формулах происходит электростатическое отталкивание между карбокатионным центром и
Подобное влияние оказывают и другие (-М)-заместители (СНО, СООН и т.п.).
Динамический фактор: влияние нитрогруппы на ориентацию SE
Слайд 29Правила ориентации в дизамещенных аренах: согласованное влияние заместителей
Заместители направляют электрофильный агент
4-нитрофенол
2-бромо-4-нитрофенол
Слайд 31 Ориентирующее влияние одного заместителя не совпадает по направлению с влиянием другого
Правила ориентации в дизамещенных аренах: несогласованное влияние заместителей
Заместители конкурируют друг с другом, что приводит к образованию смеси продуктов
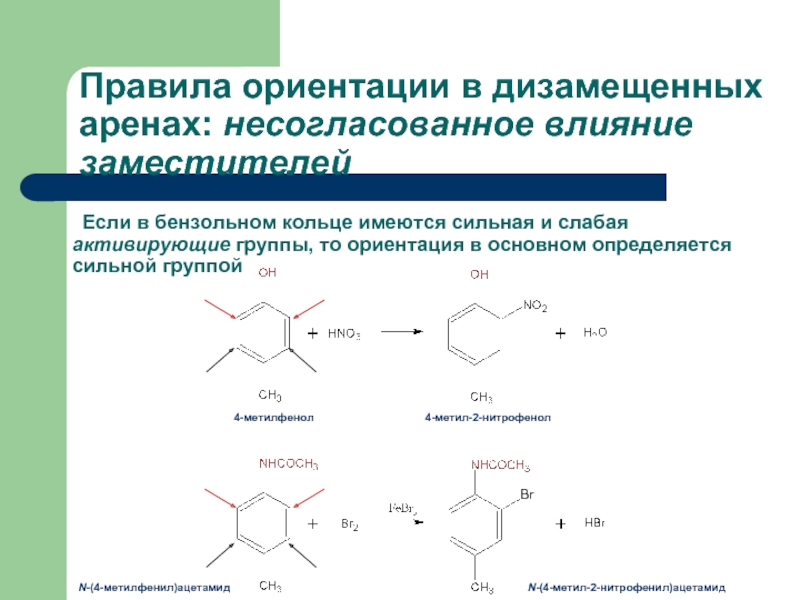
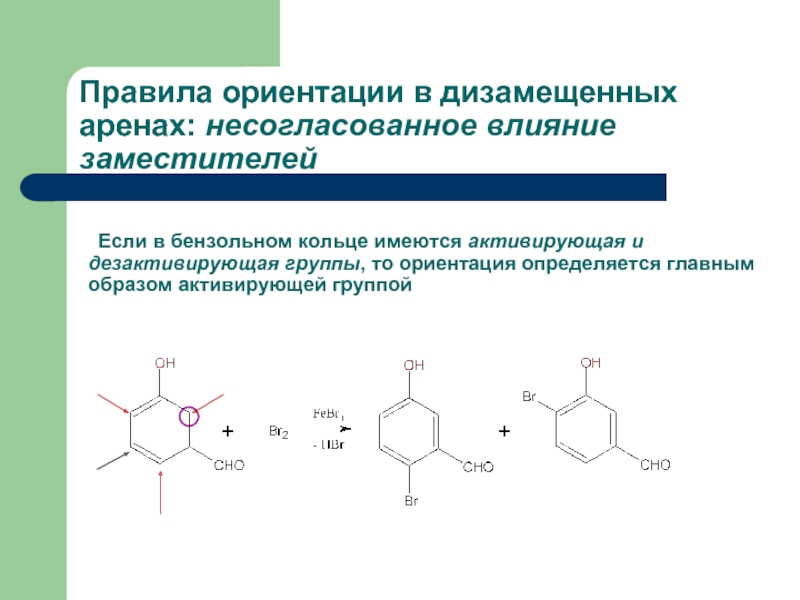
Слайд 32 Если в бензольном кольце имеются сильная и слабая активирующие группы, то
Правила ориентации в дизамещенных аренах: несогласованное влияние заместителей
N-(4-метилфенил)ацетамид
N-(4-метил-2-нитрофенил)ацетамид
4-метилфенол
4-метил-2-нитрофенол
Br
Слайд 33
Правила ориентации в дизамещенных аренах: несогласованное влияние заместителей
Если в бензольном кольце
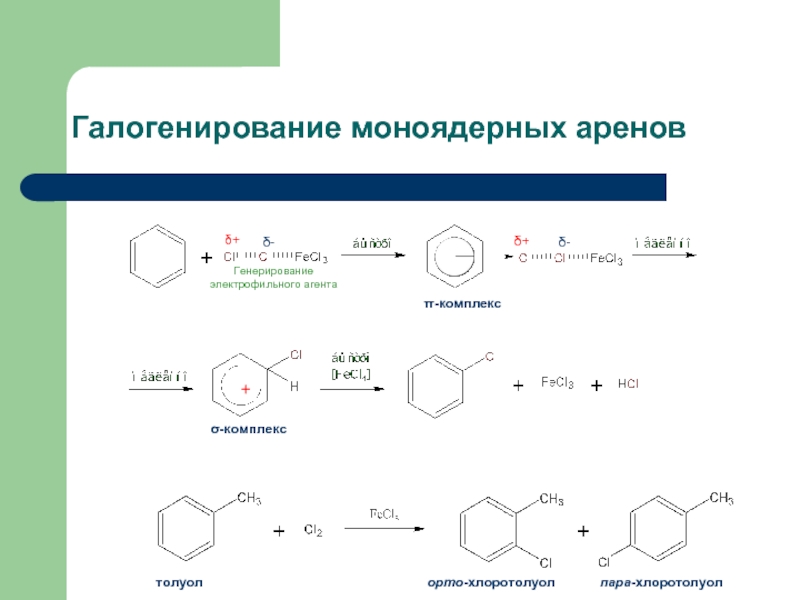
Слайд 35Галогенирование моноядерных аренов
π-комплекс
σ-комплекс
δ+
δ+
δ-
δ-
Генерирование электрофильного агента
толуол
орто-хлоротолуол
пара-хлоротолуол
+
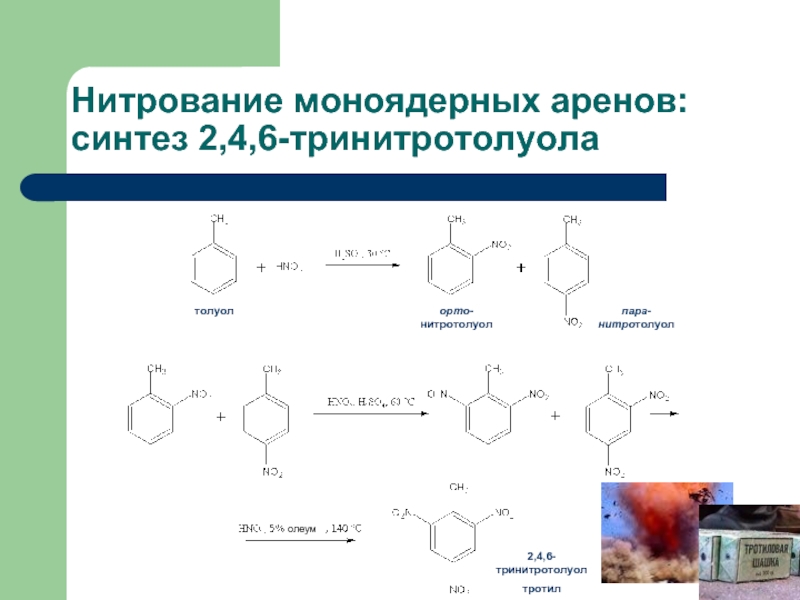
Слайд 36Нитрование моноядерных аренов: синтез 2,4,6-тринитротолуола
толуол
орто-нитротолуол
пара-нитротолуол
олеум
2,4,6-тринитротолуол
тротил
Слайд 38Реакция Фриделя-Крафтса
Введение в бензольное кольцо алкильных или ацильных групп
Алкилирующие реагенты: галогеноалканы,
Ацилирующие реагенты: хлорангидриды и ангидриды кислот
Осуществляется в присутствии кислот Льюиса
Синтез:
Поверхностно-активных веществ
Душистых веществ
Этилбензола
Кумола, тимола
Ароматических кетонов (промежуточные продукты
в производстве фармацевтических препаратов
и красителей)
этилбензол
стирол
кумол
кетон Михлера
Слайд 40Ограничения реакции алкилирования Фриделя-Крафтса
Обратимая реакция (обратная реакция – дезалкилирование)
Соединения с электроноакцепторными
Тенденция алкилирующего агента перегруппировываться в более стабильный карбокатион
Образующиеся алкилбензолы более реакционноспособны в реакциях, чем бензол: ди- и полиалкилирование бензольного кольца
пропилбензол, 30-35%
изопропилбензол, 65-70%
первичный карбокатион
вторичный карбокатион
δ-
+
+
+
δ+
-
-
-
перегруппировка
Слайд 42Реакции SE конденсированных аренов и небензоидных ароматических систем
1. Электрофильное замещение в
2. Нафталин, антрацен и фенантрен легче вступают в реакции электрофильного замещения, чем бензол и соединения с изолированными бензольными ядрами.







![Энергетическая диаграмма реакции SE в ароматическом кольцеV = k[ArH][E+]Реакция второго порядка](/img/tmb/1/74988/64b83ab8065e66a914715e8e19ad06da-800x.jpg)