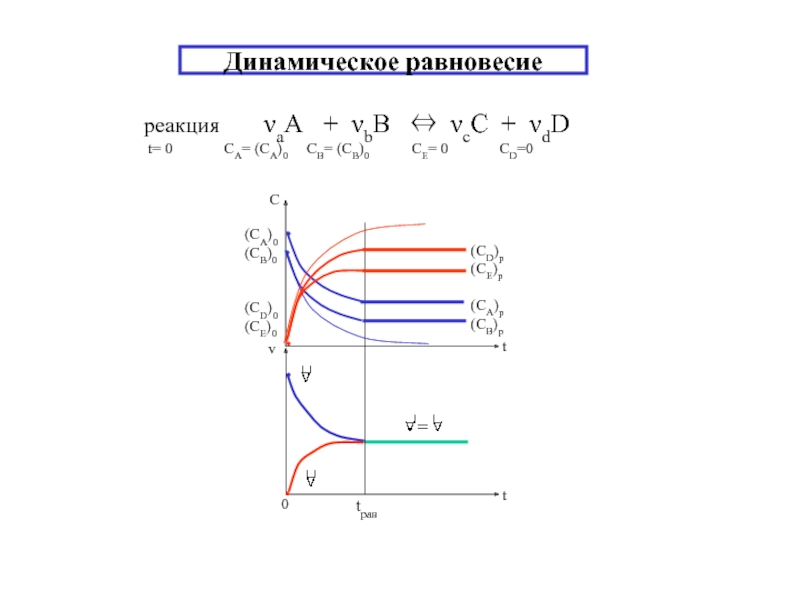
реакция νаA + νbB ⇔ νсC + νdD
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химическое равновесие презентация
Содержание
- 1. Химическое равновесие
- 2. Энергия Гиббса реакции в нестандартных условиях С
- 3. 4.7 Равновесие – термодинамические условия (ΔrG = 0)
- 4. Константа равновесия К, её размерность. Связь между
- 5. Сдвиг равновесия Изобара реакции Р-const ΔrН0•0 (экзотерм.реакция)
- 6. Динамическое равновесие реакция νаA + νbB
- 7. Расчет равновесного состава(концентраций) газовой смеси 1. Расчет
- 8. Пример.
- 9. Равновесие в растворах(дисперсных системах)
- 10. Электролитическая диссоциация С0 - общая концентрация СД
- 11. Ионное произведение воды H2O ⇔ H+ +
- 12. Водородный показатель pH = –lg[H+] Нейтральная среда
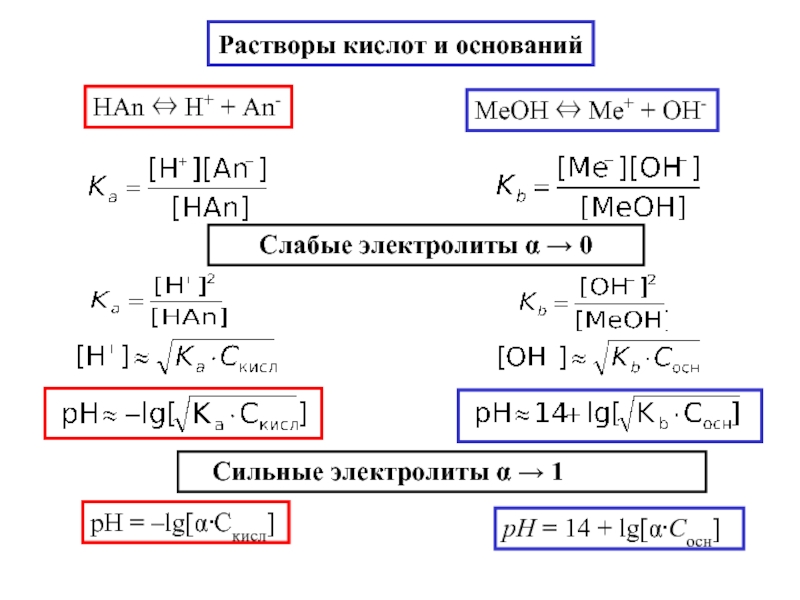
- 13. Растворы кислот и оснований МеOH ⇔ Ме+
- 14. Многоосновные кислоты и основания H2An ⇔
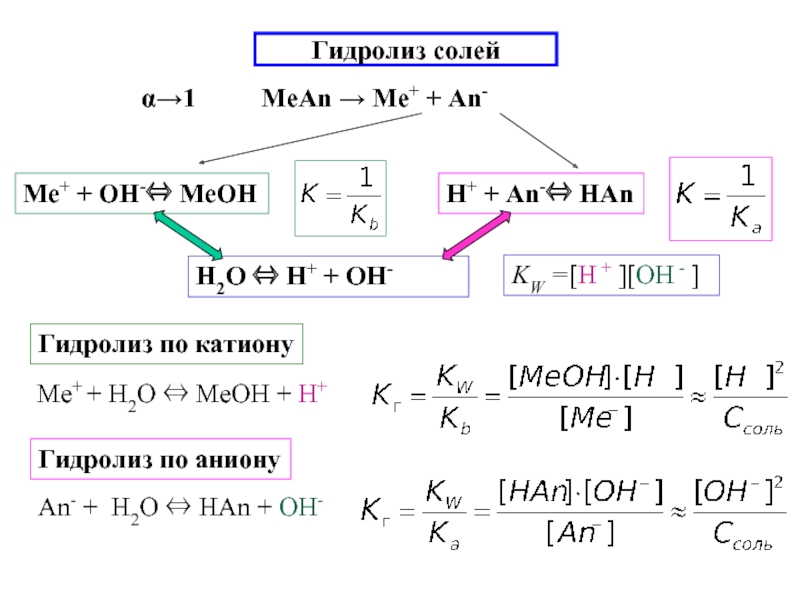
- 15. Гидролиз солей α→1 МеAn → Ме+ + An- Гидролиз по катиону Гидролиз по аниону
- 16. Примеры гидролиза солей 1) Kb→0; Ka→ ∞
- 17. Произведение растворимости - ПР S-растворимость осадка[моль/л] [Kat+] = x·S [моль/л]
- 18. Фазовые равновесия ΔG=0 Фазовый переход скачек:
- 19. Число компонентов – К (независимые составные части
- 20. Диаграмма состояния однокомпонентной системы (К=1) Н2О Ф=2
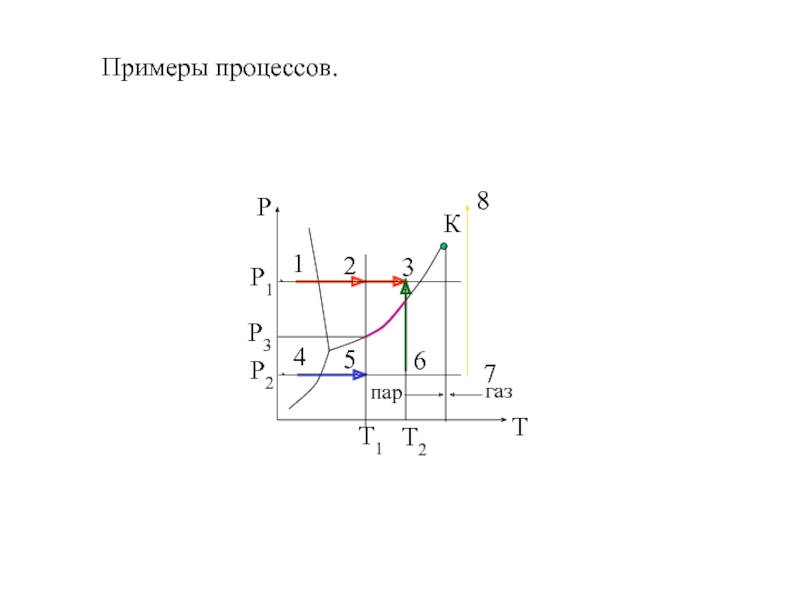
- 21. Примеры процессов.
- 22. Двухкомпонентная система [К=2(вода+ растворенное вeщество А)], молекулярный
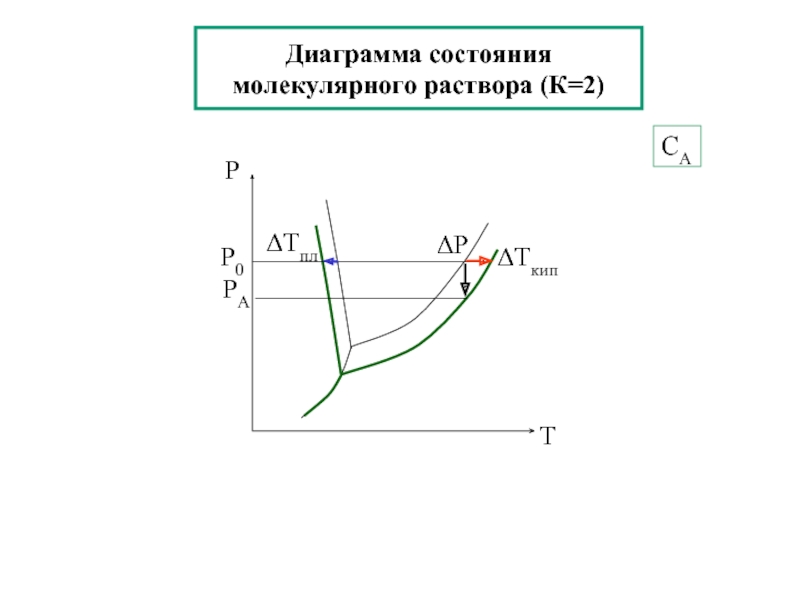
- 23. Диаграмма состояния молекулярного раствора (К=2) СА
- 24. Кипение и кристаллизация растворов Повышение температуры
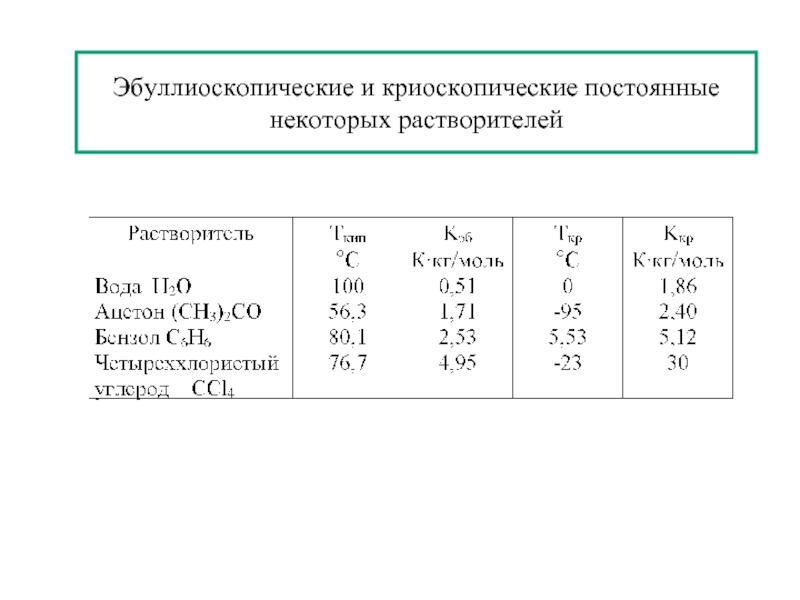
- 25. Эбуллиоскопические и криоскопические постоянные некоторых растворителей
- 26. Изотонический коэффициент – i (растворы электролитов)
Слайд 1Химическое равновесие
Термодинамические параметры: T; P; νi; Сi – const
1. Термодинамическое условие
Слайд 2Энергия Гиббса реакции в нестандартных условиях
С ≠С0 ΔrGi =ΔrG0i +
ΔrG = (νc⋅ΔfG0C+ νd⋅ΔfG0D ) – (νa⋅ΔfG0A+νb⋅ΔfG0B) + R⋅T⋅(νc⋅lnСC+νd⋅lnCD–νa⋅lnCA–νb⋅lnCB)
Слайд 4Константа равновесия К, её размерность. Связь между К (кинетич.) и стандартной
К≡KX - концентрации задаются мольными долями [безразмерная величина]
К≡Kp - концентрации задаются парциальными давлениями - [(Па)Δν ]
Δν = (νc+ νd) - (νa+ νb)
К≡KC – концентрации задаются молярной концентрацией - [(моль/л)Δν ]
р0 = 1,013⋅105 Па стандарт.давление
Слайд 5Сдвиг равновесия
Изобара реакции Р-const
ΔrН0•0 (экзотерм.реакция) – K0(T) убывающая функция(↑Т, К0↓)
ΔrН0•0 (эндотерм.реакция)
Изотерма реакции T-const
Слайд 7Расчет равновесного состава(концентраций) газовой смеси
1. Расчет К0(Т)
Для определенной Т рассчитывают
КX → Xi при Р –const
(р0 = 1,013⋅105 Па-стандартн.давление)
Кр → рi - при V - const
2. Расчет КX или Кр
Слайд 10Электролитическая диссоциация
С0 - общая концентрация
СД - конц.молекул в виде ионов
Слайд 11Ионное произведение воды
H2O ⇔ H+ + OH-
Нейтральная среда [H+] =
Кислая среда [H+] > 10-7(10-6,-5,-4 …); [OH–] <10-7(10-8,-9,-10 …) [моль/л]
Щелочная среда [H+] < 10-7 [OH–] > 10-7 [моль/л]
Слайд 12Водородный показатель
pH = –lg[H+]
Нейтральная среда pH = 7
Кислая среда pH
Щелочная среда pH > 7
pОH = –lg[ОH–]
pH + pОH = 14
Слайд 13Растворы кислот и оснований
МеOH ⇔ Ме+ + OH-
Слабые электролиты α →
Сильные электролиты α → 1
рН = –lg[α⋅Скисл]
pH = 14 + lg[α⋅Cосн]
HAn ⇔ H+ + An-
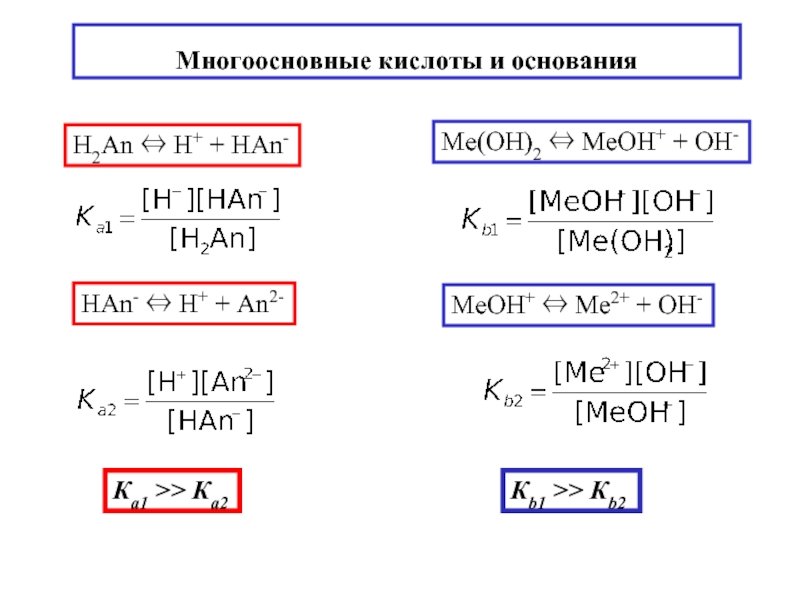
Слайд 14Многоосновные кислоты и основания
H2An ⇔ H+ + НAn-
HAn- ⇔ H+
Ка1 >> Ка2
Ме(OH)2 ⇔ МеOH+ + OH-
МеOH+ ⇔ Ме2+ + OH-
Кb1 >> Кb2
Слайд 16Примеры гидролиза солей
1) Kb→0; Ka→ ∞
CuSO4 → Cu2+ + SO42-
2
2) Ka→0; Kb→ ∞
pH <7
4) Ka→ ∞; Kb→ ∞
3) Ka→0; Kb→ 0
Na3РO4 → 3Na+ + РO43-
Na3РO4+ H2O ⇔ Na2HРO4+ NaOH
pH >7
Гидролиза нет
pH=7
NH4NO2 → NH4+ + NO2-
pH≈7
(Na++Cl-)
Cu2+ + H2O ⇔ CuOH+ + H+
РO43- + H2O ⇔ HРO42-+ OH-
NH4+ + H2O ⇔ NH4OH + H+
NO2- + H2O ⇔ НNO2 + OH-
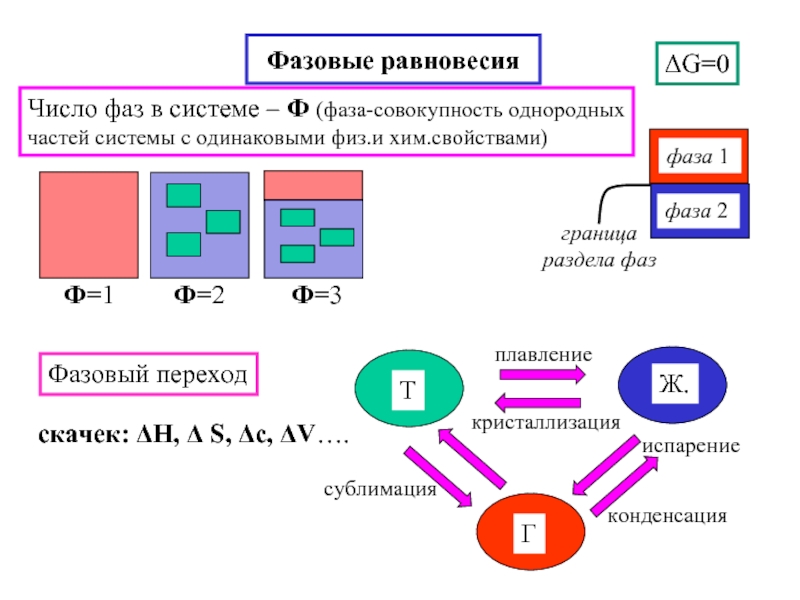
Слайд 18Фазовые равновесия
ΔG=0
Фазовый переход
скачек: ΔH, Δ S, Δc, ΔV….
Число фаз в системе
Слайд 19Число компонентов – К
(независимые составные части системы)
Число видов молекул, необходимое и
К=3
К=3–1=2
N2+3H2 ⇔ 2NH3
Число термодинамических степеней свободы - С
Число независимых параметров равновесия (p, T, C), которые могут произвольно изменяться (в определенном интервале) и при этом не изменяется число фаз в системе и ее строение
Правило фаз Гиббса - С = К + 2 – Ф
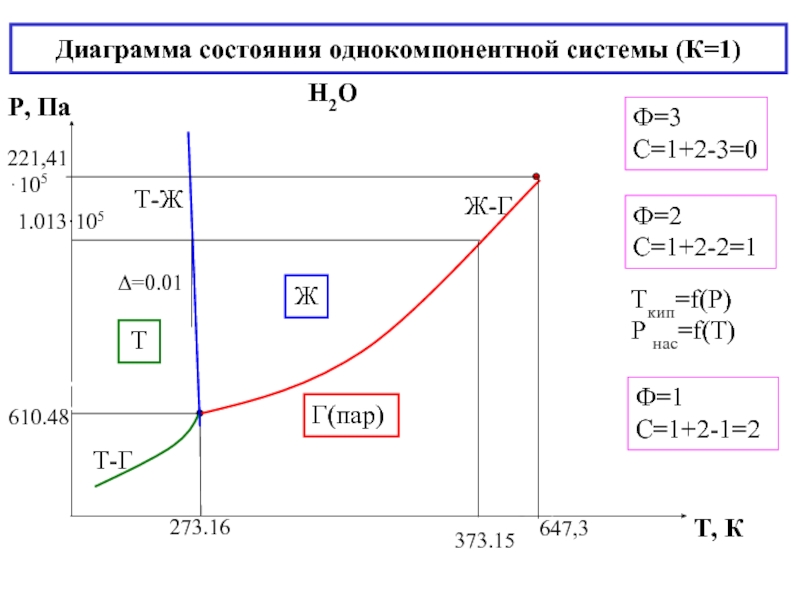
Слайд 20Диаграмма состояния однокомпонентной системы (К=1)
Н2О
Ф=2 С=1+2-2=1
Ф=3
С=1+2-3=0
Ф=1 С=1+2-1=2
Ж
Г(пар)
Т
Tкип=f(Р) Р нас=f(T)
Слайд 22Двухкомпонентная система [К=2(вода+ растворенное вeщество А)], молекулярный раствор.
α→ 0
p0
рА –давление (Н2Опар )
над раствором(Н2О+А)
Двухфазное равновесие
С = 2 + 2 – 2 = 2
1) Т⇔Ж; Ж ⇔ Г
2) Т⇔ Г
Ф=3 С = 2 + 2 – 3 = 1
Слайд 24Кипение и кристаллизация растворов
Повышение температуры кипения раствора по сравнению с
См [моль/кг] – моляльная концентрация
Kэб [К⋅кг/моль]– эбуллиоскопическая постоянная растворителя
Понижение температуры кристаллизации раствора по сравнению с чистым растворителем прямо пропорционально концентрации растворенного вещества
Kкр [К⋅кг/моль]– криоскопическая постоянная растворителя
ΔТкип = Kэб⋅См
ΔТкр = Kкр⋅См
Слайд 26Изотонический коэффициент – i
(растворы электролитов)
- показывает увеличение числа частиц в
АxВy ⇔ x А+ + y В-
α - степень диссоциации
N0 - число молекул растворенного вещества; αN0 (x + y )+(N0 - α N0 ) - суммарное число частиц (ионов и недиссоциированных молекул)
m = x + y









![Ионное произведение водыH2O ⇔ H+ + OH-Нейтральная среда [H+] = [OH–] = 10-7 [моль/л]Кислая среда](/img/tmb/2/101992/bf5a29db071117e2e0c3d72df11d0d81-800x.jpg)
![Водородный показательpH = –lg[H+]Нейтральная среда pH = 7Кислая среда pH < 7Щелочная среда pH](/img/tmb/2/101992/45e43ca4f3ba47e23a78c290d95758b4-800x.jpg)

![Произведение растворимости - ПРS-растворимость осадка[моль/л] [Kat+] = x·S [моль/л]](/img/tmb/2/101992/f871c7bc0c28a67d5d1fdd06dde17105-800x.jpg)

![Двухкомпонентная система [К=2(вода+ растворенное вeщество А)], молекулярный раствор. α→ 0 p0 –давление насыщенного пара (Н2Опар](/img/tmb/2/101992/822d0af8eca4c26b9f980ff623f284f4-800x.jpg)